基于温度的微波消融过程中约化散射系数2D/3D动态仿真方法及装置
本发明涉及肿瘤微波消融技术领域,尤其涉及一种基于温度的微波消融过程中约化散射系数2d/3d动态仿真方法及装置。
背景技术:
微波热消融疗法因其疗效明显、微创、毒副作用小、并发症少等优势,被认为是继手术、化疗、放疗、免疫治疗等后又一类新型有效的恶性肿瘤治疗的方法,在临床肿瘤治疗中已经发挥了巨大的作用,已经广泛用于肝癌、肺癌、肾癌、甲状腺癌等10多种实体瘤。但是,微波肿瘤热消融中仍存在许多需要解决的科学及技术问题,其中最主要的之一就是微波消融治疗中实时疗效评估问题。
目前,临床上主要使用单点测温来评估微波消融的疗效;同时利用多物理场耦合软件可以实现在术前对肿瘤微波消融过程中的温度分布及变化进行动态仿真,可以为临床提供治疗效果的术前评估参考。
作为肿瘤细胞失活的决定因素之一,温度尚不能准确反映肿瘤组织的消融程度。同时,温度不能表征消融过程中肿瘤组织的其他相关参数,例如蛋白质的凝结度,组织密度,血流特性等。微波消融下生物组织的热损伤是与温度和时间有关的动态变化过程,其本质上是消融过程中蛋白质变性并逐步凝固的过程。生物组织的约化散射系数(μ′s)在组织因热损伤而逐渐凝固过程中也随细胞形态和蛋白质三级结构的改变而动态变化。
目前,尚没有微波消融治疗过程中组织约化散射系数2d/3d动态变化的仿真方法
技术实现要素:
为了解决现有技术中的问题,本发明提供基于温度的微波消融过程中约化散射系数2d/3d动态仿真方法及装置,该方法实现了一种有效的微波消融过程中约化散射系数2d/3d动态仿真。
为实现上述目的,本发明采用的技术方案为:
一种基于温度的微波消融过程中约化散射系数2d/3d动态仿真方法,建立了μ′s-t相关模型和微波消融过程中温度场仿真模型,在肿瘤微波消融术前实现消融过程中肿瘤组织约化散射系数的动态变化仿真,包括以下步骤:
s1、搭建微波消融约化散射系数μ′s和温度t同步实时采集系统,获得不同消融剂量下多组μ′s和t同步变化数据,建立μ′s-t相关模型,获得μ′s-t相关方程;
s2、构建微波消融温度场仿真几何模型,设定边界条件和仿真参数,设置消融参数获得微波消融过程中温度的2d/3d动态场;
s3、将μ′s-t相关方程代入微波消融温度场仿真模型中,获得微波消融过程中的2d/3d动态变化。
所述步骤s1中,微波消融约化散射系数μ′s和温度t同步实时采集系统包括:微波消融模块、参数采集模块和数据储存模块;
所述微波消融模块包括微波源5和消融针7;所述参数采集模块包括约化散射系数和温度组合测量探针6、光纤光谱仪3和光源4;所述数据储存模块包括主控板2和pc机1;所述约化散射系数和温度组合测量探针6电连接光纤光谱仪3、光源4和主控板2,所述消融针7电连接,所述微波源5和主控板2,所述微波源5电连接主控板2,所述主控板2和光纤光谱仪3电连接pc机1;所述约化散射系数和温度组合测量探针6和消融针7在离体猪肝8内平行设置。
进一步的,所述步骤s1中,不同消融剂量指在消融数据获取过程中,消融功率从50w-100w中选择,消融时间从0-10min中选择;组合测量探针与微波消融针之间的距离从0.2cm-1.5cm中选择;任意搭配消融功率、时间和距离,在开始消融的同时启动参数采集模块。
进一步的,所述步骤s1中,对同步采集的每一组μ′s和t数据,进行多项式拟合,得到每一组μ′s和t数据的关系方程及其决定系数,从而建立μ′s-t相关模型,获得μ′s-t相关方程。
进一步的,每一组实验数据的μ′s-t关系方程及其决定系数利用多项式拟合的方法得到,参与拟合的实验组数为k,k组实验获得k个μ′s-t关系方程及k个μ′s-t关系方程的决定系数,关系方程记做yn(n=1,2,3,...k),其中:yn为第n组实验获得的第n个μ′s-t关系方程,决定系数记做
进一步的,μ′s-t关系模型y的计算公式如下:
y=ynwn(n=1,2,3......k)。
进一步的,所述步骤s2中,微波消融过程中的温度变化仿真模型利用comsolmultiphysics多物理场耦合软件实现,包括消融针和组织的几何结构设计、边界条件设定、组织介电特性参数和热物性参数设置。
进一步的,所述步骤s2中仿真几何模型分为微波消融针几何模型和肝组织几何模型两部分;微波消融针几何模型以临床应用的ky-2450-b1微波消融针的结构为原型构建,针体前部包括微波同轴电缆(50ω)、针体套管、穿刺针头(即发射前极)和聚四氟乙烯(polytetrafluoroethylene,ptfe)绝缘介质套。
进一步的,所述步骤s2中生物组织热传导边界条件设定如下:肝组织设定为恒温边界,即此处温度始终与室温t0=293.15k离体仿真模型或体温t0=310.15k在体实验模型相等;绝缘介质外边界和针体含有水冷却部分的边界设置为恒温边界,即t0=293.15k冷却水温度。
进一步的,所述步骤s2中仿真参数包括肝组织的介电特性参数和热物性参数,介电特性参数包括介电常数εr和电导率σ,热物性参数包括密度ρ、比热容c、热导率k。
进一步的,所述步骤2的具体步骤如下:
s201、选定二维轴对称组件,设定长度单位为mm;
s202、构建猪肝消融模型,仿真几何模型主要分为微波消融针几何模型和肝组织几何模型两部分。针体包括穿刺头,不锈钢套管,同轴电缆分为内导体,绝缘介质和外导体,绝缘介质套ptfe四个部分,其结构参数如长度、直径等参数与实际选用的消融针保持一致。将穿刺头和同轴电缆内导体合并为一个域,同轴电缆绝缘介质和绝缘介质套合并为一个域,猪肝为一个域,其他设为理想电导体边界,构建出二维轴对称模型猪肝微波消融几何图形。
s203、边界条件、材料参数、电磁辐射参数与生物热传导参数设置,如猪肝的恒压热容c,导热系数к,密度ρ,相对介电常数εr,电导率σ等参数。生物组织热传导边界条件的设定:肝组织几何模型的外边界由于距离消融针较远,对中心消融区域影响较小,可以直接设定为恒温边界,即此处温度始终与室温t0=293.15k离体仿真模型或体温t0=310.15k在体实验模型相等;针体水冷却循环对针管和同轴电缆线的冷却效应简化为温度边界来分析,将绝缘介质外边界和针体含有水冷却部分的边界设置为恒温边界,即t0=293.15k冷却水温度。高温对肝组织介电特性会产生十分显著的影响,静态参数显然无法对肝组织消融过程的组织特性变化进行描述。由于温度升高会使肝组织的相对介电常数εr和电导率σ呈指数形式下降,采用随温度变化的组织介电特性参数可以较为准确地反应消融过程的微波传输和能量沉积。为了简化仿真模型计算,将肝组织热物性参数密度ρ、比热容c、热导率k及消融针的材料参数设定为恒定数值。
进一步的,所述步骤s3中,在获得微波消融过程中的温度2d/3d仿真分布后,将μ′s-t相关方程代入温度变化仿真模型中,即获得微波消融过程中μ′s的2d/3d动态变化。
进一步的,所述步骤s3中,在获得微波消融过程中的温度2d/3d仿真分布后,将μ′s-t相关方程代入温度变化仿真模型中,将温度转化为约化散射系数,即可获得微波消融过程中μ′s的2d/3d动态变化。
一种基于温度的微波消融过程中约化散射系数2d/3d动态仿真装置,包括微波消融约化散射系数μ′s和温度t同步实时采集系统包括:微波消融模块、参数采集模块和数据储存模块;
所述微波消融模块包括微波源5和消融针7;所述参数采集模块包括约化散射系数和温度组合测量探针6、光纤光谱仪3和光源4;所述数据储存模块包括主控板2和pc机1;所述约化散射系数和温度组合测量探针6电连接光纤光谱仪3、光源4和主控板2,所述消融针7电连接,所述微波源5和主控板2,所述微波源5电连接主控板2,所述主控板2和光纤光谱仪3电连接pc机1;所述约化散射系数和温度组合测量探针6和消融针7在离体猪肝8内平行设置。
优选地,所述约化散射系数和温度组合测量探针6可以同步采集同一位点的温度和约化散射系数,其直径为1.6mm,长度为180mm;所述光谱仪3为fx2000光纤光谱仪;所属光源4为hl2000卤素光源;所述微波消融针7为ky-2450-b1微波消融针,其直径为1.9mm,长度为150mm;所述微波源5为2450mhz微波源。
与现有技术相比,本发明具有以下有益效果:
1、本发明建立了一种有效的基于温度的微波消融过程中约化散射系数2d/3d动态仿真方法,可以在术前对肿瘤组织在微波消融过程中的约化散射系数变化进行动态仿真,进而对治疗过程中的蛋白凝固程度、肿瘤灭活程度进行术前预判。
2、本发明有助于肿瘤微波消融临床上医生确定精准的消融治疗剂量和治疗方案。实现肿瘤微波消融治疗的精准、高效。
附图说明
图1是本发明的实施例所提供的一种基于温度的微波消融过程中组织约化散射系数2d/3d动态仿真方法的流程图;
图2是本发明的实施例所提供的一种基于温度的微波消融过程中组织约化散射系数2d/3d动态仿真方法所涉及的组织以离体猪肝脏为例微波消融过程中温度和约化散射系数实时同步采集装置;
图3是本发明的实施例所提供的一种基于温度的微波消融过程中组织约化散射系数2d/3d动态仿真方法中所构建的μ's与t相关模型相关方程曲线示例;
图4是本发明的实施例所提供的一种基于温度的微波消融过程中组织约化散射系数2d/3d动态仿真方法中所构建的离体猪肝脏微波消融仿真几何模型;
图5是本发明的实施例所提供的一种基于温度的微波消融过程中组织约化散射系数2d/3d动态仿真方法中所获得的离体猪肝脏在60w微波功率、180s消融时间下的2d/3d仿真温度分布;
图6是本发明的实施例所提供的一种基于温度的微波消融过程中组织约化散射系数2d/3d动态仿真方法中所获得的离体猪肝脏在60w微波功率、180s消融时间下的2d、3d仿真约化散射系数分布以及该消融剂量下实际约化散射系数分布。
具体实施方式
下面结合实施例对本发明作更进一步的说明。
如图1所示是本发明的实施例所提供的一种基于温度的微波消融过程中组织约化散射系数2d/3d动态仿真方法的流程图。包括以下步骤:
s1、搭建微波消融约化散射系数μ′s和温度t同步实时采集系统,获得不同消融剂量下多组μ′s和t同步变化数据,建立μ′s-t相关模型,获得μ′s-t相关方程;
s2、构建微波消融温度场仿真几何模型,设定边界条件和仿真参数,设置消融参数获得微波消融过程中温度的2d/3d动态场;
s3、将μ′s-t相关方程代入微波消融温度场仿真模型中,获得微波消融过程中的2d/3d动态变化。
如图2所示是本发明的实施例所提供的一种基于温度的微波消融过程中组织约化散射系数2d/3d动态仿真方法所涉及的离体猪肝微波消融温度和约化散射系数实时同步采集装置的原理图。优选地,1为pc,2为主控板,3为fx光纤光谱仪,4为hl2000卤素光源,5为2450mhz微波源,6为约化散射系数和温度组合测量探针,7为ky-2450-b1微波消融针,8为离体猪肝。
在实验前,将微波消融针7插入猪肝8cm,以确保整个消融区在肝实质内;将组合测量探针6插入7cm并与微波消融针7平行放置;在消融数据获取过程中,消融功率从50w-100w中选择,消融时间从0-10min中选择;组合测量探针与微波消融针之间的距离从0.3cm、0.5cm、1.0cm、1.5cm中选择;任意搭配消融功率、时间和距离,在开始消融的同时启动参数测量模块。
如图3是本发明的实施例所提供的一种基于温度的微波消融过程中组织约化散射系数2d/3d动态仿真方法中所构建的μ′s与t相关模型、相关方程曲线示例;
参与拟合的实验组数为k,k组实验获得k个μ′s-t关系方程及k个决定系数,关系方程记做yn(n=1,2,3,...k),其中:yn为第n组实验获得的第n个μ′s-t关系方程,决定系数记做
所述每一组实验数据的μ′s-t关系方程及其决定系数r2(0<r2<1)可以利用多项式拟合的方法得到,拟合结果表明μ′s与t在四阶多项式拟合上具有相对最高的拟合优度(r2更接近1),即μ′s与t可拟合出如下的方程:
y=ax4+bx3+cx2+dx+e
其中:x为t,y为μ′s,a、b、c、d、e为常数。
所述μ′s-t关系模型y计算公式如下:
y=ynwn(n=1,2,3......k)
代入k组实验获得的k个三阶关系方程和权重,即可得到最终的μ′s-t关系模型方程。
本发明基于40组实验得到μ′s-t关系模型通用方程y如下:
y=-0.000000749987x4+0.000264596x3-0.03409x2+1.92x-23.7
即:
μ′s=-0.000000749987t4+0.000264596t3-0.03409t2+1.92t-23.7
利用未参与模型建立的样本检验所建立μ′s-t模型方程的可靠性,经验证,该相关模型的最大绝对误差、最小绝对误差和平均绝对误差分别为3.835cm-1、0.003cm-1和1.128cm-1,具有较高的准确率。
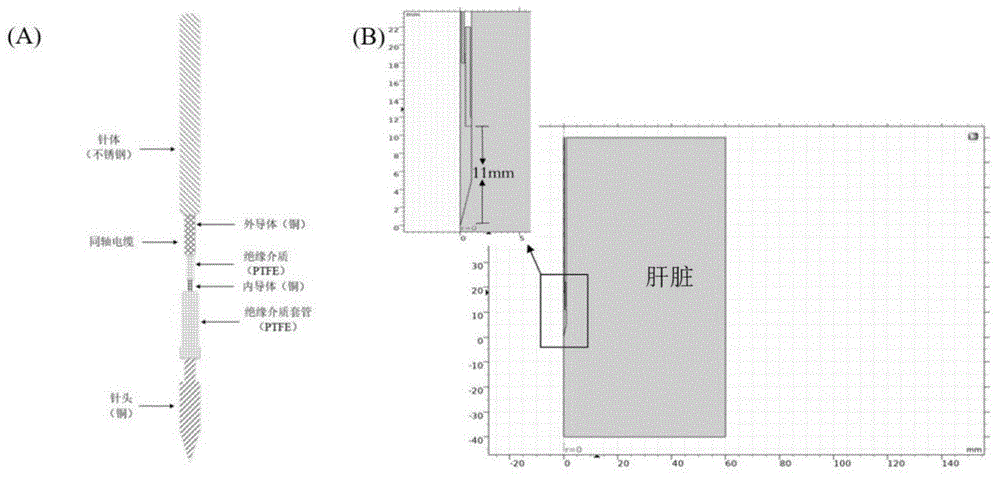
如图4所示是本发明的实施例所提供的一种基于温度的微波消融过程中组织约化散射系数2d/3d动态仿真方法所构建的离体猪肝脏微波消融仿真几何模型。
图4(a)为目前临床上微波消融针的实际结构,消融针按照实际消融针的尺寸规格进行设计以ky-2450a消融针为例,消融模型包括:穿刺头前端11mm,不锈钢套管直径1.9mm,同轴电缆分为内导体,绝缘介质和外导体,绝缘介质套四个部分。图4(b)为猪肝脏和消融针的微波消融仿真几何模型,将穿刺头和同轴电缆内导体合并为一个域,同轴电缆绝缘介质和绝缘介质套合并为一个域,猪肝为一个域,其他设为理想电导体边界,构建出二维轴对称模型猪肝微波消融几何图形。肝组织形状设定为圆柱形。针尖前部设置为距边界20mm,肝组织设置为宽40mm,以保证消融区域完整。几何模型建立之后,在comsolmultiphysics中进行网格划分。
按照电磁辐射原理和生物组织热传导原理,设置猪肝的恒压热容c,导热系数k,密度ρ,相对介电常数εr,电导率σ等参数。由于温度升高会使肝组织的相对介电常数εr和电导率σ呈指数形式下降,采用随温度变化的组织介电特性参数可以较为准确地反应消融过程的微波传输和能量沉积,如下:
为了简化仿真模型计算,将肝组织热物性参数密度ρ,比热容c、热导率k与消融针材料参数电导率、密度、热导率等设定为恒定组织参数,如表1所示。
表1仿真模型采用的参数
设置微波频率为2450mhz,选择消融功率和消融时间即可开始微波消融过程中温度动态变化仿真。
如图5所示是本发明的实施例所提供的一种基于温度的微波消融过程中组织约化散射系数2d/3d动态仿真方法中所获得的离体猪肝脏在60w微波功率、180s消融时间下的2d/3d仿真温度分布。图5(a)为离体猪肝脏在60w微波功率消融180s时的2d中心剖面仿真温度分布,图5(b)为离体猪肝脏在在60w微波功率消融180s时的3d仿真温度分布,单位为℃。
如图6所示是本发明的实施例所提供的一种基于温度的微波消融过程中组织约化散射系数2d/3d动态仿真方法中所获得的离体猪肝脏在60w微波功率、180s消融时间下的2d、3d仿真约化散射系数分布以及该消融剂量下实际约化散射系数分布;在利用comsolmultiphysics软件获得了离体猪肝脏在60w微波功率、180s消融时间下的2d/3d仿真温度分布后,在comsolmultiphysics仿真软件中代入公式:
μ′s=-0.000000749987t4+0.000264596t3-0.03409t2+1.92t-23.7
即可将获得的温度场转化为约化散射系数场,其中μ′s单位为cm-1,t单位为℃。
图6(a)为离体猪肝脏在60w微波功率消融180s时的2d仿真约化散射系数分布,图6(b)为离体猪肝脏在60w微波功率消融180s时的3d仿真约化散射系数分布,单位为cm-1。
图6(c)为离体猪肝脏在60w微波功率消融180s时的中心剖面的实际消融区域,图6(d)为测量图6(c)中实际消融区域内组织约化散射系数而绘制出的约化散射系数2d中心剖面分布,通过对比可以发现同功率时间微波消融下猪肝脏约化散射系数的仿真2d中心剖面分布与实际2d中心剖面分布在形状、大小和数值上高度一致,仅在中心消融针道区域具有细微差异,这也证明了本发明的可行性与准确度。
本发明还提出了一种基于温度的微波消融过程中组织约化散射系数2d/3d动态仿真方法的装置,微波消融模块、参数采集模块和数据储存模块;所述微波消融模块包括微波源5和消融针7;所述参数采集模块包括约化散射系数和温度组合测量探针6、光纤光谱仪3和光源4;所述数据储存模块包括主控板2和pc机1;所述约化散射系数和温度组合测量探针6电连接光纤光谱仪3、光源4和主控板2,所述消融针7电连接,所述微波源5和主控板2,所述微波源5电连接主控板2,所述主控板2和光纤光谱仪3电连接pc机1;所述约化散射系数和温度组合测量探针6和微波消融针7插入离体猪肝8内;所述约化散射系数和温度组合测量探针6和微波消融针7在离体猪肝8内平行设置。
优选地,所述约化散射系数和温度组合测量探针6可以同步采集同一位点的温度和约化散射系数,其直径为1.6mm,长度为180mm;所述光谱仪3为fx2000光纤光谱仪;所属光源4为hl2000卤素光源;所述微波消融针7为ky-2450-b1微波消融针,其直径为1.9mm,长度为150mm;所述微波源5为2450mhz微波源。
以上所述仅是本发明的优选实施方式,应当指出:对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!