一种诱导铁死亡的纳米复合物及制备方法以及其在肿瘤治疗中的应用
本发明属于医药技术领域,特别涉及一种诱导铁死亡的纳米复合物及制备方法以及其在肿瘤治疗中的应用。
背景技术:
铁死亡是一种新型调控型细胞死亡方式,其主要特征是铁依赖的活性氧堆积和脂质过氧化细胞致死。作为肿瘤治疗的新靶点,对于传统疗法无法治疗的恶性肿瘤,铁死亡是种有前景的治疗手段并显示出好的治疗效果。目前铁死亡诱导剂的开发主要聚焦于利用铁基材料增加细胞内亚铁含量和抑制细胞内抗氧化系统酶活性。但已有研究证明,铁死亡还涉及多种基因和代谢途径,铁死亡依赖于细胞自噬。自噬可以通过选择性降解铁蛋白增加不稳定铁池含量从而促进铁死亡。因此开发自噬加剧铁死亡的诱导剂为肿瘤治疗提供新策略新方法。
目前,生物体内的蛋白质因为其良好的生物相容性,降解性和不易引起排异反应,而被应用到药物载体领域。乳铁蛋白因免疫调节的能力广泛添加到奶粉中。乳铁蛋白作为药物载体的研究,多以乳铁蛋白作为配体修饰药物载体实现体内的靶向性,乳铁蛋白自身作为药物载体的研究仍较少。到目前为止,尚未发现有以乳铁蛋白为载体同时搭载了青蒿素类药物和口服补铁剂的纳米复合物作为铁死亡诱导物的制备及其抗肿瘤方面的研究报道。
技术实现要素:
本发明的首要目的在于克服现有技术的缺点与不足,提供一种诱导铁死亡的纳米复合物的制备方法。
本发明的另一目的在于提供所述方法制备得到的诱导铁死亡的纳米复合物。
本发明的再一目的在于提供所述诱导铁死亡的纳米复合物在制备抗肿瘤药物中的应用。
本发明的目的通过下述技术方案实现:
一种诱导铁死亡的纳米复合物的制备方法,包括如下步骤:
(1)将青蒿素类药物和口服补铁剂(口服铁剂)溶于有机溶剂中,得到溶液i;
(2)将乳铁蛋白分散于无机溶剂中,得到溶液ii;
(3)将溶液i加入到溶液ii中,在超声下混合均匀,得到诱导铁死亡的纳米复合物。
步骤(1)中所述的青蒿素类药物为青蒿琥酯,双氢青蒿素,蒿甲醚和蒿乙醚中的至少一种;优选为双氢青蒿素。
步骤(1)中所述的口服补铁剂为富马酸亚铁,琥珀酸亚铁和右旋糖酐铁的至少一种;优选为琥珀酸亚铁。
步骤(1)中所述的青蒿素类药物与口服补铁剂的摩尔比为1:1~20;优选为1:2。
步骤(1)中所述的有机溶剂为二甲基亚砜、二氯甲烷、丙酮和乙醇中的至少一种;优选为二氯甲烷。
步骤(1)中所述的有机溶剂的用量为按每毫克(mg)青蒿素类药物配比1~2ml有机溶剂计算;优选为按每毫克青蒿素类药物配比1ml有机溶剂计算。
步骤(2)中所述的乳铁蛋白与青蒿素类药物的质量比为1~10:1;优选为5:1。
步骤(2)中所述的无机溶剂为水、磷酸缓冲液、hbss缓冲液和生理盐水中的至少一种;优选为磷酸缓冲液(即pbs磷酸缓冲液)。
步骤(2)中所述的无机溶剂的用量为按每毫克(mg)乳铁蛋白配比0.2~7.5ml无机溶剂计算;优选为按每毫克(mg)乳铁蛋白配比0.2ml无机溶剂计算。
步骤(3)中所述的溶液i和溶液ii的体积比优选为1:1。
步骤(3)中所述的超声的条件为:250w超声3~15min;优选为:250w超声10min。
所述的诱导铁死亡的纳米复合物的制备方法,在步骤(3)之后,还包括将得到的诱导铁死亡的纳米复合物进一步分离洗涤纯化的步骤,具体步骤如下:
(4)将诱导铁死亡的纳米复合物转移至离心管中,离心、弃上清,然后加入无机溶剂重悬后,再次离心、弃上清,重复2~3次,得到离心洗涤后的纳米复合物;
(5)将纳米复合物转移至透析袋中,以生理盐水为透析液进行透析,获得纯化后的诱导铁死亡的纳米复合物。
步骤(4)中所述的离心的条件为:2000rpm离心3~5min;优选为:2000rpm离心3min。
步骤(4)中所述的无机溶剂为水、磷酸缓冲液、hbss缓冲液和生理盐水中的至少一种;优选为磷酸缓冲液(即pbs磷酸缓冲液)。
步骤(5)中所述的透析袋为截留分子量1000~5000da的透析袋;优选为截留分子量1000da的透析袋。
步骤(5)中所述的透析的时间优选为24h以上。
一种诱导铁死亡的纳米复合物,通过上述任一项所述的方法制备得到。
所述的诱导铁死亡的纳米复合物的水合粒径小于500nm,尺寸为小于100nm。
所述的诱导铁死亡的纳米复合物在制备抗肿瘤药物中的应用,该纳米复合物可以加剧细胞自噬,进而增加不稳定铁池含量,诱导肿瘤细胞铁死亡,达到抗肿瘤的目的。
所述的肿瘤包括结肠癌等。
所述的诱导铁死亡的纳米复合物在制备调控巨噬细胞表型的药物中的应用,该纳米复合物可以使抗肿瘤的m1型巨噬细胞增多,调节巨噬细胞的表型。
本发明相对于现有技术具有如下的优点及效果:
(1)本发明提供了一种诱导铁死亡的纳米复合物,以蛋白载体为乳铁蛋白,装载了青蒿素类药物和口服补铁剂,该铁死亡诱导物为尺寸小于100nm的纳米复合物,丰富铁死亡诱导剂的种类。
(2)本发明的诱导铁死亡纳米复合物,口服补铁剂装载在乳铁蛋白上增加细胞内的铁含量,青蒿素类药物作为疟症的速效药,以分子内存在过氧桥为特点,青蒿素类药物的过氧桥在二价铁的存在下断裂,产生细胞毒性自由基诱导脂质过氧化,同时青蒿素类药物触发自噬增加细胞内不稳定铁池含量。
(3)本发明的诱导铁死亡纳米复合物以乳铁蛋白装载青蒿素类药物和口服补铁剂,具有成分简单、毒副作用小的特点,可诱导肿瘤细胞铁死亡,并协同固有免疫调节巨噬细胞为抗肿瘤的表型,增强了该纳米复合物的抗肿瘤效果,可以用于抗肿瘤研究领域中。
附图说明
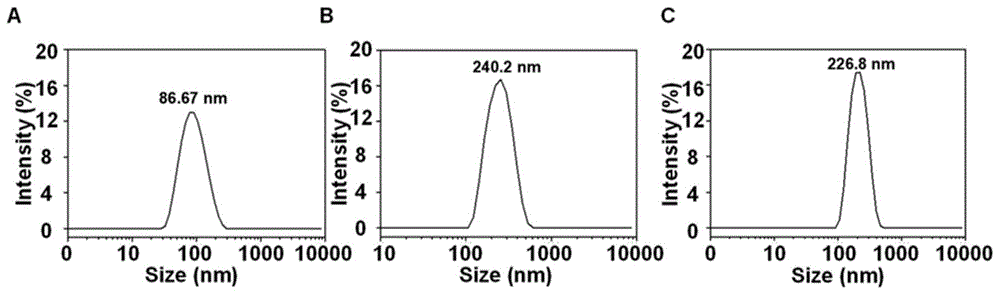
图1为实施例1~3中的诱导铁死亡纳米复合物的水合粒径图;其中,a为实施例1中的诱导铁死亡纳米复合物的水合粒径图;b为实施例2中的诱导铁死亡纳米复合物的水合粒径图;c为实施例3中的诱导铁死亡纳米复合物的水合粒径图。
图2为实施例3中的诱导铁死亡纳米复合物的透射电镜图。
图3为实施例3中制备的诱导铁死亡纳米复合物对ct26细胞ros水平的影响图。
图4为实施例3中制备的诱导铁死亡纳米复合物对ct26细胞自噬的影响图。
图5为实施例3中制备的诱导铁死亡纳米复合物对ct26细胞脂质过氧化的影响图。
图6为实施例3中制备的诱导铁死亡纳米复合物对巨噬细胞表型的影响图。
具体实施方式
下面结合实施例对本发明作进一步详细的描述,但本发明的实施方式不限于此。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。下列实施例中未注明具体实验条件的试验方法,通常按照常规实验条件或按照制造厂所建议的实验条件。除非特别说明,本发明所用试剂和原材料均可通过市售获得。
本发明实施例中涉及的青蒿素类药物如青蒿琥酯、双氢青蒿素、蒿甲醚,以及口服补铁剂右旋糖酐铁(cas:9004-66-4;分子量:153.92)、富马酸亚铁、琥珀酸亚铁可以通过常规市售获得。
本发明实施例中涉及的乳铁蛋白为牛乳铁蛋白,购于合肥博美生物公司。
实施例1
乳铁蛋白搭载青蒿琥酯-右旋糖酐铁诱导铁死亡的纳米复合物的制备,具体步骤如下:
(1)取2mg的青蒿琥酯和1.601mg的右旋糖酐铁溶于2ml的二氯甲烷中,得到溶液一;
(2)取10mg的乳铁蛋白分散于2mlpbs磷酸缓冲液(ph=7.4,1×缓冲溶液)中,得到溶液二;
(3)将溶液一加入溶液二中(溶液体积比为1:1),在超声(功率250w)探头下超声10min,得到纳米复合物粗产物;
(4)将纳米复合物粗产物转移至离心管中,2000rpm离心3min,弃除上清;然后加入2mlpbs缓冲液洗涤(ph=7.4,1×),将沉淀重悬,2000rpm,离心3min,弃除上清;再加入2mlpbs缓冲液洗涤(ph=7.4,1×),将沉淀重悬,2000rpm;
(5)将离心后的纳米复合物粗产物转移至1000da透析袋中,用生理盐水在室温下透析24h后,获得诱导铁死亡的纳米复合物。
上述诱导铁死亡纳米复合物的水合粒径如图1a所示,尺寸为小于500nm的纳米复合物。
实施例2
乳铁蛋白搭载蒿甲醚-富马酸亚铁诱导铁死亡的纳米复合物的制备,具体步骤如下:
(1)取2mg的蒿甲醚和2.28mg的富马酸亚铁溶于2ml的二氯甲烷中,得到溶液一;
(2)取10mg的乳铁蛋白分散于2mlpbs磷酸缓冲液(ph=7.4,1x)中,得到溶液二;
(3)将溶液一加入溶液二中(溶液体积比为1:1),在超声(功率250w)探头下超声10min,得到纳米复合物粗产物;
(4)将纳米复合物粗产物转移至离心管中,2000rpm离心3min,弃除上清;然后加入2mlpbs缓冲液洗涤(ph=7.4,1×),将沉淀重悬,2000rpm,离心3min,弃除上清;再加入2mlpbs缓冲液洗涤(ph=7.4,1×),将沉淀重悬,2000rpm;
(5)将离心后的纳米复合物粗产物转移至1000da透析袋中,用生理盐水在室温下透析24h后,获得诱导铁死亡的纳米复合物。
上述诱导铁死亡纳米复合物的水和粒径如图1b所示,尺寸为小于500nm的纳米复合物。
实施例3
乳铁蛋白搭载双氢青蒿素-琥珀酸亚铁诱导铁死亡的纳米复合物的制备,具体步骤如下:
(1)取2mg的双氢青蒿素和2.42mg的琥珀酸亚铁溶于2ml的二氯甲烷中,得到溶液一;
(2)取10mg的乳铁蛋白分散于2mlpbs磷酸缓冲液(ph=7.4,1x)中,得到溶液二;
(3)将溶液一加入溶液二中(溶液体积比为1:1),在超声(功率250w)探头下超声10min,得到纳米复合物粗产物;
(4)将纳米复合物粗产物转移至离心管中,2000rpm离心3min,弃除上清;然后加入2mlpbs缓冲液洗涤(ph=7.4,1×),将沉淀重悬,2000rpm,离心3min,弃除上清;再加入2mlpbs缓冲液洗涤(ph=7.4,1×),将沉淀重悬,2000rpm;
(5)将离心后的纳米复合物粗产物转移至1000da透析袋中,用生理盐水在室温下透析24h后,获得诱导铁死亡的纳米复合物。
上述诱导铁死亡纳米复合物的水合粒径和透射电镜图如图1c和图2所示,水合粒径为小于500nm,尺寸为小于100nm的纳米复合物。
实施例4
将实施例3的方法所得的诱导铁死亡纳米复合物,通过共聚焦观察其对细胞内ros水平影响,具体过程如下:
利用活性氧探针dcfh-da(sigma公司)反映细胞内的ros水平。以ct26细胞(武汉普诺赛生命科技有限公司)为模型,将ct26细胞(2×104个细胞)接种到共聚焦培养皿,培养过夜。用终浓度为100μg/ml的纳米复合物与ct26细胞共孵育后,pbs磷酸缓冲液(ph=7.4,1x)清洗细胞。将终浓度为10um的dcfh-da与细胞孵育30min,在共聚焦下观察dcfh-da进胞后的荧光情况,其具体实验分组情况如下:
pbs磷酸缓冲液组(control组),乳铁蛋白组(lf组,终浓度为100μg/ml),乳铁蛋白搭载双氢青蒿素组(lf@dha组,终浓度为100μg/ml;其制备方法同实施例3,区别在于不加入琥珀酸亚铁),乳铁蛋白搭载琥珀酸亚铁组(lf@f组,终浓度为100μg/ml;其制备方法同实施例3,区别在于不加入双氢青蒿素),乳铁蛋白搭载双氢青蒿素和琥珀酸亚铁(lf@dha@f组,终浓度为100μg/ml;实施例3制备)。
结果如图3(标尺,100微米)所示:与对照组相比,lf@dha和lf@f均在细胞内产生了高于细胞基底水平的ros,是dcfh氧化形成dcf。lf@dha@f纳米复合物较lf@dha和lf@f处理组显示强的荧光强度,说明乳铁蛋白载体装载双氢青蒿素,琥珀酸亚铁处理后细胞内产生强的ros,比的乳铁蛋白装载单一双氢青蒿素和琥珀酸亚铁效果更为显著。
实施例5
确认实例3中所得的诱导铁死亡纳米复合物能触发细胞自噬形成自噬小体,具体过程如下:
利用自噬检测试剂盒(cayman公司)标记自噬小体上的标志物反映纳米复合物诱导的自噬水平。以ct26细胞为模型,将ct26细胞(2×104个细胞)接种到共聚焦培养皿,培养过夜。用终浓度为200μg/ml的纳米复合物处理ct26细胞4h后,利用自噬检测试剂标记自噬小体上的lc3ⅱ,在共聚焦下观察细胞内自噬小体产生情况,其实验分组情况如下:
pbs磷酸缓冲液组(control组),乳铁蛋白组(lf组,终浓度为200μg/ml),乳铁蛋白搭载双氢青蒿素组(lf@dha组,终浓度为200μg/ml,其制备方法同实施例4),乳铁蛋白搭载琥珀酸亚铁组(lf@f组,终浓度为200μg/ml,其制备方法同实施例4),乳铁蛋白搭载双氢青蒿素和琥珀酸亚铁(lf@dha@f组,终浓度为200μg/ml)。
结果如图4所示:与对照组相比,lf@dha组存在lc3ⅱ蛋白的荧光强度,说明了lf@dha组中dha激起自噬,而纳米复合物lf@dha@f组存在强的lc3ⅱ蛋白的荧光强度,说明该纳米复合物与lf@dha组相比有更强的激活自噬效果,在lf@dha化疗药物的基础上加剧了细胞的自噬水平。
实施例6
将实施例3的方法所得的纳米复合物,通过共聚焦观察其对细胞内不饱和脂肪酸,脂质氧化情况的影响,具体过程如下:
以ct26细胞为模型,将ct26细胞(2x104个细胞)接种到共聚焦培养皿,培养过夜。在终浓度为200ug/ml的纳米复合物处理ct26细胞8h后,pbs磷酸缓冲液(ph=7.4,1x)清洗细胞。利用荧光探针10umc11-bodipy(invitrogen公司)与细胞孵育30min后,共聚焦观察纳米药物影响细胞膜脂质氧化和非氧化的情况,其实验分组情况如下:
pbs磷酸缓冲液组(control组),乳铁蛋白组(lf组,终浓度为200μg/ml),乳铁蛋白搭载双氢青蒿素组(lf@dha组,终浓度为200μg/ml,其制备方法同实施例4),乳铁蛋白搭载琥珀酸亚铁组(lf@f组,终浓度为200μg/ml,其制备方法同实施例4),乳铁蛋白搭载双氢青蒿素和琥珀酸亚铁(lf@dha@f组,终浓度为200μg/ml)。
结果如图5所示:在乳铁蛋白载体上装载了双氢青蒿素和琥珀酸亚铁后处理细胞,细胞膜均出现氧化态,且氧化态的趋势与实施例2中的lf@dha、lf@f影响细胞内活性氧的趋势相一致。通过与对照组,lf@dha和lf@f组相比,lf@dha@f纳米复合物处理组的氧化态荧光强度最强,表明该纳米复合物使细胞膜上的不饱和脂肪酸氧化程度最剧烈,这与实施例3中使细胞内ros水平的影响相一致。
实施例7
将实施例3的方法所得的诱导铁死亡纳米复合物,通过流式观察其对巨噬细胞表型的影响,具体过程如下:
将巨噬细胞raw264.7(武汉普诺赛生命科技有限公司)在m2型培养基(含25ng/ml细胞因子il-4的1640培养基)里培养24h后,更换新的1640细胞培养基,在培养基中加入终浓度为200μg/ml的纳米复合物处理raw264.7细胞24h。离心收集细胞,用cd86抗体(invitrogen公司)在冰上与细胞共孵育。流式细胞术分析巨噬细胞raw264.7的表型变换,其实验分组情况如下:
pbs磷酸缓冲液组(control组),乳铁蛋白组(lf组,终浓度为200μg/ml),乳铁蛋白搭载双氢青蒿素组(lf@dha组,终浓度为200μg/ml,其制备方法同实施例4),乳铁蛋白搭载琥珀酸亚铁组(lf@f组,终浓度为200μg/ml,其制备方法同实施例4),乳铁蛋白搭载双氢青蒿素和琥珀酸亚铁(lf@dha@f组,终浓度为200μg/ml)。
结果如图6所示,与对照组相比,lf@dha@f纳米复合物处理过的巨噬细胞的向cd86荧光增强方向的峰移,即说明lf@dha@f纳米复合物使m1型巨噬细胞增多,具有调节巨噬细胞表型的功能。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!