一种药物球囊导管、药物球囊导管系统及其控制方法与流程
1.本申请属于医疗器械领域,更具体地说,是涉及一种药物球囊导管、药物球囊导管系统及其控制方法。
背景技术:
2.经皮腔内血管成形术(percutaneous transluminal angiography,pta)从上世纪70年代至今经历了裸球囊,裸金属支架,药物洗脱支架,药物涂层球囊阶段。其中药物涂层球囊(drug coated balloon,dcb),一方面药物能有效抑制平滑肌细胞过度增生从而降低再狭窄发生率,另一方面无需置入支架,从而减少了血管内膜的炎症反应、降低了支架内血栓形成风险、缩短了双联抗血小板时间、减少了出血风险。
3.现有的药物球囊通常利用造影剂碘普罗胺作为载体与紫杉醇一起作为药物涂层涂覆在球囊导管上治疗冠脉血管再狭窄,由于碘普罗胺的亲水特性,可以提高脂溶性药物紫杉醇向血管组织的转载率,保证了该产品在临床使用的有效性。但该涂层结构的药物球囊产品在临床使用过程中,仍存在一定的不足,主要表现在:首先,现有的药物球囊存在一定的并发症发生率,尤其是碘普罗胺属于较大的亲水性分子,这种载体的单一使用使其临床使用过程中会出现输送损失严重,涂层产生微粒较多,微粒较大,造成下游血管堵塞的风险。
4.其次,药物球囊在输送过程中由于存在血液的冲刷作用,导致部分药物涂层脱落,使得活性药物在球囊到达靶病变血管之前被冲刷掉,同时药物球囊回撤后球囊上涂层并未全部脱落,从而有部分活性药物残留在球囊上,造成药物的浪费,被冲刷掉的部分药物还会毒害下游组织,造成下游组织坏死。并且,附着在血管内壁的药物也容易在血流的冲刷下流失,组织中维持有效药物浓度的时间较短,导致治疗效果欠佳。
5.最后,现有的药物球囊对于重度钙化病变,会存在无法扩张病变血管,且药物转载率低的问题。目前临床的策略是在药物球囊介入之前对钙化血管进行前处理,如旋磨,切割球囊处理等,但如此操作会增加手术的复杂程度,延长手术时间,且增加手术费用。
技术实现要素:
6.本申请实施例的目的在于提供一种药物球囊导管,以解决现有技术中存在的药物利用率低、药物吸收效果欠佳以及临床使用不便捷的技术问题。
7.为实现上述目的,本申请采用的技术方案是:
8.第一方面:本申请实施例提供了一种药物球囊导管包括外表面涂覆有药物涂层的球囊、贯穿所述球囊的导管和连接于所述导管的冲击波部件、导线和连接的导管接头,所述冲击波部件用于在所述导管被输送至预定位置后,向所述药物涂层发射冲击波,以使得所述药物涂层自所述球囊的外表面脱落;
9.所述药物涂层包括保护层和载药层,所述载药层位于所述球囊的外表面与所述保护层之间;或者,
10.所述药物涂层包括活性药物和高分子载体;或者,
11.所述药物涂层包括活性药物和用于包裹所述活性药物的脂质体。
12.可选地,所述载药层包括低分子载体和活性药物,所述保护层采用高分子载体制成。
13.可选地,所述脂质体采用胆固醇、卵磷脂、大豆磷脂、脑磷脂、聚乙烯醇、聚乳酸
‑
乙醇酸共聚物中的至少一种。
14.可选地,所述活性药物为雷帕霉素、佐他莫司、他克莫司、紫杉醇、地塞米松及其衍生物中的至少一种,所述活性药物在所述球囊外表面的单位载药量为0.1μg/mm2‑
2μg/mm2。
15.可选地,所述高分子载体采用自多元醇、聚酯类物质、泊洛沙姆、碘普罗胺、聚乙烯吡咯烷酮、吐温中的至少一种,和/或,所述低分子载体采用多元醇、有机酸盐、尿素中的至少一种。
16.可选地,所述多元醇采用聚乙二醇、木糖醇、甘露醇、山梨醇、氨基醇中的至少一种。
17.可选地,所述酯类物质采用聚乳酸、聚乙醇酸、聚乳酸
‑
乙醇酸共聚物、聚丁二酸丁二醇酯、聚羟基脂肪酸酯、聚己内酯、聚己二酸乙二醇酯或聚羟基丁酸酯戊酸酯共聚物中的至少一种。
18.可选地,所述冲击波部件为连接有导线的冲击波电极,所述冲击波电极包括第一电极、第二电极以及位于第一电极和第二电极之间的绝缘部。
19.可选地,所述第一电极呈环状结构且设置有电极孔,所述第二电极位于所述第一电极内部并朝向于所述电极孔;或者,所述绝缘部为所述导线位于所述球囊内部的导线断口,所述导线在所述导线断口的两端分别形成所述第一电极和所述第二电极。
20.可选地,所述冲击波部件设置有多组且分别朝向于不同方向,各所述冲击波部件独立控制,以使各所述冲击波部件单独发射冲击波;或者,各所述冲击波部件统一控制,以使各所述冲击波部件同时发射冲击波。
21.可选地,所述导管包括导管本体、导管座和导管接头,所述导管本体的一端贯穿所述球囊,所述导管本体的另一端连接于所述导管座,所述冲击波部件的导线伸出于所述导管座并连接于所述导管接头。
22.本申请实施例提供的一种药物球囊导管的有益效果在于:与现有技术相比,本申请提供的药物球囊导管利用保护层/高分子载体/脂质体来减少输送过程中血液冲刷对活性药物的影响,有效防止活性药物的脱落,减少浪费,并且在药物球囊导管输送至预定位置时,可以通过冲击波部件产生的冲击波对药物涂层进行破坏,使得药物涂层及时脱落。同时,在冲击波的作用下,能够促进血管组织对载药层的吸收,提高药物利用率,不会对下游血管组织产生影响,并且冲击波还可以对脱落的保护层/高分子载体/脂质体进行破碎,不会在血管内造成堵塞。另外,对于血管钙化严重的病变,冲击波可以选择性地破碎血管壁中的钙化病灶,造成钙化斑块破碎的同时加速药物转移至血管壁。
23.第二方面:本申请实施例还提供了一种药物球囊导管系统,包括控制组件和上述的一种药物球囊导管,所述冲击波部件通过导线连接于所述控制组件。
24.可选地,所述控制组件包括连接于所述冲击波部件的操作手柄、连接于所述操作手柄的脉冲电源主机和连接于所述导管且用于控制所述球囊伸缩的灌注泵。
25.本申请实施例提供的一种药物球囊导管系统的有益效果在于:与现有技术相比,本申请提供的药物球囊导管系统,通过控制组件来控制药物球囊导管,能够有效防止术中药物的浪费,提高药物利用率,在破碎血管钙化病灶的同时使血管壁加快吸收抗增生药物,进而缩短了血管钙化病变的手术治疗时间。
26.第三方面:本申请实施例还提供了一种药物球囊导管系统的控制方法,用于控制上述的一种药物球囊导管系统,包括如下步骤:
27.所述球囊扩张并贴近血管壁;
28.脉冲电源主机发射第一电信号,使所述冲击波部件产生冲击波以破坏所述药物涂层和/或钙化病变;
29.所述球囊继续扩张至设定压力以扩张血管,所述脉冲电源主机发射第二电信号,使所述冲击波部件产生冲击波以促进活性药物吸收;
30.所述冲击波部件于所述第一电信号下的放电周期和所述第二电信号下的放电周期可以相同或存在差异,两者放电频率可以相同或存在差异。
31.可选地,所述球囊通过导丝输送至钙化病灶治疗点,并利用显影环定位,灌注泵输送液体介质至所述球囊,使所述球囊扩张,同时控制所述液体介质在所述球囊和所述灌注泵之间循环;所述灌注泵清除所述液体介质中因液电效应产生的气体。
32.可选地,所述冲击波部件于所述第一电信号和所述第二电信号下的工作电压为500v
‑
3500v,工作频率为0.1hz
‑
50hz,放电周期持续10s
‑
120s;和/或,所述冲击波部件于所述第一电信号的工作电压、工作频率和放电周期大于或等于所述第二电信号下的工作电压、工作频率和放电周期。
33.本申请实施例提供的一种药物球囊导管系统的控制方法的有益效果在于:与现有技术相比,本申请提供的一种药物球囊导管系统的控制方法,利用脉冲电源主机发射的第一电信号和第二电信号,来控制冲击波部件的工作频率和放电周期,使得冲击波部件在特定工作频率下实现不同的用途,一方面能够破碎钙化病灶且加快药物吸收,有效提高药物利用率,同时缩短手术时间,另一方面,能够避免下游血管堵塞,减少术后并发症。
附图说明
34.为了更清楚地说明本申请实施例中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本申请的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
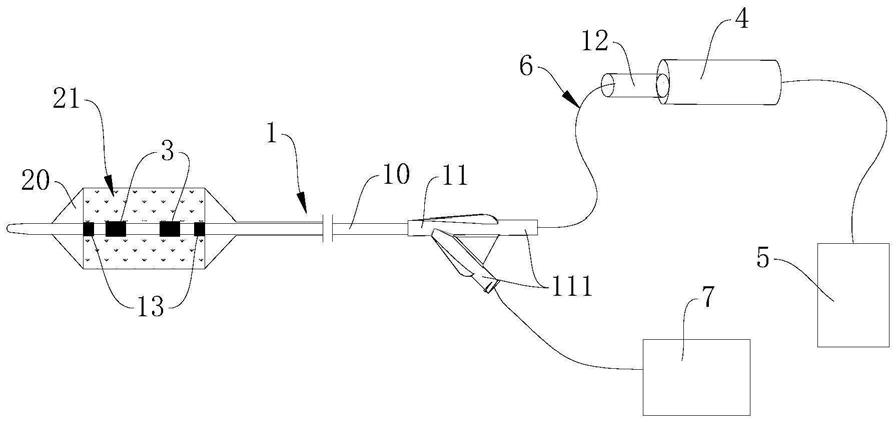
35.图1为本申请实施例一提供的一种药物球囊导管系统的结构示意;
36.图2为本申请实施例一提供的一种药物球囊导管的球囊和药物涂层的示意图;
37.图3为本申请实施例一提供的一种药物球囊导管的冲击波电极的立体结构示意图;
38.图4为本申请实施例一提供的一种药物球囊导管的冲击波电极的另一可选实施方式的示意图;
39.图5为本申请实施例一提供的一种药物球囊导管系统的控制方法的流程示意图;
40.图6为本申请实施例二提供的一种药物球囊导管的球囊和药物涂层的示意图;
41.图7为本申请实施例三提供的一种药物球囊导管的球囊和药物涂层的示意图。
42.其中,图中各附图标记:
[0043]1‑
导管
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
10
‑
导管本体
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
11
‑
导管座
[0044]
111
‑
端口
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
12
‑
导管接头
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
13
‑
显影环
[0045]
20
‑
球囊
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
21
‑
药物涂层
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
211
‑
载药层
[0046]
212
‑
保护层
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
213
‑
脂质体
[0047]3‑
冲击波部件
ꢀꢀꢀꢀꢀꢀꢀ
30
‑
冲击波电极
[0048]
31
‑
第一电极
ꢀꢀꢀꢀꢀꢀꢀꢀ
32
‑
第二电极
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
33
‑
绝缘部
[0049]
34
‑
电极孔
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ4‑
操作手柄
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ5‑
脉冲电源主机
[0050]6‑
导线
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
60
‑
导线断口
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ7‑
灌注泵。
具体实施方式
[0051]
为了使本申请所要解决的技术问题、技术方案及有益效果更加清楚明白,以下结合附图及实施例,对本申请进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本申请,并不用于限定本申请。
[0052]
需要说明的是,当元件被称为“固定于”或“设置于”另一个元件,它可以直接在另一个元件上或者间接在该另一个元件上。当一个元件被称为是“连接于”另一个元件,它可以是直接连接到另一个元件或间接连接至该另一个元件上。
[0053]
需要理解的是,术语“长度”、“宽度”、“上”、“下”、“前”、“后”、“左”、“右”、“竖直”、“水平”、“顶”、“底”、“内”、“外”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本申请和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本申请的限制。此外,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括一个或者更多个该特征。在本申请的描述中,“多个”的含义是两个或两个以上,除非另有明确具体的限定。
[0054]
在具体实施方式中所描述的各个具体技术特征和各实施例,在不矛盾的情况下,可以通过任何合适的方式进行组合,例如通过不同的具体技术特征/实施例/实施方式的组合可以形成不同的实施方式,为了避免不必要的重复,本申请中各个具体技术特征/实施例/实施方式的各种可能的组合方式不再另行说明。
[0055]
实施例一:
[0056]
请参考图1,本申请提供了一种药物球囊导管,包括球囊20、导管1和冲击波部件3,其中,导管1贯穿球囊20,冲击波部件3位于球囊20内部并连接于导管1,请一并参考图2,球囊20的外表面涂覆有药物涂层21,药物涂层21包括保护层212和载药层211,载药层211位于球囊20的外表面与保护层212之间,即球囊20的外表面、载药层211和保护层212依次相邻设置。具体应用中,药物球囊导管上的药物可以根据药物的流向可以分为三部分:第一部分是在药物球囊导管输送和回撤过程中,由于血液的冲刷作用,药物部分脱落并聚集到下游血管组织中;第二部分是通过组织吸附转移到病变血管处;第三部分是在药物球囊导管撤出后遗留在球囊20表面的部分药物。现有的药物球囊导管在应用时,其第二部分的药物(即被
有效利用的药物)仅占药物总量的10%左右,而在本实施例的药物球囊导管应用于临床时,在将导管1连接有球囊20的部分移动至病灶的过程中,由于保护层212覆盖在载药层211的外表面,药物涂层21即便受到血液的冲刷,在保护层212的作用下,载药层211也不易从球囊20的外表面上脱落,有效减少了药物在第一部分的浪费,而在药物球囊导管抵达病灶位置处后,且在球囊20膨胀并贴附于病变血管壁时,可以利用冲击波部件3产生冲击波并作用于球囊20,使球囊20外表面的保护层212和载药层211破碎并脱落,同时在冲击波的刺激下,病变处血管壁能够加快对药物的吸收,进而增加药物向组织的转移速度,有利于提高第二部分药物的利用率,并且减少药物在球囊20上的残留,进一步减少第一部分和第三部分药物的浪费。同时,一并脱落的保护层212可以在冲击波的作用下,碎化至更小尺寸,以避免下游血管堵塞,减少术后并发症。另外,对于血管钙化严重的病变,冲击波可以选择性地破碎血管壁中的钙化病灶,造成钙化斑块破碎的同时加速药物转移至血管壁,简化手术,减少治疗时间。
[0057]
作为本实施例的其中一种可选实施方式,载药层211包括低分子载体(即低分子赋形剂)和活性药物,保护层212包括高分子载体(即高分子赋形剂),载药层211可以为低分子载体和活性药物均匀混合后喷涂于球囊20的外表面,保护层212可以为高分子载体直接喷涂于载药层的外表面,以形成双层结构。具体应用中,高分子载体具有稳定性,能够稳定地附着在载药层的表面,而不会在血液的冲刷下脱落,高分子载体具有冲击波敏感性,在冲击波的作用下,保护层能够被击碎并脱落,使载药层暴露出来,由于低分子载体的附着力不如高分子载体,相较于高分子载体,低分子载体更易在冲击波的作用下脱落,使得载药层211从球囊20的外表面脱落,从而使活性药物被血管组织吸收。如此,通过合理选择载体的种类,使药物涂层21在抵达病变血管处前不随意脱落,同时在抵达病变血管处后,药物涂层21能够在冲击波的作用下及时破碎并脱落。
[0058]
可选地,作为本实施例的其中一种可选实施方式,活性药物可以为雷帕霉素、佐他莫司、他克莫司、紫杉醇、地塞米松及其衍生物中的至少一种,活性药物在球囊20外表面的单位载药量为0.1μg/mm2‑
2μg/mm2,例如0.5μg/mm2、1μg/mm2或1.5μg/mm2。具体应用中,活性药物能够有效抑制平滑肌细胞过度增生,降低血管再狭窄发生率,从而达到在有效扩张血管钙化病变的同时降低远期再狭窄发生率的目的。
[0059]
可选地,作为本实施例的其中一种可选实施方式,高分子载体可以采用多元醇、聚酯类物质、泊洛沙姆、碘普罗胺、聚乙烯吡咯烷酮、吐温中的至少一种,低分子载体可以采用多元醇、有机酸盐、尿素中的至少一种。具体应用中,保护层212能够保护内部的载药层211不会在血液的冲刷下脱落,并且保护层212可以对冲击波具有敏感性,即保护层212可以在冲击波的作用下,容易破碎并脱落,有利于载药层211中的药物扩散和吸收,同时保护层212在冲击波的作用下会被击碎至更小尺寸,避免保护层212的碎片在血管下游集结堵塞。
[0060]
可选地,作为本实施例的其中一种可选实施方式,酯类物质可以采用聚乳酸、聚乙醇酸、聚乳酸
‑
乙醇酸共聚物、聚丁二酸丁二醇酯、聚羟基脂肪酸酯、聚己内酯、聚己二酸乙二醇酯或聚羟基丁酸酯戊酸酯共聚物中的至少一种。具体应用中,载药层211和保护层212也可以由其他合适的成分和结构构成,本实施例不加以限制。
[0061]
作为本实施例的其中一种可选实施方式,请一并参考图1和图3,冲击波部件3为连接有导线6的冲击波电极30,冲击波电极30包括第一电极31、第二电极32以及位于第一电极
31和第二电极32之间的绝缘部33。具体应用中,第一电极31和第二电极32可以分别连接于脉冲电源主机5的正极和负极,第一电极31和第二电极32在接收电信号后,第一电极31和第二电极32之间可以发生液电效应,以产生冲击波并作用于球囊20和/或钙化病变。
[0062]
具体地,在第一电极31和第二电极32接收电信号后,电极之间液体中的电子被加速,并电离电极附近的液体分子。液体中被电离出的电子被电极间强电场加速电离出更多的电子,形成电子雪崩。在液体分子被电离的区域形成等离子体通道,随着电离区域的扩展,在电极间形成放电通道,液体被击穿。放电通道产生后,由于放电电阻很小,将产生放电电流并加热通道周围液体,使液体汽化并迅速向外膨胀。迅速膨胀的气腔外沿在液体介质中产生冲击波,并且冲击波随放电电流和放电时间的不同,以冲量或者冲击压力的方式作用于周围介质。
[0063]
具体应用中,冲击波部件3可以设置有多组且可以朝向于不同方向,各冲击波部件3可以单独控制,使得冲击波部件3可以选择性的向各方向发射冲击波,实现定向治疗,提高手术精度和效果。
[0064]
具体地,作为本实施例的其中一种可选实施方式,请参考图3,第一电极31可以呈环状结构并连接于导管1,且第一电极31可以设置有电极孔34,第二电极32可以位于第一电极31内部并朝向于电极孔34,绝缘部33位于电极孔34中以将第一电极31和第二电极32分隔。优选地,本实施方式中第一电极31的直径可以与导管1的直径相同,且两者可以同轴设置。具体应用中,第一电极31、第二电极32以及电极孔34的数量和位置可以根据实际情况合理设置,本实施例不加以限制。
[0065]
或者,作为上述实施方式的可选替代实施方式,请一并参考图1和图4,绝缘部33可以为导线6位于球囊20内部的导线断口60,导线6在导线断口60的两端分别形成第一电极和第二电极,如此,第一电极和第二电极也可以在接收到电信号后,发生液电效应并产生冲击波。当然,在别的实施方式中,第一电极、第二电极和绝缘部可以为其他合适的具体结构,或者,冲击波部件3也可以为超声波器件,超声波器件可以产生超声波,具体应用中,载药层211和保护层212对冲击波(尤其是超声波)具有敏感性,超声波可以进一步提高药物涂层21的脱落及活性药物的吸收效率,同时超声波作为附加驱动力,也可以使药物能够快速扩散至中膜,减少短期内血流冲刷血管内壁造成的药物流失,且药物存续时间会延长,从而使得组织中的有效药物浓度维系时间变长,进一步降低远期再狭窄的发生率。
[0066]
作为本实施例的其中一种可选实施方式,请参考图1,导管1包括导管本体10、导管座11和导管接头12,导管本体10的一端贯穿球囊20,导管本体10的另一端连接于导管座11,冲击波部件3的导线6伸出于导管座11并连接于导管接头12。具体地,导管座11可以具有多个端口111,端口111可以用于供导线6以及液体介质等通过,具体应用中,导管本体10靠近球囊20的一端可以具有光滑的倒角结构,且导管本体10在球囊20内部可以设置有显影环13,以便于导管1在血管中行进。
[0067]
本申请提供的一种药物球囊导管的有益效果在于:与现有技术相比,本申请提供的药物球囊导管利用保护层212来减少输送过程中血液冲刷对载药层211的影响,有效防止载药层211的脱落,减少浪费,并且在药物球囊导管输送至预定位置时,可以通过冲击波部件3产生的冲击波对药物涂层21进行破坏,使得药物涂层21及时脱落,同时,在冲击波的作用下,能够促进组织对载药层211的吸收,提高药物利用率(经申请人测试,本实施例在体外
动物血管模型模拟测试的结果显示,活性药物从球囊20转移至组织上的转载率达30%
‑
60%),不会对下游组织产生影响,并且冲击波还可以对脱落的保护层212进行破碎,不会在血管内造成堵塞。另外,对于血管钙化严重的病变,冲击波可以选择性地破碎血管壁中的钙化病灶,造成钙化斑块破碎的同时加速药物转移至血管壁。
[0068]
本申请实施例还提供了一种药物球囊导管系统,请参考图1,药物球囊导管系统包括控制组件和上述的一种药物球囊导管,冲击波部件3通过导线6连接于控制组件。具体应用中,操作人员可以通过控制组件控制药物球囊导管,并由此控制冲击波部件3的工作频率和放电周期,可以根据不同情况,调整冲击波的工作频率和放电周期,进一步提高手术效果。
[0069]
作为本实施例的其中一种可选实施方式,控制组件包括连接于冲击波部件3的操作手柄4、连接于操作手柄4的脉冲电源主机5和用于控制球囊20扩张或收缩的灌注泵7。具体应用中,冲击波部件3的导线6可以通过导管接头12与操作手柄4连接,脉冲电源主机5可以发射电信号至冲击波部件3,以驱动冲击波部件3产生冲击波,灌注泵7可以通过导管1向球囊20内灌注液体介质(例如造影剂和生理盐水等),使球囊20膨胀或收缩,同时可以清除液体介质中因液电效应产生的气体。
[0070]
本申请提供的一种药物球囊导管系统的有益效果在于:与现有技术相比,本申请提供的药物球囊导管系统,通过控制组件来控制药物球囊导管,能够有效防止术中药物的浪费,提高药物利用率,在破碎血管钙化病灶的同时使血管壁加快吸收抗增生药物,进而缩短了血管钙化病变的手术治疗时间。
[0071]
本申请实施例还提供了一种药物球囊导管系统的控制方法,用于控制上述的一种药物球囊导管系统,请参考图5,控制方法包括如下步骤:
[0072]
球囊20扩张并贴近血管壁,脉冲电源主机5发射第一电信号,使冲击波部件3产生冲击波以破坏药物涂层21和/或钙化病变;
[0073]
球囊20继续扩张至设定压力,脉冲电源主机5发射第二电信号,使冲击波部件3产生冲击波以促进活性药物吸收;
[0074]
冲击波部件3于第一电信号下的工作功率高于第二电信号下的工作功率。
[0075]
可选地,作为本实施例的其中一种可选实施方式,冲击波部件3于第一电信号下的工作电压可以为500v
‑
3500v,工作频率可以为0.1hz
‑
50hz,放电周期为10s
‑
120s,例如,工作电压可以为1000v、2000v或3000v,工作频率可以为1hz、5hz或10hz,放电周期可以为30s、45s、90s或100s。冲击波部件3于第二电信号下的工作电压可以为500v
‑
3500v,工作频率可以为0.1hz
‑
50hz,放电周期可以持续10s
‑
120s,例如,工作电压可以为500v、1000v、或1500v,工作频率可以为1hz、5hz或10hz,放电周期可以持续30s、45s、90s或100s。
[0076]
具体地,冲击波部件3在第一电信号和第二电信号下的工作电压范围、工作频率范围和放电周期范围可以相同,但在第一电信号下和第二电信号下可以选取不同的参数,进一步地,冲击波部件3在第一电信号下所选取的工作电压、工作频率和放电周期可以大于或等于第二电信号下所选取的工作电压、工作频率和放电周期。
[0077]
具体应用中,在药物球囊导管可以通过导丝输送至病灶位置处,并利用显影环13定位,而后可以通过灌注泵7输送液体介质扩张膨胀球囊20,以使球囊20的外表面贴近血管壁,同时控制液体介质在球囊20和灌注泵7之间循环,而后通过操作手柄4,使脉冲电源主机
5发射第一电信号,冲击波部件3会产生冲击波,以破坏药物涂层21和/或钙化病变,在其放电周期结束后,继续扩张球囊20至设定压力,使球囊20的外表面进一步贴合血管壁,此时脉冲电源主机5发射第二电信号至冲击波部件3处,冲击波部件3产生冲击波,促进活性药物从血管壁渗透进入组织中,同时,可以将保护层212及其他赋形剂击碎至更小尺寸,以避免造成下游及远端血管栓塞,减少术后并发症。第二电信号的放电周期结束后,脉冲电源主机5停止工作,灌注泵7收缩球囊20,使球囊20恢复原尺寸。
[0078]
本申请实施例提供的一种药物球囊导管系统的控制方法的有益效果在于:与现有技术相比,本申请提供的一种药物球囊导管系统的控制方法,利用脉冲电源主机5发射的第一电信号和第二电信号,来控制冲击波部件3的工作频率和放电周期,使得冲击波部件3在特定工作频率和放电周期下实现不同的用途,一方面能够破碎钙化病灶且加快药物吸收,有效提高药物利用率,同时缩短手术时间,另一方面,能够避免下游血管堵塞,减少术后并发症。
[0079]
实施例二:
[0080]
本实施例提供了一种药物球囊导管,本实施例与实施例一的区别在于,请参考图6,药物涂层21包括活性药物和高分子载体,活性药物可以与高分子载体剂均匀混合后喷涂于球囊20的外表面,使球囊20的外表面形成一层稳定的药物涂层21,该药物涂层21中的高分子载体能够使活性药物稳定地粘附在球囊20的表面,有效避免因血液冲刷而导致的药物涂层21脱落,防止活性药物的浪费。同时,本实施例的药物涂层21可以在冲击波的作用下,从球囊20的外表面脱落,促进血管组织吸收活性药物,并且冲击波还能够将赋形剂击碎至更小尺寸,避免其在下游血管聚集而造成堵塞,提高手术的治疗效果。
[0081]
作为本实施例的其中一种可选实施方式,高分子载体可以采用多元醇、聚酯类物质、泊洛沙姆、碘普罗胺、聚乙烯吡咯烷酮、吐温中的至少一种,具体应用中,高分子载体能够保护的药物涂层21不会在血液的冲刷下脱落,并且高分子载体可以对冲击波具有敏感性,即高分子载体可以在冲击波的作用下,容易破碎并脱落,有利于药物涂层21中的活性药物扩散和吸收,同时高分子载体在冲击波的作用下会被击碎至更小尺寸,避免碎片在血管下游集结堵塞。
[0082]
可选地,作为本实施例的其中一种可选实施方式,酯类物质可以采用聚乳酸、聚乙醇酸、聚乳酸
‑
乙醇酸共聚物、聚丁二酸丁二醇酯、聚羟基脂肪酸酯、聚己内酯、聚己二酸乙二醇酯或聚羟基丁酸酯戊酸酯共聚物中的至少一种。具体应用中,高分子载体也可以由其他合适的成分和结构构成,本实施例不加以限制。
[0083]
本申请提供的一种药物球囊导管的有益效果在于:与现有技术相比,本申请提供的药物球囊导管利用高分子载体来提高药物涂层21的稳定性,以减少输送过程中血液冲刷对药物涂层21的影响,有效防止药物涂层21的脱落,减少浪费,并且在药物球囊导管输送至预定位置时,可以通过冲击波部件3产生的冲击波对药物涂层21进行破坏,使得药物涂层21及时脱落,同时,在冲击波的作用下,能够促进组织对活性药物的吸收,提高药物利用率(经申请人测试,本实施例在体外动物血管模型模拟测试的结果显示,活性药物从球囊20转移至组织上的转载率达25%
‑
55%),不会对下游组织产生影响,并且冲击波还可以对脱落的高分子载体进行破碎,不会在血管内造成堵塞。另外,对于血管钙化严重的病变,冲击波可以选择性地破碎血管壁中的钙化病灶,造成钙化斑块破碎的同时加速药物转移至血管壁。
[0084]
实施例三:
[0085]
本实施例提供了一种药物球囊导管,本实施例与实施例一、实施例二的区别在于,请参考图7,药物涂层21包括活性药物和用于包裹活性药物的脂质体213,具体地,脂质体213可以呈空心球状,活性药物可以位于脂质体213的内部,脂质体213具有靶向性、缓释性以及细胞亲和性,并且脂质体213对冲击波具有一定的敏感性,在冲击波的作用下,脂质体213会分散并转移至组织处,继而发生破裂,释放其内部的活性药物,有效组织对活性药物的吸收率,提高手术效果。
[0086]
可选地,作为本实施例的其中一种可选实施方式,脂质体213可以采用胆固醇、卵磷脂、大豆磷脂、脑磷脂、聚乙烯醇、聚乳酸
‑
乙醇酸共聚物中的至少一种,脂质体213的尺寸可以在0.1um
‑
10um之间,例如0.5um、1um和5um等,较小的颗粒有利于组织的吸收,同时也可以进一步避免脂质体213的堆积对血管的堵塞。
[0087]
本申请提供的一种药物球囊导管的有益效果在于:与现有技术相比,本申请提供的药物球囊导管利用脂质体213来提高药物涂层21的稳定性,以减少输送过程中血液冲刷对药物涂层21的影响,有效防止药物涂层21的脱落,减少浪费,并且在药物球囊导管输送至预定位置时,可以通过冲击波部件3产生的冲击波对药物涂层21进行破坏,使得药物涂层21及时脱落并击碎脂质体213,使脂质体内部的活性药物释放出来,同时,在冲击波的作用下,能够促进组织对活性药物的吸收,提高药物利用率(经申请人测试,本实施例在体外动物血管模型模拟测试的结果显示,活性药物从球囊20转移至组织上的转载率达15%
‑
40%),不会对下游组织产生影响。另外,对于血管钙化严重的病变,冲击波可以选择性地破碎血管壁中的钙化病灶,造成钙化斑块破碎的同时加速药物转移至血管壁。
[0088]
以上所述仅为本申请的较佳实施例而已,并不用以限制本申请,凡在本申请的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本申请的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1