指甲醌的新用途
1.本发明涉及生物医药技术领域,具体涉及凤仙花提取物或lawsone在制备治疗自身免疫疾病的药物中的应用。
背景技术:
2.神奇的自然界蕴含着最丰富的化学多样性,传统中医药材大多来源于自然植物,中外医用药物的发展一直都与天然小分子化合物的开发和研究密切相关。指甲花因其花头、翅、状如飞禽,似传说中仙鸟凤凰,又名凤仙花,为凤仙花科植物凤仙花impatiens balsamina l.的全草。凤仙花主要含黄酮醇类及萘醌衍生物,如2-甲氧基-1,4-萘醌、山奈酚-3-鼠李糖基双葡萄糖苷、2-羟基-1,4-萘酚等,凤仙花的根含有指甲醌(lawsone)、2-甲氧基-1,4-萘醌(2-methoxy-1,4-naphtho-quinone)、东莨菪素、异嗪皮啶,菠菜甾醇(spinasterol等,具有抗真菌、抗过敏、抗炎镇痛、促皮透析等作用。
3.多发性硬化症(multiple sclerosis,ms)为一种典型的由t细胞介导的免疫细胞引发的以中枢神经系统(central nervous system,cns)炎症、脱髓鞘病变和神经损伤为主要特征的自身免疫疾病,临床症状主要表现为肌肉无力、肢体感觉障碍、视觉障碍、认知障碍、忧郁、晕眩、共济失调、膀胱或直肠功能障碍等,少数患者伴有癫痫及智力障碍,是造成中青年人非创伤性瘫痪的首要原因,被称为“死不了的癌症”,实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,eae)因病理特征与ms极为相似而被广泛用于研究ms的理想动物模型。2018年5月,ms被纳入中国《第一批罕见病目录》,2020年8月the lancet regional health杂志报道了我国大陆地区ms发病率,填补了中国ms流行病学数据的空白,研究表明我国儿童发病率为0.055/100000,成人发病率为0.288/100000,发病高峰期年龄为40-49岁,严重影响患者的生活质量,对患者家庭和社会造成巨大经济负担,全球约200万患者,每年相关费用超过240亿美元,研发新的治疗ms药物迫在眉睫而任重道远。
4.对于ms的治疗,临床药物芬戈莫德(fingolimod,fty-720)由日本科学家于20世纪80年代末将真菌辛克莱虫草和其近亲冬虫夏草作为研究对象分离得到具有较强免疫抑制活性的化合物isp-i,并将其作为苗头化合物进行一系列结构优化而最终获得,为fda批准的第一个用于治疗rrms的口服药;富马酸二甲酯原本是一种抑菌、防潮、防霉的常用工业原料,价格低廉、结构简单,被多发性硬化症领域的主导者biogen idec公司成功开发用于多发性硬化症治疗,2013年获得美国fda批准上市,上市后如重磅炸弹席卷全球;2018年7月23日,由赛诺菲公司研发的奥巴捷(特立氟胺片)获得国家药品监督管理局批准在华上市,用于治疗复发型多发性硬化症。芬戈莫德、富马酸二甲酯和特立氟胺三种ms临床药物均为小分子化合物,三者的成功研发同样启发着诸多科学家相继将目光转向天然小分子化合物,希望从中发现能够治愈ms的药物。
5.lawsone作为一种天然小分子化合物,因可与角蛋白发生反应,产生永久性染色,作为天然染色剂用于染头发和指甲以及纹身已有5000多年历史,并被fda批准用于化妆品
用途。但是迄今为止,相关文献报道多集中在lawsone及其衍生物的提取、含量测定、化学合成、结构改造以及抑菌性质的研究,与免疫相关的文献报道几乎空白。
6.进一步的,专利文献wo1991006863a1中公开了二氯烯丙基散沫花素(dichloroallyl lawsone)可以治疗ms,以及专利us20030139353a1中公开了拓扑异构酶抑制剂(topoisomerase inhibitor)治疗ms,但是该专利中明确表明plumbagin、lawsone或juglone对于ms的缓解没有作用。
技术实现要素:
7.为了进一步研究ms的致病机理,以及开发更多的可以治愈ms的天然小分子化合物。本技术提供了lawsone在治疗自身免疫疾病(尤其在于ms或eae)中的用途,并经试验验证表明lawsone给药不仅推迟小鼠eae发病时间,而且剂量依赖式缓解疾病严重程度,且安全无毒副作用。表明lawsone可显著缓解多发性硬化症(multiple sclerosis,ms)动物模型小鼠eae临床症状,体内和体外结果均显示显著抑制炎性cd4
+
t细胞比例。进一步的,本技术从作用机理上明确,lawsone对于自身免疫疾病的治疗作用主要体现在对炎性cd4
+
t细胞亚型th1分化的抑制上(包括体内和体外),而且显著降低体内外周免疫系统脾脏和引流淋巴结及浸润至中枢神经系统脑和脊髓中的th1细胞,但却不影响th17和treg细胞。
8.事实上,有证据证明th1与th17细胞都能够独立的诱导eae,基于组织形态学和cns趋化因子谱的不同推断th1细胞和th17细胞可能通过不同机制诱导产生不同类型的eae。也就是说,本技术从机理上的研究更加透彻的让大众了解lawsone的治疗靶点,以为自身免疫疾病的治疗提供新的思路。也更加证明了,lawsone对于自身免疫疾病的治疗主要体现在由th1介导产生的自身免疫疾病的治疗,对于th17介导的自身免疫疾病没有作用。对于th1和th17细胞在eae致病机理上的差异和共性将为ms的治疗提供有效思路和靶点。
9.本发明的第一方面,提供了一种凤仙花提取物在制备治疗自身免疫疾病的药物中的应用。
10.优选的,所述的自身免疫疾病为器官特异性自身免疫病或系统性自身免疫病。所述的器官特异性自身免疫病包括但不限于慢性淋巴细胞性甲状腺炎、甲状腺功能亢进、胰岛素依赖型糖尿病、重症肌无力、溃疡性结肠炎、恶性贫血伴慢性萎缩性胃炎、肺出血肾炎综合征、寻常天疱疮、类天疱疮、原发性胆汁性肝硬化、多发性脑脊髓硬化症、急性特发性多神经炎。所述的系统性自身免疫病包括但不限于系统性红斑狼疮、类风湿关节炎、系统性血管炎、硬皮病、天疱疮、皮肌炎、混合性结缔组织病、自身免疫性溶血性贫血、甲状腺自身免疫病、溃疡性结肠炎。
11.进一步优选的,所述的自身免疫疾病包括但不限于过敏、自身免疫性脑脊髓炎、多发性硬化症、哮喘、皮炎、心肌炎、肾炎、肝炎、系统性红斑狼疮、类风湿性关节炎、硬皮病、甲状腺功能亢进、原发性血小板减少性紫癜、自身免疫性溶血性贫血、溃疡性结肠炎、自身免疫性肝病、糖尿病、疼痛或神经障碍。
12.在本发明的一个具体实施方式中,所述的自身免疫疾病为自身免疫性脑脊髓炎(实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,eae))或多发性硬化症(multiple sclerosi s,ms)。
13.本发明的第二方面,提供了凤仙花提取物在抑制cd4
+
t细胞亚型比例或在髓鞘再
生中的应用。
14.本发明的第三方面,提供了凤仙花提取物在制备抑制cd4
+
t细胞亚型比例在制备髓鞘再生的产品中的应用。
15.优选的,所述的cd4
+
t细胞亚型选自th1、th17或treg。
16.优选的,所述的凤仙花提取物选自凤仙花的根、茎、叶、花、果实或种子的提取物。
17.在本发明的一个具体实施方式中,所述的凤仙花提取物为凤仙花的根的提取物。
18.所述的凤仙花提取物可以采用任何常规方式进行提取。优选为采用煎煮法、渗漉法、超声提取法、浸渍法、水蒸气蒸馏法或超临界萃取的提取方法获得。
19.优选的,所述的凤仙花提取物包含质量百分比50%-99.9%的lawsone。具体可以为55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或99.9%的lawsone。
20.进一步优选的,所述的凤仙花提取物还可以包含黄酮醇类、2-甲氧基-1,4-萘醌、山奈酚-3-鼠李糖基双葡萄糖苷、2-羟基-1,4-萘酚、东莨菪素、异嗪皮啶或菠菜甾醇。
21.本发明的第四方面,提供了一种治疗自身免疫疾病的药物,所述的药物包含凤仙花提取物或lawsone。
22.优选的,所述的药物还包含药学上可接受的辅料。所述的辅料包括但不限于载体、稀释剂、粘合剂、润滑剂或润湿剂。
23.优选的,所述的药物剂型可以为片剂、胶囊、丸剂、注射剂、吸入剂、含片、栓剂、乳剂、微乳剂、亚微乳剂、纳米颗粒、凝胶剂、粉剂、悬乳液、乳膏剂、胶冻剂或喷雾剂等。
24.优选的,所述的药物的给药方式可以为口服、肠给药、皮下注射、肌肉注射、静脉注射、鼻腔给药、透皮给药、结膜下给药、眼球内给药、眼眶给药、眼球后给药、视网膜给药、脉络膜给药、鞘内注射等。
25.本发明的第五方面,提供了lawsone在制备治疗自身免疫疾病的药物中的应用。
26.优选的,所述的自身免疫疾病为器官特异性自身免疫病或系统性自身免疫病。所述的器官特异性自身免疫病包括但不限于慢性淋巴细胞性甲状腺炎、甲状腺功能亢进、胰岛素依赖型糖尿病、重症肌无力、溃疡性结肠炎、恶性贫血伴慢性萎缩性胃炎、肺出血肾炎综合征、寻常天疱疮、类天疱疮、原发性胆汁性肝硬化、多发性脑脊髓硬化症、急性特发性多神经炎。所述的系统性自身免疫病包括但不限于系统性红斑狼疮、类风湿关节炎、系统性血管炎、硬皮病、天疱疮、皮肌炎、混合性结缔组织病、自身免疫性溶血性贫血、甲状腺自身免疫病、溃疡性结肠炎。
27.进一步优选的,所述的自身免疫疾病包括但不限于过敏、自身免疫性脑脊髓炎、多发性硬化症、哮喘、皮炎、心肌炎、肾炎、肝炎、系统性红斑狼疮、类风湿性关节炎、硬皮病、甲状腺功能亢进、原发性血小板减少性紫癜、自身免疫性溶血性贫血、溃疡性结肠炎、自身免疫性肝病、糖尿病、疼痛或神经障碍。
28.在本发明的一个具体实施方式中,所述的自身免疫疾病为自身免疫性脑脊髓炎(实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,eae))或多发性硬化症(multiple sclerosi s,ms)。
29.本发明的第六方面,提供了lawsone在抑制cd4
+
t细胞亚型比例在髓鞘再生中的应用。
30.本发明的第七方面,提供了lawsone在制备抑制cd4
+
t细胞亚型比例在制备髓鞘再生的产品中的应用。
31.优选的,所述的cd4
+
t细胞亚型选自th1、th17或treg。
32.本发明的第八方面,提供了一种治疗自身免疫疾病的方法,所述的方法包括向个体施加凤仙花提取物、lawsone或者上述的药物。
33.本发明的第九方面,提供了一种分析自身免疫疾病致病机理或确定自身免疫疾病待治疗靶点的方法,所述的方法包括向个体施加凤仙花提取物或lawsone或上述的药物,然后检测潜在靶点。
34.优选的,所述的检测方法包括rna-seq转录组和蛋白质谱分析。
35.优选的,所述的靶点包括基因水平和蛋白水平的靶点。进一步优选的,基因水平的靶点采用crispr/cas9技术寻找,所述蛋白水平的靶点采用darts-ms技术寻找。
36.本发明的第十方面,提供了一种构建动物模型的方法,所述的方法包括确定自身免疫疾病待治疗靶点的步骤,然后结合抑制剂或激动剂,敲除或者过表达靶基因等方式构建动物模型。
37.本发明所述的“个体”可以为人或非人动物。所述的非人动物优选为非人哺乳动物,包括但不限于猴、犬、兔、鼠、牛、羊等等。
38.本发明所述的“药学上可接受的”是指既不显著刺激生物体也不抑制所施用的产品的活性物质的生物学活性及特性。所述的“药学上可接受的辅料”,所述辅料包括但不限于载体、稀释剂、粘合剂、润滑剂、润湿剂。
39.本发明所述的“施加”可以为口服、肠给药、皮下注射、肌肉注射、静脉注射、鼻腔给药、透皮给药、结膜下给药、眼球内给药、眼眶给药、眼球后给药、视网膜给药、脉络膜给药、鞘内注射等。
40.本发明所述的“cd4
+
t细胞亚型比例”即为cd4
+
t细胞的各亚型个数占总cd4
+
t细胞个数的比值,在本发明的一个具体实施方式中,所述的cd4
+
t细胞亚型选自th1、th17或treg。也就是说th1比例即为th1个数占cd4
+
t细胞个数的比例。th17或treg比例同理。
41.本发明所述的“抑制”,例如抑制cd4
+
t细胞亚型比例,即为其他条件不变的条件下,施加某种化合物与未施加某种化合物相对照,降低了原有的比例。
42.本技术所述的“lawsone”为指甲花醌、指甲醌、醌蒽醌吨酮类或散沫花素,化学式为:c
10
h6o3,结构式为:
[0043][0044]
本发明所述的“治疗”表示在疾病已开始发展后减缓、中断、阻止、控制、停止、减轻、或逆转一种体征、症状、失调、病症、或疾病的进展或严重性,但不一定涉及所有疾病相关体征、症状、病症、或失调的完全消除。
附图说明
[0045]
以下,结合附图来详细说明本发明的实施例,其中:
[0046]
图1:cd4
+
t细胞体外分化th1细胞流式图(图1a)和统计图(图1b),*p《0.05,***p《0.001(student’s t-test)。
[0047]
图2:lawsone对th17和treg分化结果,其中,图a代表cd4
+
t细胞体外分化为th17细胞流式分析图;图b代表th17细胞占cd4
+
t细胞比例统计图;图c代表cd4
+
t细胞体外分化为treg细胞流式分析图;图d代表treg细胞占cd4
+
t细胞比例统计图。
[0048]
图3:中枢神经系统脑和脊髓中浸润th1(图3a)、th17(图3b)和treg(图3c)细胞占cd4
+
t细胞的比例。
[0049]
图4:lawsone减少eae小鼠体内脾脏和引流淋巴结中cd4
+
t细胞亚群th1比例,其中,a为脾脏中th1、th17和treg细胞占cd4
+
t细胞的比例;b为引流淋巴结中th1、th17和treg细胞占cd4
+
t细胞的比例,*p《0.05,***p《0.001(student’s t-test)。
[0050]
图5:sds-page凝胶银染图。
[0051]
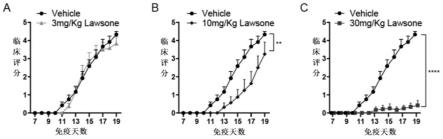
图6:lawsone通过抑制th1细胞缓解小鼠eae临床症状,其中,图a代表低剂量lawsone(3mg/kg)组;图b代表中等剂量lawsone(10mg/kg)组;图c代表高剂量lawsone(30mg/kg)组。
[0052]
图7:lawsone治疗性给药显著改善eae小鼠疾病进程和严重程度,其中,图a为从eae模型免疫诱导后第14天开始灌胃给药,图b为从eae模型免疫诱导后第18天开始灌胃给药。
[0053]
图8:lawsone对小鼠免疫稳态的影响情况。其中,a为体重变化情况;b为脾脏中主要免疫细胞类型的变化;c为引流淋巴结中主要免疫细胞类型的变化;d为血液中主要免疫细胞类型的变化。
具体实施方式
[0054]
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明的部分实施例,而不是全部。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0055]
实施例中使用的疾病小鼠模型(eae小鼠模型)的制备:
[0056]
选取8-10周龄雄性c57bl/6小鼠,以200μg少突胶质细胞髓磷脂糖蛋白mog
35-55联合等体积完全弗氏佐剂(含5mg/ml结核菌素mtb)背部皮下免疫,第0天及第2天小鼠腹腔注射200ng百日咳毒素ptx,获得eae小鼠模型。
[0057]
实施例1 lawsone体外抑制th1分化
[0058]
本实施例主要确定lawsone体外细胞水平上是否直接影响作为致病性cd4
+
t细胞亚群的th1的分化。同时,不影响th17和treg分化效果。
[0059]
试验步骤:
[0060]
取7-8周龄c57bl/6小鼠,分离脾脏,用红细胞裂解液去除红细胞,biolegend磁珠负选cd4
+
t细胞,加入cd3和cd28抗体激活t细胞,添加相应细胞因子和中和抗体诱导th1(il-12和anti-il4)、th17(tgfβ、il-6、tnfα、il-1β、il-23、anti-il4和anti-ifnγ)或treg
(tgfβ、il-2和anti-ifnγ)分化,同时,加入终浓度为25μm、50μm或100μm lawsone,每浓度梯度设3复孔,对照组加入同体积的二甲基亚砜dmso,分别37℃、5%co2细胞培养箱中培养72h,显微镜下观察药物对细胞生长状态的影响,流式分析胞内th1特征性细胞因子ifn-γ的表达,以及th17、treg特征性细胞因子胞内il-17a和核内foxp3表达变化。
[0061]
试验结果:
[0062]
lawsone对th1的分化结果见图1,结果表明lawsone在不影响细胞数量、生长状态以及克隆形成能力情况下剂量依赖式抑制th1分化。
[0063]
lawsone对th17和treg分化结果见图2,结果表明lawsone体外并不影响th17和treg分化。
[0064]
实施例2 lawsone减少eae小鼠体内cd4
+
t细胞亚群th1比例
[0065]
从eae小鼠建模第三天起,每天单次不同剂量lawsone灌胃或溶剂灌胃给药。10%水合氯醛麻醉,取溶剂对照组(dmso)和lawsone给药组eae小鼠发病前期(第7天)免疫外周器官脾脏和引流淋巴结以及发病高峰期(19天)中枢免疫系统脑和脊髓,获得单细胞悬液后体外mog
35-55
抗原重刺激,对细胞进行cd4
+
t亚群th1、th17和treg细胞的染色,流式分析lawsone给药对eae小鼠体内th1、th17和treg细胞的影响。
[0066]
eae诱导第19天取对照组和lawsone给药组小鼠脑和脊髓中浸润免疫细胞,流式分析结果见图3。相较于对照组,lawsone给药不仅明显减少浸润至中枢神经系统脑和脊髓中th1细胞比例,而th17和treg细胞比例均没有明显变化。
[0067]
eae诱导第7天小鼠脾脏和引流淋巴结中免疫细胞,通过细胞表面抗原cd4染色和胞内ifn-γ、il17a以及核内foxp3染色,流式细胞仪检测脾脏cd4
+
t细胞中th1、th17和treg细胞亚群比例结果见图4,结果显示,显著降低脾脏、引流淋巴结中th1细胞。
[0068]
实施例3 lawsone作用靶点
[0069]
从7-8周龄c57bl/6小鼠脾脏中分离cd4
+
t细胞,体外诱导th1极化,加入终浓度100μm lawsone或dmso,诱导分化72h,收集dmso(对照组)或lawsone处理的th1细胞,进行darts实验,sds-page电泳后银染,鉴定lawsone处理被保护的差异蛋白。
[0070]
72h收集细胞裂蛋白,分别以链霉蛋白酶质量:总蛋白质量=1:100、1:500或1:1000加入,室温孵育20min后,蛋白酶抑制剂终止反应,sds-page电泳后银染结果见图5。结果表明与对照组相比,在40kd、50kd和70kd附近均显示因与lawsone结合未被降的蛋白条带,切下差异条带进行后续质谱检测,以确定lawsone的作用靶点。
[0071]
取eae发病前期的引流淋巴结、脾脏、外周血和发病高峰期的脑和脊髓,对每个样本进行barcoding编码,将细胞重悬于50μl maxpar细胞染色缓冲液中,加入fc-受体(biolegend)封闭溶液,温育10min,然后加入50μl重金属元素标记的抗体混合物以使总体积为100μl进行细胞染色,包括18个细胞表面标记,10个磷酸化蛋白,7个转录因子和其他炎症标记抗体。cytof实验检测靶点抗体列表详见表1-3。
[0072]
表1
[0073][0074][0075]
表2
[0076][0077]
表3
[0078][0079]
实施例4 lawsone显著缓解eae小鼠临床症状
[0080]
在eae模型诱导后第3天开始进行预防性灌胃给药,分为低剂量组lawsone(3mg/kg)、中剂量组lawsone(10mg/kg)和高剂量组lawsone(30mg/kg)。每天同一时间每只小鼠给药200μl,对照组给予相同体积溶剂(dmso)对照,eae小鼠发病后每天记录临床评分。采用标准5分法对小鼠进行神经功能评分:0分,无临床表征;1分,尾部瘫痪无力;2分,轻瘫(虚弱,单或双后肢不完全瘫痪);3分,截瘫(双后肢完全瘫痪);4分,截瘫伴随前肢麻痹;5分,垂死或死亡。
[0081]
结果显示lawsone给药不仅推迟eae小鼠发病时间,而且剂量依赖式缓解eae发病的严重程度(见图6)。
[0082]
实施例5 lawsone治疗性给药显著改善eae小鼠疾病进程和严重程度
[0083]
考虑到ms病人一般在表现出临床症状后才进行药物治疗,因此,本实施例在不同疾病进程对eae小鼠进行治疗性给药。
[0084]
分别在eae免疫诱导后第14天(急性进展期,临床平均分为1.6分)和第18天(高峰期)开始灌胃给药治疗,剂量为30mg/kg,每天同一时间每只小鼠给药200μl,相同体积溶剂(dmso)做对照,每天记录临床评分。。结果显示lawsone可有效阻断疾病的快速发展并显著
缓解eae小鼠疾病严重程度(见图7),表明lawsone不仅干预eae起病阶段的病理活动,一旦发病,对疾病的治疗同样效果显著。
[0085]
实施例6 lawsone不影响小鼠免疫稳态
[0086]
lawsone在30mg/kg剂量下效果最为显著,本实施例目的在于验证该剂量下的安全性。
[0087]
选取7-8周c57bl/6小鼠,30mg/kg剂量lawsone每天灌胃给药,每天每只小鼠给药200μl,对照组给予相同体积溶剂对照,5天称一次体重,20天后分别取外周脾脏、引流淋巴结和血液,流式分析不同免疫细胞类型的变化情况,结果表明lawsone不影响外周脾脏、引流淋巴结以及血液中cd4
+
t、cd8
+
t、cd19、cd11b、nk1.1、ly6g和ly6c免疫细胞亚群(见图8),小鼠生长发育正常,说明该剂量不影响小鼠免疫稳态,无毒副作用。
[0088]
以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,这些简单变型均属于本发明的保护范围。
[0089]
另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本发明对各种可能的组合方式不再另行说明。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1