氧化铈纳米颗粒在制备增强细胞毒性CD8+T细胞活性的药物中的应用
氧化铈纳米颗粒在制备增强细胞毒性cd8+t细胞活性的药物中的应用
技术领域
1.本发明属于生物医药技术领域,具体涉及氧化铈纳米颗粒在制备增强细胞毒性cd8+t细胞活性的药物中的应用。
背景技术:
2.细胞毒性cd8
+
t细胞(cytotoxic cd8
+
t cells,ctls)对控制病毒,肿瘤和胞内细菌感染十分重要。2020年爆发的新型冠状肺炎(sars
‑
cov
‑
2)中ctls被证实在抵抗sars
‑
cov
‑
2感染,防止无症状感染者和轻症感染者向中重症感染的进展中都发挥了重要的作用。当机体遭遇抗原后,抗原递呈细胞在次级淋巴器官中激活初始的cd8
+
t细胞(cd8
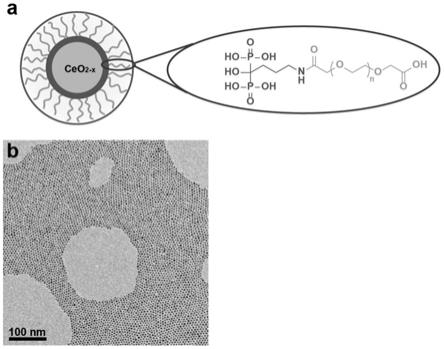
+
t cells)。激活的cd8
+
t细胞经过克隆增殖后迁移到感染局部通过直接杀伤或释放效应分子如ifn
‑
γ,il
‑
2,tnf
‑
α,颗粒酶b和穿孔素对病原微生物或癌细胞进行杀伤。因此如何有效提高ctls活性对病原微生物和肿瘤进行有效杀伤显得十分的重要!
3.目前针对提高ctls的杀伤活性有以下2种方法比较常用:
4.(1)增强ctls内特定转录因子的表达促进效应分子的合成和释放。t
‑
bet和eomes可以协同促进ctls中ifn
‑
γ,颗粒酶b和穿孔素的表达。blimp1可以促进ctls迁移到炎症和感染部位,增强ifn
‑
γ和颗粒酶b的表达。
5.(2)过继t细胞疗法(adoptive t cell transfer,act)主要分为3种:肿瘤浸润淋巴细胞(tils),tcr
‑
t细胞,和car
‑
t细胞疗法。目前使用最为广泛的是针对肿瘤细胞治疗的car
‑
t疗法,需要将激活的t细胞经过基因改造技术装上car(肿瘤嵌合抗原受体),从而特异性识别并杀伤肿瘤细胞。
6.但是以上的两种方法也存在诸多不足:增强特定转录因子的表达从而促进效应分子的合成和释放,有较大的技术难度。目前一般利用合成小分子化合物实现,但价格昂贵,且小分子化合物缺乏靶向性。不同的转录因子在不同的细胞中起到了不同的作用,错误的转录因子激活不利于机体的稳定甚至产生毒副作用。尽管act疗法已经取得了令人瞩目的成就,特别是car
‑
t疗法已经被fda批准用于某些血液肿瘤的治疗。但是它昂贵的价格,实体瘤疗效差,只能针对特定抗原产生作用,严重的细胞因子释放综合征等严重制约了它的应用。
技术实现要素:
7.有鉴于此,本发明的目的之一在于提供一种氧化铈纳米颗粒在制备增强细胞毒性cd8+t细胞活性的药物中的应用,本发明的目的之二在于提供一种增强细胞毒性cd8+t细胞活性的药物。
8.为达到上述目的,本发明提供如下技术方案:
9.1、氧化铈纳米颗粒在制备增强细胞毒性cd8+t细胞活性的药物中的应用。
10.作为优选的技术方案之一,所述氧化铈纳米颗粒的制备方法为,ce(no3)3·
6h2o和
三辛基氧化膦加入乙醇和1
‑
十八烯中,真空条件下加热至90℃,保持15min,再加入油胺,加热至190℃保持15min,室温冷却,洗涤至无色,即得氧化铈纳米颗粒,所述ce(no3)3·
6h2o、三辛基氧化膦、乙醇、1
‑
十八烯和油胺的质量体积比为0.7:1:3:5:100,g:g:ml:ml:μl。
11.作为优选的技术方案之一,所述细胞毒性cd8+t细胞为疾病的治疗靶标。
12.作为优选的技术方案之一,所述疾病为病毒感染性疾病、肿瘤、胞内菌感染。
13.作为优选的技术方案之一,所述增强细胞毒性cd8+t细胞活性具体为,提高细胞毒性cd8+t细胞的杀伤能力。
14.作为优选的技术方案之一,所述增强细胞毒性cd8+t细胞活性具体为,增强细胞毒性cd8+t细胞中细胞因子的分泌和效应分子的合成。
15.作为优选的技术方案之一,所述增强细胞毒性cd8+t细胞活性的信号通路为,下调细胞毒性cd8+t细胞中线粒体膜电位,从而降低活性氧的产生,激活nf
‑
κb信号通路。
16.2、一种增强细胞毒性cd8+t细胞活性的药物,所述药物包括氧化铈纳米颗粒和一种或多种药学上可以接受的载体或辅料。
17.本发明的有益效果在于:
18.本发明通过细胞实验证实了氧化铈纳米颗粒对ctls没有细胞毒性且不影响细胞的增殖能力,并显著的增强了ctls效应分子和细胞因子如il
‑
2,tnf
‑
α,颗粒酶b和穿孔素的合成和分泌;细胞因子和效应分子合成和分泌能力的提高使得ctls在体外对递呈特异性抗原的靶细胞有着更高效的杀伤能力。在小鼠体内lcmv病毒感染模型中,注射氧化铈纳米颗粒帮助小鼠更有效的清除各组织脏器(心,肝,脾,肺,肾)的病毒感染;并且氧化铈纳米颗粒增强ctls功能依赖于nf
‑
κb通路的激活。氧化铈纳米颗粒的新应用为临床上以细胞毒性cd8+t细胞为治疗靶标的疾病治疗治疗提供了新思路。
附图说明
19.为了使本发明的目的、技术方案和优点更加清楚,下面将结合附图对本发明作优选的详细描述,其中:
20.图1为氧化铈纳米颗粒的设计和表征。a为氧化铈纳米颗粒结构图,b为扫描电镜检测图。
21.图2为氧化铈纳米颗粒处理后ctls的存活和增值能力检测。a为ctls和氧化铈纳米颗粒共培养4天后检测ctls的存活情况;b为活细胞的百分比统计图;c为ctls细胞分裂的代表图;d为ki67
+
细胞的比例图;e为ki67
+
细胞比例统计图。
22.图3为氧化铈纳米颗粒处理后对ctls细胞因子和效应分子的产生和释放能力的影响结果。a为ifn
‑
γ阳性细胞群的流式代表图和阳性细胞比例统计图,平均荧光强度值统计图;b为il
‑
2阳性细胞群的流式代表图和阳性细胞比例统计图;c为tnf
‑
α阳性细胞群的流式代表图和阳性细胞比例统计图;d为颗粒酶b阳性细胞群的流式代表图和阳性细胞比例统计图,平均荧光强度值统计图;e为穿孔素阳性细胞群的流式代表图和阳性细胞比例统计图,平均荧光强度值统计图。
23.图4为氧化铈纳米颗粒对ctls的杀伤能力影响。a为ctls的体外特异性杀伤实验;b为cnps腹腔注射lcmv感染后的小鼠,5天后检测血清,肝脏,脾脏,肾脏的病毒滴度情况。
24.图5为氧化铈纳米颗粒通过清除ros激活nf
‑
κb通路结果。a为dcfh
‑
da
+
细胞的流式
代表图和mfi值的统计图;b,c为线粒体发生极化的ctls的流式代表图和比例统计图;d为wb检测nf
‑
κb通路相关蛋白ikkβ,p
‑
iκbα,iκbα。
25.图6为氧化铈纳米颗粒增强ctls功能的模式图。
具体实施方式
26.以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
27.实施例1
28.氧化铈纳米颗粒的制备与形态检测
29.氧化铈纳米颗粒(cerium oxide nanoparticles,cnps)的制备方法为:0.7g ce(no3)3·
6h2o(acros,99%)与1g三辛基氧化膦(sigma
‑
aldrich,99%)混合在3ml乙醇和5ml 1
‑
十八烯(sigma
‑
aldrich,90%)中,真空条件下加热至90℃、15min,加入100μl油胺,加热至190℃、15分钟。冷却至室温后,用丙酮洗涤至上清液呈无色,得到氧化铈纳米颗粒。
30.扫描电镜检测氧化铈纳米颗粒,结果如图1中a、b所示,cnps为均匀的纳米粒子,其直径约为4纳米,呈球形。
31.实施例2
32.氧化铈纳米颗粒对cd8
+
t细胞的影响
33.从小鼠体内筛选纯化初始的cd8
+
t细胞,具体方法如下:
34.处死wt小鼠,取小鼠脾脏于装有3ml ack的培养皿中磨碎,放置3
‑
5min。加入6ml facs终止反应,用移液枪吹打均匀后移入15ml离心管中。在4℃的离心机中,1600rpm离心5min。取出离心管去除上清,加入1ml facs溶液用移液枪吹打使细胞重悬,再用移液枪将细胞悬液移入ep管中。4℃的离心机中,2000rpm离心5min。按照600μl体系配置抗体混悬液,在ep管离心后去除上清,加入抗体混悬液,4℃冰柜中旋转器上旋转30min。准备磁珠,将需要使用的磁珠吸入一个新的ep管中,并放置在磁力架上用pbs溶液清洗磁珠两次,然后用等量pbs溶液重悬磁珠。将准备好的100μl磁珠加入细胞溶液中,4℃冰柜中旋转器上旋转20min。磁珠进入到液体中,会和抗体的fc端进行连接,而抗体的fab端则会和细胞表面标志进行结合。将装有细胞,抗体和磁珠混悬液的ep管放置在磁力架上1
‑
2min,等磁珠完全吸附在ep管管壁后,将移液枪伸入管壁的一侧,小心吸取上清,移入另一个新的ep管中,再加入50μl之前准备好的磁珠,4℃冰柜中旋转器旋转20min。将ep管置于磁力架上,待液体澄清后吸走上清,移入另一只新的ep管中。将筛选得到的细胞进行细胞计数和纯度检测。
35.(1)氧化铈纳米颗粒对ctls存活和增殖能力的影响
36.a.检测氧化铈纳米颗粒对ctls的细胞毒性
37.将筛选得到初始cd8+t细胞在体外刺激活化的同时,加入不同浓度(0,10μm,100μm,500μm,和1000μm)的氧化铈纳米颗粒共同培养。在共培养4天后,通过annexin v和7
‑
aad染色检测存活的细胞比率。结果如图2中a、b所示,有约90%细胞存活,并且各组之间没有统计学差异,说明氧化铈纳米颗粒对ctls没有毒性。
38.b.检测氧化铈纳米颗粒对ctls的增殖能力的影响
39.将初始cd8+t细胞用羧基荧光素二醋酸酯(carboxyfluorescein diacetate succinimidyl ester,cfse)荧光标记后,在体外刺激活化的同时加入不同浓度(0,10μm,100μm)的氧化铈纳米颗粒,共同培养4天后流式检测。cfse荧光染料会结合在细胞膜上,它的荧光强度会随着细胞的二分裂而减半,因此流式图中一个峰值代表增殖了一代。结果如图2中c所示,在不同浓度的氧化铈纳米颗粒培养条件下,ctls显示出了相似的增殖效率(大约3代)。按照同样的方法,在体外刺激活化的同时加入不同浓度的氧化铈纳米颗粒(0,10μm,100μm)共同培养4天后,检测细胞增殖的标志ki
‑
67蛋白,结果如图2中d、e所示,在不同浓度条件下的ctls表达的ki
‑
67蛋白的比例相似。以上结果说明了氧化铈纳米颗粒对ctls增殖没有影响。
40.(2)氧化铈纳米颗粒提高ctls细胞因子和效应分子的产生和释放能力
41.将初始cd8+t细胞在体外刺激活化的同时,加入不同浓度(0,10μm,100μm)的氧化铈纳米颗粒共同培养,在共培养4天后,将cd8+t细胞以每孔约2
‑4×
106个细胞加入96孔板中,1800rpm离心2min,去上清。用现配的facs溶液清洗细胞。用排枪吸取200μl液体量的facs溶液,加入96孔板中,吹打混匀,1800rpm离心2min,去除上清,清洗2次,以1:200的比例加入预冷的相应表面染色抗体。每孔加入100μl抗体混悬液(按照不同的实验目的进行配置),混匀后,置于4℃冰箱中避光孵育30min。将96孔板以1800rpm离心2min,弃去上清。每孔用200μl facs溶液清洗2次,弃去上清。每孔加入100μl穿膜液(cytofix/cytoperm solution,bd),在4℃避光环境中孵育30min。穿膜液含有多聚甲醛,将细胞固定的同时会使细胞死亡,然后试剂中的其他成分可以在细胞的细胞膜上打出小孔,使得流式抗体进入细胞质内和相应的蛋白结合。取出96孔板,2100rpm离心3min,弃去上清。每孔加入200μl 1
×
perm/wash buffer清洗细胞2次。用1
×
perm/wash buffer按照1:50的比例配置抗体混悬液,每孔加入100μl抗体混悬液,在4℃避光环境中孵育30min。取出96孔板,2100rpm离心3min,弃去上清,每孔加入200μl 1
×
perm/wash buffer清洗细胞2次。加入适当量的facs溶液后移入流式管中,上机检测,flowjo软件进行分析。
42.氧化铈纳米颗粒对ctls细胞因子分泌的影响结果如图3中a、b、c所示,大多数活化的ctls表达了ifn
‑
γ,并且各组之间的平均荧光强度值都很相似(图3中a);经过氧化铈纳米颗粒处理后,相较于对照组而言,处理组有着更高比例和平均荧光强度的il
‑
2的分泌,并且这种增长是呈剂量相关的(图3中b);活化的ctls在处理组和对照组中虽然有着相似的分泌频率,但是处理组细胞中tnf
‑
α的mfi值确是明显增高,说明了氧化铈纳米颗粒处理后增强了单个ctl分泌tnf
‑
α的能力(图3中c)。
43.氧化铈纳米颗粒对ctls效应因子合成的影响结果如图3中d、e所示,当遇到被感染或功能障碍的细胞时,ctl细胞释放出细胞溶解效应分子,如穿孔素和granzyme b。在穿孔素的作用下,granzyme b进入靶细胞的细胞质并最终导致靶细胞的凋亡。在加入了氧化铈纳米颗粒处理后,ctls相较于对照组,有着更高的granzyme b分泌频率以及mfi值(图3中d);处理组细胞perforin分泌频率也要明显高于对照组(图3中e)。
44.(3)氧化铈纳米颗粒提高ctls的杀伤能力
45.a.氧化铈纳米颗粒提高了ctls的体外杀伤能力
46.将初始cd8+t细胞在体外刺激活化的同时,加入不同浓度(0,10μm,100μm)的氧化铈纳米颗粒共同培养4天。带有gp33
‑
41肽段的el4细胞用较低浓度的cfse染液染色,作为特
异性杀伤的靶细胞,称为cfse
low
组。而不带有gp33
‑
41肽段的el4细胞用较高剂量的cfse染色,作为对照,称为cfse
high
组。将两组细胞按照1:1混合均匀后,按照1:30的比例和氧化铈纳米颗粒处理后的ctls共同培养4小时后检测。结果如图4中a所示,在和ctls共培养之后,虽然对照组细胞没有变化,但是靶细胞却显著降低,并且这种降低随着cnps处理剂量的增高而增高,说明了氧化铈纳米颗粒促进了ctls的体外杀伤能力。
47.b.氧化铈纳米颗粒提高了体内清除病毒的能力
48.对8周的c57bl/6j小鼠注射不同浓度(0,10μm,100μm)的氧化铈纳米颗粒,2小时后,注射(2
×
105pfu)lcmv病毒感染。在感染后第5天通过rt
‑
qrcr检测小鼠不同组织中的病毒滴度情况。结果如图4中b所示,在小鼠肝脏、肾脏、脾脏、血清和肺脏中,处理组的病毒滴度相较对照组有着显著性的下降,并且这种下降是剂量依赖性的,在肝脏,脾脏,和血清中,高剂量组组织中的病毒几乎被完全清除,说明氧化铈纳米颗粒有效提升了ctls的体内杀伤能力。
49.(4)氧化铈纳米颗粒通过清除ros激活nf
‑
κb通路
50.a.氧化铈纳米颗粒有效降低ctls的活性氧水平和线粒体膜电位水平
51.将初始cd8+t细胞在体外刺激活化的同时,加入不同浓度(0,10μm,100μm)的氧化铈纳米颗粒共同培养,在共培养4天后,使用美国abcam公司的ros detection assay kit试剂盒进行ros的染色实验,检测ros水平;使用multisciences company公司的mitochondria staining kit(jc
‑
1)试剂盒进行染色,检测细胞的线粒体膜电位水平。
52.结果如图5中a、b、c所示,相较于对照组,处理组中ctls的ros水平明显降低,并且这种降低是呈剂量依赖性的(图5中a);p14细胞的线粒体膜电位在氧化铈纳米颗粒处理后也是显著下降的,并且也是呈现出剂量依赖性的下降(图5中b、c)。综上结果说明氧化铈纳米颗粒通过降低线粒体膜电位从而降低了ctls内ros的水平。
53.b.氧化铈纳米颗粒通过清除ros激活nf
‑
κb通路
54.将初始cd8+t细胞在体外刺激活化的同时,加入不同浓度(0,10μm,100μm)的氧化铈纳米颗粒共同培养4天,收集细胞,进行western blot检测。按照每组样本30ug的蛋白量加入10%的sds
‑
page胶中进行蛋白电泳,随后将蛋白转膜到pvdf膜上。转膜完毕后,pvdf膜用5%脱脂牛奶进行封闭,随后按照1:1000的比例加入一抗(β
‑
actin(clone 8h10d10,cell signaling technology),iκbα(clone 44d4,cell signaling technology),phospho
‑
iκbα(ser32)(clone 14d4,cell signaling technology),ikkβ(clone d30c6,cell signaling technology))检测目的蛋白。过夜孵育后加入二抗,染色1小时进行检测。
55.结果如图5中d所示,和未处理组细胞相比,处理组细胞表现出了更高的ikkβ,p
‑
iκbα表达水平和较低的iκbα表达水平。在经典的nf
‑
κb信号通路中,iκbα蛋白通过遮蔽nf
‑
κb蛋白的核定位序列,从而使nf
‑
κb/rela复合物停留在细胞质中,并且处于一种未活化的状态。iκbα发生磷酸化后,形成的p
‑
iκbα随后通过泛素蛋白酶体途径降解。随着iκbα的降解,nf
‑
κb复合物被释放到细胞核中,并在细胞核内调节靶基因的表达。以上的结果说明cnps的处理激活了nf
‑
κb信号。图6为氧化铈纳米颗粒增强ctls功能的模式图,显示了cnps通过清除ctls细胞内过量ros,激活nf
‑
kb通路,增强了ctls细胞的功能,加强了对病毒感染的清除能力,对细菌感染和肿瘤也可能存在潜在的清除能力。
56.综上结果证明,cnps通过下调ctl细胞的线粒体膜电位(mmp)从而降低了ros的产
量并最终激活了nf
‑
κb信号通路。
57.最后说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本技术方案的宗旨和范围,其均应涵盖在本发明的权利要求范围当中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1