光学消融灶评估的制作方法
光学消融灶评估
1.本申请是2013年12月17日提交的、申请号为201310692975.0、发明名称为“光学消融灶评估”的专利申请的分案申请。
2.相关专利申请的交叉引用本专利申请为2010年6月16日提交的并公布为美国专利申请公开2011/0313280的美国专利申请12/816,492的部分继续申请,其公开内容以引用方式并入本文中。
技术领域
3.本发明一般涉及侵入式医疗装置和医疗手术,并且具体地,涉及对以此类手术治疗的组织状况的评估。
背景技术:
4.微创心内消融是对于各种类型的心律失常的治疗选择。为了执行此类治疗,医生通常通过血管系统将导管插入到心脏中、使导管的远端在异常电活动的区域中与心肌组织接触、并且接着使远端处或远端附近的一个或多个电极通电,以便导致组织坏死。
5.通常难以确定适当的能量剂量,所述适当的能量剂量应该应用于消融手术中,以便达到期望的结果。当所述剂量不足时,非传导消融灶不会足够深地延伸穿过心脏壁以破坏异常传导,使得在所述手术完成之后,心律失常可持续或反弹。另一方面,过量的剂量可导致对在消融位点处或围绕消融位点的组织的危险损伤。已知适当的剂量随病例改变,这取决于各种因素,诸如导管几何形状、心脏壁的厚度、导管电极和心脏壁之间的电接触质量、以及在消融位点附近的血液流动。
6.为了改善消融手术的精密度和一致性,已经尝试基于具有相关性的生理参数的测量来预测和控制所述消融。一些此类方法,例如在美国专利7,306,593中有所描述,该专利的公开内容以引用的方式并入本文。作为另一个例子,美国专利7,918,850描述了通过评价起搏信号的捕获而接近实时地监测心内消融进展,该专利的公开内容以引用的方式并入本文。
7.用于心内消融灶评估的光学方法在本领域中也是已知的。例如,美国专利7,662,152描述了导管,该导管包括导管主体和适于消融组织的末端电极,该专利的公开内容以引用的方式并入本文。该导管还包括多个光波导,所述多个光波导适于向所述末端电极传输光学能量以及从其传输光学能量。每个波导的远侧部分延伸穿过所述末端电极的中空远侧部分,并在形成于壳体中的开口中终止。消融灶评估通过在一个或多个波长处测量光强度而实现,所述光强度是从所述导管末端辐射的光到消融组织上产生并在所述导管末端处重新捕获的。美国专利8,123,745描述了用于类似目的的具有光学透明的导电末端的消融导管,该专利的公开内容以引用的方式并入本文。。
技术实现要素:
8.在下文描述的本发明的实施例提供用于测量所述身体内组织的光学特性的改进
的方法和装置。此类方法和装置可有效地用于光学消融灶评估中。
9.因此,根据本发明的实施例提供了包括探针的医疗设备,所述探针具有配置成用于插入到患者的身体中的远侧段。所述探针包括至少一个光学感测单元,所述至少一个光学感测单元沿所述远侧段设置并且包括第一辐射源和第二辐射源,所述第一辐射源和第二辐射源配置成朝向接近所述远侧段的、身体内组织发射不同的相应第一波长波段和第二波长波段的光学辐射。光学传感器配置成接收从所述组织散射的在所述第一波长波段和第二波长波段的光学辐射,并且响应于所接收的光学辐射的强度而输出第一电信号和第二电信号。
10.在一些实施例中,所述第一波长波段是红外波段,并且所述第二波长波段是可见光波段。例如,所述第一波长波段可具有介于860nm和880nm之间的峰值强度,并且所述第二波长波段具有介于710nm和730nm之间的峰值强度。
11.通常,该设备包括控制单元,所述控制单元被耦合以比较所述第一信号和第二信号,并且响应于该比较而输出对所述组织的状况的指示。该指示可基于所述第一信号和第二信号的比率。
12.在本发明所公开的实施例中,所述探针的远侧段包括消融元件,该消融元件配置成消融所述组织,并且所述指示提供对消融灶的评估,所述消融灶通过所述消融元件形成于所述组织中。所述消融元件可包括电极,该电极配置成与所述组织接触并且通过施加射频能量至所述组织来消融所述组织,其中所述控制单元配置成当所述消融灶在施加所述射频能量的过程中形成时,提供对所述消融灶的评估。在一个实施例中,所述探针的远侧段配置成与患者的心脏内的心内膜组织接触并且对其进行消融。
13.在一些实施例中,所述第一辐射源和第二辐射源包括嵌入所述远侧段中的发光二极管。
14.任选地,所述至少一个光学感测单元包括多个光学感测单元,所述多个光学感测单元沿所述远侧段设置在不同的相应位置处。在一个实施例中,所述多个光学感测单元包括至少第一光学感测单元和第二光学感测单元,所述至少第一光学感测单元和第二光学感测单元沿所述远侧段间隔开,并且该设备包括控制单元,所述控制单元配置成与所述第一光学感测单元和第二光学感测单元通信,以便测量信号,所述信号由所述第一光学感测单元中的光学传感器响应于发射的辐射而输出,可替换地,由所述第一光学感测单元和第二光学感测单元中的每个光学感测单元中的辐射源输出。
15.在另一个实施例中,所述远侧段包括顶盖,该顶盖包括外壁和内壁,其中所述外壁穿有一个或多个孔,所述内壁被包含在所述外壁内侧并且所述至少一个光学感测单元安装在所述内壁上,以便经由所述外壁中的孔朝向所述组织发射光学辐射以及从所述组织接收光学辐射。所述外壁可包括导电材料,所述导电材料配置成与所述组织接触并且施加电能量至所述组织,以便消融所述组织,同时冲洗流体流动穿过所述内壁和外壁之间的腔体并且穿过所述一个或多个孔离开该腔体。
16.根据本发明的实施例还提供了用于组织评估的方法,该方法包括将探针的远侧段插入到患者的身体中。沿所述远侧段设置的第一辐射源和第二辐射源被致动以朝向接近所述远侧段的、身体内组织而发射不同的相应第一波长波段和第二波长波段的光学辐射。沿所述远侧段设置的光学传感器接收从所述组织散射的在所述第一波长波段和第二波长波
段的光学辐射。处理第一电信号和第二电信号以便评估所述组织的状况,其中所述第一电信号和第二电信号由所述光学传感器分别响应于所接收的在所述第一波长波段和第二波长波段的光学辐射的强度而输出。
17.根据本发明的实施例还提供了用于组织评估的方法,该方法包括施加射频(rf)电能量,以便在患者的身体内组织的区域中形成消融灶。在施加所述rf电能量的同时,测量该区域对红外线辐射的第一散射强度以及该区域对红光的第二散射强度。通过比较所述第一散射强度和所述第二散射强度来评估所述消融灶的形成。
附图说明
18.结合附图,通过以下对本发明的实施例的详细说明,将更全面地理解本发明,其中:图1为根据本发明的实施例的用于心内消融的系统的示意性说明图;图2a为根据本发明的实施例的消融和感测导管的远侧段的示意性说明图;图2b为根据本发明的另一个实施例的消融和感测导管的远侧段的示意性说明图;图3为根据本发明的实施例在消融手术过程中由导管测量的光谱反射比率的曲线图;并且图4为根据本发明的另一个实施例的消融和感测导管的远侧段的示意性剖面图。
具体实施方式
19.下文描述的本发明的实施例提供了如下装置和方法,其可通过比较从组织散射的在不同波长处的强度而用于快速且准确地评价身体内组织状况。具体地,本发明人已经发现随着身体内组织被消融,从所述组织并且具体地心脏组织散射的红外光和可见光之间的关系明显改变,其中散射的红外光对可见光的比率急剧增加。所述消融探针中(诸如在心脏的消融导管中)的合适光学感测单元可因此用于在消融手术过程中实时评估消融灶形成。本公开和权利要求中使用的术语“散射”在其广泛、传统意义上一般包括反射和透射的辐射,所述反射和透射的辐射经由所考虑的组织到达光学传感器,或者换句话说,向前和向后散射。
20.在本发明所公开的实施例中,至少一个光学感测单元沿探针的远侧段设置,所述探针的远侧段被插入到患者的身体中。该感测单元包括(至少)两个辐射源,所述(至少)两个辐射源朝向身体内的接近远侧段的组织发射不同的相应波长波段的光学辐射。感测单元中的光学传感器接收从所述组织散射的在不同的波长波段的光学辐射,并且响应于所述辐射强度而输出电信号。如在本说明书和权利要求中使用的术语“光学辐射”包括可见辐射、红外线辐射和紫外线辐射。通常(尽管不一定),所述辐射源为发光二极管(led),其中一个发光二极管发射红外线辐射,并且另一个发光二极管在不同的相应时隙发射可见光。所述辐射源和所述感测单元中的传感器可接近彼此定位,或者它们可选择地沿所述远侧段散开于不同位置处。
21.耦合到所述探针的控制单元对信号进行比较并且基于该比较产生对所述组织状况的指示,所述信号由传感器响应于所接收的不同波长波段中的散射辐射的强度而输出。该指示可通常包括在由所述探针执行的组织消融过程中的消融灶形成的评估。所述指示可
基于例如散射的红外光对可见光的比率,本发明人已经发现随着组织被消融,所述散射的红外对可见光的比率急剧增加。
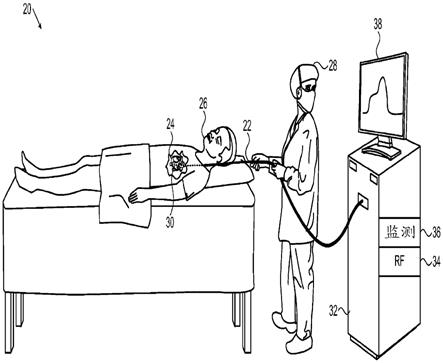
22.图1为根据本发明的实施例的用于心脏消融治疗的系统20的示意性说明图。操作者28(诸如介入性心脏病医生)经由患者26的血管系统将侵入式探针,诸如导管22插入到该患者的心脏24的腔室中。例如,为了治疗心房纤颤,操作者可将所述导管推进到左心房中,并使所述导管的远侧段30接触要被消融的心肌组织。
23.在操作者28的控制下,导管22在其近端处连接到控制台32,该控制台用作施加和监测期望的治疗的控制单元。控制台32包括射频(rf)能量发生器34,该rf能量发生器经由导管22提供电力至远侧段30,以便消融所述靶组织。如下面所述,通过处理沿所述远侧段由一个或多个光学感测单元输出的信号,监测电路36提供对接近远侧段30的组织的状况的指示,并且可在显示屏38上显示该指示。通常,冲洗泵(未示出)经导管22供给冷却流体,诸如盐水溶液,通过远侧段30冲洗治疗中的组织。基于由监测电路36提供的信息,自动地或响应于操作者28的输入,控制台32可控制由rf能量发生器34施加的功率和/或由所述泵提供的流体的流量。
24.系统20可例如基于由biosense webster inc. (diamond bar, california)提供的carto系统,该系统提供大量设施以支持导管22的导航和控制。然而,这些系统设施一般超出本专利申请的范围,这些系统设施包括控制台32的监测和控制功能(除了本文所述光学感测功能)细节。
25.图2a为根据本发明的实施例的导管22的远侧段30的示意性说明图。在该实施例中,所述远侧段被示出包括具有“套索”形式的弓形部分40。这种类型的导管形式常用于围绕肺静脉口建立环形消融灶,例如用于心房纤颤治疗。为了此目的,远侧段30贴着弓形部分40的所有长度或至少一部分长度接触心内膜组织。消融元件以电极42的形式沿远侧段30的长度设置,并且由发生器34的rf能量致动,以消融与其接触的组织。作为另外一种选择,远侧段30可包括本领域已知的其它类型的消融元件,诸如高功率超声换能器或冷冻消融元件。
26.光学感测单元44沿远侧段30设置在电极42之间交错的位置处。如图2a中的插入物所示,每个此类单元44包括两个辐射源50和辐射源52,所述两个辐射源引导不同的相应波长波段的光学辐射朝向接近所述感测单元的心肌组织48。本发明人已经发现对于消融灶形成的评估,辐射源50可有利地发射红外线辐射,而辐射源52发射可见光,例如红光。所述波长波段可具有相应的峰值强度,例如,介于860nm和880nm之间的峰值强度,以及介于710nm和730nm之间的峰值强度。在一个实施例中,辐射源50和辐射源52包括led,该led具有分别在大约870nm和720nm的中心发射波长。
27.作为另外一种选择,其它波长组合可用于消融的评估和其它指示,如评估所述导管和身体组织之间的接触。例如,选择血液中的血红蛋白高度吸收的可见光谱中的波长是有用的,因为在没有良好的组织接触时,在该波长的散射强度将接近零。在与所述组织接触时,血液的位移导致减少的吸收,从而给出指示组织接触的增加信号。此外,在消融的启动时,氧化血液的损耗(除所述组织光学特性中的其它变化之外)和随后的吸收减少可以提供关于所述消融过程的进一步信息。
28.每个感测单元44也包括光学传感器46,诸如光电二极管或其它合适的辐射
‑
感测
元件,所述光学传感器接收从组织48反射的光学辐射,并且响应于所接收的辐射的强度而输出电信号。通常,辐射源50和辐射源52是时间
‑
多路复用的,使得由于在所述两个波长的反射辐射,可以明确区分由传感器46输出的相应信号。任选地,感测单元44可包括三个或更多个辐射源,每个辐射源均具有其自己的发射波长,使得传感器46可以更精细的波长分辨率和/或在更宽的波长范围内测量组织反射率。辐射源50, 52和传感器46通常被嵌入在适合的透明密封封套内(诸如透明的生物相容性塑料内)的远侧段30中。
29.监测电路36接收由传感器46输出的信号,并且比较由于辐射源50和辐射源52在不同波长处的辐射的散射导致的信号水平,以便得到组织48的消融水平的指示。这样,控制台32能够评估正在所述消融过程中形成的消融灶,并可在显示屏38上呈现该评估。通常,如下面所述,所述信号水平的比较基于由于辐射源50和辐射源52的不同波长处散射的信号比,但是作为另外一种选择或除此之外,其它数学关系可用于分析信号。
30.在图2a中所示的实施例中,多个光学感测单元44设置在不同的相应位置处,沿远侧段30的弓形部分40间隔开。作为另外一种选择,导管22可包括仅单个这种类型的光学感测单元,但使用多个感测单元使得控制台32能够评估在更宽区域内的消融灶形成。为了沿所述远侧段的长度使评估的区域更进一步扩展到所述不同光学感测单元之间的区域,监测电路36可控制在相邻感测单元44中的辐射源50, 52交替地操作,使得在所述光学感测单元之一中的传感器46可以测量来自所述相邻感测单元中辐射源的辐射的散射,包括透射和反射。该散射发生在所述相邻感测单元44之间的组织48中,并且因此给出在这些中间区域中的消融灶形成的指示。
31.图2b为根据本发明的可供选择的实施例的导管22的远侧段30的示意性说明图。在该实施例中,辐射源50, 52和传感器46沿弓形部分40的长度在不同位置处间隔开。一对辐射源50, 52和传感器46的任何组合可被视为此构型中的光学感测单元,以便采样来自所选辐射源和传感器之间的组织区域的散射。
32.虽然图2a和图2b示出沿远侧段30在某些位置和构型中设置的特定数量的光学感测单元44,但是在可供选择的实施例中,基本上可使用任何数量的此类光学感测单元,并且可能仅单个光学感测单元。此外,虽然图2a和图2b示出套索导管,但是在其它实施例中,这种类型的光学感测单元可装配到其它类型的导管和具有任何合适构型的其它侵入式探针,不仅用于心脏中,而且用于其它身体器官和区域中。
33.图3为根据本发明的实施例的作为在消融手术过程中的时间函数的接收信号的光谱比率的曲线图,所述接收信号是通过使用光学感测单元44的导管系统测量的。此例子中的辐射源50和辐射源52是led,所述led在具有870nm和720nm的峰值强度的波长波段中发射。垂直轴示出根据传感器46输出的信号,在两个不同波长处从组织48散射的强度比率(在图中标记为i1/i2)。此图示出在评估组织消融中强度比率的有效性。
34.在消融开始之前的初始时间段期间,从t0至t1,未消融组织的基线散射强度比率约为5:1。在时间t1处开始,rf能量被施加到所述导管电极。随着消融灶通过消融形成,所述比率逐渐增加至约40:1。在时间t2处,所述rf能量被关闭,并且所述导管被移动,使得感测单元44观察另一未消融组织区域,并且所述比率返回到先前约为5:1的值。当所述导管从所述组织取出时,在时间t3处,传感器44仅接收来自所述心脏腔室中的血细胞散射的辐射,并
且所述强度比率下降至几乎为零。
35.图4为根据本发明的另一个实施例的消融和感测导管的远侧段30的示意性剖面图。在该实施例中,附接到所述导管的插入管58远端的顶盖包括外壁62和内壁60,其中所述外壁穿有孔66,所述内壁被包含在所述外壁内侧。内腔68供给冲洗流体至外壁62和内壁60之间形成的腔体64,并且所述冲洗流体通过孔66离开此腔体。通常,壁60和壁62包括薄的金属材料壳体,所述薄壳体由小金属金属间隔物(未示出)保持分开,围绕所述薄壳体,流体能够在腔体64内流动。导体70从控制台32供给rf电能量到所述顶盖,其用作电极来消融与外壁62接触的组织。
36.光学感测单元72安装在内壁60上,使得辐射源50, 52通过孔66而朝向接近所述顶盖的组织发射光学辐射,并且传感器46经所述孔接收反射的辐射。辐射源50, 52和传感器46可为所述内壁内的凹口中的插入物,如本图中所示。在引导从所述辐射源发射的辐射向外朝向所述组织中,以及在限制由所述传感器观测的反射辐射的角度范围中,这个插入物构型是有用的。
37.虽然上面示出和描述了许多特定光学感测单元构型,但是在本领域的技术人员阅读上述描述之后,可明显看出用于类似目的的可供选择的构型,并且可供选择的构型被认为在本发明的范围内。因此应意识到,上述实施例均以举例的方式示出,并且本发明不受上文具体示出和描述的内容限制。相反,本发明的范围包括上述各种特征的组合和子组合以及它们的变型和修改形式,本领域的技术人员在阅读上述说明时将会想到所述变型和修改形式,并且所述变型和修改形式并未在现有技术中公开。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1