一种头孢克洛缓释组合物及其制备方法与流程
1.本发明属于医药制备技术领域,具体地,涉及一种头孢克洛缓释组合物及其制备方法。
背景技术:
2.头孢克洛缓释制剂属第二代口服头孢菌素,对多种革兰氏阳性菌和革兰氏阴性菌均具有很强的杀灭作用。对产青霉素酶金黄色葡萄球菌、a组溶血性链球菌、草绿色链球菌和表皮葡萄球菌的活性与头孢羟氨苄相同,对不产酶金黄色葡萄球菌和肺炎球菌的抗菌作用较头孢羟氨苄强2~4倍。对革兰阴性杆菌包括对大肠埃希菌和肺炎克雷伯菌等的活性较头孢氨苄强,与头孢羟氨苄相仿,对奇异变形杆菌、沙门菌属和志贺菌属的活性较头孢羟氨苄强。2.9~8mg/l的头孢克洛缓释制剂可抑制所有流感嗜血杆菌,包括对氨苄西林耐药的菌株。
3.cn102028667a公开了一种头孢克洛缓释片(∥)剂及其制备方法;使用到了羧甲基淀粉钠为崩解剂,以hpmc为骨架材料的分散性缓释制剂,该缓释制剂需使用崩解剂对骨架进行溶蚀后扩散,易引起药物的突释。
4.cn101897678a公开了一种头孢克洛缓释组合物,以丙烯酸树脂为阻滞剂,高粘度的hpmc为骨架材料,同理也是用到了羧甲基淀粉钠为崩解剂,其要求在4
‑
8个小时完全释放;未能满足4小时内累计达到释放90%以上的参比剂释放曲线(参见希刻劳释放度)。
5.现在技术中公开的组成和制备工艺均使用了高粘度的材料为骨架,释放目标并不符合参比剂希刻劳设计的需要药物在低ph位置迟滞释放,在小肠上端完全释放以达到维持一定程度的治疗血药浓度,并且均存在释放时间过长,达不到维持治疗血药浓度的目标的问题。
技术实现要素:
6.为了解决上述技术问题中的至少一个,本发明提供的技术方案如下:
7.本发明第一方面提供一种头孢克洛缓释组合物,包括以下重量份的组分:头孢克洛375份、甘露醇28
‑
35份、hpmc和/或hpc 90
‑
130份、尤特奇l100
‑
55 5
‑
20份、硬脂酸2
‑
5份、硬脂酸镁1
‑
5份。
8.在本发明中,所述hpmc选自hpmc
‑
e5、hpmc
‑
e50、hpmc
‑
k4、hpmc
‑
k15、hpmc
‑
k100中的至少一种。进一步地,所述hpmc为低粘度型(lv)、高分子量型(m)或控释型(cr)。
9.在本发明的一些实施方案中,所述hmpc选自hpmc
‑
e5、hpmc
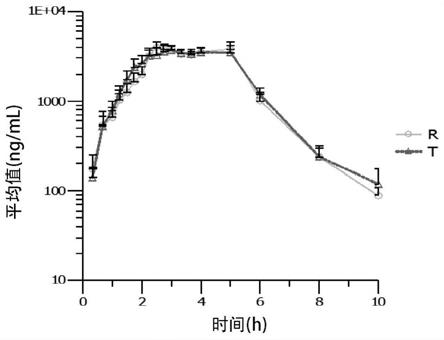
‑
e50和hpmc
‑
k100中的至少一种,优选地,所述hmpc是低粘度型。
10.在本发明的一些具体实施方案中,所述hpmc为hpmc
‑
e5;在本发明的另一些具体实施方案中,所述hpmc为hpmc
‑
e50;在本发明的又一些具体实施方案中,所述hpmc为hpmc
‑
k100。在本发明的一些优先实施方案中,所述hpmc为hpmc
‑
e50和hpmc
‑
k100lv。
11.在本发明中,所述hpc选自hpc
‑
hxf、hpc
‑
mxf、hpc
‑
gxf、hpc
‑
jxf、hpc
‑
lxf、hpc
‑
exf
和hpc
‑
elf中的至少一种。
12.在本发明的一些实施方案中,所述hpc为hpc
‑
hxf。
13.在本发明的一些具体实施方案中,所述孢克洛缓释组合物包括头孢克洛375份、甘露醇30份、hpmc
‑
e50 73.2份、hpc
‑
hxf 50份、尤特奇l100
‑
55 19.4份、硬脂酸3.5份、硬脂酸镁2.5份。
14.在本发明的另一些具体实施方案中,所述孢克洛缓释组合物包括头孢克洛375份、甘露醇30份、hpmc
‑
e5 34份、hpc
‑
hxf 61.3份、尤特奇l100
‑
55 7.5份、硬脂酸4份、硬脂酸镁3份。
15.在本发明的又一些具体实施方案中,所述孢克洛缓释组合物包括头孢克洛375份、甘露醇30份、hpmc
‑
k100lv 76.6份、hpmc
‑
e50 21.5份、尤特奇l100
‑
55 7.1份、硬脂酸3.2份、硬脂酸镁2.1份。
16.在本发明的一些实施方案中,所述头孢克洛缓释组合物还包括包衣剂15
‑
20份。在本发明的一些具体实施方案中,所述包衣剂为欧巴代蓝色包衣粉。
17.本发明的第二方面提供本发明第一方面所述的头孢克洛缓释组合物的制备方法,包括以下步骤:
18.s1,将头孢克洛、甘露醇、hpmc和/或hpc分别过筛,混合得到第一混合物;
19.s2,将尤特奇l100
‑
55溶解于乙醇中,缓慢搅拌至完全溶解澄清,得到第一溶液;
20.s3,将步骤s1获得的第一混合物加入制粒机中,搅拌1
‑
5min,将步骤s2得到的第一溶液加入至制粒机中,继续搅拌1
‑
5min,得到第二混合物;
21.s4,将步骤s3得到的所述第二混合物干燥到水分低于4%;
22.s5,向步骤s5干燥后的第二混合物中加入硬脂酸和硬脂酸镁进行混合,即得到所述头孢克洛缓释组合物。
23.在本发明的一些实施方案中,步骤s3中,第一溶液以雾化的形式加入至制粒机中。在本发明的一些优选实施方案中,所述第一溶液在2min之内全部加入至制粒机中。
24.在本发明的一些实施方案中,进一步包括:
25.s6,将所述头孢克洛缓释组合物在压片机上压片的步骤。
26.在本发明的一些实施方案中,进一步包括:
27.s7,对步骤s6压片后的药片进行包衣的步骤。
28.本发明的有益效果
29.相对于现有技术,本发明具有以下有益效果:
30.本发明的头孢克洛缓释组合物与参比剂希刻劳溶出曲线拟合度高,无论在盐酸介质中还是在含乙醇的盐酸介质中,均有非常高的拟合度。
31.本发明的头孢克洛缓释组合物与参比剂希刻劳具有生物等效性,可以替代希刻劳使用。
32.本发明的头孢克洛缓释组合物为缓释制剂,可以弥补患者日服用次数多的缺陷,减少给药次数,每日只需口服两次,每次一片即可保持平稳而有效的血药浓度,并应用了肠溶材料,体内释放延长到肠道部位,降低药品对肠胃道的不良反应,从而提高病人的依从性,进一步提高疗效。
33.本发明的头孢克洛缓释组合物在酒精中不会引起突释的可能,具有更高的安全
性。
附图说明
34.图1示出了本发明实施例1
‑
3制备的头孢克洛缓释片(∥)#1、头孢克洛缓释片(∥)#2和头孢克洛缓释片(∥)#3在0.1mol/l盐酸介质中的溶出曲线。
35.图2示出了本发明实施例1
‑
3制备的头孢克洛缓释片(∥)#1、头孢克洛缓释片(∥)#2和头孢克洛缓释片(∥)#3在含5%乙醇的0.1mol/l盐酸介质中的溶出曲线。
36.图3示出了本发明实施例1
‑
3制备的头孢克洛缓释片(∥)#1、头孢克洛缓释片(∥)#2和头孢克洛缓释片(∥)#3在含20%乙醇的0.1mol/l盐酸介质中的溶出曲线。
37.图4示出了本发明实施例1
‑
3制备的头孢克洛缓释片(∥)#1、头孢克洛缓释片(∥)#2和头孢克洛缓释片(∥)#3在含40%乙醇的0.1mol/l盐酸介质中的溶出曲线。
38.图5示出了受试者分别服用本发明实施例1制备的头孢克洛缓释片(∥)#1(t)和参比制剂希刻劳(r)后血浆中头孢克洛的药代动力学。
具体实施方式
39.除非另有说明、从上下文暗示或属于现有技术的惯例,否则本申请中所有的份数和百分比都基于重量,且所用的测试和表征方法都是与本申请的提交日期同步的。在适用的情况下,本申请中涉及的任何专利、专利申请或公开的内容全部结合于此作为参考,且其等价的同族专利也引入作为参考,特别这些文献所披露的关于本领域中的合成技术、产物和加工设计、聚合物、共聚单体、引发剂或催化剂等的定义。如果现有技术中披露的具体术语的定义与本申请中提供的任何定义不一致,则以本申请中提供的术语定义为准。
40.本申请中的数字范围是近似值,因此除非另有说明,否则其可包括范围以外的数值。数值范围包括以1个单位增加的从下限值到上限值的所有数值,条件是在任意较低值与任意较高值之间存在至少2个单位的间隔。例如,如果记载组分、物理或其它性质(如分子量,熔体指数等)是100至1000,意味着明确列举了所有的单个数值,例如100,101,102等,以及所有的子范围,例如100到166,155到170,198到200等。对于包含小于1的数值或者包含大于1的分数(例如1.1,1.5等)的范围,则适当地将1个单位看作0.0001,0.001,0.01或者0.1。对于包含小于10(例如1到5)的个位数的范围,通常将1个单位看作0.1。这些仅仅是想要表达的内容的具体示例,并且所列举的最低值与最高值之间的数值的所有可能的组合都被认为清楚记载在本申请中。
41.另外,除非明确地说明,否则用“一个”,“一种”或“该”形容的名词也包括其复数形式。术语“包含”,“包括”,“具有”以及它们的派生词不排除任何其它的组分、步骤或过程的存在,且与这些其它的组分、步骤或过程是否在本申请中披露无关。为消除任何疑问,除非明确说明,否则本申请中所有使用术语“包含”,“包括”,或“具有”的组合物可以包含任何附加的添加剂、辅料或化合物。相反,出来对操作性能所必要的那些,术语“基本上由
……
组成”将任何其他组分、步骤或过程排除在任何该术语下文叙述的范围之外。术语“由
……
组成”不包括未具体描述或列出的任何组分、步骤或过程。除非明确说明,否则术语“或”指列出的单独成员或其任何组合。
42.为了使本发明所解决的技术问题、技术方案及有益效果更加清楚明白,以下结合
实施例,对本发明进行进一步详细说明。
43.实施例
44.以下例子在此用于示范本发明的优选实施方案。本领域内的技术人员会明白,下述例子中披露的技术代表发明人发现的可以用于实施本发明的技术,因此可以视为实施本发明的优选方案。但是本领域内的技术人员根据本说明书应该明白,这里所公开的特定实施例可以做很多修改,仍然能得到相同的或者类似的结果,而非背离本发明的精神或范围。
45.除非另有定义,所有在此使用的技术和科学的术语,和本发明所属领域内的技术人员所通常理解的意思相同,在此公开引用及他们引用的材料都将以引用的方式被并入。
46.那些本领域内的技术人员将意识到或者通过常规试验就能了解许多这里所描述的发明的特定实施方案的许多等同技术。这些等同将被包含在权利要求书中。
47.下述实施例中未作具体说明的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的仪器设备,如无特殊说明,均为实验室常规仪器设备;下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。
48.实施例1头孢克洛缓释片(∥)#1及其制备方法
49.本实施例提供一种头孢克洛缓释片(∥)#1,为片剂,每1000片含量如下:
50.成分含量(g)功能头孢克洛37573.26%甘露醇305.86%hpmc
‑
e5073.210.28%hpc
‑
hxf508.13%尤特奇l100
‑
5519.41.31%硬脂酸3.50.68%硬脂酸镁2.50.49%总片重512 欧巴代蓝色包衣粉163.12%
51.该头孢克洛缓释片(∥)#1的制备方法包括:原辅料过筛、称量混合、制粒、干燥、压片、包衣等工序。具体工艺步骤如下:
52.步骤1:将头孢克洛原料和hpc
‑
hxf、hpmc
‑
e50、甘露醇分别过筛,混合后保存备用;
53.步骤2:按尤特奇l100
‑
55溶解于乙醇中,缓慢搅拌至完全溶解澄清,保持备用;
54.步骤3:将步骤1均匀混合的物料倒入制粒机,开启搅拌3分钟;
55.步骤4:将步骤2中的肠溶材料溶液以雾化方式加入到步骤3中制粒机的继续混合的物料,2分钟内加完,并继续搅拌3分钟后开启切刀1分钟;
56.步骤5:步骤4种的物料出锅后干燥,控制物料水分低于3.8%;
57.步骤6:将步骤5中干燥颗粒加入硬脂酸、硬脂酸镁和hpmc
‑
50进行总混,测定混合均匀度至合格;
58.步骤7、将步骤5中的物料转移至压片机上压片;
59.步骤8、将步骤7中的未包衣素片转移至高效包衣机中进行常规薄膜保护包衣,包衣增重约为3.12%。
60.实施例2头孢克洛缓释片(∥)#2及其制备方法
61.本实施例提供一种头孢克洛缓释片(∥)#2,为片剂,每1000片含量如下:
62.成分含量(g)功能头孢克洛37572.84%甘露醇305.83%hpmc
‑
e5346.60%hpc
‑
hxf61.311.91%尤特奇l100
‑
557.51.46%硬脂酸40.78%硬脂酸镁30.58%总片重514.8 欧巴代蓝色包衣粉163.12%
63.该头孢克洛缓释片(∥)#2的制备方法包括:原辅料过筛、称量混合、制粒、干燥、压片、包衣等工序。具体工艺步骤如下:
64.步骤1:将头孢克洛原料和hpc
‑
hxf、hpmc
‑
e50、甘露醇分别过筛,混合后保存备用;
65.步骤2:按尤特奇l100
‑
55溶解于乙醇中,缓慢搅拌至完全溶解澄清,保持备用;
66.步骤3:将步骤1均匀混合的物料倒入制粒机,开启搅拌3分钟;
67.步骤4:将步骤2中的肠溶材料溶液以雾化方式加入到步骤3中制粒机的继续混合的物料,2分钟内加完,并继续搅拌3分钟后开启切刀1分钟;
68.步骤5:步骤4种的物料出锅后干燥,控制物料水分低于3.8%;
69.步骤6:将步骤5中干燥颗粒加入硬脂酸、硬脂酸镁和hpmc
‑
50进行总混,测定混合均匀度至合格;
70.步骤7、将步骤5中的物料转移至压片机上压片;
71.步骤8、将步骤7中的未包衣素片转移至高效包衣机中进行常规薄膜保护包衣,包衣增重约为3.12%。
72.实施例3头孢克洛缓释片(∥)#3及其制备方法
73.本实施例提供一种头孢克洛缓释片(∥)#3,为片剂,每1000片含量如下:
74.成分含量(g)功能头孢克洛37572.74%甘露醇305.82%hpmc
‑
k100lv76.614.86%hpmc
‑
e5021.54.17%尤特奇l100
‑
557.11.38%硬脂酸3.20.62%硬脂酸镁2.10.41%总片重515.5 欧巴代蓝色包衣粉163.12%
75.该头孢克洛缓释片(∥)#3的制备方法包括:原辅料过筛、称量混合、制粒、干燥、压片、包衣等工序。具体工艺步骤如下:
76.步骤1:将头孢克洛原料和hpc
‑
hxf、hpmc
‑
e50、甘露醇分别过筛,混合后保存备用;
77.步骤2:按尤特奇l100
‑
55溶解于乙醇中,缓慢搅拌至完全溶解澄清,保持备用;
78.步骤3:将步骤1均匀混合的物料倒入制粒机,开启搅拌3分钟;
79.步骤4:将步骤2中的肠溶材料溶液以雾化方式加入到步骤3中制粒机的继续混合的物料,2分钟内加完,并继续搅拌3分钟后开启切刀1分钟;
80.步骤5:步骤4种的物料出锅后干燥,控制物料水分低于3.8%;
81.步骤6:将步骤5中干燥颗粒加入硬脂酸、硬脂酸镁和hpmc
‑
50进行总混,测定混合均匀度至合格;
82.步骤7、将步骤5中的物料转移至压片机上压片;
83.步骤8、将步骤7中的未包衣素片转移至高效包衣机中进行常规薄膜保护包衣,包衣增重约为3.12%。
84.实施例4实施例1
‑
3头孢克洛缓释片(∥)的溶出性能
85.利用实施例1
‑
3制备的头孢克洛缓释片(∥)#1、头孢克洛缓释片(∥)#2和头孢克洛缓释片(∥)#3与参比剂希刻劳(礼来)进行溶出性能比较。
86.首先,利用高效液相色谱方法分别测定头孢克洛缓释片(∥)#1、头孢克洛缓释片(∥)#2和头孢克洛缓释片(∥)#3与参比剂希刻劳分别在0.1mol/l盐酸介质中、在含5%乙醇的0.1mol/l盐酸介质中、在含20%乙醇的0.1mol/l盐酸介质中和在含40%乙醇的0.1mol/l盐酸介质中的溶出曲线,结果分别如图1
‑
4所示。
87.结果显示,实施例1
‑
3制备的头孢克洛缓释片(∥)#1、头孢克洛缓释片(∥)#2和头孢克洛缓释片(∥)#3与参比剂希刻劳在0.1mol/l盐酸介质中的溶出曲线拟合度分别是:80.4、74.8和66.7;在含5%乙醇的0.1mol/l盐酸介质中的溶出曲线拟合度分别是:85.5、69.9和78.1;在含20%乙醇的0.1mol/l盐酸介质中的溶出曲线拟合度分别是:77.3、76.4和62.3;在含40%乙醇的0.1mol/l盐酸介质中的溶出曲线拟合度分别是:85.7、62.1和69.2。
88.由此可见,本发明的头孢克洛缓释片(∥)#1与参比剂希刻劳的在不同介质中的溶出曲线拟合度均比较高,高于头孢克洛缓释片(∥)#2和头孢克洛缓释片(∥)#3。除在含5%乙醇的0.1mol/l盐酸介质外,头孢克洛缓释片(∥)#2与参比剂希刻劳的溶出曲线拟合度更高。
89.并且,实施例1
‑
3制备的头孢克洛缓释片(∥)#1、头孢克洛缓释片(∥)#2和头孢克洛缓释片(∥)#3在酒精(乙醇)中不会引起突释的可能,具有更高的安全性。
90.实施例5实施例1制备的头孢克洛缓释片(∥)的生物等效性
91.利用实施例1制备头孢克洛缓释片(∥)#1与参比剂希刻劳进行生物等效性验证。
92.生物等效性试验采用双周期自身交叉设计,将12名男性健康志愿者随机分成a、b两组,a组首次服受试制剂——头孢克洛缓释片(∥)#3(t),b组首次服参比制剂希刻劳(r),一周后交换。
93.结果如图5所示,证明本发明和参比剂希刻劳生物等效。
94.在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1