一种向表面富含神经节苷脂的细胞递送重组蛋白质的方法
1.本发明属于蛋白质递送制造技术领域,尤其是一种向表面富含神经节苷脂的细胞递送重组蛋白质的方法。
背景技术:
2.蛋白质具有十分多样的生物功能,以蛋白质为基础的重组蛋白类药物为疾病的治疗提供了新的手段,使用蛋白药物可以治疗因先天基因缺陷或后天疾病等因素所导致的体内相应功能蛋白的缺失,向细胞内递送某一种特定的功能蛋白也可以用于细胞生物学中信号传导通路的研究。
3.但是,绝大部分的蛋白质都无法穿过细胞膜进入细胞内部,这严重阻碍了蛋白药物的开发,以及纯化蛋白在细胞通路研究中的应用。事实上,目前市面上几乎所有的蛋白药物都是针对细胞膜和细胞外基质的靶点而发挥作用的,目前还没有能够进入细胞内部从而发挥作用的蛋白药物。
4.细胞生物学研究中常用的向细胞内递送蛋白的策略是利用纳米颗粒、聚合物或脂质体等载体向细胞内递送蛋白,但是这些载体往往会对细胞或机体造成一定的毒性,通过静脉给药后也不易被身体代谢掉。电转染和显微注射技术可以利用高压电或极细的针头将大分子蛋白递送到细胞内部,但是这些方法需要特殊的仪器辅助,并且仅适用于小规模的细胞生物学科学研究,不适用于蛋白药物治疗。细胞通透肽是一种较为成熟的递送蛋白的技术,但是细胞通透肽递送蛋白效率较低,严重影响了其在蛋白药物中的应用。
5.综上所述,开发一种能够高效地向细胞内递送重组蛋白质的方法对于疾病的治疗具有重要的意义。
技术实现要素:
6.本发明的目的在于克服现有技术的不足,提供一种向表面富含神经节苷脂的细胞递送重组蛋白质的方法,该方法利用霍乱外毒素b亚基(cholera toxin b subunit,ctxb)和断裂内含肽(split intein),不需要依赖于纳米颗粒、聚合物或脂质体等人工合成的非蛋白物质。可以选择性地向表面富含神经节苷脂的细胞(例如神经细胞)递送蛋白质,且递送效率远高于细胞通透肽。对比市面上一些商业用的递送蛋白的转染试剂,该方法可以在含血清的培养基中向细胞内递送目标重组蛋白(poi),因此最大程度保证了细胞的生长条件不被干扰。
7.本发明采取的技术方案是:
8.一种向表面富含神经节苷脂的细胞递送重组蛋白质的方法,其特征在于:包括以下步骤:
9.制备ctxb
‑
cfan和cfac
‑
poi;
10.培养待递送重组蛋白的目标细胞;
11.将ctxb
‑
cfan和cfac
‑
poi稀释为蛋白溶液并共孵育;
12.向目标细胞的培养基内加入蛋白溶液;
13.将加入蛋白溶液的培养基培养后完成重组蛋白的递送。
14.再有,所述ctxb
‑
cfan的蛋白序列为:
15.mgsshhhhhhtpqnitdlcaeyhntqiytlndkifsyteslagkremaiitfkngaifqvevpgsqhidsqkkaie rmkdtlriaylteakveklcvwnnktphaiaaismanypydvpdyaaeyclsydteiltveygflpigkiveeriectvy tvdkngfvytqpiaqwhnrgeqevfeycledgsiiratkdhkfmttdgqmlpideifergldlkqvdglp。
16.再有,所述ctxb
‑
cfan蛋白序列中:第5
‑
10位为his6标签,第11
‑
112位为ctxb,第113
‑
121 位为ha标签,剩余部分为cfan。
17.再有,所述cfac
‑
poi的蛋白序列为:
18.mvkiisrkslgtqnvydigvekdhnfllknglvasncxxxxdykddddkdykddddkhhhhhh。
19.再有,所述cfac
‑
poi的蛋白序列为:
20.mvkiisrkslgtqnvydigvekdhnfllknglvasnxxxxdykddddkdykddddkhhhhhh。
21.再有,所述cfac
‑
poi蛋白序列中:第1
‑
36位为cfac,xxxx表示待递送的蛋白(poi) 片段,倒数第1
‑
6位为his6标签,倒数第7
‑
22位为2xflag标签。
22.本发明的优点和积极效果是:
23.1.本方法中,以霍乱外毒素b亚基为递送的载体,利用b亚基能够自发诱导细胞吞入的特性,将待递送的蛋白片段送入细胞内,b亚基本身不会对细胞造成损伤,而且递送效率远高于现有技术。
24.2.本方法中,以断裂内含肽为连接体,由其将b亚基和待递送蛋白片段连接在一起,连接过程是自发的,无需消耗atp等能量物质,可以便捷地将可溶组分提取出来的待递送蛋白片段和包涵体内纯化出来的b亚基偶联起来。
25.3.本发明中,b亚基可以通过包涵体纯化的方法预先大量制备出来,并长期在保存,无需针对不同的待递送蛋白片段设计不同的表达载体,虽然操作时需要表达融合了c
‑
intein的待递送蛋白片段,但相比之下,c
‑
intein本身长度较短,能够兼容各种纯化方法,提高了操作的便捷性和递送效率。
附图说明
26.图1是本发明的重组蛋白进入细胞的验证数据;
27.图2是本发明的重组蛋白进入细胞的荧光显微技术验证数据;
28.图3是不同细胞递送效率的比较数据;
29.图4是递送过程不受血清影响的验证数据。
具体实施方式
30.下面结合实施例,对本发明进一步说明,下述实施例是说明性的,不是限定性的,不能以下述实施例来限定本发明的保护范围。
31.一种向表面富含神经节苷脂的细胞递送重组蛋白质的方法,本发明的创新在于:包括以下步骤:
32.1.制备融合了n
‑
intein的ctxb
‑
cfan和融合了c
‑
intein的cfac
‑
poi。
33.2.培养待递送重组蛋白的目标细胞;
34.在37℃,5%co2饱和湿度的培养箱中培养待递送重组蛋白的目标细胞(如:hek293t, hek293a,neuro2a,u87等)。培养基即可采用rpmi1640完全培养基,也可采用dmem完全培养基。培养细胞待汇合度达到20%
‑
80%时,进入下一步骤。
35.3.将ctxb
‑
cfan和cfac
‑
poi稀释为蛋白溶液并孵育;
36.用含有10mm tcep的pbs溶液稀释ctxb
‑
cfan和cfac
‑
poi至20μm,以体积比1:1的方式在混合稀释后的蛋白溶液。在室温下孵育10分钟。
37.4.向目标细胞的培养基内加入蛋白溶液;
38.向目标细胞培养基内直接加入混合后的蛋白溶液,确保其在培养基的的终浓度为0.5 μm。即加入蛋白溶液体积为细胞培养基体积的1/40。
39.5.将加入蛋白溶液的培养基培养放入孵箱内继续培养12
‑
24小时,完成重组蛋白的递送。
40.上述ctxb
‑
cfan的制备方法包括以下步骤:
41.1.将pet28a
‑
ctxb
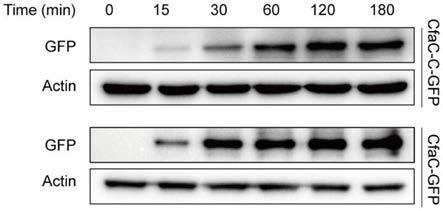
‑
cfan表达质粒(该表达质粒既可通过常规分子克隆手段获得,也可由能够提供克隆服务的公司构建。克隆载体所需的模板可通过基因合成获得。江苏金唯智,南京金斯瑞和上海生工等公司均可提供质粒克隆和基因合成的服务以构建该表达质粒)转化 e.coli bl21(de3),并接种含卡那霉素的lb琼脂板培养,挑取单菌落接种新鲜lb培养基中,在37℃培养至od600为0.5
‑
0.9,将温度降至30℃后加入iptg至终浓度为0.5mm。
42.2.继续诱导培养(12
‑
16小时),收集菌液。
43.3.离心(7000g,10min),然后将菌体重悬于非变性裂解液(50mm nah2po4,10mm imidazole, 1%tritonx
‑
100,5mm bme,1mm pmsf ph=7)中,并在冰上超声进行破碎。
44.4.超声破碎后离心(10000g,10min)并收集包涵体。
45.5.用含尿素的变性缓冲液(100mm nah2po4,10mm tris
‑
base,8m urea,20mm imidazole, ph=8)溶解包涵体至溶液呈透明。
46.6.然后再次离心(10000g,10min)弃去剩余的少量沉淀。
47.7.将上清与ni
‑
ida树脂在室温搅拌孵育1小时。
48.8.然后继续用10倍树脂体积的变性缓冲液洗去非特异性吸附的蛋白,之后用2.5倍树脂体积的变性洗脱液(100mm nah2po4,10mm tris
‑
hcl,8m urea,100mm imidazole,ph=4.5) 洗脱。
49.9.将收集的洗脱液装入透析袋中,进行逐步透析复性。
50.逐步复性的缓冲液如下:
51.复性缓冲液i:50mm tris(ph=7.5),50mm nacl,4m urea
52.复性缓冲液ii:50mm tris(ph=7.5),50mm nacl,2m urea
53.复性缓冲液iii:50mm tris(ph=7.5),50mm nacl,1m urea
54.复性缓冲液iv:100mm nah2po4(ph=7.5),150mm nacl,0.5mm tcep,10%(v/v)glycerol
55.10.复性后的蛋白溶液用超滤管浓缩蛋白并保存蛋白于
‑
80℃冰箱内。
56.上述cfac
‑
poi中,制备方法取决于poi的特性,可以使用与ctxb
‑
cfan相同的包涵体纯化方法(该表达质粒既可通过常规分子克隆手段获得,也可由能够提供克隆服务的公
司构建。克隆载体所需的模板可通过基因合成获得。江苏金唯智,南京金斯瑞和上海生工等公司均可提供质粒克隆和基因合成的服务以构建该表达质粒),也可以使用如下的非变性纯化的制备方法,包括以下步骤:
57.1.将pet28a
‑
cfac
‑
poi表达质粒转化e.coli bl21(de3),并接种含卡那霉素的lb琼脂板培养,挑取单菌落接种新鲜lb培养基中,在37℃培养至od600为0.5~0.9,将温度降至 19℃后加入iptg至终浓度为0.5mm。
58.2.继续诱导培养(12
‑
16小时),收集菌液。
59.3.离心(7000g,10min),然后将菌体重悬于非变性裂解液(50mm nah2po4,10mm imidazole, 1%tritonx
‑
100,5mm bme,1mm pmsf ph=7)中,并在冰上超声进行破碎。
60.4.超声破碎后离心(10000g,10min)并收集上清。
61.5.向上清中逐滴加入30%硫酸链霉素溶液使上清中的核酸沉淀。
62.6.然后再次离心去除沉淀并收集上清。
63.7.将上清与ni
‑
ida树脂在4℃搅拌孵育1小时。
64.8.然后继续用20倍树脂体积的非变性清洗液(50mm nah2po4,30mm imidazole,500mmnacl,ph=7)洗去非特异性吸附的蛋白。
65.9.之后用非变性洗脱液(50mm nah2po4,100mm nacl,300mm imidazole,ph=7)将树脂上结合的目标蛋白洗脱。
66.10.收集洗脱中含有较高浓度蛋白的组分(蛋白浓度通过测量od280确定),然后用 sephadex g
‑
25凝胶过滤层析脱盐。
67.11.脱盐的流动相缓冲液为100mm nah2po4(ph=7.5),150mm nacl,0.5mm tcep,10%(v/v) glycerol。
68.12.脱盐后收集的蛋白组分用超滤管浓缩并保存蛋白于
‑
80℃冰箱内。
69.上述工艺过程中使用的材料的厂商为:dmem厂商gibco、非必须氨基酸厂商索莱宝、penicillin/streptamycin厂商新赛美、胎牛血清厂商gibco、tcep厂商生工生物、pbs 厂商索莱宝。
70.上述ctxb
‑
cfan的蛋白序列为:
71.mgsshhhhhhtpqnitdlcaeyhntqiytlndkifsyteslagkremaiitfkngaifqvevpgsqhidsqkkaie rmkdtlriaylteakveklcvwnnktphaiaaismanypydvpdyaaeyclsydteiltveygflpigkiveeriectvy tvdkngfvytqpiaqwhnrgeqevfeycledgsiiratkdhkfmttdgqmlpideifergldlkqvdglp。
72.ctxb
‑
cfan蛋白序列中:第5
‑
10位为his6标签,第11
‑
112位为ctxb,第113
‑
121位为ha标签,剩余部分为cfan。
73.ctxb
‑
cfan氨基酸序列为:
74.tgggcagcagccatcatcatcatcatcacacacctcaaaatattactgatttgtgtgcagaataccacaacacaca aatatatacgctaaatgataagatattttcgtatacagaatctctagctggaaaaagagagatggctatcattactttta agaatggtgcaatttttcaagtagaagtaccaggtagtcaacatatagattcacaaaaaaaagcgattgaaaggatgaag gataccctgaggattgcatatcttactgaagctaaagtcgaaaagttatgtgtatggaataataaaacgcctcatgcgat tgccgcaattagtatggcaaattacccatacgatgttccagattacgctgccgaatattgcctgtcttacgacacagaga ttctgaccgttgaatatggattccttcctatcggtaagatcgtggag
gaacggattgaatgcacagtctatacggtagat aaaaatggctttgtgtatacacaacctattgctcagtggcataaccggggagaacaggaagttttcgaatactgcttaga agacggttcgattatccgtgcaacgaaagatcacaaatttatgacgaccgacggtcagatgttaccgattgatgagattt tcgaacgggggttagacctgaaacaagttgatggtttgccg。
75.cfac
‑
poi的蛋白序列为:
76.⑴
mvkiisrkslgtqnvydigvekdhnfllknglvasncxxxxdykddddkdykddddkhhhhhh。
77.cfac
‑
poi的氨基酸序列为:
78.atggtcaagatcattagtcgtaagagtctgggcactcaaaacgtctacgatattggagtagaaaaagatcataatt ttttgctgaagaatgggctggtggcctctaactgcxxxxgactacaaagacgatgacgacaaggattataaagatgatga tgataaacaccaccaccaccaccac。
79.或者,cfac
‑
poi的蛋白序列为:
80.⑵
mvkiisrkslgtqnvydigvekdhnfllknglvasnxxxxdykddddkdykddddkhhhhhh。
81.cfac
‑
poi的氨基酸序列为:
82.atggtcaagatcattagtcgtaagagtctgggcactcaaaacgtctacgatattggagtagaaaaagatcataatt ttttgctgaagaatgggctggtggcctctaacxxxxgactacaaagacgatgacgacaaggattataaagatgatgatga taaacaccaccaccaccaccac。
83.上述
⑴
和
⑵
的cfac
‑
poi蛋白序列中:第1
‑
36位为cfac,xxxx表示待递送的蛋白片段,倒数第1
‑
6位为his6标签,倒数第7
‑
22位为2xflag标签。
84.上述两个cfac
‑
poi的不同在于:第
⑴
个序列在第37位增加了一个半胱氨酸(c)的蛋白。第
⑴
使待递送蛋白片段(xxxx)与ctxb以共价方式偶联,第
⑵
使待递送蛋白片段(xxxx)借助断裂内含肽间接地以非共价相互作用的方式和ctxb结合。上述两种连接虽然不同,但都可以实现待递送蛋白片段的递送。实施例中,为了表述清楚,将
⑴
和
⑵
分别标记为cfac
‑
c
‑
poi 和cfac
‑
poi,以示区别。
85.实施例1
86.目标细胞:neuro2a
87.待递送蛋白片段:gfp绿色荧光蛋白
88.制备融合了n
‑
intein的ctxb
‑
cfan;制备融合了c
‑
intein的cfac
‑
c
‑
gfp和cfac
‑
gfp。
89.上述cfac
‑
c
‑
gfp和cfac
‑
gfp的含义是:cfac
‑
c
‑
gfp表示采用第
⑴
种带有半胱氨酸(c) 的结构,cfac
‑
gfp表示采用第
⑵
种不带有半胱氨酸(c)的结构。
90.cfac
‑
c
‑
gfp蛋白序列:
91.mvkiisrkslgtqnvydigvekdhnfllknglvasncmvskgeelftgvvpilveldgdvnghkfsvsgegegdat ygkltlkficttgklpvpwptlvttltygvqcfsrypdhmkqhdffksampegyvqertiffkddgnyktraevkfegdt lvnrielkgidfkedgnilghkleynynshnvyimadkqkngikvnfkirhniedgsvqladhyqqntpigdgpvllpdn hylstqsalskdpnekrdhmvllefvtaagitlgmdelykdykddddkdykddddkhhhhhh
92.cfac
‑
c
‑
gfp氨基酸序列:
93.atggtcaagatcattagtcgtaagagtctgggcactcaaaacgtctacgatattggagtagaaaaagatcataatt ttttgctgaagaatgggctggtggcctctaactgcatggtgagcaagggcgaggagctgttcaccgg
ggtggtgcccatc ctggtcgagctggacggcgacgtaaacggccacaagttcagcgtgtccggcgagggcgagggcgatgccacctacggcaa gctgaccctgaagttcatctgcaccaccggcaagctgcccgtgccctggcccaccctcgtgaccaccctgacctacggcg tgcagtgcttcagccgctaccccgaccacatgaagcagcacgacttcttcaagtccgccatgcccgaaggctacgtccag gagcgcaccatcttcttcaaggacgacggcaactacaagacccgcgccgaggtgaagttcgagggcgacaccctggtgaa ccgcatcgagctgaagggcatcgacttcaaggaggacggcaacatcctggggcacaagctggagtacaactacaacagcc acaacgtctatatcatggccgacaagcagaagaacggcatcaaggtgaacttcaagatccgccacaacatcgaggacggc agcgtgcagctcgccgaccactaccagcagaacacccccatcggcgacggccccgtgctgctgcccgacaaccactacct gagcacccagtccgccctgagcaaagaccccaacgagaagcgcgatcacatggtcctgctggagttcgtgaccgccgccg ggatcactctcggcatggacgagctgtacaaggactacaaagacgatgacgacaaggattataaagatgatgatgataaa caccaccaccaccaccac
94.cfac
‑
gfp蛋白序列:
95.mvkiisrkslgtqnvydigvekdhnfllknglvasnmvskgeelftgvvpilveldgdvnghkfsvsgegegdaty gkltlkficttgklpvpwptlvttltygvqcfsrypdhmkqhdffksampegyvqertiffkddgnyktraevkfegdtl vnrielkgidfkedgnilghkleynynshnvyimadkqkngikvnfkirhniedgsvqladhyqqntpigdgpvllpdnh ylstqsalskdpnekrdhmvllefvtaagitlgmdelykdykddddkdykddddkhhhhhh
96.cfac
‑
gfp氨基酸序列:
97.atggtcaagatcattagtcgtaagagtctgggcactcaaaacgtctacgatattggagtagaaaaagatcataatt ttttgctgaagaatgggctggtggcctctaacatggtgagcaagggcgaggagctgttcaccggggtggtgcccatcctg gtcgagctggacggcgacgtaaacggccacaagttcagcgtgtccggcgagggcgagggcgatgccacctacggcaagct gaccctgaagttcatctgcaccaccggcaagctgcccgtgccctggcccaccctcgtgaccaccctgacctacggcgtgc agtgcttcagccgctaccccgaccacatgaagcagcacgacttcttcaagtccgccatgcccgaaggctacgtccaggag cgcaccatcttcttcaaggacgacggcaactacaagacccgcgccgaggtgaagttcgagggcgacaccctggtgaaccg catcgagctgaagggcatcgacttcaaggaggacggcaacatcctggggcacaagctggagtacaactacaacagccaca acgtctatatcatggccgacaagcagaagaacggcatcaaggtgaacttcaagatccgccacaacatcgaggacggcagc gtgcagctcgccgaccactaccagcagaacacccccatcggcgacggccccgtgctgctgcccgacaaccactacctgag cacccagtccgccctgagcaaagaccccaacgagaagcgcgatcacatggtcctgctggagttcgtgaccgccgccggga tcactctcggcatggacgagctgtacaaggactacaaagacgatgacgacaaggattataaagatgatgatgataaacac caccaccaccaccac
98.操作步骤是:
99.1.在37℃,5%co2饱和湿度的培养箱中用dmem完全培养基培养待递送gfp的目标细胞 neuro2a。培养目标细胞待汇合度达到20%
‑
80%时,进入下一步骤。
100.2.用含有10mm tcep的pbs溶液稀释ctxb
‑
cfan和cfac
‑
c
‑
gfp至20μm,以体积比1:1 的方式混合稀释后的蛋白溶液。在室温下孵育10分钟。
101.3.向目标细胞培养基内直接加入混合后的蛋白溶液,确保其在培养基的的终浓度为0.5 μm。即加入蛋白溶液体积为细胞培养基体积的1/40。
102.4.在孵箱内继续培养细胞2
‑
24小时,完成递送。
103.同样完成以cfac
‑
gfp结构的递送过程。
104.利用wb检测细胞内gfp蛋白含量如图1所示,上两行为以cfac
‑
c
‑
gfp进行递送、随
着第4步孵育时间增长时的细胞内gfp蛋白含量变化的效果;上两行为以cfac
‑
gfp进行递送、随着第4步孵育时间增长时的细胞内gfp蛋白含量变化的效果。
105.图2为与细胞通透肽介导的对比实验,荧光图片的左边标记了向培基内所加入的重组蛋白,右边为使用的细胞类型以及孵育时间。从第一行到第二行可知:在向培基内加入重组蛋白(gfp荧光蛋白)的初期,大量荧光蛋白会结合在细胞膜上,一部分gfp荧光蛋白以内吞的方式进入了细胞。在16小时孵育后,大量gfp荧光蛋白脱离了内吞小体,进入到细胞质内。第三行为相同实验条件下,使用细胞通透肽介导的蛋白递送情况,从图2第三行可知:tat
‑
gfp 是融合了细胞通透肽的gfp蛋白,在相同条件下几乎无法检测到细胞通透肽介导的蛋白递送。
106.实施例2
‑
4分别是向u87、hek293a和hek293t内递送gfp荧光蛋白,操作过程和实施例 1相同,经过验证,取得了和实施例1相同的实验结果,具体实验结果如图3所示。图3中的细胞在收集前已经用pbs反复冲洗,并用胰酶消化,因此已经除去了细胞表面粘附的少量 gfp荧光蛋白。gfp抗体检测到的条带深浅指示了细胞内部的gfp含量。
107.如图4所示,传统的基于脂质体的蛋白转染试剂(如chariot
tm
,pierce
tm
和pulsin
tm
等) 往往需要在无血清的培基中向细胞内递送蛋白(参考这几种试剂的使用说明书)。本发明的转运效率不受血清的影响。柱状图中左数第一组和第二组无显著差异。
108.实施例5
109.采用如实施例1相同的操作方法,向neuro2a和u87细胞内递送apoptin蛋白,最终诱导细胞凋亡。实施过程与实施例1的区别为,将cfac
‑
gfp(或cfac
‑
c
‑
gfp)替换为 cfac
‑
apoptin,其他所有操作方法不变。
110.cfac
‑
apoptin蛋白序列:
111.mvkiisrkslgtqnvydigvekdhnfllknglvasnmnalqedtppgpstvfrpptssrpletphcreirigiagi titlslcgcanaraptlrsatadssestgfknapdlrtdqpkppskkrscdpseyrvselkenlitttpsrprtarrcir ldykddddkdykddddkhhhhhh
112.cfac
‑
apoptin氨基酸序列:
113.atggtcaagatcattagtcgtaagagtctgggcactcaaaacgtctacgatattggagtagaaaaagatcataatt ttttgctgaagaatgggctggtggcctctaacatgaacgctctccaagaagatactccacccggaccatcaacggtgttc aggccaccaacaagttcacggccgttggaaacccctcactgcagagagatccggattggtatcgctggaattacaatcac tctatcgctgtgtggctgcgcgaatgctcgcgctcccacgctaagatctgcaactgcggacagttcagaaagcactggtt tcaagaatgcgccggacttgaggaccgatcaacccaagcctccctcgaagaagcgatcctgcgacccctccgagtacagg gtaagcgagctaaaagaaaacttgattaccactactcccagccgaccccgaaccgcaagaaggtgtataagactggacta caaagacgatgacgacaaggattataaagatgatgatgataaacaccaccaccaccaccac
114.制备以上相应蛋白所需的质粒,可通过常规分子克隆实验方法获得,使用者需将上述dna 序列所对应的开放阅读框(orf)到克隆至任意原核表达空载体中(例如pet28a)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1