免疫细胞联合抗体在治疗癌症中的用途的制作方法
1.本发明涉及生物领域,更具体的涉及免疫细胞联合抗体在治疗癌症中的用途。
背景技术:
2.近年来,肿瘤的免疫治疗因其对于常规疗法无效的晚期肿瘤具有显著疗效而受到极大关注。目前,主要的免疫细胞治疗包括t细胞治疗和nk细胞的治疗。
3.t细胞是认为能够特异性杀伤肿瘤细胞的细胞。dc将抗原提呈给t细胞,诱导t细胞活化和增殖,包括cd4辅助性t细胞和cd8杀伤性t细胞。肿瘤抗原特异性t细胞一直是肿瘤治疗的重要目标。目前来看,正在进行的针对t细胞的肿瘤免疫治疗,可以分为两大类,一类是t细胞过继疗法,主要包括从患者til中扩增肿瘤特异性t细胞进行回输;另一类是通过基因修饰的方法,在正常t细胞表面表达能够识别肿瘤抗原的受体,包括t细胞受体(tcr)基因修饰t细胞和嵌合抗原受体(car)修饰t细胞(car
‑
t)。
4.nk细胞因其不需预先致敏就可以杀死病毒感染的细胞或者肿瘤细胞而得名。除此之外,nk细胞还可以产生多种细胞因子调节免疫应答,因此,nk细胞是固有免疫系统中非常重要的一群细胞。nk细胞的功能执行主要通过两大类细胞表面受体,包括杀伤细胞活化受体(kar)和杀伤细胞抑制受体(kir)进行调控。正常情况下,kir与mhci类分子结合,产生抑制性信号,尽管自身细胞上多糖类抗原与kar结合产生活化性信号,但由于抑制性占主导地位,从而保证了自身细胞不被nk杀伤。但是,当细胞表面mhci类分子的表达降低或者缺失,抑制性信号功能减弱,nk则被活化,杀伤相应的细胞。活化后的nk细胞通过释放穿孔素和颗粒酶等细胞毒性颗粒,或者表达fas和trail诱导靶细胞发生凋亡。
5.在对nk细胞的分子特征和功能调控深入研究的基础上,开发以nk细胞为基础的免疫治疗可能引发肿瘤免疫治疗的新的突破。虽然早期的il
‑
2活化的淋巴因子激活的杀伤细胞(lak)治疗肿瘤效应不佳,但nk细胞的抗肿瘤效应在2002年获得确认。接受同种异体骨髓回输的急性粒细胞白血病患者,由于kir和hla
‑
c不匹配,复发率明显降低,表明供体来源的nk细胞介导了针对aml的同种异体抗原的反应而没有导致移植物抗宿主反应。根据这一策略,向aml患者过继回输体外活化的同种异体kir不匹配nk细胞,或者向恶性神经胶质瘤患者回输体外活化自体nk细胞获得了一定的治疗效果。但目前看来,过继回输nk细胞若想获得更好的疗效,还需要解决nk细胞抑制性受体的效应并清除treg等一系列问题。为了解决nk细胞抑制性受体的效应,研究者们进行了深入的研究。体外实验表明,使用iph2102单抗阻断kir2dl1、kir2dl2和kir2dl3,可以增加nk细胞的抗肿瘤活性。近期的研究表明,某些情况下,活化的nk细胞也表达pd
‑
1和ctla4。一项研究表明,在mm患者体内,nk细胞表达pd
‑
1,而且,应用pd
‑
1单抗可以恢复nk细胞的抗肿瘤效应;此外,应用pd
‑
l1的igg1单抗还可能激发nk细胞的adcc效应。由于近期靶向pd
‑
1和pd
‑
l1的多个抗体获得批准,因此,进一步深入研究pd
‑
l1单抗和nk细胞对肿瘤的治疗功能具有重要的意义。
6.肝细胞癌(hcc)占原发性肝癌的70%~80%,世界范围内是第6位常见的癌症,术后的复发以及转移引起的死亡排名第3。肝癌发生时,细胞外基质微环境的改变、hsc分泌的
tgf
‑
β等可以抑制nk细胞活性及功能,进而使其对肝细胞的监视功能减弱。由于hcc发病率高,死亡率高,治疗及预后差,亟需新的治疗方法来解决这些难题,近年来肝癌的免疫治疗(如阻断激活t细胞上的免疫抑制受体pd
‑
1/pd
‑
l1等)成为研究的热点。但是目前,针对pd
‑
l1抗体种类还不够丰富,将其与nk细胞一起用于肝癌的治疗研究也不多。
技术实现要素:
7.本发明克服现有技术的缺陷,提供多肽体外培养nk细胞提高其杀伤力的用途。
8.本发明目的通过下面的技术方案实现:
9.一方面,seq id no:1的多肽体外培养nk细胞提高其对肿瘤细胞杀伤力的用途。以25μg/ml的多肽培养的nk细胞对肿瘤细胞具有提高的的杀伤力,与对照nk细胞相比,具有显著的提高。
10.在一个具体实施例中,所述肿瘤为肝癌。
11.本发明此外还提供一种pd
‑
l1单克隆抗体,所述该抗体的重链可变区和轻链可变区分别如下seq id no:2所示和seq id no:3所示。
12.本发明还提供一种治疗用的药物组合物,所述药物组合物为nk细胞和pd
‑
l1抗体以及紫杉醇组合而成;其中所述抗体的重链可变区和轻链可变区分别如下seq id no:2所示和seq id no:3所示;所述nk细胞为seq id no:1所述的多肽培养制备而成。
13.在某些实施方案中,通过本文公开的方法制备的含有nk细胞或者nk细胞和pd
‑
l1抗体的组合物和制剂可配制成用于输注到受试者中。
14.在某些实施例中,在某些实施方案中,nk细胞组合物还可包含低温保护剂,并且nk细胞组合物冷冻以备将来使用。在某些特定实施方案中,配制nk细胞组合物用于输注到受试者中。所述制剂可包含用于储存所述组合物的低温保护剂。nk细胞组合物可包含约500万至约20亿活细胞。
15.本公开还提供了治疗有此需要的受试者的方法,包括给予所述受试者治疗有效量的上述nk细胞以及pd
‑
l1组合物。受试者可患有例如表达肿瘤抗原的癌症,抗原为pd
‑
l1。
16.本发明还提供一种nk细胞和pd
‑
l1抗体和紫杉醇在制备治疗肝癌的药物组合物中的用途;其中所述抗体的重链可变区和轻链可变区分别如下seq id no:2所示和seq id no:3所示;所述nk细胞为seq id no:1所述的多肽培养制备而成。具体的培养为收集培养的nk细胞,接种于96孔板,用nk细胞完全培养基加入多肽终质量浓度为25μg/ml于37℃培养箱中继续培养48h即可。
17.本发明进一步的,在某些实施方案中,药物组合物施用途径符合已知的方法,例如经口;通过静脉内、腹膜内、脑内(脑实质内)、脑内、脑室内、肌肉内、皮下、眼内、动脉内、门静脉内或病变内途径进行注射;通过持续释放系统或通过植入装置。在某些实施方案中,组合物可通过推注或通过输注连续地施用,或通过植入装置施用。在某些实施方案中,该组合疗法中的个别成分可藉由不同途径施用。
18.进一步的,本发明的药物组合物还含有其他的治疗药剂。
19.适用于与本公开的组合物共施用的其他的治疗药剂为化学治疗剂包括例如紫杉醇、细胞松弛素b、短杆菌肽d、溴化乙锭、依米丁、丝裂霉素、依托泊苷、替尼泊苷、长春新碱、长春碱(vinblastine)、秋水仙素、多柔比星、佐柔比星、二羟基蒽二酮、米托蒽醌、光辉霉
素、放线菌素d、1
‑
去氢睾酮、糖皮质激素、普鲁卡因、丁卡因、利多卡因、普萘洛尔和嘌呤霉素及其类似物或同源物。其他试剂包括例如抗代谢物(例如,甲氨蝶呤、6
‑
巯基嘌呤、6
‑
硫鸟嘌呤、阿糖胞苷、5
‑
氟尿嘧啶、达卡巴嗪)、烷基化剂(例如,氮芥、噻替哌、苯丁酸氮芥、美法仑、卡莫司汀(bsnu)、洛莫司汀(ccnu)、环磷酰胺、白消安、二溴甘露糖醇、链脲佐菌素、丝裂霉素c、顺
‑
二氯二胺铂(ii)(ddp)、丙卡巴肼、六甲蜜胺、顺铂、卡铂、奥沙利铂、奈达铂、赛特铂或四硝酸三铂)、蒽环霉素(例如,佐柔比星(daunorubicin),先前称为道诺霉素(daunomycin)和多柔比星)、抗生素(例如,更生霉素(dactinomcin,先前为放线菌素)、博来霉素、光辉霉素和安曲霉素(amc))和抗有丝分裂剂(例如,长春新碱和长春碱)和替莫唑胺。
20.有益效果:
21.本发明证实了多肽可以有效提高nk细胞对肿瘤细胞的杀伤力。将多肽用于nk细胞体外培养,获得杀伤力更强的nk细胞,将所述培养后的nk细胞与pd
‑
l1抗体以及紫杉醇一起,能够有效的用于肝癌的治疗,具有较好的应用价值和应用价值。
附图说明
22.图1nk细胞增殖率结果图
23.图2western blot结果图
24.图3多肽处理的nk细胞对肝癌细胞的杀伤结果图
25.图4pd
‑
l1抗体抑制pd
‑
l1蛋白表达水平结果图
26.图5肿瘤质量结果图
27.图6肿瘤质量结果图
28.图7小鼠的生存时间图
具体实施方式
29.公开了可用于所公开的实施方案、可联合所公开的实施方案使用或可用于制备所公开的实施方案的材料、组合物和成分。这些及其他材料均公开于本文中,且应理解,早公开这些材料的组合、子集、相互作用、组等时,虽然可能未明确地具体提及这些组合物的每一种不同的个体和集合组合和排列,但每一者均具体地涵盖于且描述于本文中。例如,若公开且论述一种方法且论述了可对包括于该方法中的多种分子进行的多种修饰,则除非特定地相反指示,否则具体地涵盖该方法的每一种组合和排列,和可能的修饰。同样,亦具体地涵盖且公开了其任何子集或组合。此概念适用于本公开的所有方面,包括但不限于使用所公开组合物的方法的步骤。因此,若可执行多个额外步骤,则应理解这些额外步骤中每一者均可与所公开的方法的任何特定方法步骤或方法步骤组合一起执行,且具体地涵盖了各该组合或组合子集,且应将其视为已公开。
30.本文所引用的公开和公开中经引用的材料由此特定地以引用方式整体并入。以下描述提供了所公开的组合物和方法的进一步非限制性实例。
31.实施例1nk细胞的分离及纯化
32.取外周静脉血50ml,收集于肝素瓶中。用50ml离心管离心全血,2000r/min离心8min,收集自体血浆,56℃水浴灭活30min,4℃冷水浴置15min后,2500r/min离心8min,取上清待用。将离心收集后的志愿者外周血细胞用无血清培养基重悬至60ml,用玻璃毛细吸管
将患者外周血均匀注入于离心管中的淋巴细胞分离液液面上层,每支离心管加30ml外周血。高速低温离心机离心,800
×
g离心15min,4℃。使用负压器吸掉离心后分离管中的血浆层大部分血浆,收获分离所得的志愿者淋巴细胞层细胞于另一支50ml离心管中。用适量含庆大霉素1.6x105u/l的注射用生理盐水加满到50ml,混匀,1800
‑
2000r/min离心8min,4℃,洗涤1次。弃上清液。
33.将分离所得的淋巴细胞置于nk纯化试剂盒中,置于饱和湿度、37℃、5%co2培养。第5d,用显微镜观察细胞生长状态,用nk细胞完全培养基(品牌为procell,购自武汉普诺赛生命科技有限公司)其中含有(20ng/ml il
‑
15)将nk细胞传代扩瓶到2个75cm2培养瓶中,50ml/瓶,置于饱和湿度、37℃、5%co2培养,平均每3d扩瓶1次,收集第10d细胞加入percp
‑
cy5.5标记的cd3、fitc标记的cd56进行细胞表面标志检测,结果如表1所示,人nk细胞表型为cd3
‑
cd56+比例达到了99.12%,说明分离纯化nk细胞成功。
34.表1细胞表面标志检测结果
35.细胞类型cd3
‑
cd56+标志物比例nk细胞(99.12
±
0.13)%
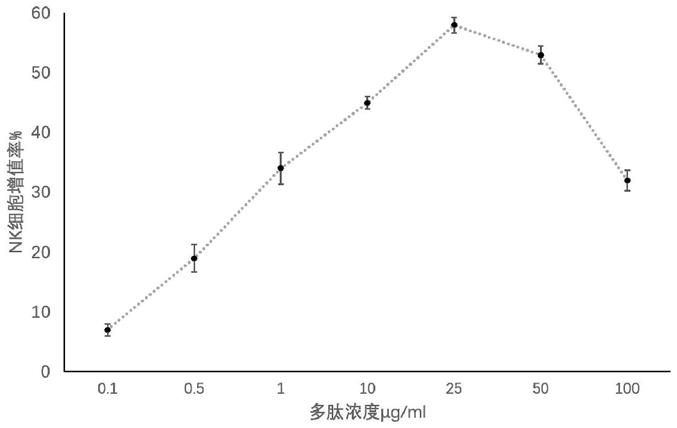
36.实施例2nk细胞的增殖
37.收集培养10d的nk细胞配成5
×
104/ml的细胞悬液;接种于96孔板,用nk细胞完全培养基(品牌为procell,购自武汉普诺赛生命科技有限公司)加入多肽(终质量浓度分别为0、0.1、0.5、1.0、10、25、50、100μg/ml),每组设3个复孔,于37℃培养箱中继续培养48h后,每孔加入cck8 20μl继续培养4h后弃去上清,于酶标仪450nm处检测各孔吸光值(od)记录结果,求其平均值,同时计算细胞生长增殖率(%)。nk细胞增殖率(%)=[(实验od值)-(对照od值)]/(对照od值)
×
100%。结果如图1所示。
[0038]
结果显示,多肽作用nk细胞48h后所有质量浓度(0.1
‑
100μg/ml)组nk细胞的增殖率均较对照组显著升高(p<0.05);作用48h时,多肽质量浓度为25μg/ml组nk细胞增殖率(58.13%
±
1.32%)最高。
[0039]
实施例3westernblot检测多肽作用48h后nk细胞p
‑
akt、β
‑
catenin、bcl
‑
2、p
‑
erk蛋白的表达
[0040]
实验组:取培养10d的nk细胞,配成5
×
105/ml细胞悬液,分别接种于6孔板,3ml/孔,加入多肽(终质量浓度分别为0、0.1、25μg/ml),同时设置只有nk细胞的对照组。继续培养48h后,提取蛋白,forlin检测蛋白质量浓度,sds
‑
聚丙烯酰胺凝胶电泳分离、转膜、封闭,一抗孵育:加入新鲜配制的1∶500稀释p
‑
erk1/2抗体、p
‑
akt抗体、bcl
‑
2抗体、β
‑
catenin抗体和gapdh抗体,置于4℃冰箱过夜;二抗孵育:加入相应二抗1∶1000稀释ap标记兔抗山羊igg、ap标记鼠抗兔igg和碱性磷酸酶标记马抗鼠igg,将滤膜浸入nbt/bcip显色液,终止反应后取出条带晾干,odseey上机扫描。用imagej图像分析软件进行分析。结果如图2所示。
[0041]
多肽对nk细胞中p
‑
akt、β
‑
catenin、bcl
‑
2、p
‑
erk1/2蛋白的表达如图2。结果显示,经多肽作用48h后的nk细胞p
‑
akt、β
‑
catenin表达显著高于对照组;实验组nk细胞的p
‑
erk1/2、bcl
‑
2的表达没有明显差异。
[0042]
本实验研究表明多肽作用48h后nk细胞中p
‑
akt、β
‑
catenin的表达量高于对照组,提示多肽能够上调nk细胞中p
‑
akt、β
‑
catenin的表达,推测wnt信号传导通路及pi3k/akt信号通路可能在多肽促进nk细胞的增殖中发挥着作用。
[0043]
实施例4多肽处理的nk细胞对肝癌细胞的杀伤作用
[0044]
取经不同终质量浓度的多肽(分别为0、0.1、1、10、25μg/ml)作用48h后的nk细胞经pbs在离心机上充分洗涤3次,以去除多肽,将nk细胞配成2
×
106/ml,作为效应细胞;对数生长期的肝癌细胞smmc
‑
7721配成2
×
105/ml,作为靶细胞;加入6孔细胞培养板中,每孔3ml,同时设不加药物为对照组,每检测样本设3个复管。效靶细胞等量混合(效靶细胞数比例=15:1),置37℃、5%co2培养箱中孵育6h后,1500r/min离心10min,收集上清液。按ldh试剂盒说明书要求操作,340nm波长下encore自动生化分析仪测定吸光度值(od)。每检测样本设3个复管。nk细胞的杀伤活性=(实验组od值-效应细胞自然释放组od值)/(靶细胞最大释放od值:
‑
靶细胞自然释放组od值)
×
100%。结果如图3所示。
[0045]
多肽作用48h后的nk细胞对肝癌细胞杀伤活性的影响质量浓度0.1
‑
25μg/ml。多肽作用nk细胞48h后,nk细胞对肝癌细胞的杀伤活性随着多肽质量浓度增加逐渐增强,在25μg/ml时杀伤活性为65.18%
±
2.17%。
[0046]
实施例5pd
‑
l1 mab的制备
[0047]
以发明人筛选鉴定的具有较好免疫原性的pd
‑
l1片段dykritvkvnapynkinqr ilvvdpvtseheltcqaegypkaeviwts重组蛋白为免疫原,取6周龄的balb/c雌鼠,皮下多点免疫方法,免疫剂量为50μg/只。采用常规细胞融合及筛选方法,最终筛选出4株阳性最强的细胞株,采用小鼠体内诱生法制备腹水型抗体;protein g亲和层析柱进行纯化后备用。采用间接elisa对4株抗体效价进行测定,结果显示腹水效价最高的是1a7为1:2.56
×
106,且1a7与结构及功能相似的pd
‑
l2蛋白无明显交叉反应,说明特异性较好。
[0048]
pd
‑
l1 mab ig类及亚类的鉴定采用sbaclonotyping system
‑
hrp试剂盒对筛选的抗体ig类及亚类进行测定,所有操作严格依照试剂盒说明书操作。结果显示1a7为igg1。
[0049]
采用表面等离子共振技术(spr)检测抗体与人pd
‑
l1结合动力学特性摇将人pd
‑
l1
‑
his稀释至1ug/ml,流穿偶联抗his抗体的series s sensor chip cm5芯片,捕获时间为45s,流速为10ul/min。将pd
‑
l1抗体进行连续2倍稀释,共计10个浓度,即浓度为:1000、500、250、125、62.5、31.3、15.6、7.8、3.9、0nmol/l,将稀释完成的样品从低浓度到高浓度依次流穿芯片进行结合、解离,结合时间为60s,解离时间为600s,流速30ul/min,检测结束后选择kinetics选项中1:1binding模式进行曲线拟合,以时间为横坐标,响应值为纵坐标,确定其动力学常数。结果显示本抗体结合pd
‑
l1的亲和力为4.19
×
10
‑9m,显示本抗体具有较好的亲和力。
[0050]
采用常规的抗体轻重链序列鉴定方法,获得了该抗体的重链可变区和轻链可变区分别如下seq id no:2所示和seq id no:3所示。
[0051]
seq id no:1:重链可变区序列
[0052]
evklvesggglvkpggslklscaasgftfsqttmawvrqipekrlewvasieeggsccfpdsalsrftisrdnarnicylqmnslrsddtamyycarareacagyfarwgqgttltvss
[0053]
seq id no:2:轻链可变区序列
[0054]
divltqspaslavssgqratiscsaqqsvhrygtslaswyqqkpgqppklliyarsrvergvparfsgsgsgtdfslnihpveeddiamyfcaasgqrpasfgagtklelk。
[0055]
实施例6pd
‑
l1抗体在western blot检测上的应用
[0056]
取经不同终质量浓度的单抗(分别为0、0.1、1、10、25μg/ml)作用24h后的肝癌细胞
经pbs在离心机上充分洗涤3次,裂解肿瘤细胞,提取总蛋白,经sds
‑
page电泳后将蛋白转到pvdf膜上,5%脱脂奶粉封闭膜后加入稀释的pd
‑
l1纯化抗体(1∶2000),4℃反应过夜后取出膜pbst洗涤3次,加入hrp酶标二抗(1∶8000)室温反应1h,洗涤5次,加入化学发光液反应,在凝胶成像仪成像。结果见图4。结果显示pd
‑
l1抗体能在蛋白水平上与肿瘤细胞中pd
‑
l1特异性结合,并且抑制所述蛋白的表达,抑制效果随抗体浓度的增加而抑制效果增强。
[0057]
实施例7nk细胞与pd
‑
l1抗体治疗肝癌的动物实验
[0058]
细胞培养
[0059]
以细胞培养皿进行细胞培养,将肝癌细胞smmc
‑
7721细胞以106/ml种于10ml含10%胎牛血清的rpmi1640细胞培养基中,3d后待细胞长满80%培养皿进行细胞传代及后续实验。
[0060]
收集培养6d的肝癌细胞smmc
‑
7721细胞,以pbs重悬细胞制成1.5
×
107/ml的细胞悬液。选用7周龄到9周龄大小的雌性balb/c小鼠,按每只小鼠2
×
106个细胞进行皮下注射,大约1周后成瘤,成瘤率是100%。成瘤后每3天测量肿瘤直径1次,在肿瘤直径约为5mm时开始治疗。
[0061]
本研究实验分组包括对照组、pd
‑
l1抗体组、nk细胞组、和pd1抗体联合nk细胞组,每组6只小鼠。对照组小鼠用pbs进行腹腔注射,每3天1次,每周2次;pd
‑
l1抗体组用pd
‑
l1抗体进行处理,以100μg/只的剂量腹腔注射,每3天1次,每周2次;nk细胞组:nk细胞(采用实施例2的增殖方法扩增的nk细胞,其中多肽浓度为25μg/ml)按照5
×
108/ml 200μl/次一起进行腹腔注射,每3天1次,每周2次。pd1抗体联合nk组:将pd
‑
1抗体按照50μg/只和nk细胞(采用实施例2的增殖方法扩增的nk细胞,其中多肽浓度为25μg/ml)按照5
×
108/ml 200μl/次一起进行腹腔注射,每3天1次,每周2次。治疗过程中每3天测量1次肿瘤直径;成瘤15d后杀小鼠,分离肿瘤,测量体质量。结果如图5所示。
[0062]
从图5可以看出,单抗治疗以及单抗和nk细胞联合治疗均可以有效的降低小鼠肿瘤质量,特别是nk细胞与单抗一起,能够显著的降低肿瘤质量,具有较好的治疗效果。
[0063]
实施例8多药物联合治疗效果进一步验证
[0064]
细胞培养
[0065]
以细胞培养皿进行细胞培养,将肝癌细胞smmc
‑
7721细胞以106/ml种于10ml含10%胎牛血清的rpmi1640细胞培养基中,3d后待细胞长满80%培养皿进行细胞传代及后续实验。
[0066]
收集培养6d的肝癌细胞smmc
‑
7721细胞,以pbs重悬细胞制成1.5
×
107/ml的细胞悬液。选用7周龄到9周龄大小的雌性balb/c小鼠,按每只小鼠2
×
106个细胞进行皮下注射,大约1周后成瘤,成瘤率是100%。成瘤后每3天测量肿瘤直径1次,在肿瘤直径约为5mm时开始治疗。
[0067]
本研究实验分组包括对照组、pd
‑
l1抗体组、nk细胞组、pd
‑
l1抗体联合nk细胞组、pd
‑
l1抗体联合nk细胞联合紫杉醇组,每组8只小鼠。对照组小鼠用pbs进行腹腔注射,每3天1次,每周2次;pd
‑
l1抗体组用pd
‑
l1抗体进行处理,以100μg/只的剂量腹腔注射,每3天1次,每周2次;pd1抗体联合nk细胞组:将pd
‑
l1抗体按照50μg/只和nk细胞(采用实施例2的增殖方法扩增的nk细胞,其中多肽浓度为25μg/ml)按照5
×
108/ml 200μl/次一起进行腹腔注射,每3天1次,每周2次。nk细胞组:nk细胞(采用实施例2的增殖方法扩增的nk细胞,其中多
肽浓度为25μg/ml)按照5
×
108/ml 200μl/次一起进行腹腔注射,每3天1次,每周2次。pd1抗体联合nk细胞联合紫杉醇组:将pd
‑
l1抗体按照50μg/只、紫杉醇按照10μg/只和nk细胞(采用实施例2的增殖方法扩增的nk细胞,其中多肽浓度为25μg/ml)按照5
×
108/ml 200μl/次一起进行腹腔注射,每3天1次,每周2次。治疗过程中每3天测量1次肿瘤直径;成瘤15d后每组杀灭4只小鼠,分离肿瘤,测量体质量。结果如图6所示。
[0068]
从图6可以看出,单抗治疗组、nk细胞组以及单抗和nk细胞联合治疗组、单抗和nk细胞以及紫杉醇联合治疗组均可以有效的降低小鼠肿瘤质量,特别是nk细胞与单抗和紫杉醇一起,能够极显著的降低肿瘤质量,具有较好的治疗效果。
[0069]
将每组剩余的小鼠继续进行培养研究,记录小鼠的生存时间结果如图7所示。从图7可以看出,三组治疗组菌可以有效的延长小鼠的生存时间,具有较好的用用价值。
[0070]
以上结合具体实施方式和范例性实例对本发明进行了详细说明,不过这些说明并不能理解为对本发明的限制。本领域技术人员理解,在不偏离本发明精神和范围的情况下,可以对本发明技术方案及其实施方式进行多种等价替换、修饰或改进,这些均落入本发明的范围内。本发明的保护范围以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1