一种酶敏感型多肽胶束型诊疗剂及其在制备抗肿瘤药物中的应用
本发明属于抗肿瘤药物制备技术领域,具体涉及一种酶敏感型多肽胶束型诊疗剂(aiegens-1@mpa)及其在制备抗肿瘤药物中的应用。
背景技术:
癌症的诊断治疗一体化将诊断和治疗合二为一,通过将药物和成像试剂集成于纳米载体中,有针对性地运输至肿瘤组织并对治疗效果进行实时监测,从而实现癌症早期诊断和精确治疗。目前,癌症治疗试剂的成功应用很大程度上依赖于多功能材料的设计和合理使用,开发高效低毒的诊疗药物对癌症的精准诊疗具有重大意义。
传统的有机荧光分子在高浓度溶液或聚集状态下往往会出现荧光猝灭现象(acq),因而在生物荧光成像等领域的应用受到了严重限制。聚集诱导发光分子(aiegens)作为一种特殊的有机发光分子,在稀溶液中分子内部可以自由旋转和振动,导致能量的散失以非辐射跃迁为主,从而呈现极弱的荧光发射或非发射状态。但是在聚集态和固态中,aiegens的分子内转动受到限制,能量散失从非辐射跃迁变为辐射跃迁,从而表现出强烈的荧光发射,从根本上解决有机荧光染料的acq问题。与此同时,aiegens在特定波长的光照下吸收适当能量的光子后,处于基态(s0)的电子被激发至单重激发态(s1),然后通过系间窜跃到达三重激发态(t1)。处于t1的aiegens与周围的氧分子反应产生形成自由基(o2·-和·oh)和氧化性物质(h2o2),或者直接与三线态氧(3o2)反应生成单线态氧(1o2)。这一类活性氧(ros)具有很高的细胞毒性,对细胞膜、核酸及蛋白等生物活性物质会产生氧化损伤,进而加速细胞凋亡。这种利用光化学反应产生的ros引起严重的细胞损伤的治疗手段称为光动力学治疗(pdt)。相较于传统的癌症治疗模式,pdt具有一系列优势,包括创伤小、时空选择性高、可控性强、毒副作用低和疗效高等优点,因而在肿瘤高效治疗方面具有巨大前景。这种将成像和治疗功能整合于同一种纳米材料,从而实现荧光成像指导的pdt的方法称为光学诊疗[张志军,康苗苗,王媛玮,宋光杰,温海飞,王东,唐本忠.聚集诱导发光材料在光学诊疗中的研究进展[j].发光学报,2021,42(03):361-378.],属于诊疗一体化领域的重要分支。然而在传统的pdt治疗过程中往往使用白光或近紫外光光源,意味着其组织穿透能力有限,无法应用于深层肿瘤治疗。由于近红外光(nir)的组织穿透力非常强,且光源能量较低,对生物组织的伤害较小,在肿瘤成像与治疗领域具有重要的应用前景。
aiegens的种类有很多,其中线型三苯胺类给体-苯并噻二唑受体-氰基受体(d-a-a)型分子具有合成路线简单和空穴传输性能良好的优点。例如文献(chen,yi-hong,etal."vacuum-depositedsmall-moleculeorganicsolarcellswithhighpowerconversionefficienciesbyjudiciousmoleculardesignanddeviceoptimization."journaloftheamericanchemicalsociety134.33(2012):13616-13623.)公开了一种aiegens分子(结构式如下),该aiegens分子具有nir光发射的aie性能,但是该文未提及是否具有ros性能,申请人按该文方法合成该分子,结果发现该分子没有nir光发射的ros产生性能。
因此,寻找一种具有nir光发射的aie性能及ros产生性能的aiegens分子具有重要的现实意义。
多肽胶束是由两亲性多肽序列通过自组装形成得到,由于多肽本身具有很好的生物相容性,生物可降解性及无免疫原性等显著优势,将其作为药物载体在生物医学方面具有很广泛的应用前景。此外,通过在分子水平上进行设计和调控多肽自组装行为,使其根据环境刺激(ph值、温度和光照等)的变化而改变自组装体结构与形状,这使其在生物医学领域具有更巨大的应用潜力。目前,尚未有两亲性小分子功能肽和线型三苯胺类给体-苯并噻二唑受体-氰基受体构建的诊疗剂用于肿瘤的特异性诊疗的报道。
技术实现要素:
针对现有技术中存在的不足,本发明以4,4'-二甲氧基-4”-硼酸三苯胺和4-溴-7-(2,2-二氰基乙烯基)苯并[c][1,2,5]噻二唑为主要原料,采用suzukicoupling一步反应合成得到aiegens-1光敏剂;采用多肽固相合成法合成水溶性小分子功能肽(fmoc2-k-gflgg-r8gd);利用多肽本身的两亲性结构在水溶液中自组装形成胶束,进而实现对疏水性aiegens-1光敏剂的有效包埋,构建一种酶敏感型多肽胶束型诊疗剂(aiegens-1@mpa)。本发明的酶敏感型多肽胶束型诊疗剂利用多肽本身的功能多样性,实现aiegens-1光敏剂在肿瘤细胞中的特异性富集,组织蛋白酶刺激响应性释放及光照刺激诱导的诊疗一体化功能。
为了实现上述目的,本发明采用的技术方案为:
一种酶敏感型多肽胶束型诊疗剂aiegens-1@mpa,所述诊疗剂aiegens-1@mpa是球型多肽胶束mpa将疏水性aiegens-1光敏剂包埋于其疏水腔内;所述球型多肽胶束mpa是由两亲性小分子功能肽fmoc2-k-gflgg-r8gd在水溶液中自组装形成。
所述aiegens-1分子,其结构式如下:
分子式:c30h21n5o2s;
分子量:515.59;
所述aiegens-1分子采取以下合成工艺路线进行合成:
所述aiegens-1分子的合成方法:在四-(三苯基膦)钯催化下,将摩尔比=1:2的4,4'-二甲氧基-4”-硼酸三苯胺和4-溴-7-(2,2-二氰基乙烯基)苯并[c][1,2,5]噻二唑(4,4'-二甲氧基-4”-硼酸三苯胺:4-溴-7-(2,2-二氰基乙烯基)苯并[c][1,2,5]噻二唑的摩尔比=1:2)进行suzuki偶联反应,从而有效合成碳-碳键化合物(aiegens-1)。
所述aiegens-1分子在水溶液中具有灵敏的aie性能,并且在aie光照条件下能够产生大量的ros,具有pdt治疗效果;
所述aiegens-1分子在良性溶剂中的荧光强度极弱,这是因为aiegens-1分子在溶解状态能够自由运动,通过非辐射衰变消耗能量。随着乙腈/水溶液中水体积增加到70%时,aiegens-1的荧光强度突然显著增强,主要因为aiegens-1在不良溶剂中的聚集会限制分子内的运动,这时候荧光分子通过辐射跃迁的形式消耗能量,激活了aie性能。
所述两亲性小分子功能肽fmoc2-k-gflgg-r8gd,其结构式如下:
分子量:2443.83;
所述两亲性小分子功能肽fmoc2-k-gflgg-r8gd的多肽序列为:fmoc2-lys-gly-phe-leu-gly-gly-arg-arg-arg-arg-arg-arg-arg-arg-gly-asp。
所述两亲性小分子功能肽fmoc2-k-gflgg-r8gd是由四种功能性多肽序列构成,分别为能与肿瘤细胞发生特异性粘附的肿瘤靶向肽序列rgd,能快速跨膜进入细胞的细胞穿膜肽序列r8,容易被溶酶体中组织蛋白酶(cathepsinb)水解断裂的酶敏感性多肽序列gflgg,及疏水性氨基酸fmoc2-k(氨基酸的2个n端被fmoc基团保护),赋予了胶束较好的自组装性能、主动靶向肿瘤细胞、快速穿膜进入细胞以及酶刺激响应性四种不同功能。
所述两亲性小分子功能肽fmoc2-k-gflgg-r8gd的制备方法:通过多肽固相fmoc合成法依次连接天冬氨酸asp(d),甘氨酸gly(g),精氨酸arg(r)×8,甘氨酸gly(g),甘氨酸gly(g),亮氨酸leu(l),苯丙氨酸phe(f),甘氨酸gly(g)和赖氨酸lys(k),用茚三酮的甲醇溶液(10mg/ml)验证树脂上的氨基酸之间酰胺缩合反应是否彻底完成,若验色溶液为亮黄色或者未变色则证明酰胺缩合反应成功。通过脱除氨基保护基团(fmoc)以后,继续下一步酰胺缩合反应,直至合成目标氨基酸序列gflgg-r8gd,最后接上赖氨酸lys时,不需要脱去fmoc基团,最终得到目标产物。
所述酶敏感型多肽胶束型诊疗剂aiegens-1@mpa的制备方法:将aiegens-1分子、两亲性小分子功能肽fmoc2-k-gflgg-r8gd溶解于有机溶剂中得溶液,然后将所得溶液加入透析袋,于超纯水中透析除去有机溶剂,两亲性小分子功能肽fmoc2-k-gflgg-r8gd在水溶液中自组装形成球形胶束mpa,并将疏水性aiegens-1分子包埋其疏水腔内,透析完成后,将透析袋内的水溶液冷冻干燥成粉末,即得酶敏感型多肽胶束型诊疗剂aiegens-1@mpa。
进一步,所述有机溶剂为dmf(n,n-二甲基甲酰胺)或dmso(二甲基亚砜)。
进一步,所述透析袋的截留分子量为1000-3500da。
进一步,所述透析过程至少为24h。
上述酶敏感型多肽胶束型诊疗剂aiegens-1@mpa在制备抗肿瘤药物中的应用,所述肿瘤例如是前列腺癌、宫颈癌或乳腺癌等。
由于三苯胺单元具有很强的空穴传输能力,苯并噻二唑和氰基作为吸电子基团能允许更大的电子离域,本发明设计的新型aiegens-1分子作为一类基于苯并噻二唑的d-a-a型aiegens分子具有较低的能级带隙(1.97ev),因此具有强的nir区荧光发射及优异的ros产生性能。基于在光照条件下aiegens-1分子能够产生具有细胞毒性的ros,因此aiegens-1分子可能实现成像与治疗一体化。
体外释药研究证明了aiegens-1@mpa诊疗剂在含有组织蛋白酶(cathepsinb)的环境下具有刺激响应型药物释放行为。本发明对其进行了初步的生物活性评价,结果显示,aiegens-1@mpa诊疗剂具有明显的特异性进入肿瘤细胞hela,并抑制肿瘤细胞生长的作用。
与现有技术相比,本发明的技术方案具有以下优点和有益效果:
1、本发明设计和合成的新型aiegens-1光敏剂具有合成简单、产率高和nir(主要在第一近红外nir-i窗口,650-900nm)荧光发射及优异的ros产生性能的优点,有利于其在生物医用领域的应用。
2、本发明设计和合成的新型两亲性小分子功能肽(fmoc2-k-gflgg-r8gd)具有肿瘤细胞靶向性(rgd),细胞穿膜性(r8),组织蛋白酶敏感性(gflgg)和自组装性能,在水溶液中能够自组装形成核-壳型纳米胶束。该两亲性小分子功能肽的临界胶束浓度值(cmc)为1.9mg/l,远远小于传统的两亲性多肽的cmc值,表明该两亲性小分子功能肽在极低的浓度下能够自组装形成胶束,且纳米胶束的结构更稳定。
3、负载aiegens-1光敏剂的胶束(aiegens-1@mpa)的平均粒径为35nm±1nm,具有epr(高渗透长滞留)效应,在药物载体的制备和药物可控释放等生物领域具有巨大的应用潜力。
4、相比常用的聚合物胶束,多肽胶束具有无毒,生物相容性好、生物可降解性及功能多样化等优势。材料的结构组成简单,能有效避免组成结构复杂的治疗系统中效率低、系统副作用大的不良后果,为精准的可视化肿瘤诊疗提供新的研究思路。
附图说明
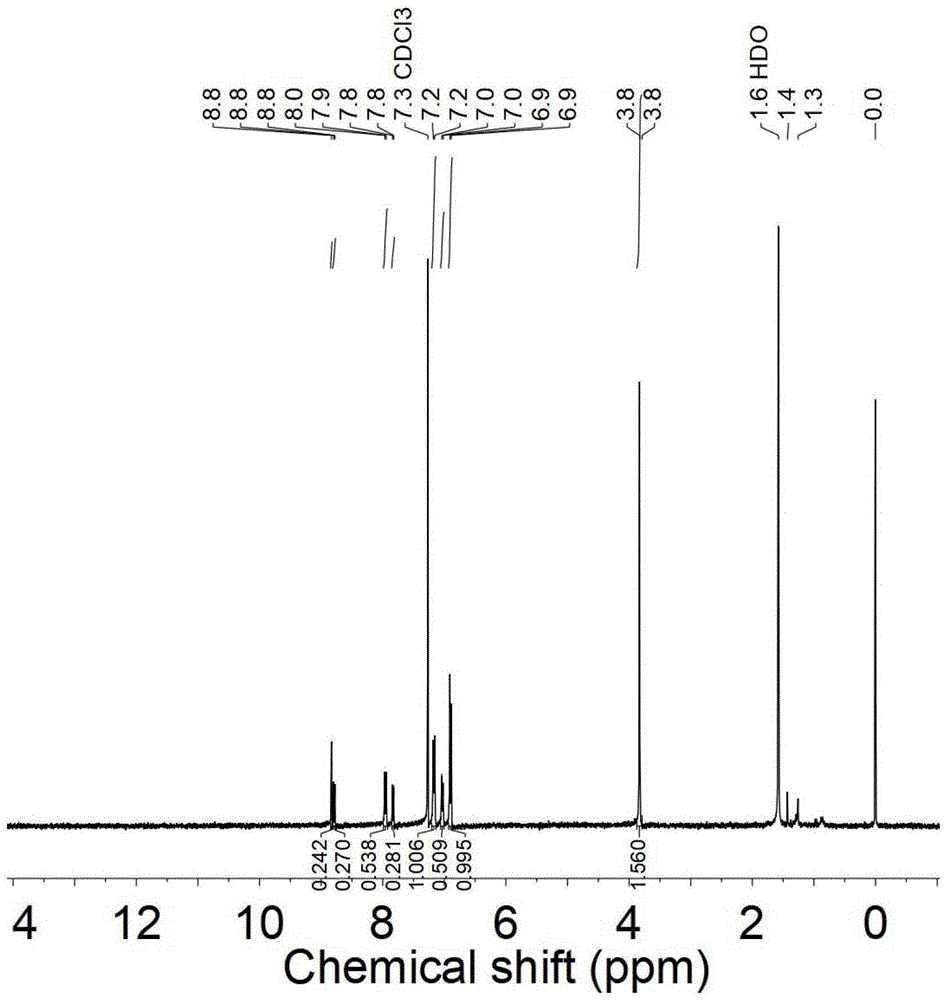
图1为实施例一合成的aiegens-1的1hnmr图谱;
图2为实施例一合成的aiegens-1的maldi-tofms图谱;
图3为实施例二合成的fmoc2-k-gflgg-r8gd的maldi-tofms图谱;
图4为实施例二合成的fmoc2-k-gflgg-r8gd的cmc图;
图5为实施例三合成的aiegens-1@mpa的tem图谱;
图6为实施例四中aiegens-1的aie性能测试实验结果图;
图7为实施例五中aiegens-1@mpa的ros产生性能测试实验结果图;
图8为实施例六中aiegens-1@mpa的体外细胞内吞实验结果图;
图9为实施例六中aiegens-1@mpa的肿瘤细胞内产生ros性能实验结果图;
图10为实施例六中aiegens-1@mpa的细胞暗毒性实验结果图,其中,*:p<0.05,**:p<0.01;
图11为实施例六中aiegens-1@mpa的细胞光毒性实验结果图,其中,*:p<0.05,**:p<0.01。
具体实施方式
下面申请人将结合具体的实施例和附图对本发明的技术方案做详细说明,便于本领域技术人员清楚地理解本发明。但是以下实施例不应以任何方式被解释为对本发明权利要求书请求保护的范围的限制。
以下实施例中所用试剂均为常见市售商品,纯度级别均为分析纯。
实施例一、aiegens-1的合成
向三口烧瓶中加入1mol4-溴-7-(2,2-二氰基乙烯基)苯并[c][1,2,5]噻二唑,2mol4,4'-二甲氧基-4”-硼酸三苯胺,10mmol无水碳酸钠(1.06g),0.04mmol四-(三苯基膦)钯(50mg),通入氮气以除尽烧瓶中的氧气。在氮气氛围下向三口烧瓶中加入20ml甲苯和3ml去离子水,于110℃条件下回流反应4h。待反应结束后,加入40ml二氯甲烷和4.0g硅胶粉,将得到的产物旋转浓缩成粉末。随后将其置于60℃真空干燥箱中,烘干得到粗产物。采用硅胶柱层析法进行产物分离,用体积比为4:1的二氯甲烷/石油醚混合溶剂作为洗脱剂,最终纯化并烘干得到紫黑色固体(收率:51%)。其结构通过核磁氢谱验证(见图1)。1hnmr(400mhz,cdcl3)δ3.83(s,6h),6.90(d,j=8.0hz,4h),7.03(d,j=8.0hz,2h),7.15(d,j=8.0hz,4h),7.83(d,j=8.0hz,h),7.95(d,j=8.0hz,2h),8.78(d,j=8.0hz,1h),8.83(s,1h)。利用基质辅助激光解析电离飞行时间质谱(maldi-tofms)检测其分子量,实际测得分子量为551.03,见图2,与理论值符合(理论分子量为551.59)。结合maldi-tofms图谱和1hnmr数据,证明成功合成了aiegens-1光敏剂。
实施例二、两亲性小分子肽(fmoc2-k-gflgg-r8gd)的合成
采用标准的fmoc固相多肽合成法合成fmoc2-k-gflgg-r8gd:称取2-氯-三苯甲基氯树脂(0.8g,0.97mmol/g)加入多肽固相合成柱中,加入20mln,n-二甲基甲酰胺(dmf)浸泡树脂30分钟,使其充分溶胀后抽滤除去dmf。准备接入第一个氨基酸,进入氨基酸缩合反应。随后向多肽固相合成柱中加入溶有fmoc-asp(otbu)-oh(相当于树脂取代度的3倍量)和diea(相当于树脂取代度的6当量)的dmf溶液,反应2h。反应结束后抽走滤液,并用dmf洗涤4次。得到第一个被fmoc保护的氨基酸缩合后的肽树脂。然后将20%的哌啶(piperidine)/dmf(v/v)溶液加到树脂中,脱除氨基酸n端的氨基保护基fmoc基团,反应半小时(15min×2)后除去反应溶液,并用dmf洗涤树脂三次。此后每一次在树脂上连接氨基酸残基时,均将溶解有被fmoc保护的氨基酸(相当于树脂取代度的4倍量)、1-羟基苯并三唑(hobt,相当于树脂取代度的4倍量)、苯并三氮唑-n,n,n’n’-四甲基脲六氟磷酸盐(hbtu,相当于树脂取代度的4倍量)和n,n-二异丙基乙胺(diea,相当于树脂取代度的6倍量)的dmf加入到树脂中进行缩合反应。反应1.5h后,用茚三酮的甲醇溶液(10mg/ml)验证树脂上的氨基酸之间酰胺缩合反应是否彻底完成,若验色溶液为亮黄色或者未变色则证明酰胺缩合反应成功。酰胺缩合反应成功后,脱除fmoc基团以后,继续进行酰胺缩合反应,依次与fmoc-gly-oh,fmoc-arg(pbf)-oh(与fmoc-arg(pbf)-oh重复八次),fmoc-gly-oh,fmoc-gly-oh,fmoc-leu-oh,fmoc-phe-oh,fmoc-gly-oh,fmoc-lys(boc)-oh)进行酰胺缩合反应,直至合成目标氨基酸序列。待多肽序列合成完毕,依次用dmf和dcm洗涤树脂3次,并将树脂真空干燥过夜。用配好的多肽切落剂(三氟乙酸:水:三异丙基硅烷=95:2.5:2.5,v/v/v)加入到树脂中,在室温下搅拌反应2h。收集滤液并进行浓缩得到浓缩液,然后选用冰乙醚使多肽粗产品从中沉淀出来,最后将沉淀置于真空干燥箱中进行干燥,得到白色粉末产物。通过基质辅助激光解析-飞行时间质谱(maldi-tofms)检测所得白色粉末的分子量(见图3)。fmoc2-k-gflgg-r8gd小分子肽的理论分子量为2443.83,实际测得分子量为2443.72,证明fmoc2-k-gflgg-r8gd多肽的成功合成。在maldi-tof谱图中,分子量为2540.81处的峰为fmoc2-k-gflgg-r8gd与一个三氟乙酸分子之间发生缩合反应,脱去一个h2o分子得到的产物。
以芘为疏水性荧光探针,利用荧光分光光度计测fmoc2-k-gflgg-r8gd的临界胶束浓度(cmc)值。精确称量9.7mg疏水性芘荧光分子,将其溶于10ml丙酮,然后稀释至4.6×10-6mol/l,备用。往3.6ml已配好的一系列浓度的fmoc2-k-gflgg-r8gd多肽水溶液(取fmoc2-k-gflgg-r8gd多肽粉末溶于去离子水中配置而成)加入45μl4.6×10-6mol/l芘的丙酮溶液,配置成样品。将配置好的样品放入37℃摇床(150r/min)震荡24h,确保丙酮完全挥发。最后,利用荧光分光光度计测定样品溶液在360-400nm内的发射光谱(激发波长为342nm,发射光和激发光的狭缝宽度均设为5nm)。以fmoc2-k-gflgg-r8gd溶液在390nm与360nm处的荧光强度比值(i390/i360)作为纵坐标,以fmoc2-k-gflgg-r8gd溶液浓度的对数(lgc)为横坐标作图。找出两条直线的交点对应的横坐标值,从而计算得到该胶束的临界胶束浓度(cmc)。fmoc2-k-gflgg-r8gd的cmc值测得为1.9mg/l(见图4),远远小于传统的两亲性多肽的cmc值。表明该两亲性小分子功能肽在极低的浓度下能自组装形成胶束,且结构稳定,非常适合于药物载体的设计和制备。
实施例三、aiegens-1@mpa的合成
将50mgaiegens-1(实施例一制备的)、50mgfmoc2-k-gflgg-r8gd(实施例二制备的)和20mldmf加入单口圆底烧瓶中,室温下搅拌反应24h。随后将上述溶液加入透析袋(mwco1000da),于超纯水中透析24h,每隔4h换一次超纯水。透析完后,将透析袋内的水溶液冻成固体,然后置于冻干机冷冻干燥成粉末状。利用透射电子显微镜(tem)表征fmoc2-k-gflgg-r8gd小分子肽自组装形成胶束的形貌和尺寸,如图5所示。从图5tem中观察到胶束呈球形,并具有较好的分散性,胶束的干态粒径为35nm±1nm,证明了两亲性小分子肽fmoc2-k-gflgg-r8gd在水溶液中具有较好的自组装性能。
实施例四、aie性能测试实验
配制一系列aiegens-1(实施例一制备的)浓度为30mg/l的aiegens-1溶液(以乙腈-水作溶剂),其中水与乙腈的体积比分别为95%、90%、80%、70%、60%、50%、40%、30%、20%、10%和0%。设定激发波长为572nm,利用荧光分光光度计测定以上溶液在600-650nm范围内的荧光发射光谱(见图6a),并记录其在606nm处的荧光强度值(见图6b)。aiegens-1在良性溶剂(乙腈)中,在606nm处的荧光强度极弱。随着乙腈/水混合溶液中水的体积比(waterfraction,指水与乙腈的体积比)增加到70%时,aiegens-1在606nm处的荧光强度突然显著增强,激活了aie过程。当水的体积比为90%和95%时,aiegens-1的荧光强度分别是在纯乙腈中的荧光强度的36倍和54倍,证明了我们合成的荧光小分子aiegens-1具有良好的aie效应。
实施例五、ros产生性能测试实验
首先,取0.5mlnaoh(10mmol/l)溶液加至100uldcfh-da溶液(10mmol/l)中,在室温条件下避光静置0.5h;再将以上溶液加至0.5mlph为7.4的pbs(0.2mol/l)溶液中,配制得到dcfh。取实施例三合成的冻干粉(aiegens-1@mpa材料)溶于去离子水中,配制50mg/laiegens-1@mpa溶液。随后,将dcfh加入50mg/laiegens-1@mpa溶液中,使dcfh的最终浓度为20μmol/l。将以上溶液分成两份,将第一份溶液置于红外光(680nm,30mwcm-2)下照射,并在预定的时间间隔用荧光分光光度计测定aiegens-1@mpa在525nm处的荧光强度值。第二份溶液则在避光条件下重复上述荧光检测的方法。如图7所示,第一份溶液经过红外光照120s以后,aiegens-1@mpa在525nm处的荧光强度比初始的荧光强度高出17倍。而避光条件下的aiegens-1@mpa在525nm处的荧光强度在此期间基本没有变化。证明了aiegens-1@mpa在特定波长的光照刺激下,能够在短时间内产生大量的ros,所以具备杀死细胞的潜力。但是,在无光照刺激的情况下,aiegens-1@mpa产生的ros很少。因此,我们可以通过调整光照时间的长短,实现有效调控aiegens-1@mpa产生pdt治疗的效果。
实施例六、体外细胞实验
人宫颈癌细胞(hela)和非洲绿猴肾细胞(cos7)均为本申请发明人实验室的冻存材料,细胞培养基则由1%的双抗(青霉素-链霉素)加入购买的含10%的胎牛血清蛋白的dmem培养基中配制而成(以下简称dmem)。所有细胞均在细胞培养基中孵育,在37℃条件下,含有5%co2的细胞培养箱中培养。
体外细胞内吞实验:将hela细胞和cos7细胞分别接种到共聚焦培养皿中培养24h,然后各加入1ml含有aiegens-1@mpa诊疗剂(50mg/l)的dmem溶液,并将共聚焦培养皿放入细胞培养箱中继续培养4h。随后用ph为7.4的pbs溶液(10mmol/l)洗涤细胞三次,再加入1ml含hoechst33342(10μg/ml)的dmem(不含胎牛血清)对细胞核进行染色15min。完成细胞核染色后吸出培养基,用ph为7.4的pbs溶液(10mmol/l)洗涤细胞三次,加入2mldmem培养基,并通过超分辨显微镜观测(激发波长:552nm,荧光接收通道:680nm±30nm)。
图8为实施例六中aiegens-1@mpa的体外细胞内吞实验结果图;图8从左至右依次为明场(bright),细胞核的hoechst33342蓝色荧光场(hoechst33342),aiegens-1@mpa的红色荧光场(aiegens-1@mpa)和叠加场(merge)。从上至下依次为与aiegens-1@mpa诊疗剂共培养的cos7细胞、与aiegens-1@mpa诊疗剂共培养的hela细胞。从图8所知,hela细胞中出现了大量aiegens-1的红色荧光,这是由于aiegens-1@mpa诊疗剂表面修饰的靶向肽rgd,能够识别并与hela细胞表面过度表达的整合素αvβ3结合,并且在穿膜肽r8的辅助下快速穿膜进入hela细胞,从而将aiegens-1光敏剂有效运输到细胞质内。接着,hela细胞质内过表达的cathepsinb能有效裂解gflgg序列,从而引发多肽胶束结构瓦解,实现aiegens-1的定点释放。与此同时,疏水性aiegens-1光敏剂在细胞内会迅速团聚,激活其aie效应,进而发挥细胞内成像功能。相比而言,aiegens-1@mpa在正常细胞(cos7)中的荧光强度很弱,有效证明了rgd肽的靶向性能。
肿瘤细胞内产生ros性能实验:将hela细胞接种于共聚焦培养皿中培养24h,随后加入1ml含有aiegens-1@mpa诊疗剂(50mg/l)的dmem溶液,并继续共培养4h后。然后加入1ml配制好的dcfh-da溶液(20μmol/l),继续共培养30min。以不加aiegens-1@mpa的dmem溶液与hela细胞共培养为对照组。最后,将共聚焦培养皿置于近红外光照(680nm,150mwcm-2)下照射1min,用ph为7.4的pbs(10mmol/l)溶液洗涤细胞三次,并通过超分辨显微镜观测(激发波长:488nm,荧光接收通道:525nm±10nm)。
图9为实施例六中aiegens-1@mpa的肿瘤细胞内产生ros性能实验结果图;图9从左至右依次为明场(bright),dcf的绿色荧光场(dcf)和叠加场(merge)。从上至下依次为没经过任何处理的hela细胞(blank),在避光条件下与aiegens-1@mpa诊疗剂共培养的hela细胞(aiegens-1@mpa),和在光照条件下与aiegens-1@mpa诊疗剂共培养的hela细胞(aiegens-1@mpa+light)。如图9所示,近红外光照下的hela细胞中呈现强烈的dcf绿色荧光,这是由于aiegens-1@mpa胶束将aiegens-1光敏剂靶向运输至hela细胞以后,680nm光照会诱导其在细胞内产生大量的ros,从而将不发光的dcfh氧化为发绿色荧光的dcf。相比而言,在避光条件下的hela细胞中基本上没有出现dcf绿色荧光,进一步证明了nir光照能诱导aiegens-1@mpa胶束在细胞内有效产生ros,具有pdt治疗的生物医用潜能。
细胞毒性实验:采用cck-8法评估aiegens-1@mpa诊疗剂分别对正常细胞和肿瘤细胞的毒性大小。
aiegens-1@mpa的细胞光毒性实验:将hela细胞以5000个/孔的密度接种在96孔板中并加入100μl含有10%fbs的dmem培养基,于37℃下在5%co2培养箱中培养48h。然后,每孔加入100μl含有固定浓度的aiegens-1@mpa诊疗剂的dmem培养基。培养4h后,将其置于近红外光照(680nm,150mwcm-2)下照射3min,再放回培养箱中继续培养24h,用酶标仪检测每个孔在460nm处的吸光度值(od)。随后吸出所有培养基,再加入100μl新鲜dmem培养基和20μlcck-8试剂于96孔板各个孔中,于37℃下在细胞培养箱中培养4h,使用酶标仪第二次检测每个板在460nm处的od,并计算出细胞的存活率。以上操作未作说明的均在避光条件下进行。
aiegens-1@mpa的细胞暗毒性实验:暗毒性实验同aiegens-1@mpa的细胞光毒性实验一样,唯一不同在于“将培养基置于近红外光照(680nm,150mwcm-2)下照射3min”这一操作调整为“继续在培养箱中培养”,即暗毒性实验全程均在避光条件下进行。
细胞光毒性实验、细胞暗毒性实验中检测得到的od值均基于4个独立平行样的平均值,结果表示为平均值±标准偏差(sd)。细胞的相对存活率根据以下公式可计算得到:
viability(%)=(odtreated/odcontrol)×100
其中,odcontrol为cck-8试剂材料加入96孔板前检测到的吸光度值,odtreated为cck-8试剂材料加入96孔板后检测到的吸光度值。
图10为实施例六中aiegens-1@mpa的细胞暗毒性实验结果图,其中,*:p<0.05,**:p<0.01。如图所示,在避光条件下,aiegens-1@mpa诊疗剂含量在0-50mg/l(μg/ml)的范围内对正常细胞(cos7)和肿瘤细胞(hela)的均没有毒性,aiegens-1@mpa诊疗剂含量在0-25mg/l的范围内细胞存活率都在90%以上,表明aiegens-1@mpa诊疗剂在无光照刺激条件下具有很好的生物相容性。
但是,在nir光照下(图11为实施例六中aiegens-1@mpa的细胞光毒性实验结果图,其中,*:p<0.05,**:p<0.01),aiegens-1@mpa诊疗剂在浓度为25mg/l时与hela细胞共培养以后的细胞存活率下降至68%左右,当浓度为50mg/l时,hela细胞的存活率甚至下降至20%左右(见图11)。与此同时,cos7细胞的存活率仍在90%左右。
以上细胞毒性实验足以证明aiegens-1@mpa诊疗剂表面修饰的rgd肽对肿瘤细胞的靶向性和近红外光照引发的pdt治疗性能。
- 还没有人留言评论。精彩留言会获得点赞!