桃花心木果实中的萜类化合物THXM88-3-3作为肿瘤多药耐药逆转剂的应用
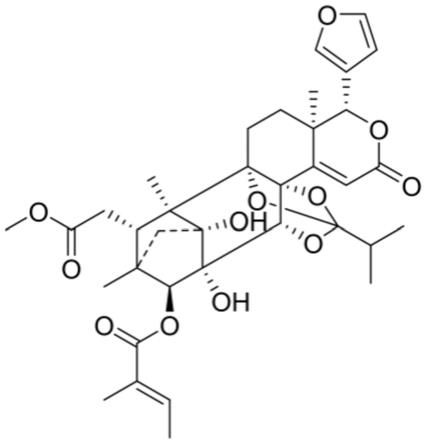
桃花心木果实中的萜类化合物thxm 88
‑3‑
3作为肿瘤多药耐药逆转剂的应用
技术领域
1.本发明涉及一种从中药有效成份中提取对多药耐药肿瘤细胞具有杀伤作用的新化合物的方法,属于天然产物药理活性和分离与提纯天然原料药方法。本发明涉及化合物thxm 88
‑3‑
3作为多药耐药逆转剂的新用途,特别是与抗肿瘤药物合用治疗发生多药耐药的肿瘤,提高肿瘤细胞对抗肿瘤药的敏感性的新用途。
背景技术:
2.癌症已成为严重危害人类健康且难以治愈的疾病之一,是仅次于心血管疾病的人类第二大杀手。随着人类生存环境和生活习性的改变,在不良的外部环境和一些不利因素作用下,肿瘤的发病率正在逐步上升。肿瘤细胞中多药耐药(multidrug
‑
resistance,mdr)的存在被认为是癌症化疗失败的主要原因。其中,产生多药耐药现象的原因主要来自于肿瘤细胞内abc转运蛋白的高表达,转运蛋白将药物排出细胞从而降低胞内抗癌药物的有效浓度,并且使癌细胞对多种药物产生交叉耐药性,是限制癌症化学疗法有效性的重大障碍。
3.中药在肿瘤治疗中的应用由来已久,中草药具有成本低、毒性低、靶点多的优点,从植物中寻找高效低毒的抗肿瘤活性成分已成为国内外学者共同关注的热点。世界上从高等植物中筛选出的抗癌活性成分己达万种,另外动物、海洋生物中也存在有大量的抗癌活性成分,为恶性肿瘤的治疗开辟了广阔的天地。大量的研究工作证明从天然动、植物药中筛选抗肿瘤药的命中率要比合成药高得多,所以筛选天然抗肿瘤药倍受人们重视。从天然药物中研制开发新的抗癌药物具有广阔前景。
4.我们首次发现,本发明中的化合物thxm 88
‑3‑
3体外实验显示出其具有较强的肿瘤耐药逆转活性,能够与抗肿瘤药物合用治疗发生多药耐药的肿瘤,为寻找新的有效的抗肿瘤药物开辟了一条新的途径。
5.该化合物从楝科常绿乔木桃花心木提取物中分离纯化而得。
技术实现要素:
6.本发明的目的在于公开了化合物thxm 88
‑3‑
3在制备肿瘤多药耐药逆转剂中的新用途。
7.本发明的另一目的在于提供一种联苯双酯和抗肿瘤药物的联用,以满足临床用药的需要。
附图说明
8.图1 thxm88
‑3‑
3结构式
9.图2 thxm88
‑3‑
3增加hela/ddp对盐酸阿霉素的药敏性
10.图3 thxm88
‑3‑
3增加k562/a02对盐酸阿霉素的药敏性
11.图4 thxm88
‑3‑
3增加hela/ddp对盐酸米托蒽醌的药敏性
12.图5 thxm88
‑3‑
3增加k562/a02对盐酸米托蒽醌的药敏性
13.图6 thxm88
‑3‑
3对hela/ddp细胞abcb1转录水平的影响
14.图7 thxm88
‑3‑
3对k562/a02细胞abcb1转录水平的影响
15.图8 thxm88
‑3‑
3对abc转运蛋白的外排功能的影响。
具体实施方式
16.下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。
17.实施例一:thxm 88
‑3‑
3影响人宫颈癌耐药细胞株hela/ddp对阿霉素和米托蒽醌的药敏性。
18.将处于对数生长期的hela细胞和其耐药细胞株hela/ddp细胞接种于96孔板中,接种密度约为每孔2 500个细胞,96孔板外周一圈36个孔不铺细胞,只加pbs。每孔加100μl含有10%胎牛血清的dmem培养基,将96孔板置于37℃,5%co2和100%湿度下培养24h。
19.每个样品设置三个复孔,实验重复三次。
20.本研究主要以p
‑
gp为研究对象,以verapamil为逆转剂标准品,化疗药物为阿霉素、米托蒽醌。
21.加入化疗药物。将化疗药物阿霉素、米托蒽醌配制成不同浓度梯度的储液。
22.将化疗药物按照一定浓度梯度加入96孔板中;
23.设置空白对照组;
24.设置阳性对照组,在加入化疗药物的每孔中加入逆转剂标准品verapamil,使其终浓度为 1μm;
25.设置实验组,在加入化疗药物的每孔中加入待测样品thxm 88
‑3‑
3,使其终浓度为0.5μm、 1μm;
26.96孔板置于37℃,5%co2和100%湿度下继续培养24h。
27.培养结束后每孔加入cck
‑
8溶液10μl,继续培育4h。用酶标仪在450nm处测定各孔od值,记录结果。以细胞存活率对剂量作图求ic
50
值。
28.实验结果如表1及表2所示。
29.表1表明,hela细胞株对阿霉素的ic
50
值为0.534
±
0.086μm,其耐药细胞株hela/ddp对阿霉素的ic
50
值为2.188
±
0.083μm,耐药倍数为约4.10倍。经标准对照逆转剂1μm verapamil 处理过后的阿霉素的ic
50
值为0.8918
±
0.1474μm,逆转倍数为约2.45倍。当0.5μm的thxm 88
‑3‑
3与阿霉素联合作用时,thxm 88
‑3‑
3使hela/ddp细胞株对阿霉素的ic
50
值下降到1.052
±ꢀ
0.025μm,逆转倍数为约2.08倍。当1μm的thxm 88
‑3‑
3与阿霉素联合作用时,thxm 88
‑3‑
3 使hela/ddp细胞株对阿霉素的ic
50
值下降到0.9085
±
0.1718μm,逆转倍数为约2.41倍。
30.由此可见,thxm 88
‑3‑
3可增加抗癌药物阿霉素对耐药细胞hela/ddp的药物毒性,且其工作浓度与其逆转作用呈正相关。
31.表1
[0032][0033]
表2表明,hela细胞株对米托蒽醌的ic
50
值为0.0470
±
0.0019μg/ml,其耐药细胞株hela/ddp 对阿霉素的ic
50
值为0.1592
±
0.0054μg/ml,耐药倍数为约3.39倍。经标准对照逆转剂1μm verapamil处理过后的阿霉素的ic
50
值为0.0825
±
0.0005μg/ml,逆转倍数为约1.93倍。当0.5μm 的thxm 88
‑3‑
3与阿霉素联合作用时,thxm 88
‑3‑
3使hela/ddp细胞株对阿霉素的ic
50
值下降到0.1249
±
0.0161μg/ml,逆转倍数为约1.28倍。当1μm的thxm 88
‑3‑
3与阿霉素联合作用时, thxm 88
‑3‑
3使hela/ddp细胞株对阿霉素的ic
50
值下降到0.1038
±
0.0025μg/ml,逆转倍数为约 1.53倍。
[0034]
由此可见,thxm 88
‑3‑
3可增加抗癌药物米托蒽醌对耐药细胞hela/ddp的药物毒性,且其工作浓度与其逆转作用呈正相关。
[0035]
表2
[0036][0037]
实施例二:thxm 88
‑3‑
3影响人慢性髓系白血病耐药细胞株k562/a02对阿霉素的药敏性。
[0038]
将处于对数生长期的k562细胞和其耐药细胞株k562/a02细胞接种于96孔板中,接种密度约为每孔1
×
104个细胞,96孔板外周一圈36个孔不铺细胞,只加pbs。每孔加100μl含有10%胎牛血清的rpmi 1640培养基。
[0039]
每个样品设置三个复孔,实验重复三次。
[0040]
本研究主要以p
‑
gp为研究对象,以verapamil为逆转剂标准品,化疗药物为阿霉素。
[0041]
加入化疗药物。将化疗药物阿霉素配制成不同浓度梯度的储液。
[0042]
将化疗药物按照一定浓度梯度加入96孔板中;
[0043]
设置空白对照组;
[0044]
设置阳性对照组,在加入化疗药物的每孔中加入逆转剂标准品verapamil,使其终
浓度为 1μm;
[0045]
设置实验组,在加入化疗药物的每孔中加入待测样品thxm 88
‑3‑
3,使其终浓度为0.5μm、 1μm;
[0046]
96孔板置于37℃,5%co2和100%湿度下培养48h。
[0047]
培养结束后每孔加入cck
‑
8溶液10μl,继续培育4h。用酶标仪在450nm处测定各孔od值,记录结果。以细胞存活率对剂量作图求ic
50
值。
[0048]
实验结果如表3所示,k562细胞株对阿霉素的ic
50
值为0.846
±
0.012μm,其耐药细胞株 k562/a02对阿霉素的ic
50
值为76.75
±
1.82μm,耐药倍数为约90.72倍。经标准对照逆转剂1μm verapamil处理过后的阿霉素的ic
50
值为11.79
±
0.32μm,逆转倍数为约6.51倍。当0.5μm的 thxm 88
‑3‑
3与阿霉素联合作用时,thxm 88
‑3‑
3使hela/ddp细胞株对阿霉素的ic
50
值下降到 63.78
±
1.62μm,逆转倍数为约1.20倍。当1μm的thxm 88
‑3‑
3与阿霉素联合作用时,thxm 88
‑3‑
3使k562/a02细胞株对阿霉素的ic
50
值下降到13.82
±
0.80μm,逆转倍数为约5.56倍。
[0049]
由此可见,thxm 88
‑3‑
3可增加抗癌药物阿霉素对耐药细胞k562/a02的药物毒性,且其工作浓度与其逆转作用呈正相关。
[0050]
表3
[0051][0052]
表4
[0053][0054]
实施实例三:对p
‑
glycoprotein蛋白外排功能的影响
[0055]
bwb74
‑5‑
5对mdr1蛋白外排功能的影响可以改变相应的荧光染料在细胞内的荧光强度。
[0056]
将hela和hela/dpp细胞以密度以密度为1x104/孔接种到96孔板,每孔体积为200μl,设置96三个复,96孔板的四周一圈加灭菌的蒸馏水。把96孔板放入37℃,5%co2恒温培养箱中培养96h。
[0057]
将逆转剂标准品verapamil配置成2mm,染料rhodamine123配制成50ug/ml,待测样品 bwb74
‑5‑
5配制成2.5mm。
[0058]
标准品和待测样品bwb74
‑5‑
5加入后放入37℃,5%co2恒温培养箱中孵育15min。
[0059]
15min后加入荧光染料孵育4h;每个样品设置三个复孔。
[0060]
将96孔板从培养箱中拿出,每孔用200μl冷的pbs洗两遍,弃去pbs,在全波长多功能酶标仪上检测。
[0061]
rho123激发波长为480nm,发射波长为550nm;检测mdr1蛋白的rh0123荧光染料最终浓度为2ug/ml,标准品verapamil的最终浓度为10μm,待测样品bwb74
‑5‑
5的浓度分别是5μm和10μm。
[0062]
实验结果显示bwb74
‑5‑
5能够增加染料rho123在细胞内的积累量,hyl1005
‑
2在10μm的浓度下rho123在细胞内的荧光强度比在5μm浓度下的荧光强度强。但是在同一浓度10μm 下,在细胞内rho123的荧光强度bwb74
‑5‑
5比verapamil的荧光强度强。说明bwb74
‑5‑
5对荧光染料在细胞内的积累量呈浓度依赖性。
[0063]
实施实例四:对abcb1表达水平的影响
[0064]
1细胞总rna提取
[0065]
(1)配1
‰
浓度(v/v)固相rnase清除剂,并用配好的rnase清除剂分别擦拭移液器、超净工作台台面等。用紫外灯照射超净台30min,并预冷高速离心机。
[0066]
(2)1000rpm 3min离心,弃上清,收集细胞。加入1ml trizol试剂,用1ml移液枪多次吹打,使细胞全部裂解,得到细胞裂解液。
[0067]
(3)多次吹打后,在超净台上室温放置5min,等待核酸和蛋白充分解离。在按每用1mltrizol试剂加进去0.2ml三氯甲烷的比例,盖紧管盖,手动剧烈震荡15s钟左右,在超净台中室温静置3min。
[0068]
(4)4℃12000rpm 15min,离心后,小心离心管,放在冰上,并转移到超净台中。
[0069]
(5)用200μl移液枪小心吸取400
‑
500μl上层无色水相(若少可以少吸)转移到新的1.5ml 无酶离心管中。吸取时枪头触碰dna和蛋白杂质中间层(中间层,白色)。
[0070]
(6)加入所吸取水相一样体积,并提前预冷的异丙醇,盖紧管盖,轻轻颠倒混匀。冰上静置10min。
[0071]
(7)4℃12000rpm离心10min,使rna沉淀到离心管底部。
[0072]
(8)弃上清,去上清时候注意不要把rna也倒掉,每管加入1ml提前预冷用无酶水配置的 75%乙醇洗涤两次,用移液器轻轻吹打,以去除残留的异丙醇和盐份。4℃,12000rpm离心5 min。
[0073]
(9)用移液枪可以吸取上清,将rna沉淀干燥(室温挥发或真空干燥)。注意rna沉淀不要完全干燥,否则难以看见,并且难以溶解。
[0074]
(10)将rna沉淀溶解于适量(10~40μl)的rnase
‑
free water中。此rna溶液可用于进一步实验,或者
‑
80℃保存。
[0075]
2rna逆转录成cdna
[0076]
(1)取2μl rna溶液用rnase
‑
free water稀释50倍,用eppendorf biophotometer plus仪测定rna样品的浓度及纯度。
[0077]
(2)计算500ng rna所需的体积,加2μl的4
×
gdna wiper mix,并用rnase
‑
free water补足至8ml。用移液器轻轻吹打,42℃温育2min,除去模板rna中的基因组dna。
[0078]
(3)在上一步的反应管中直接加入2μl 5
×
hiscript ll qrt supermix ll用移液器轻轻吹打混匀。
[0079]
(4)全部加完后,25℃,10min。
[0080]
(5)50℃反应30min进行逆转录。
[0081]
(6)85℃,5min使反转录酶失活。
[0082]
(7)第一链cdna储存于
‑
20℃备用。
[0083]
3 real
‑
time pcr
[0084]
下表合成real
‑
time pcr所需引物。
[0085]
表real
‑
time pcr引物表
[0086][0087]
(4)建立10μl反应体系
[0088][0089]
(5)设置real
‑
time pcr反应条件
[0090][0091]
2.2.5.4结果分析
[0092]
本实验的目的是比较分析jurkat细胞中某些基因转录水平的相对于对照的变化,所以采用 2
‑△△
ct法。这种分析的方法可以直截了当的计算出对照组和实验组之间同一基因mrna的表达倍数关系;管家基因gapdh作为内参,对数值进行校正,减少误差。
[0093]
倍数关系(实验组/对照组)=2
‑
[(ct目的基因
‑
ct内参)实验组
‑
(ct目的基因
‑
ct内参)对照组。
[0094]
实验结果:
[0095]
bwb74
‑5‑
5在2.5μm和52.5μm浓度下处理hela/ddp对abcb1的转录没有影响。在10μm 浓度下对abcb1的转录有较弱的下调作用,在10μm浓度下分别处理hela/ddp 24h、48h、72h bwb74
‑5‑
5对abcb1的转录没有影响。
[0096]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1