一种质子剂量的计算方法及装置与流程
1.本发明涉及医疗辅助的技术领域,尤其涉及一种质子剂量的计算方法及装置。
背景技术:
2.质子治疗是放射线治疗的一种。质子进入人体后,在射程终点处形成一个尖锐的剂量峰,称为bragg峰。通过调制能量展宽bragg峰可以使bragg峰覆盖肿瘤。由于质子治疗在深度剂量分布上具有好的物理特性—布拉格峰(指的是质子治疗法中的辐射的高剂量峰值在达到肿瘤部位时达到最高),相比传统的放射治疗,它能够达到更高的靶区区域剂量照射,并且实现对周围正常组织的低剂量照射。
3.其中,目前常用的质子剂量计算方法是蒙特卡洛剂量计算方法,它是一种可用于任意吸收介质和适用于任意射线的随机采样模拟方法。通过统计学方法来模拟大量单个光子在输运过程中与物质的作用。例如,质子放疗时,质子束进入人体组织后,通过与组织介质的原子相互作用,在bragg峰处传递大部分剂量。蒙特卡洛方法可以模拟这种作用的过程,可对每一次质子的相互作用进行预测并统计结果。
4.但采用蒙特卡罗方法有如下技术问题:由于它的高计算成本以及计算复杂,不但延长了计算时间,降低治疗效率,同时也难以推广应用,不利于导应用于临床决策。
技术实现要素:
5.本发明提出一种质子剂量的计算方法及装置,所述方法可以缩短计算时间,提高计算效率和计算精度。
6.本发明实施例的第一方面提供了一种质子剂量的计算方法,所述方法包括:
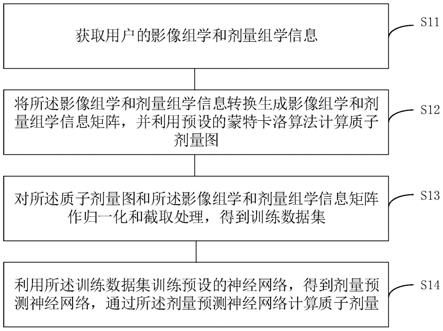
7.获取用户的影像组学和剂量组学信息;
8.将所述影像组学和剂量组学信息转换生成影像组学和剂量组学信息矩阵,并利用预设的蒙特卡洛算法计算质子剂量图;
9.对所述质子剂量图和所述影像组学和剂量组学信息矩阵作归一化和截取处理,得到训练数据集;
10.利用所述训练数据集训练预设的神经网络,得到剂量预测神经网络,通过所述剂量预测神经网络计算质子剂量。
11.在第一方面的一种可能的实现方式中,所述影像组学和剂量组学信息包括ct三维矩阵影像,所述影像组学和剂量组学信息矩阵包括质子相对停止功率图矩阵;
12.所述将所述影像组学和剂量组学信息转换生成影像组学和剂量组学信息矩阵,包括:
13.采用预设的线性插值法将所述ct三维矩阵影像的层间距缩放至预设的第一尺寸,得到缩放影像;
14.根据hu
‑
spr转换表将所述缩放影像的每个像素点的hu值转换为spr值,生成质子相对停止功率图矩阵。
15.在第一方面的一种可能的实现方式中,所述影像组学和剂量组学信息还包括治疗计划信息,所述影像组学和剂量组学信息矩阵还包括能量矩阵;
16.所述将所述影像组学和剂量组学信息转换生成影像组学和剂量组学信息矩阵,还包括:
17.基于所述治疗计划信息确定治疗的治疗参数,所述治疗参数包括照射野区域、照射角度、质子可用量及治疗靶区结构;
18.基于所述照射野区域、所述照射角度和所述质子可用量对所述治疗靶区结构进行分层离散,并将分层离散后的治疗靶区结构构建成质子点扫描点阵;
19.基于所述质子可用量向所述质子点扫描点阵发送多束不同质子量的模拟射束,并获取所述模拟射束在所述质子点扫描点阵中形成的布拉格峰的能量值;
20.将所述能量值添加至预设的第一矩阵中构建生成能量矩阵,其中,所述预设的第一矩阵为与所述缩放影像相同尺寸的三维矩阵。
21.在第一方面的一种可能的实现方式中,所述影像组学和剂量组学信息矩阵还包括权重矩阵;
22.所述将所述影像组学和剂量组学信息转换生成影像组学和剂量组学信息矩阵,还包括:
23.获取多个沉积比,所述沉积比为单个射束从射入人体至布拉格峰位置的质子沉积的数量与该射束从射入人体至能量消减为0位置的质子沉积数量的比值;
24.将所述多个沉积比添加至预设的第一矩阵中构建生成权重矩阵,所述预设的第二矩阵为与所述缩放影像相同尺寸的三维矩阵。
25.在第一方面的一种可能的实现方式中,所述影像组学和剂量组学信息矩阵还包括蒙版矩阵;
26.所述将所述影像组学和剂量组学信息转换生成影像组学和剂量组学信息矩阵,包括:
27.根据所述ct三维矩阵影像和所述治疗计划信息确定非照射区域;
28.基于所述非照射区域计算蒙版矩阵;
29.所述蒙版矩阵mask的计算公式如下:
[0030][0031][0032]
mask=m
surface
·
m
lat
[0033]
其中j下标表示影像矩阵里病人身体内的坐标,i下标表示点阵即射束的坐标。m是范围扩展的距离。
[0034]
在第一方面的一种可能的实现方式中,
[0035]
所述利用所述训练数据集训练预设的神经网络,得到剂量预测神经网络,包括:
[0036]
将所述质子相对停止功率图矩阵、所述能量矩阵、所述权重矩阵和所述蒙版矩阵输入至预设的神经网络,并得到质子预测量;
[0037]
将所述质子预测量与所述质子可用量代入至预设的损失函数中,并对预设的损失函数求偏导,得到预设的神经网络的更新梯度参数;
[0038]
根据所述更新梯度参数的梯度下降方向进行更新训练,得到剂量预测神经网络。
[0039]
在第一方面的一种可能的实现方式中,所述对所述质子剂量图和所述影像组学和剂量组学信息矩阵作归一化和截取处理,得到训练数据集,包括:
[0040]
通过预设的线性插值法分别将所述影像组学和剂量组学信息矩阵和所述质子剂量图的层间距归一化到预定的第二尺寸,得到归一化矩阵和归一化剂量图;
[0041]
获取所述ct三维矩阵影像的肿瘤靶区的中心点坐标,以所述中心点坐标为中心在所述归一化矩阵中截取矩阵矩形块,以及在所述归一化剂量图截取剂量矩形块,并以所述矩阵矩形块和所述剂量矩形块为训练数据集。
[0042]
在第一方面的一种可能的实现方式中,所述预设的训练模型为u
‑
net和循环神经网络。
[0043]
在第一方面的一种可能的实现方式中,所述u
‑
net和循环神经网络使用的损失函数如下式所示:
[0044]
loss(d
pred
,d
label
)
‑
l1(d
pred
,d
label
)+αddsim(d
pred
,d
label
)+β*idd(d
pred
,d
label
)
[0045]
其中:
[0046][0047]
dssim(d
pred
,d
label
)=1
‑
ssim(d
pred
,d
label
)
[0048][0049]
idd(d
pred
,d
label
)=∑crossentropy(d
pred,i
,d
label,i
)
[0050][0051]
d
pred
,d
label
分别是预测值和真实值;
[0052]
α,β是为权衡损失函数的比例,m是总像素点个数,cov是d
pred
_d
label
的协方差矩阵,c1与c2是为了避免分母为0,μ与σ平均值和标准差;
[0053]
idd是计算d
pred
,d
label
对于最高剂量值的等高等值线的交叉熵函数。
[0054]
本发明实施例的第二方面提供了一种质子剂量的计算装置,所述装置包括:
[0055]
获取模块,用于获取用户的影像组学和剂量组学信息;
[0056]
转换模块,用于将所述影像组学和剂量组学信息转换生成影像组学和剂量组学信息矩阵,并利用预设的蒙特卡洛算法计算质子剂量图;
[0057]
截取模块,用于对所述质子剂量图和所述影像组学和剂量组学信息矩阵作归一化和截取处理,得到训练数据集;
[0058]
计算模块,用于利用所述训练数据集训练预设的神经网络,得到剂量预测神经网络,通过所述剂量预测神经网络计算质子剂量。
[0059]
相比于现有技术,本发明实施例提供的一种质子剂量的计算方法及装置,其有益效果在于:本发明可以将获取的用户的影像组学和剂量组学信息转换生成影像组学和剂量组学信息矩阵,并利用预设的蒙特卡洛算法计算质子剂量图,然后对所述质子剂量图和所述影像组学和剂量组学信息矩阵作归一化和截取处理,得到训练数据集,最后将所述训练数据集输入至预设的神经网络进行模型训练,得到剂量预测神经网络,通过所述剂量预测神经网络计算质子剂量中计算质子剂量,整个过程简单快捷,可以大大缩短计算时间,提高质子剂量的计算效果,而且通过多个不同的矩阵进行剂量计算,可以进一步提高计算准确率。
附图说明
[0060]
图1是本发明一实施例提供的一种质子剂量的计算方法的流程示意图;
[0061]
图2是本发明一实施例提供的质子形成的布拉格峰的示意图;
[0062]
图3是本发明一实施例提供的一种质子剂量的计算装置的结构示意图。
具体实施方式
[0063]
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0064]
采用蒙特卡罗方法有如下技术问题:由于它的高计算成本以及计算复杂,不但延长了计算时间,降低治疗效率,同时也难以推广应用,不利于导应用于临床决策。
[0065]
为了解决上述问题,下面将通过以下具体的实施例对本技术实施例提供的一种质子剂量的计算方法进行详细介绍和说明。
[0066]
参照图1,示出了本发明一实施例提供的一种质子剂量的计算方法的流程示意图。
[0067]
其中,作为示例的,所述质子剂量的计算方法,可以包括:
[0068]
s11、获取用户的影像组学和剂量组学信息。
[0069]
该影像组学和剂量组学信息可以包括患者的状态信息、病况信息和医生的医疗方案信息等等。
[0070]
基于上述各种信息可以计算所需的质子剂量。例如,若症状较重,所用的剂量较多,若症状较轻,所用的剂量也相对减少。
[0071]
s12、将所述影像组学和剂量组学信息转换生成影像组学和剂量组学信息矩阵,并利用预设的蒙特卡洛算法计算质子剂量图。
[0072]
在本实施例中,将影像组学和剂量组学信息转换生成影像组学和剂量组学信息矩阵不但可以方便后续计算,也可以提高计算的准确率。同时可以利用剂量计算的“金标准”与预测计算的质子剂量作对比,然后计算损失函数的值,对损失函数求偏导在模型上反向传播作为模型参数更新的幅度。更新后的模型继续预测剂量图反复更新参数直至最后的计算结果最优。
[0073]
在其中一种实施例中,所述影像组学和剂量组学信息包括ct三维矩阵影像,所述影像组学和剂量组学信息矩阵包括质子相对停止功率图矩阵。具体地,ct三维矩阵影像为
病人ct影像数据,质子相对停止功率图矩阵具体为质子相对停止功率图(spr)。
[0074]
其中,作为示例的,步骤s12可以包括以下子步骤:
[0075]
子步骤s121、采用预设的线性插值法将所述ct三维矩阵影像的层间距缩放至预设的第一尺寸,得到缩放影像。
[0076]
在可选的实施例中,可以使用线性插值法将ct影像数据的层间距缩放到一定的尺寸,形成缩放影像。例如,缩放的尺寸可以是3mmx3mmx3mm、5mmx5mmx5mm。
[0077]
子步骤s122、根据hu
‑
spr转换表将所述缩放影像的每个像素点的hu值转换为spr值,生成质子相对停止功率图矩阵。
[0078]
缩放影像里的值相当于电子密度值hu,可以通过查hu
‑
spr表将缩放影像的每个像素点的hu值转换为spr值,即质子沉积的相对比例,得到质子相对停止功率图矩阵(spr)。
[0079]
在其中一种实施例中,所述影像组学和剂量组学信息还包括治疗计划信息,所述影像组学和剂量组学信息矩阵还包括能量矩阵(pe)。该治疗计划信息为在对病人诊断后确定的治疗计划。具体可以包括ct影像和射野角度,处方剂量。
[0080]
其中,作为示例的,步骤s12可以包括以下子步骤:
[0081]
子步骤s123、基于所述治疗计划信息确定治疗的治疗参数,所述治疗参数包括照射野区域、照射角度、质子可用量及治疗靶区结构。
[0082]
在具体实现中,可以在治疗计划信息确定治疗疾病的类型和治疗方案等信息,基于疾病的类型和治疗方案获取各个治疗的治疗参数,该治疗参数包括照射野区域、照射角度、质子可用量及治疗靶区结构。
[0083]
在实际操作中,针对不同病种安排不同角度的照射野,不同的疾病可能会有不同的一个或者多个照射野角度(具体为放疗机发出射线所照射到的区域)。例如前列腺癌,照射野为90度和270度。
[0084]
接着可以使用预设的质子调强计划系统获取质子治疗系统中现存的可用治疗能量和质子治疗照射野的方向。
[0085]
子步骤s124、基于所述照射野区域、所述照射角度和所述质子可用量对所述治疗靶区结构进行分层离散,并将分层离散后的治疗靶区结构构建成质子点扫描点阵。
[0086]
具体地,可以对治疗靶区结构进行分层离散,以类似3d打印的方式将靶区结构离散为质子点扫描点阵。
[0087]
例如,肿瘤专家在ct影像上勾画肿瘤位置(靶区),生成一个与ct同尺寸的三维矩阵,靶区内的值为1,其他为0。
[0088]
在实际操作中,该质子点扫描点阵可以满足剂量投照射程短,且符合质子治疗系统能量条件的要求。
[0089]
为了便于质子剂量的计算,本技术提出将每个射野单独计算质子剂量,再将所有射野的剂量加和作为最终的计算结果。此方式使得模型能单独学习单个射野的束点分布,相比与其他所有射野同时预测的模型,在精度上有很大的提升。
[0090]
子步骤s125、基于所述质子可用量向所述质子点扫描点阵发送多束不同质子量的模拟射束,并获取所述模拟射束在所述质子点扫描点阵中形成的布拉格峰的能量值。
[0091]
具体地,可以基于matlab的治疗计划,在matrad中建立的光线跟踪法,然后模拟多束不同质子量的模拟射束,并将多束不同质子量的模拟射束射入质子点扫描点阵中,使得
质子点扫描点阵形成“布拉格峰”。
[0092]
需要说明的是,质子穿过人体时,会减速并与电子相互作用,释放能量。能量释放的最高点叫做“布拉格峰”。质子束在到达“布拉格峰”后能量会迅速衰减为零,此特性能对危及器官有很好的保护。
[0093]
参照图2,示出了本发明一实施例提供的质子形成的布拉格峰的示意图。参照图2,在质子点扫描点阵中的每个点代表的射束,可以获取每个点的坐标,从而计算布拉格峰的坐标x
b
,y
b
,z
b
。
[0094]
子步骤s126、将所述能量值添加至预设的第一矩阵中构建生成能量矩阵,其中,所述预设的第一矩阵为与所述缩放影像相同尺寸的三维矩阵。
[0095]
具体地,可以获取质子点扫描点阵中的“布拉格峰”的点坐标,分别为x,y,z,e,其中e是能量,相当于射束的射程。每一个射束有一个布拉格峰,新建一个与缩放后的ct影像相同尺寸的三维矩阵,将每个布拉格峰位置的能量值设定为对应射束的能量值z,其余位置的能量值为0,得到能量矩阵pe。
[0096]
在其中一种实施例中,所述影像组学和剂量组学信息矩阵还包括权重矩阵(pw);
[0097]
其中,作为示例的,步骤s12可以包括以下子步骤:
[0098]
子步骤s127、获取多个沉积比,所述沉积比为单个射束从射入人体至布拉格峰位置的质子沉积的数量与该射束从射入人体至能量消减为0位置的质子沉积数量的比值。
[0099]
由于不同能量的质子束有不同的曲线,不同曲线可以有不同的沉积比。具体可以从质子点扫描点阵中获取多个沉积比。
[0100]
子步骤s128、将所述多个沉积比添加至预设的第一矩阵中构建生成权重矩阵,所述预设的第二矩阵为与所述缩放影像相同尺寸的三维矩阵。
[0101]
参照图2,图中曲线图下的面积即为沉积的粒子数。用截止到布拉格峰位置的曲线下面积比上总曲线下面积即可得到沉积比。
[0102]
新建一个与缩放后的ct影像相同尺寸的三维矩阵,将每个布拉格峰位置的能量值设定为对应射束的沉积比w,其余位置的能量值为0,得到能量矩阵pw。
[0103]
所述影像组学和剂量组学信息矩阵还包括蒙版矩阵(mask)。
[0104]
其中,作为示例的,步骤s12可以包括以下子步骤:
[0105]
子步骤s129、根据所述ct三维矩阵影像和所述治疗计划信息确定非照射区域。
[0106]
该非照射区域为不应该有质子射线照射的区域,即默认非照射区域的质子剂量应该为0。例如,在ct三维矩阵中体表外的空气区域。
[0107]
通过治疗计划信息确定照射区域,从ct三维矩阵影像中减去照射区域得到非照射区域。
[0108]
具体地,可以在ct三维矩阵影像中将非照射区域的能量值设置为0,其他为1。这种操作可以辅助模型更快的提取有用的信息,加快收敛。
[0109]
子步骤s1210、基于所述非照射区域计算蒙版矩阵。
[0110]
其中,所述蒙版矩阵mask的计算公式如下:
[0111]
[0112][0113]
mask=m
surface
·
m
lat
[0114]
其中j下标表示影像矩阵里病人身体内的坐标,i下标表示点阵即射束的坐标。m是范围扩展的距离。
[0115]
在实际操作中,质子剂量图可以通过预设的蒙特卡洛算法计算得到。
[0116]
s13、对所述质子剂量图和所述影像组学和剂量组学信息矩阵作归一化和截取处理,得到训练数据集。
[0117]
由于质子剂量图和影像组学和剂量组学信息矩阵所包含的数据量还有很多,若全部一一处理,将增加处理时间,降低处理效率。为了能进一步提高数据处理效率,可以分别从质子剂量图和影像组学和剂量组学信息矩阵截取相关数据,再利用部分相关的数据进行计量计算。
[0118]
为了提高截取的准确率,其中,作为示例的,步骤s13可以包括以下子步骤:
[0119]
子步骤s131、通过预设的线性插值法分别将所述影像组学和剂量组学信息矩阵和所述质子剂量图的层间距归一化到预定的第二尺寸,得到归一化矩阵和归一化剂量图。
[0120]
在归一化处理时,可以将所述质子相对停止功率图矩阵、能量矩阵、权重矩阵和蒙版矩阵将矩阵都自归一化到[0,1]。
[0121]
其中,计算公式如下式所示:
[0122][0123]
例如,预设的线性插值法分别将ct三维矩阵影像(ct),质子相对停止功率图矩阵(spr),能量矩阵(pe),权重矩阵pw,蒙版矩阵(mask),质子剂量图(d)的层间距归一化到3mmx3mmx3mm。
[0124]
子步骤s132、获取所述ct三维矩阵影像的肿瘤靶区的中心点坐标,以所述中心点坐标为中心在所述归一化矩阵中截取矩阵矩形块,以及在所述归一化剂量图截取剂量矩形块,并以所述矩阵矩形块和所述剂量矩形块为训练数据集。
[0125]
具体地,可以计算治疗靶区在对应ct三维矩阵影像的中心点(xc,yc,zc)。以同中心点在质子相对停止功率图矩阵(spr),能量矩阵(pe),权重矩阵pw,蒙版矩阵(mask),质子剂量图(d)上截取一定尺寸的矩形块,例如(50,50,80)尺寸的矩形块,以截取的矩形块为训练数据集。
[0126]
以(50,50,80)的尺寸为例,在在质子相对停止功率图矩阵(spr),能量矩阵(pe),权重矩阵pw,蒙版矩阵(mask)上截取时,可以以各个矩阵的左上角以(xc
‑
25,yc
‑
25,zc
‑
40)为起始点截取(50,50,80)的矩形块。
[0127]
从而在x轴上选取[xc
‑
25,xc+25],在y轴选取[yc
‑
25,yc+25],在z轴选取[zc
‑
40,zc+40]。
[0128]
s14、利用所述训练数据集训练预设的神经网络,得到剂量预测神经网络,通过所述剂量预测神经网络计算质子剂量。
[0129]
在其中一种可选的实施例中,步骤s14可以包括以下子步骤:
[0130]
子步骤s141、将所述质子相对停止功率图矩阵、所述能量矩阵、所述权重矩阵和所述蒙版矩阵输入至预设的神经网络,并得到质子预测量。
[0131]
子步骤s142、将所述质子预测量与所述质子可用量代入至预设的损失函数中,并对预设的损失函数求偏导,得到预设的神经网络的更新梯度参数。
[0132]
子步骤s143、根据所述更新梯度参数的梯度下降方向进行更新训练,得到剂量预测神经网络。
[0133]
具体地,可以将质子相对停止功率图矩阵、能量矩阵、权重矩阵和蒙版矩阵这4个矩阵输入至预设的神经网络中,由预设的神经网络计算得到质子预测量,将质子预测量与质子可用量代入至预设的损失函数,对预设的损失函数求偏导,得到预设的神经网络的参数更新的梯度,往梯度下降的方向更新参数。
[0134]
然后继续将4个矩阵输入更新过参数的预设的神经网络中,再计算损失函数,重复更新参数的操作直至损失函数的值最小,完成训练得到剂量预测神经网络。最后将4个矩阵和质子剂量图输入剂量预测神经网络中,剂量预测神经网络可以基于4个矩阵和质子剂量图预测计算得到质子剂量。
[0135]
在本实施例中,所述预设的训练模型为u
‑
net和循环神经网络。
[0136]
其中ru
‑
net由四层下采样,四层上采样与四个上下采样之间的跳跃连接组成,输入数据尺寸经由网络从50x50x80下采样到7x7x10,再返回到原尺寸50x50x80。
[0137]
除了第一个和最后一个卷积层,每一个非上采样和非下采样卷积层都包含一个循环卷积—自注意力门机制,3*3*3的卷积核,组归一化(batch normalization),relu激活函数。u
‑
net和循环神经网络的输出即为最终的剂量值。
[0138]
在可选的实施例中,ru
‑
net具有多尺度级别,并且利用跳连接将编码器信息直接传穿递给解码器。
[0139]
而通过循环卷积和残差单元也有助于开发更有效的深部模型,循环卷积中基于不同时间步长的特征积累过程带来了更合适的特征表示,有助于提取非常低级的特征,这些特征对于剂量预测任务非常重要。
[0140]
具体地,所述u
‑
net和循环神经网络使用的损失函数如下式所示:
[0141]
loss(d
pred
,d
label
)=l1(d
pred
,d
label
)+αddsim(d
pred
,d
label
)+β*idd(d
pred
,d
label
)
[0142]
其中:
[0143][0144]
dssim(d
pred
,d
label
)=1
‑
ssim(d
pred
,d
label
)
[0145][0146]
idd(d
pred
,d
label
)=∑crossentropy(d
pred,i
,d
label,i
)
[0147][0148]
d
pred
,d
label
分别是预测值和真实值;
[0149]
α,β是为权衡损失函数的比例,m是总像素点个数,cov是d
pred
_d
label
的协方差矩阵,c1与c2是为了避免分母为0,μ与σ平均值和标准差;
[0150]
idd是计算d
pred
,d
label
对于最高剂量值的等高等值线的交叉熵函数。
[0151]
需要说明的是,在计算最后的质子剂量后,可以将质子剂量发送至医生,以辅助医生进行后续的治疗操作。
[0152]
在本实施例中,本发明实施例提供了一种质子剂量的计算方法,其有益效果在于:本发明可以将获取的用户的影像组学和剂量组学信息转换生成影像组学和剂量组学信息矩阵,并利用预设的蒙特卡洛算法计算质子剂量图,然后对所述质子剂量图和所述影像组学和剂量组学信息矩阵作归一化和截取处理,得到训练数据集,最后将所述训练数据集输入至预设的神经网络进行模型训练,得到剂量预测神经网络,通过所述剂量预测神经网络计算质子剂量,整个过程简单快捷,可以大大缩短计算时间,提高质子剂量的计算效果,而且通过多个不同的矩阵进行剂量计算,可以进一步提高计算准确率。
[0153]
本发明实施例还提供了一种质子剂量的计算装置,参见图3,示出了本发明一实施例提供的一种质子剂量的计算装置的结构示意图。
[0154]
其中,作为示例的,所述质子剂量的计算装置可以包括:
[0155]
获取模块301,用于获取用户的影像组学和剂量组学信息;
[0156]
转换模块302,用于将所述影像组学和剂量组学信息转换生成影像组学和剂量组学信息矩阵,并利用预设的蒙特卡洛算法计算质子剂量图;
[0157]
截取模块303,用于对所述质子剂量图和所述影像组学和剂量组学信息矩阵作归一化和截取处理,得到训练数据集;
[0158]
计算模块304,用于利用所述训练数据集训练预设的神经网络,得到剂量预测神经网络,通过所述剂量预测神经网络计算质子剂量。
[0159]
可选地,所述影像组学和剂量组学信息包括ct三维矩阵影像,所述影像组学和剂量组学信息矩阵包括质子相对停止功率图矩阵;
[0160]
所述转换模块还用于:
[0161]
采用预设的线性插值法将所述ct三维矩阵影像的层间距缩放至预设的第一尺寸,得到缩放影像;
[0162]
根据hu
‑
spr转换表将所述缩放影像的每个像素点的hu值转换为spr值,生成质子相对停止功率图矩阵。
[0163]
可选地,所述影像组学和剂量组学信息还包括治疗计划信息,所述影像组学和剂量组学信息矩阵还包括能量矩阵;
[0164]
所述转换模块还用于:
[0165]
基于所述治疗计划信息确定治疗的治疗参数,所述治疗参数包括照射野区域、照射角度、质子可用量及治疗靶区结构;
[0166]
基于所述照射野区域、所述照射角度和所述质子可用量对所述治疗靶区结构进行分层离散,并将分层离散后的治疗靶区结构构建成质子点扫描点阵;
[0167]
基于所述质子可用量向所述质子点扫描点阵发送多束不同质子量的模拟射束,并获取所述模拟射束在所述质子点扫描点阵中形成的布拉格峰的能量值;
[0168]
将所述能量值添加至预设的第一矩阵中构建生成能量矩阵,其中,所述预设的第一矩阵为与所述缩放影像相同尺寸的三维矩阵。
[0169]
可选地,所述影像组学和剂量组学信息矩阵还包括权重矩阵;
[0170]
所述转换模块还用于:
[0171]
获取多个沉积比,所述沉积比为单个射束从射入人体至布拉格峰位置的质子沉积的数量与该射束从射入人体至能量消减为0位置的质子沉积数量的比值;
[0172]
将所述多个沉积比添加至预设的第一矩阵中构建生成权重矩阵,所述预设的第二矩阵为与所述缩放影像相同尺寸的三维矩阵。
[0173]
可选地,所述影像组学和剂量组学信息矩阵还包括蒙版矩阵;
[0174]
所述转换模块还用于:
[0175]
根据所述ct三维矩阵影像和所述治疗计划信息确定非照射区域;
[0176]
基于所述非照射区域计算蒙版矩阵;
[0177]
所述蒙版矩阵mask的计算公式如下:
[0178][0179][0180]
mask=m
suface
·
m
lat
[0181]
其中j下标表示影像矩阵里病人身体内的坐标,i下标表示点阵即射束的坐标。m是范围扩展的距离。
[0182]
可选地,所述计算模块还用于:
[0183]
将所述质子相对停止功率图矩阵、所述能量矩阵、所述权重矩阵和所述蒙版矩阵输入至预设的神经网络,并得到质子预测量;
[0184]
将所述质子预测量与所述质子可用量代入至预设的损失函数中,并对预设的损失函数求偏导,得到预设的神经网络的更新梯度参数;
[0185]
根据所述更新梯度参数的梯度下降方向进行更新训练,得到剂量预测神经网络。
[0186]
可选地,所述截取模块还用于:
[0187]
通过预设的线性插值法分别将所述影像组学和剂量组学信息矩阵和所述质子剂量图的层间距归一化到预定的第二尺寸,得到归一化矩阵和归一化剂量图;
[0188]
获取所述ct三维矩阵影像的肿瘤靶区的中心点坐标,以所述中心点坐标为中心在所述归一化矩阵中截取矩阵矩形块,以及在所述归一化剂量图截取剂量矩形块,并以所述矩阵矩形块和所述剂量矩形块为训练数据集。
[0189]
可选地,所述预设的训练模型为u
‑
net和循环神经网络。
[0190]
可选地,所述u
‑
net和循环神经网络使用的损失函数如下式所示:
[0191]
loss(d
pred
,d
label
)=l1(d
pred
,d
label
)+αddsim(d
pred
,d
label
)+β*idd(d
pred
,d
label
)
[0192]
其中:
[0193][0194]
dssim(d
pred
,d
label
)=1
‑
ssim(d
pred
,d
label
)
[0195][0196]
idd(d
pred
,d
label
)=∑crossentropy(d
pred,i
,d
labe,i
)
[0197][0198]
d
pred
,d
label
分别是预测值和真实值;
[0199]
α,β是为权衡损失函数的比例,m是总像素点个数,cov是d
pred
_d
label
的协方差矩阵,c1与c2是为了避免分母为0,μ与σ平均值和标准差;
[0200]
idd是计算d
pred
,d
label
对于最高剂量值的等高等值线的交叉熵函数。
[0201]
进一步的,本技术实施例还提供了一种电子设备,包括:存储器、处理器及存储在存储器上并可在处理器上运行的计算机程序,所述处理器执行所述程序时实现如上述实施例所述的质子剂量的计算方法。
[0202]
进一步的,本技术实施例还提供了一种计算机可读存储介质,所述计算机可读存储介质存储有计算机可执行指令,所述计算机可执行指令用于使计算机执行如上述实施例所述的质子剂量的计算方法。
[0203]
以上所述是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1