用于预防组织沾粘的温度敏感组成物及其应用的制作方法
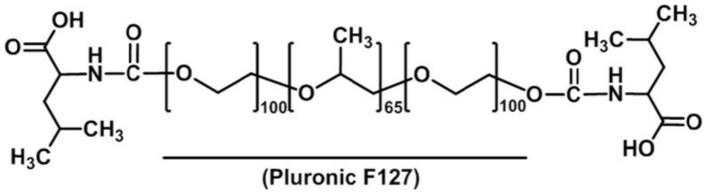
1.本发明总体上涉及一种预防组织沾粘组成物和载体的应用。特别地,本发明涉及具有增强的机械性能和改善的耐水蚀性能的温度敏感组成物,以有效地防止组织沾粘,并且可以用作具有生物相容性,可生物降解性/可生物吸收性和体内可持续性的载体。
背景技术:
2.沾粘是指于愈合过程中,其受损组织与相邻组织或器官表面异常纤维化的结合。因此,当组织修复机制响应由手术,创伤和感染等引起的损伤时,会发生组织沾粘的状况。尽管组织沾粘可以发生在任何地方,但是引起组织粘粘的最常见因素是手术。由外科手术过程引起的组织沾粘可能导致严重的临床并发症,例如慢性疼痛,局部缺血,肠阻塞,器官功能障碍等,这通常需要重新手术进行沾粘分离,而再次手术去除术后沾粘的风险很高,由于引入了许多危险因素,如麻醉不足,出血过多,组织对异物的反应以及术后发炎等,这样的第二次手术可能会危及生命。因此,为了预防术后组织沾粘,在受损组织和相邻组织之间引入物理屏障以阻止组织沾粘的形成已被广泛接受并在临床上使用。
3.聚合物或高分子复合材料已被广泛用作防止组织沾粘的物理性屏障,根据其生物降解能力,一般可分为两类:不可生物降解和可生物降解/可生物吸收。可生物降解的抗粘附屏障已被配制成多种类型,包括薄膜/片材、液体和凝胶。尽管非生物降解聚合物可通过持续分离伤口而表现出良好的抗沾粘作用,但它们的生物相容性低,因此长时间作为外来材料存于体内时,会导致伤口周围组织的发炎。在最坏的情况下,当发炎严重时,需要重新手术来去除生物不可降解的聚合物。一般来说,可生物降解聚合物具有良好的生物相容性,但其抗沾粘能力相对低于非生物可降解聚合物。
4.薄膜/薄片型防沾粘屏障可以将受损组织与邻近组织以物理性方式隔离,从而防止组织沾粘。但是,在紧急手术状态下,很难处理膜/片型抗沾粘材料。此外,膜/片型防沾粘屏障不适合在应用于地理环境复杂、微观、管状或任何难以触及的伤口部位使用。另一个缺点是,使用薄膜/片状抗沾粘材料可能会导致在缝合过程中对伤口部位的额外伤害。
5.就液体型防沾粘剂而言,目前商业上已有几种液体型防沾粘制剂可使用,它们很容易作为灌注剂应用于手术后清洗整个伤口。然而,这些产品普遍存在一个缺点,即对应用部位的附着力不足。
6.为了解决这些问题,人们开发了多种凝胶型防沾粘剂,并将其高分子溶液以涂布式、注射式、喷雾式、水凝胶涂层等应用到受损组织上以预防组织沾粘。这些凝胶型防沾粘剂的应用与膜/片型抗沾粘制剂相比,可以大大减少操作时间。然而,凝胶型防沾粘剂会因为快速的生物降解或体内溶解而被早期吸收,最终导致防沾粘效果低下。此外,大多数可喷涂的凝胶型防沾粘剂还使用粉末来形成物理屏障,但其屏障形成的效率很低。因此,对于发展一种在操作过程中呈现溶液特性,但在与受损组织接触后可表现出凝胶特性的热敏感性防沾粘剂是有帮助的。同时,若能发展一种热敏感性防沾粘剂其能表现出强大的机械强度而足以抵御体内的快速溶解,从而克服上述各项高分子防沾粘剂的缺点,是目前非常渴望
的发展目标。
7.普朗尼克(pluronic)或泊洛莎姆(poloxamer),为三嵌段共聚物,通常具有a-聚环氧乙烷-b-聚环氧丙烷-a-聚环氧乙烷(peo-ppo-peo)的结构,是一种热可逆材料,可表现出热敏感的溶胶-凝胶转换行为。一般来说,在低温下,普朗尼克以溶液状态存在,但当温度升高时就会形成凝胶。这种溶胶-凝胶转换行为可以受到包括成分、浓度、分子量、环境离子强度、ph值、添加剂等因素的影响。因此,有鉴于其多样的物理化学和可生物溶解的特性,发展以普朗尼克为主的聚合物具有强大的吸引力。虽然普朗尼克表现出优秀的溶胶-凝胶相变行为,但其水合结构相对脆弱,容易溶解于水。因此,普朗尼克具有体内停留时间短的限制,所以不能在手术部位达到有效的防沾粘结果。此外,长期以来,在制药科学领域,人们广泛地研究了以普朗尼克为材料的载体,但因受限于它的机械强度和稳定性不足,使其不适合于载体的应用。
8.尽管目前在预防组织沾粘以及载体应用领域已有许多进展,但持续的改进仍然是必须的。理想中,若能为防沾粘剂或载体提供可生物兼容、可生物降解/可生物吸收以及体内可持续的特性,同时具有更长的持续时间、足够的覆盖程度或递送量以及操作方便的给药,是最终极的发展目标。尽管这样的防沾粘剂或载体还没有被开发出来,但至少其中的一些目标将通过下文所揭露的发明来实现。
技术实现要素:
9.本发明的第一种态样在于提供一种包含聚合物和羧基多糖的组成物,其中该聚合物具有下式(i)的任何一种结构:
[0010][0011]
或其组合,其中:
[0012]
poly为聚环氧乙烷(peo)-聚环氧丙烷(ppo)-聚环氧乙烷(peo)的三嵌段共聚物;
[0013]
m和n彼此独立地为0或1,其中m和n不能同时为0;以及
[0014]
aa为氨基酸残基,其氨基直接与poly的链端结合形成氨基甲酸酯(o—c(
═
o)—nh)键。
[0015]
在一具体例中,该组合选自两种或多种氨基酸改质聚合物的组合。
[0016]
本发明的第二种态样在于提供一种组成物用于制备预防术后组织沾粘和药物传输的药物的用途。
附图说明
[0017]
通过参考详细说明和权利要求书,当结合以下图式时,可以得出对该目标更完整的理解。以下各图式仅为说明所执行的实施例而提供,本发明的范围不应受到这些图式的限制。
[0018]
图1显示使用hoffmann沾粘评分系统评估组织沾粘的结果。对照组和实验组之间的统计学差异通过使用prism 9for mac(graphpad software,usa)进行双尾计算的单因子
变异数分析(anova)进行分析。p《0.05的值被认为其差异具有统计学意义,**表示p《0.01,***表示p《0.001,****表示p《0.0001,ns代表无统计学意义的差异。
[0019]
图2a显示对照组的组织沾粘情况。
[0020]
图2b显示经比较例1处理后的组织沾粘情况。
[0021]
图2c显示经实施例6处理后的组织沾粘情况。
[0022]
图2d显示经实施例7处理后的组织沾粘情况。
[0023]
图2e显示经实施例8处理后的组织沾粘情况。
[0024]
图2f显示经实施例9处理后的组织沾粘情况。
[0025]
图2g显示经实施例10处理后的组织沾粘情况。
[0026]
图2h显示经实施例11处理后的组织沾粘情况。
[0027]
图2i显示经实施例12处理后的组织沾粘情况。
[0028]
图2j显示经实施例13处理后的组织沾粘情况。
[0029]
图2k显示经实施例14处理后的组织沾粘情况。
[0030]
图3a显示由比较例1所制备的水凝胶的紫杉醇(ptx)释放曲线。
[0031]
图3b显示由实施例10制备的水凝胶组成物的紫杉醇(ptx)释放曲线,其中聚合物组合首先被装载紫杉醇(ptx),随后向形成的紫杉醇-聚合物组合中加入一定量的羧甲基纤维素,以获得含紫杉醇-聚合物组合-羧甲基纤维素的组成物。
具体实施方式
[0032]
在详细描述本发明的一个或多个实施例之前,必须指出,在本说明书和权利要求书中使用的单数形式“一”,“一个”及“该”,除非上下文明确规定,否则其包括复数对象。因此,例如,有关“一个氨基酸”包括一个的氨基酸以及两个或多个相同或不同的氨基酸,有关“聚合物的链端”包括一个的链端以及两个相同或不同的聚合物的链端等。
[0033]
在描述和请求本发明时,除非另有规定,本文使用的术语具有以下定义。
[0034]
于本文中,术语如“包括”、“包含”、“具有”,或任何其他变化旨在涵盖非排他性的囊括。例如,包括元素列表的部件、结构、物品或装置都不一定只限于这些元素,而是可以包括未明确列出,但为该部件、结构、物品或装置所固有的其他元素。
[0035]
术语“氨基酸”是指蛋白质的结构单元。由遗传密码所编码的20种氨基酸被称为“标准氨基酸”。这些氨基酸的结构是h2n-chr-cooh,其中r是氨基酸特有的侧链。标准氨基酸有丙氨酸、精氨酸、天门冬氨酸、半胱氨酸、谷氨酸、谷氨酰氨、甘氨酸、组氨酸、异白氨酸、白氨酸、离氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸和缬氨酸。氨基酸可分为五类,具体而言,疏水性氨基酸、亲水性氨基酸、碱性氨基酸、酸性氨基酸和芳香族氨基酸。如本文所用,氨基酸可以以两种立体形式存在,即本文所述的“d型”和“l型”。
[0036]
本发明的氨基酸改质的聚合物和组成物可以在各种术后类型的任何情况下被施用以防止组织沾粘。如本文所用,术语“术后”是指本发明的氨基酸改质聚合物和组合物于具有使用价值的术后手术实例,包括但不限于腹部、腹盆腔、眼科、骨科、胃肠道、胸腔、颅部、头颈部、心血管、妇科、产科、关节(如关节镜)、泌尿科、整形、重建、肌肉骨骼和神经肌肉手术。
[0037]
根据本发明,可以有效防止术后组织沾粘。本发明中使用的防沾粘聚合物及其组
成物可以为任何形式,如粉末、溶液或凝胶形式。因此,即使在相对局部的手术中,如内视镜手术,也易于执行。
[0038]
本发明中使用的抗沾粘聚合物及其组成物可以通过如涂抹或喷洒的方式直接施用于伤口部位,也可以施用于伤口部位周围器官或周围组织表面来应用于手术上。该应用可以一次性进行,也可以多次涂抹或喷洒到目标器官或周围组织表面的局部部分。此外,还可以使用涂抹或喷洒装置。该装置可以是一个预填充的注射器。剂量可以由所属领域的技术者适当选择或调整。
[0039]
术语“氨基酸改质聚合物”是指其链端通过氨基甲酸酯连接与氨基酸和/或聚氨基酸结合的聚合物,其中该聚合物可以是含聚氧化乙烯的共聚物,并且该聚氧化乙烯是由包括-(o-ch
2-ch2)-的化合物重复单元组成的亲水聚合物。该共聚物可以包含与聚氧化乙烯共聚的另一种化合物。此另一种化合物可以是两个或更多,例如,两个或三个或更多选择包含聚氧化丙烯(ppo)、聚乙二醇(peg)、聚l-离氨酸(pll)、聚二氧六环酮(pdo)、聚乙醇酸(pga)、聚乳酸(pla)、聚(dl-乳酸-共聚乙二醇)(plga)、聚己内酯(pcl)。
[0040]
进一步地,该共聚物可以是普朗尼克(pluronic),它是一种三嵌段聚合物,由聚环氧乙烷(peo)-聚环氧丙烷(ppo)-聚环氧乙烷(peo)组成。该氨基酸改质聚合物的结构表示为下式(i):
[0041]
其中:poly是聚环氧乙烷(peo)-聚环氧丙烷(ppo)-聚环氧乙烷(peo)的三嵌段共聚物;m和n彼此独立地为0或1,其中m和n不能同时为0;以及aa代表一种氨基酸或一种聚氨基酸残基,其氨基直接与poly的链端结合,形成氨基甲酸酯键,其中aa的选择包含疏水性氨基酸、碱性氨基酸、酸性氨基酸、芳香族氨基酸和亲水性氨基酸。其中,疏水性氨基酸包括疏水性氨基酸和/或疏水性聚氨基酸,例如甘氨酸、丙氨酸、缬氨酸、甲硫氨酸、白氨酸、异白氨酸、苯丙氨酸及其聚合物;碱性氨基酸包括碱性氨基酸和/或碱性聚氨基酸,例如离氨酸、组氨酸、精氨酸和其聚合物。酸性氨基酸包括酸性氨基酸和/或酸性聚氨基酸,例如天冬氨酸、天冬酰胺、谷氨酸及其聚合物;芳香族氨基酸包括芳香族氨基酸和/或芳香族聚氨基酸,例如酪氨酸、色氨酸及其聚合物;亲水性氨基酸包括亲水性氨基酸和/或亲水性聚氨基酸,例如丝氨酸、苏氨酸、半胱氨酸、脯氨酸及其聚合物。
[0042]
术语“氨基酸改质聚合物组成物”是指包含具有结构式(i)的聚合物中的任何一种或其组合的组成物。
[0043]
术语“以一定量”是指本发明中基于最终组成物的任何一种聚合物或其组合的重量。本发明中,聚合物或其组合的量可以是最终组成物重量的5%至30%,7%至25%,较佳为10%至20%,12%至18%,更加为13%至17%。
[0044]
术语“聚合物组合”是指将其不同种类的氨基酸改质聚合物中的两种或更多种进行混合的组合。对于两种氨基酸改质聚合物的组合,聚合物的含量可以从特定的重量比中选择,范围为最终组成物的重量百分比,包含重量百分比1%:99%、重量百分比10%:90%、重量百分比20%:80%、重量百分比30%:70%、重量百分比40%:60%和重量百分比50%:
50%。对于两种以上的氨基酸改质聚合物的组合,组合中所有聚合物组分的含量为最终组合的100%(重量百分比),聚合物组分的含量可以从任何比例中选择,但组合中任何聚合物组分的含量必须超过0%(重量百分比),且必须低于最终组合的100%(重量百分比)。
[0045]
术语“生物相容性”是指在所使用的数量和位置上对接受者的细胞基本上无毒、无免疫原性和无刺激性的材料,并且在所使用的位置上也不会引起或导致对接受者身体的重大危害或不良影响。
[0046]
术语“抗沾粘”是指施用可用于防止相邻组织或器官表面粘连在一起的组合物,以使粘连的范围(例如面积)、粘连的强度和/或沾粘的严重程度(例如厚度或对机械或化学破坏的抵抗力)相对于没有施用此类物质而发生的粘连的范围、强度和/或严重程度达到有效的降低。
[0047]
术语“防沾粘剂”或“抗沾粘剂”是指施用或应用一种用于抑制相邻组织或器官表面粘附在一起的组合物。
[0048]
术语“载体”是指能够装载、传递及释放医药活性剂的携带物质。
[0049]
术语“载体应用”是指需要载体来传递和释放药物活性制剂的应用。
[0050]
术语“氨基甲酸酯连接”是指氨基酸的氨基与聚合物链端碳酸酯之间的氨基甲酸酯结合。这种氨基甲酸酯连接的化学结构表示为以下公式(ii):
[0051][0052]
术语“医药活性剂”是指任何可对人体或动物身体产生某些治疗、预防和/或诊断作用的医药有用物质。在此,医药活性剂的选择可包含抗癌药、抗生素、止血剂、类固醇、非类固醇抗发炎剂、荷尔蒙、止痛剂和麻醉剂。优选为抗癌药物紫杉醇。
[0053]
本发明中使用的术语“医药上可接受的载体”是指药学上可接受的材料、组成物或载体,如液体或固体填充物、稀释剂、赋形剂、溶剂或封装材料。每种载体必须是“可接受的”,即与制剂中的其他成分兼容,且不会对病人造成危害。
[0054]
在一个态样中,一种包含聚合物和羧基多糖的组成物,其中该聚合物具有下式(i)的任何一种结构:
[0055][0056]
或其组合,其中:poly为聚环氧乙烷(peo)-聚环氧丙烷(ppo)-聚环氧乙烷(peo)的三嵌段共聚物;m和n彼此独立地为0或1,其中m和n不能同时为0;以及aa为氨基酸残基,其氨基直接与poly的链端结合形成氨基甲酸酯(o—c(
═
o)—nh)键。
[0057]
在一具体例中,该羧基多糖选自由羧甲基纤维素(cmc),羧乙基纤维素,透明质酸(ha),藻酸盐,羧甲基几丁聚糖,果胶,羧甲基葡聚糖,硫酸肝素及硫酸软骨素中的一种或多种所组成的群组。
[0058]
在另一具体例中,该羧基多糖较佳地可为羧甲基纤维素(cmc)和透明质酸(ha)之一。
[0059]
在一具体例中,该羧基多糖可选自分子量范围在50kg/mol至4,000kg/mol内的材
料,具体取决于特性。羧基多糖的分子量可以是50kg/mol至4,000kg/mol,100kg/mol至3,500kg/mol,500kg/mol至3,000kg/mol,或者1,000kg/mol至2,500kg/mol。
[0060]
本发明中,该羧基多糖的含量范围可选自为最终组成物重量的0.1%至20%,0.5%至15%,较佳为1%至10%,2%至8%,更佳为3%至7%。
[0061]
在一具体例中,该poly具有从1,000到20,000道尔顿的平均分子量。
[0062]
在一具体例中,该三嵌段共聚物选自普朗尼克f-127(pf127),普朗尼克f-68(pf68)及普朗尼克l-35(pl35)。
[0063]
在一具体例中,该组合选自两种或多种氨基酸改质聚合物的组合。
[0064]
在一具体例中,该组合为离氨酸改质的聚合物和半胱氨酸改质的聚合物的组合。
[0065]
在另一具体例中,该组合为离氨酸改质的聚合物和丝氨酸改质的聚合物的组合。
[0066]
在一具体例中,该组成物进一步包含金属离子。
[0067]
在一具体例中,该金属离子的选择可以包含li
+
,na
+
,k
+
,ag
+
,cu
+2
,mg
+2
,ca
+2
,zn
+2
,sn
+2
,fe
+2
,al
+3
,fe
+3
,co
+3
,ni
+3
,ce
+4
,se
+4
,and ti
+4
中的一种。
[0068]
在一具体例中,该金属离子较佳地可为钠离子。
[0069]
在一具体例中,该金属离子的含量范围大约为最终组合物的重量的0.5%至2%。
[0070]
在一具体例中,该组成物进一步包含医药活性剂。
[0071]
在一具体例中,该医药活性剂可为抗癌药,抗生素,止血剂,类固醇,非类固醇抗发炎剂,激素,止痛剂及麻醉剂。
[0072]
在另一个态样中,一种组成物用于制备预防术后组织沾粘和药物传输的药物的用途。
[0073]
本发明的组成物具有增加医药活性剂的装载能力以及改善医药活性剂传输的释放曲线。
[0074]
在本发明中,该羧基多糖可提供额外的交互作用以提高组成物的机械强度,从而增加组成物于体内的留存时间。此外,羧基多糖可为该组成物提供更好的粘附性,这可增加该组成物于施用处的覆盖时间。
[0075]
在本发明中,该金属离子可在共聚物链端的氨基酸基团之间提供离子键及氢键、在共聚物和羧基多糖之间提供氢键以及在共聚物的链端氨基酸基团和羧基多糖之间提供氢键。因此,由于离子键和氢键的诱导增强,该组成物可形成稳定的水凝胶。此外,添加金属可用于调整该组成物的溶胶-凝胶转变温度。
[0076]
在本发明中,包括氨基酸改质聚合物和添加多糖后的组成物可以水凝胶型式存在,并且可具备温度敏感性。因此,该组成物的型态可于温度变化时在溶胶和凝胶状态之间可逆地变化,且溶胶-凝胶相变(凝胶化)的温度可通过调整聚合物的含量来控制。聚合物组成物在室温下可呈现溶胶状态,但当温度略低于人体温度时,这里是指28℃至36℃之间,则转变为凝胶状态。因此它们可以注射或喷入方式施用于人体或动物体内的手术部位,进而提供足够的伤口覆盖。当其被施用到手术部位后,聚合物组成物随后可发生凝胶化,并粘附在伤口上,作为防止组织沾粘的物理性屏障。
[0077]
本发明中的聚合物组合物可允许热敏感性溶胶-凝胶状态可逆转变,这使它们能够被用为载体,对许多药用活性制剂进行经皮、注射、喷雾以及可控制性递送。
[0078]
在本发明中,未经改质的普朗尼克(pluronic)被作为实施例中的比较例,而用的
评估本发明的发明步骤对由氨基酸改质的普朗尼克与羧基多糖组成的组成物以及金属离子添加与否,所贡献的抗组织沾粘能力及药物释放功效。经由广泛研究的结果,本技术的发明人发现,本发明的组成物可以(1)提高聚合物结构的机械强度、(2)提高抗水侵蚀能力、(3)提高聚合物与组织之间的附着性、(4)提高抗组织沾粘的能力,以及(5)改善传输医药活性剂时的释放情况。
[0079]
本发明使用本领域技术人员已知的有机合成、生物化学、流变学等常规技术进行。
[0080]
以下,本发明将以参照实施例方式进行更详细的描述。然而,以下每个实施例仅用于说明所执行的实施方案,且本发明的范围不受这些实施例的限制。
[0081]
本发明中,用于执行实施例和比较例的化学品如下:
[0082]
普朗尼克-f127(12,500da)、普朗尼克-f-68(8,400da)和普朗尼克-l-35(1,900da)购于巴斯夫公司。无水四氢呋喃(以下简称“thf”)、4-二甲基氨基吡啶(以下简称“dmap”)和无水二甲亚砜(以下简称“无水dmso”)均购于acrose公司。n,n'-二琥珀酰亚氨基碳酸酯(以下简称“dsc”),和紫杉醇(以下简称“ptx”)可从fluorochem购买。l-天冬氨酸、l-天冬酰氨、l-离氨酸、l-丝氨酸和l-酪氨酸购于acrose。l-白氨酸、l-半胱氨酸和l-甲硫氨酸购于cj海德(宁波)生物技术有限公司。羧甲基纤维素(cmc)购于sigma,透明质酸(ha)可从kewpie购得,nacl可从acrose购得。
[0083]
实施例1
[0084]
制备疏水性氨基酸改质的普朗尼克(pluronic)
[0085]
(1)白氨酸改质的普朗尼克f-127
[0086]
首先将疏水性氨基酸,4.8摩尔l-白氨酸溶解在碱性溶液中,形成氨基酸溶液。随后,于氮气保护下将0.6摩尔的普朗尼克f-127和4.8摩尔的dmap溶解在30毫升无水thf中,得到透明的混合溶液,并持续搅拌。经30分钟后,于1小时内滴加10毫升含有4.8摩尔dsc的无水dmso,并在室温及氮气保护下持续搅拌24小时。24小时后,加入含有白氨酸的溶液,并将该混合物保持搅拌24小时。所得的白氨酸改质的普朗尼克f-127溶液通过透析纯化,并经冷冻干燥得到产率约45%的白色聚合物粉末。1h nmr(600mhz,d2o):δ4.30,4.21(m,-ch
2-o-(c=o)-nh-),4.01(m,-o-(c=o)-nh-ch-),1.70(m,-ch
2-ch-(ch3)2),1.60(m,-ch-(ch3)2),0.96(m,-ch-(ch3)2);ftir:780cm-1
(—nh wag),1531cm-1
(—cnh),1569cm-1
(—(c
═
o)—nh—),1731cm-1
(—(c
═
o))。
[0087]
白氨酸改质的普朗尼克f-127的化学结构示例如下:
[0088][0089]
(2)白氨酸改质的普朗尼克f-68
[0090]
首先将疏水性氨基酸,4.8摩尔l-白氨酸溶解在碱性溶液中,形成氨基酸溶液。随后,于氮气保护下将0.6摩尔的普朗尼克f-68和4.8摩尔的dmap溶解在30毫升无水thf中,得到透明的混合溶液,并持续搅拌。经30分钟后,于1小时内滴加10毫升含有4.8摩尔dsc的无
水dmso,并在室温及氮气保护下持续搅拌24小时。24小时后,加入含有白氨酸的溶液,并将该混合物保持搅拌24小时。所得的白氨酸改质的普朗尼克f-68溶液通过透析纯化,并经冷冻干燥得到产率约40%的白色聚合物粉末。1h nmr(600mhz,d2o):δ4.28,4.23(m,-ch
2-o-(c=o)-nh-),4.06(m,-o-(c=o)-nh-ch-),1.72(m,-ch
2-ch-(ch3)2),1.62(m,-ch-(ch3)2),0.97(m,-ch-(ch3)2);ftir:780cm-1
(—nh wag),1531cm-1
(—cnh),1569cm-1
(—(c
═
o)—nh—),1731cm-1
(—(c
═
o))。
[0091]
白氨酸改质的普朗尼克f-68的化学结构示例如下:
[0092][0093]
(3)白氨酸改质的普朗尼克l-35
[0094]
首先将疏水性氨基酸,4.8摩尔l-白氨酸溶解在碱性溶液中,形成氨基酸溶液。随后,于氮气保护下将0.6摩尔的普朗尼克f-35和4.8摩尔的dmap溶解在30毫升无水thf中,得到透明的混合溶液,并持续搅拌。经30分钟后,于1小时内滴加10毫升含有4.8摩尔dsc的无水dmso,并在室温及氮气保护下持续搅拌24小时。24小时后,加入含有白氨酸的溶液,并将该混合物保持搅拌24小时。所得的白氨酸改质的普朗尼克l-35溶液通过透析纯化,并经冷冻干燥得到产率约35%的透明聚合物。1h nmr(600mhz,d2o):δ4.30(m,-o-(c=o)-nh-ch-),4.22(m,-ch
2-o-(c=o)-nh-),1.70(m,-ch
2-ch-(ch3)2),1.61(m,-ch-(ch3)2),0.97(m,-ch-(ch3)2);ftir:780cm-11
(—nh wag),1531cm-1
(—cnh),1569cm-1
(—(c
═
o)—nh—),1731cm-1
(—(c
═
o))。
[0095]
白氨酸改质的普朗尼克l-35的化学结构示例如下:
[0096][0097]
(4)甲硫氨酸改质的普朗尼克f-127
[0098]
首先将疏水性氨基酸,4.8摩尔l-甲硫氨酸溶解在碱性溶液中,形成氨基酸溶液。随后,于氮气保护下将0.6摩尔的普朗尼克f-127和4.8摩尔的dmap溶解在30毫升无水thf中,得到透明的混合溶液,并持续搅拌。经30分钟后,于1小时内滴加10毫升含有4.8摩尔dsc的无水dmso,并在室温及氮气保护下持续搅拌24小时。24小时后,加入含有甲硫氨酸的溶液,并将该混合物保持搅拌24小时。所得的甲硫氨酸改质的普朗尼克f-127溶液通过透析纯化,并经冷冻干燥得到产率约45%的白色聚合物粉末。1h nmr(600mhz,d2o):δ4.30(m,-o-(c=o)-nh-ch-),4.23(m,-ch
2-o-(c=o)-nh-),2.61(m,-ch
2-ch
2-s-ch3),2.16(s,-s-ch3),2.13,1.96(m,-ch
2-ch
2-s-ch3);ftir:1215cm-1
(—cnh),1603cm-1
(—(c
═
o)—nh—),1733cm-1
(—(c
═
o))。
[0099]
实施例2
[0100]
制备碱性氨基酸改质的普朗尼克(pluronic)
[0101]
离氨酸改质的普朗尼克f-127
[0102]
首先将碱性氨基酸,2.4摩尔l-离氨酸溶解在蒸馏水中,,形成氨基酸溶液。随后,于氮气保护下将0.6摩尔的普朗尼克f-127和4.8摩尔的dmap溶解在30毫升无水thf中,得到透明的混合溶液,并持续搅拌。经30分钟后,于1小时内滴加10毫升含有4.8摩尔dsc的无水dmso,并在室温及氮气保护下持续搅拌24小时。24小时后,加入含有离氨酸的溶液,并将该混合物保持搅拌24小时。所得的离氨酸改质的普朗尼克f-127溶液通过透析纯化,并经冷冻干燥得到产率约45%的白色聚合物粉末。1h nmr(600mhz,d2o):δ4.25(m,-ch
2-o-(c=o)-nh-),3.16(m,-o-(c=o)-nh-ch
2-),1.81,1.70(m,nh-ch
2-ch
2-ch
2-ch2),1.57(m,nh-ch
2-ch
2-ch
2-ch
2-),1.41(m,nh-ch
2-ch
2-ch
2-ch
2-,2h);ftir:776cm-1
(—nh wag),1557cm-1
(—cnh),1710cm-1
(—(c
═
o))。
[0103]
实施例3
[0104]
制备酸性氨基酸改质的普朗尼克(pluronic)
[0105]
(1)天冬氨酸改质的普朗尼克f-127
[0106]
首先将酸性氨基酸,4.8摩尔l-天冬氨酸溶解在碱性溶液中,形成氨基酸溶液。随后,于氮气保护下将0.6摩尔的普朗尼克f-127和4.8摩尔的dmap溶解在30毫升无水thf中,得到透明的混合溶液,并持续搅拌。经30分钟后,于1小时内滴加10毫升含有4.8摩尔dsc的无水dmso,并在室温及氮气保护下持续搅拌24小时。24小时后,加入含有天冬氨酸的溶液,并将该混合物保持搅拌24小时。所得的天冬氨酸改质的普朗尼克f-127溶液通过透析纯化,并经冷冻干燥得到产率约45%的白色聚合物粉末。1h nmr(600mhz,d2o):δ4.38(m,-o-(c=o)-nh-ch-),4.26(m,-ch
2-o-(c=o)-nh-),2.70,2.51(m,-ch
2-(c=o)-oh);ftir:776cm-1
(—nh wag),1557cm-1
(—cnh),1710cm-1
(—(c
═
o))。
[0107]
(2)天冬酰胺改质的普朗尼克f-127
[0108]
首先将酸性氨基酸,2.4摩尔l-天冬酰胺溶解在碱性溶液中,形成氨基酸溶液。随后,于氮气保护下将0.6摩尔的普朗尼克f-127和4.8摩尔的dmap溶解在30毫升无水thf中,得到透明的混合溶液,并持续搅拌。经30分钟后,于1小时内滴加10毫升含有4.8摩尔dsc的无水dmso,并在室温及氮气保护下持续搅拌24小时。24小时后,加入含有天冬酰胺的溶液,并将该混合物保持搅拌24小时。所得的天冬酰胺改质的普朗尼克f-127溶液通过透析纯化,并经冷冻干燥得到产率约45%的白色聚合物粉末。1h nmr(600mhz,d2o):δ4.35(m,-o-(c=o)-nh-ch-),4.27(m,-ch
2-o-(c=o)-nh-),2.82,2.68(m,-ch
2-(c=o)-nh2);ftir:1416cm-1
(—cn),1680cm-1
(—(c
═
o)—nh—),1720cm-1
(—(c
═
o))。
[0109]
实施例4
[0110]
制备芳香族类氨基酸改质的普朗尼克(pluronic)
[0111]
酪氨酸改质的普朗尼克f-127
[0112]
首先将芳香族氨基酸,4.8摩尔l-酪氨酸溶解在碱性溶液中,形成氨基酸溶液。随后,于氮气保护下将0.6摩尔的普朗尼克f-127和4.8摩尔的dmap溶解在30毫升无水thf中,得到透明的混合溶液,并持续搅拌。经30分钟后,于1小时内滴加10毫升含有4.8摩尔dsc的无水dmso,并在室温及氮气保护下持续搅拌24小时。24小时后,加入含有酪氨酸的溶液,并
将该混合物保持搅拌24小时。所得的酪氨酸改质的普朗尼克f-127溶液通过透析纯化,并经冷冻干燥得到产率约40%的白色聚合物粉末。1h nmr(600mhz,d2o):δ7.20(d,2ch,6ch
–
phenyl ring),.6.89(d,3ch,5ch
–
phenyl ring),4.21(m,-ch
2-o-(c=o)-nh-),4.11(m,-o-(c=o)-nh-ch-),3.15,2.83(m,-ch
2-ph);ftir:1403cm-1
(—cn),1517cm-1
(—cnh),1604cm-1
(—c—c—/c
═
c),1710cm-1
(—(c
═
o))。
[0113]
实施例5
[0114]
制备亲水性氨基酸改质的普朗尼克(pluronic)
[0115]
(1)丝氨酸改质的普朗尼克f-127
[0116]
首先将亲水性氨基酸,4.8摩尔l-丝氨酸溶解在蒸馏水中,形成氨基酸溶液。随后,于氮气保护下将0.6摩尔的普朗尼克f-127和4.8摩尔的dmap溶解在30毫升无水thf中,得到透明的混合溶液,并持续搅拌。经30分钟后,于1小时内滴加10毫升含有4.8摩尔dsc的无水dmso,并在室温及氮气保护下持续搅拌24小时。24小时后,加入含有丝氨酸的溶液,并将该混合物保持搅拌24小时。所得的丝氨酸改质的普朗尼克f-127溶液通过透析纯化,并经冷冻干燥得到产率约40%的白色聚合物粉末。1h nmr(600mhz,d2o):δ4.30(m,-ch
2-o-(c=o)-nh-),4.16(m,-o-(c=o)-nh-ch-),3.93,3.83(m,-ch
2-oh);ftir:1410cm-1
(—cn),1604cm-1
(—(c
═
o)—nh—),1720cm-1
(—(c
═
o))。
[0117]
(2)半胱氨酸改质的普朗尼克f-127
[0118]
首先将亲水性氨基酸,4.8摩尔l-半胱氨酸溶解在蒸馏水中,形成氨基酸溶液。随后,于氮气保护下将0.6摩尔的普朗尼克f-127和4.8摩尔的dmap溶解在30毫升无水thf中,得到透明的混合溶液,并持续搅拌。经30分钟后,于1小时内滴加10毫升含有4.8摩尔dsc的无水dmso,并在室温及氮气保护下持续搅拌24小时。24小时后,加入含有半胱氨酸的溶液,并将该混合物保持搅拌24小时。所得的半胱氨酸改质的普朗尼克f-127溶液通过透析纯化,并经冷冻干燥得到产率约50%的白色聚合物粉末。1h nmr(600mhz,d2o):δ4.46(m,-o-(c=o)-nh-ch-),4.27(m,-ch
2-o-(c=o)-nh-),3.20,2.98(m,-ch
2-sh);ftir:1412cm-1
(—cn),1515cm-1
(—cnh),1604cm-1
(—(c
═
o)—nh—),1700cm-1
(—(c
═
o))。
[0119]
实施例6-9
[0120]
温度敏感型抗组织沾粘组成物的制备
[0121]
使用表1中所示配方的成分和含量以制备温度敏感型抗沾粘组成物。简单来说,首先将一定量的氯化钠(nacl)溶解在蒸馏水中,得到浓度为20%(w/v)的氯化钠母液。然后,将一定量由实施例2制备的聚合物粉末与一定量的透明质酸(ha)或羧甲基纤维素(cmc)、一定量的蒸馏水与有氯化钠溶液或无氯化钠(nacl)溶液混合,得到含有离氨酸改质的普朗尼克f-127、透明质酸或羧甲基纤维素以及含钠离子或不含钠离子的温度敏感型组成物。
[0122]
表1
[0123]
[0124][0125]
实施例10-14
[0126]
温度敏感型抗组织沾粘及药物传递组成物的制备
[0127]
使用与实施例6-9相同的方式制备温度敏感型组成物,但每个实施例中的主要聚合物成分被离氨酸和半胱氨酸改质的普朗尼克f-127的组合所替代,其中离氨酸的含量为组合物总重量的80%,而半胱氨酸为组合物总重量的20%。所制备的组成物的配方如表2所示。
[0128]
表2
[0129][0130]
实施例15-18
[0131]
用于粘膜粘性测量的温度敏感型组成物制备
[0132]
使用与实施例8-9和13-14中相同的方式制备温度敏感组成物,但上述实施例中的羧甲基纤维素浓度被替换为最终组成物重量的1%的浓度。所制备的组成物的配方显示于表3中。
[0133]
表3
[0134][0135]
实验例1
[0136]
流变分析
[0137]
(1)制备氨基酸改质的聚合物水胶
[0138]
将实施例1-5中制备的每种氨基酸改质的普朗尼克f-127溶解在一定量的蒸馏水中,得到最终浓度为15%(重量/体积)的聚合物水胶。
[0139]
(2)制备氨基酸改质的聚合物组成物水胶
[0140]
每组聚合物组成物水胶按实施例6-14中所述制备,其配方见表1和表2。
[0141]
(3)比较例1的制备
[0142]
将一定量的未改质的普朗尼克f-127,与一定量的蒸馏水一起加入,形成最终浓度为15%(重量/体积)的聚合物水胶。
[0143]
(4)溶胶-凝胶相变转移温度的测量
[0144]
使用配备了锥板结构和防溶剂蒸发金属盖的hr10流变仪(ta instruments),对实施例1-5制备的水胶、实施例6-14的水胶复合材料以及比较例1的未改质对应物的溶胶-凝胶相变转移温度进行了分析。溶胶-凝胶相变转移温度被定义为当材料的储存模量和损失模量呈现相互交叉的一个特定的温度。于本发明中,此温度可通过振荡模式在20℃至37℃的温度范围内测量,其中升温速率为2℃/min,扭矩值为100μn.m,固定频率为1hz。溶胶-凝胶相变转移温度的测量结果列于表4。
[0145]
表4展示了由实施例1-14制备的水胶和水胶组成物的溶胶-凝胶相变转移温度。如表4所示,首先,确认所有制备的水胶和组成物具有温度敏感的特性。。其次,从实施例1-6制备的水胶和实施例10的组成物都高于比较例1的水胶相转变温度。重要的是,由实施例2、5(2)和10制备的水胶明显表现出高于比较例1的溶胶-凝胶相变转移温度,表明水胶和水之间形成了更多的氢键结合或相互作用,其中氢键结合或相互作用的形成应归因于聚合物链中离氨酸的氨基或半胱氨酸的硫醇基,因此,这些改质水胶的疏水链可能需要更高的温度来聚集,并最终形成固体状凝胶。此外,含有透明质酸(ha)或羧甲基纤维素(cmc)的组成物的溶胶-凝胶相变转移温度略低于其主要成分。这应归因于透明质酸(ha)和羧甲基纤维素(cmc)的吸水特性。一般来说,在一定范围内,以pluronic为主材料的水凝胶的溶胶-凝胶相变温度随着pluronic浓度的增加而降低,因此,由于组成物的水已被添加的羧基多糖成分
部分吸收,羧基多糖和其周围的水之间形成一定量的氢键而限制了水分子的移动,所以组成物中pluronic的相对浓度增加,导致组成物的溶胶-凝胶相变转移温度降低。此外,同样的机制可以用来解释为何含有氯化钠(nacl)的透明质酸(ha)或羧甲基纤维素(cmc)的组成物比那些没有添加的相比,呈现了最低的溶胶-凝胶相变转移温度。由于nacl溶解在周围的水中,一定量的钠离子可能与周围的水和羧基多糖通过离子结合形成强烈的相互作用,这可能会固定水分子,因而增加组成物中pluronic的相对浓度,导致组成物的溶胶-凝胶相变温度急剧下降。通过对溶胶-凝胶相变温度的测量结果发现,添加了金属离子的羧基多糖可能会极大地影响溶胶-凝胶相变转移温度,故金属离子可能有助于调整组成物的溶胶-凝胶相变转移温度。
[0146]
表4
[0147][0148]
实验例2
[0149]
体外聚合物生存时间的测量
[0150]
(1)制备氨基酸改质的聚合物水胶
[0151]
将实施例1-5中制备的每种氨基酸改质的普朗尼克f-127溶解在一定量的蒸馏水中,得到最终浓度为15%(重量/体积)的聚合物水胶。
[0152]
(2)制备氨基酸改质的聚合物组成物水胶
[0153]
每组聚合物组成物水胶按实施例6-14中所述制备,其配方见表1和表2。
[0154]
(3)比较例1的制备
[0155]
将一定量的未改质的普朗尼克f-127,与一定量的蒸馏水一起加入,形成最终浓度为15%(重量/体积)的聚合物水胶。
[0156]
(4)比较例2的制备
[0157]
将一定量的透明质酸,与一定量的蒸馏水一起加入,形成最终浓度为0.5%(重量/体积)的聚合物凝胶。
[0158]
(5)比较例3的制备
[0159]
将一定量的羧甲基纤维素与一定量的蒸馏水一起加入,形成最终浓度为5%(重量/体积)的聚合物凝胶。
[0160]
(6)留存时间的测量
[0161]
本发明中,用于测量所制备的聚合物水凝胶的停留时间的方法是参照美国专利,专利案号为10,105,387b2号。
[0162]
简而言之,由实施例1-14及比较例1、2和3中制备的每种聚合物水胶中,取1毫升添加到7毫升的单独玻璃小瓶中。然后,将所有的小瓶放在37℃的培养箱中,以获得固体聚合物水胶。当所有小瓶中的水胶皆转变为凝胶态后,向其中加入1毫升磷酸盐缓冲溶液(pbs,ph7.4)后,储存于37℃的培养箱中。每天于固定的时间去除所制备的聚合物凝胶表面层上的磷酸盐缓冲溶液,并观察聚合物凝胶于玻璃小瓶中的剩余体积以估计聚合物的生存时间,结果见表5。
[0163]
如表5所示,由实施例1至5制备的水胶的凝胶生存时间都长于比较例1,生存时间范围为4到18天。值得注意的是,由实施例2和5(2)制备的水胶显示出明显优越的凝胶生存时间,分别为16天和18天。比较例1没有经过任何改质,显示出最短的凝胶生存时间,约2天。这些结果表明,经过氨基酸改质的普朗尼克(pluronic)水胶可能增加了聚合物链中及链间的氢键以及聚合物链与周围水之间的氢键,进而提高了水凝胶的抗水侵蚀能力。此外,离氨酸和半胱氨酸改质的普朗尼克(pluronic)水胶,提供了额外的证据证明经改质后的普朗尼克(pluronic)能提高抗水侵蚀能力,因为它们的氨和硫醇基团倾向于形成氢键,甚至形成双硫键(通过硫醇基团),致使凝胶抗水侵蚀的稳定性大大增强。作为结论,本发明提供了一种氨基酸改质的普朗尼克(pluronic)化合物,与未改质的普朗尼克(pluronic)相比,其凝胶生存时间显著延长。
[0164]
一般来说,伤口愈合的时间取决于伤口的程度,但大约是7天。因此,为了防止在伤口愈合过程中发生组织沾粘,设计的组成物配方应具有凝胶停留时间超过7天的能力。
[0165]
在此,本发明旨在提供一种设计后的组成物,其凝胶生存时间远远超过7天,并且假定凝胶生存时间超过21天的组成物可能呈现高效的防沾粘效果。如表5所示,确认实施例6至14的水凝胶组成物的凝胶停留时间都长于比较例1-3,其中许多组成物皆表现出超过21天的凝胶生存时间。此外,通过比较实施例2的水凝胶与实施例6-9的水凝胶组成物,发现添加透明质酸可微幅增加其生存时间(从16天到17天),而添加透明质酸与氯化钠则可大大改善组成物的凝胶生存时间(从17天到超过21天)。有趣的是,添加羧甲基纤维素可以显著提高组成物的凝胶生存时间(从16天到21天),而同时添加羧甲基纤维素与氯化钠则可更大幅地延长组成物的凝胶生存时间(从16天到21天以上)。此外,通过比较由实施例2和5(2)制备的水胶与实施例10-14的水胶组成物,表明由重量比80%的实施例2粉末与20%的实施例5(2)粉末混合制备的聚合物组合(实施例10),在实施例2和5(2)之间表现出合理的凝胶生存
时间增加。重要的是,当实施例10被用作水胶组成物的主要成分时,添加透明质酸或羧甲基纤维素,无论是否添加氯化钠,都表现出明显延长的凝胶生存时间,超过21天。这些结果表明,在氨基酸改质的普朗尼克f-127中添加含有或不含有金属离子的羧基多糖,应该都能够增加组成物的机械强度,并可能促进组成物中各成分之间形成更多的相互作用,从而加强和稳定组成物的水合结构,最终导致延长水胶组成物的凝胶生存时间。
[0166]
表5
[0167][0168]
实验例3
[0169]
体外粘膜粘性测量
[0170]
(1)聚合物组成物溶液的制备
[0171]
每种聚合物组成物的溶液制备配方如表6中所述。要注意的是,由于遇到了测量上的困难,故于实施例15-18中使用了最终浓度为1%(重量/体积)的羧甲基纤维素。困难点为当使用5%(重量/体积)的羧甲基纤维素作为组分时,该组成物会表现出极高的粘度,故该
组成物组织粘附性无法被准确测量。因此,通过降低羧甲基纤维素的浓度,可以解决这个问题,并且仍然可以观察到不同配方间的组织粘附性差异的趋势。所测组合物的配方列于表6。
[0172]
表6
[0173][0174][0175]
(2)比较例1的制备
[0176]
将一定量的普朗尼克f127,与一定量的超纯水一起加入,形成最终浓度为15%(重量/体积)的聚合物溶液。
[0177]
(3)制备粘蛋白溶液
[0178]
将粘蛋白粉溶于超纯水中以获得5%(重量/体积)粘蛋白溶液。详细地说,于4℃的冷水浴中,在温和的磁力搅拌(200rpm)下,将一定量的粘蛋白缓慢加入到100ml超纯水中。制备结束后,将粘蛋白溶液储存于4℃备用。
[0179]
(4)制备包含聚合物组成物及粘蛋白(聚合物组成物-粘蛋白)的混合物将未经改质的普朗尼克聚合物粉末及如表6所示的各配制好的聚合物组成物,分别与(3)中所制备好的5%(重量/体积)粘蛋白溶液混合,得到15%(重量/体积)聚合物组成物-粘蛋白混合物。
[0180]
(5)体外粘膜粘性测定
[0181]
本发明应用了流变学方法(hassan,ee,et al.,a simple rheological method for the in vitro assessment of mucin-polymer bioadhesive bond strength,pharm res 7,491-495,1990)达成水胶粘附性的预测和间接评量。使用hr10流变仪(ta instruments)评估由实施例6-7、10-12和15-18所制备的组成物溶液、比较例1的未改质对应物、制备的粘蛋白溶液以及聚合物组成物和粘蛋白的混合物溶液的粘附性质,该流变仪配有锥板和防止溶剂蒸发的保护性金属盖。流变分析采用流动模式,在37℃下以10s-1
的剪切率进行,每次分析前都要在室温下静置5分钟,以避免热冲击引起的结构改变。
[0182]
本实验乃基于对由聚合物组成物和粘蛋白溶液的混合物中获得的分散体的测量粘度的评估。组成物和粘蛋白之间的相互作用程度是计算混合物的最终粘度(η
final
)的量测结果,它代表了这些成分之间既定的相互作用的参数,可以通过以下公式计算:
[0183]
η
final
=η
mixture-(η
polymer composition
+η
miucin
)
[0184]
其中,
[0185]
η
mixture
为由聚合物组成物和粘蛋白所组成的混合物的粘度,
[0186]
η
polymer composition
为聚合物组成物的粘度,
[0187]
η
mucin
为粘蛋白的粘度,
[0188]
当聚合物组合物和粘蛋白之间存有相互作用的情况下,η
final
的值》0(mayol l.,et al.,a novel poloxamers/hyaluronic acid in situ forming hydrogel for drug delivery:rheological,mucoadhesive and in vitro release properties,eur j pharm biopharm 70(1);199-206,2008)。粘膜粘性量测结果显示于表7。
[0189]
表7
[0190][0191]
如表7所示,由所有实施例所制备的聚合物组成物的粘膜粘附性以计算的粘度η
final
表示。显然,实施例10和15-18的聚合物组成物表现出一定程度的组织附着性(η
final
》0),且它们都显示明显高于比较例1的组织粘附性。而由其它实施例制备的聚合物组成物其η
final
皆为负值,表明使用羧甲基纤维素作为组成成分将导致聚合物组合物的粘膜粘附性增加,而使用透明质酸的组成则会获得相反的结果。此外,与实施例17相比,实施例16和18显示出明显较高的η
final
值,表明金属离子的加入将促进组成物的组织粘附性。这些结果可归因于羧甲基纤维素的天然特性。据报导,由于羧甲基纤维素的多个羧基能够与组织形成氢键,因此它具有良好的组织粘附性。此外,金属离子的加入可以进一步引入羧甲基纤维素、聚合物和组织之间更多的相互作用,从而提高组成物的粘附性能。
[0192]
此外,实施例10的聚合物组合物本身在不添加羧甲基纤维素的情况下即可表现出明显的组织粘附性,这可以解释为该聚合物组合物具有可用的侧链,其中来自离氨酸的氨基和来自半胱氨酸的硫醇基能够与粘蛋白形成氢键和/或双硫键。因此,这种聚合物组合物能够呈现出强大的粘膜粘附性。
[0193]
实验例4
[0194]
动物模型的防沾粘功效性测试
[0195]
(1)比较例1的制备
[0196]
将一定量的普朗尼克f127,与一定量的蒸馏水一起加入,形成最终浓度为15%(重量/体积)的聚合物水胶。
[0197]
(2)水胶组成物的制备
[0198]
依实施例6-14所述制备各个聚合物组成物水胶,其配方见表1和2。
[0199]
(3)动物试验
[0200]
为了评估所提供的聚合物组成物的组织粘附预防功效,进行了经过一些修改的腹壁缺损-盲肠擦伤的大鼠模型的研究。在此,将实施例6-14中制备的聚合物组成物作为实验组,将比较例1中制备的未改质的对应物作为比较组,并将手术部位没有使用任何材料的组别作为对照组。
[0201]
于动物试验中,每组4只雄性sprague dawley(sd)大鼠通过注射1ml/kg含有和(1:1)的混合物进行腹腔内麻醉。先将麻醉后的大鼠腹部剃毛,再用聚维酮碘消毒,并沿腹壁白线切开5厘米长的腹膜。然后,用手术刀在右腹壁上创造一个1
×
2cm2的长方形腹膜缺损。然后使用无菌手术纱布擦伤盲肠的浆膜层,直到其受损和出血,但不穿孔。接着,用3.0丝线在所创造的长方形腹壁缺损处外的四角,将受损的腹壁和受伤的盲肠缝合,以迫使其发生沾粘。接着,对于实验组,将0.5毫升由实施例6-14和比较例1中制备的各个水胶分别均匀地涂抹在受伤部位,原位凝胶化约在2分钟内形成。对于对照组,仅用0.5ml无菌生理盐水清洗损伤位置。最后,用3-0丝线缝合腹膜,再用4-0丝线缝合皮肤。
[0202]
术后10天,根据霍夫曼沾粘评分系统,以双盲方式检查组织沾粘的程度,评分越高,组织沾粘越严重。
[0203]
hoffmann组织沾粘程度评分系统的详细说明提供于表8(hoffmann ne.,et al.,choice of hemostatic agent influence adhesion formation in a rat cecal adhesion model,j surg res.155(1),77-81,2009)。组织沾粘程度的评估结果显示表9,并在图1中进行图形说明,统计分析采用prism 9for mac(graphpad software,usa)进行双尾计算的单因子变异数分析,如果p《0.05,则认为对照组和实验组的差异具有统计学意义。对照组、比较组和实验组的组织沾粘的照片说明显示于图2a至图2k。
[0204]
如表9所示(也见图1),实施例6-14中制备的水胶都表现出对组织沾粘的明显预防作用,而由比较例1中制备的水胶与对照组相比,其对预防组织沾粘的效果并不具有统计意义(也见图2a至图2k)。值得注意的是,从实施例9、13和14中制备的水凝胶在预防组织沾粘方面皆表现出显著的优异功效。而由实验例2的凝胶存留结果所示,实施例9、13和14都表现出了超过21天的凝胶生存时间。这些结果表明,具有较长生存时间的水胶应能更有效地预防组织沾粘7和11-12也表现出比21天更长的凝胶生存时间,但并,这也支持我们的假设。然而,实施例没有表现出更优越的预防沾粘性能(见图2d,图2h至图2j)。这应可以归因于它们的组织粘附性。沾粘预防剂的组织粘附性可能是至关重要的,如果抗沾粘剂不能牢固地粘附在伤口组织上,则它可能在一些日常的活动中被挤压而造成变形或位移,这可能会减少覆盖范围,最终导致对组织沾粘的预防不足。而如实验例3的粘膜粘附力测量结果所示,实施例7和11-12的组成物的η
final
均呈现负值,表明这些组合物与粘蛋白之间的相互作用较差,这可能影响其材料的最终防沾粘能力。
[0205]
总之,欲设计理想的防沾粘材料,材料的生存时间不是唯一需要考虑的方面,还应该仔细考虑材料的组织粘附特性。本发明提供了一种或一些设计好的聚合物组成物,它们不仅呈现出延长的生存时间,而且还表现出显著的组织粘附特性,这使得该聚合物组成物成为优秀的沾粘预防剂。
[0206]
表8
[0207][0208][0209]
表9
[0210][0211]
注:平均值
±
sem(n=4);*:p《0.05;**:p《0.01;***:p《0.001;****:p《0.0001;ns:无统计意义的差异
[0212]
实验例5
[0213]
医药活性物质的装载、封包及释放
[0214]
(1)ptx和氨基酸改质聚合物组合的混合溶液的制备
[0215]
首先将12毫克的ptx溶解在8毫升的甲醇中。再将1克来自实施例10的聚合物组合(分别含有800毫克和200毫克离氨酸改质和半胱氨酸改质的普朗尼克f-127)溶解在ptx-甲醇溶液中,得到ptx-氨基酸改质的聚合物组合的混合物。
[0216]
(2)比较例1的制备
[0217]
将12毫克ptx溶解在8毫升的甲醇中。再将1克未经改质的普朗尼克f-127加入到ptx-甲醇溶液中,形成ptx-普朗尼克f-127混合物。
[0218]
(3)药物装载及封包
[0219]
本发明中,选择紫杉醇(ptx)作为医药活性剂,使用薄膜水合法对其进行装载和封装(wei z.,et al.,paclitaxel-loaded pluronic p123/f127 mixed polymeric micelles:formulation,optimization and in vitro characterization,int.j.pharm,376(1),176-185,2009)。简而言之,将由比较例1及实施例10所制备的药物和氨基酸改质聚合物的混合物分别转移到一个独立的茄子形玻璃瓶中,并进行1小时的旋转蒸发以去除甲醇。当甲醇被除去后,瓶中形成了一层装载ptx的聚合物薄膜,然后将其置于50℃的真空烘箱中过夜,以完全去除溶剂。每个装载ptx的聚合物薄膜以8ml蒸馏水再次水合以封装ptx,然后用23μm的纤维素膜过滤去除未封装的ptx。最后,将每一种包封有ptx的聚合物进行冻干,得到ptx-聚合物粉末,该粉末可配合公式来计算药物装载能力和封包效力。
[0220]
计算药物装载能力和药物封包效力的公式如下:
[0221][0222][0223]
装载能力和封包效力结果显示于表10。
[0224]
表10
[0225][0226]
如表10所示,证实由实施例10制备的水胶与比较例1相比,显示出更好的载药能力和封包功效。
[0227]
(4)药物释放
[0228]
本发明中,药物释放试验采用无膜扩散法来实施(zhang l.,et al.,development and in-vitro evaluation of sustained release poloxamer 407(p407)gel formulations of ceftiofur,j.controlled release,85(1),73-81,2002)。简而言之,首先将50毫克羧甲基纤维素加入由实施例10制备的ptx-聚合物粉末中,得到一种组成物,其中最终的聚合物成分与实施例13相同。然后,将由比较例1制备的ptx-聚合物粉末的样品和
上述的组成物的样品分别置于对应的烧杯中,加水重新水合成含有20%(w/v)聚合物或聚合物组成物的ptx-聚合物水胶。于本文,聚合物含量为20%(w/v)的ptx-未改质普朗尼克水胶是由比较例1制备的,作为比较样品。然后,将所有制备的ptx-聚合物水胶于37℃的培养箱中预热,以保持凝胶状态。之后,将50毫升预热的pbs-甲醇混合溶液(90%:10%;体积/体积)的释放介质直接加入到每组已制备的ptx-聚合物水凝胶表面,然后将其置于37℃的培养箱中,以100rpm的速度持续摇晃。在预定的时间,从每个烧杯中取1毫升溶液用于评估药物释放,随即加入1毫升释放介质以保持固定体积。对所制备的组成物和比较例1进行三次重复的药物释放试验,用紫外光光谱仪检测药物释放数据,其中紫外光波长设置为236nm。分析后的药物释放曲线显示于图3a至图3b。
[0229]
图3a显示了由未改质的普朗尼克f-127所制备水胶的ptx释放曲线。如图3a所示,约50%的已封装ptx在24小时内被释放,所有ptx在48小时内完全释放,显示了快速的药物释放行为。此外,大约30%的ptx在最初的12小时内被释放,表明发生了药物突释现象。图3b显示了包含与实施例13相同组合成分的水胶的ptx释放模式,其中ptx首先被实施例10的组合物封装,随后加入一定量的羧甲基纤维素而获得ptx-聚合物组成物。如图3b所示,在最初的24小时内,具有与实施例13相同组成所制备的水胶仅释放了低于累积释放率10%的ptx,而在随后的144小时内,ptx的累积释放率仍低于40%,显示了这种水凝胶组合物的明显可持续药物缓慢释放特征。这些药物释放结果的差异可归因于此两种水凝胶的机械强度不同。如实验例2中例13的凝胶停留结果所示,与比较例1中制备的水凝胶相比,例13的水凝胶组成物表现出极长的凝胶生存时间。
[0230]
总结来说,基于本发明的实验结果,证实了通过使用由不同氨基酸改质的普朗尼克聚合物为主体所组成的组合,可以大大改善以普朗尼克(pluronic)为主的药物释放系统的载药能力和药物封装效果。此外,通过使用包含由不同的氨基酸改质的普朗尼克(pluronic)聚合物的组合与羧基多糖的组成物,可以大幅增强药物释放的可持续性。
[0231]
综上所述,本发明发现由氨基酸改质的普朗尼克(pluronic)聚合物/组合、羧基多糖及含或不含金属离子的组成物可以:(1)提高聚合物结构的机械强度、(2)提高抗水侵蚀能力、(3)增加聚合物与组织之间的粘附性、(4)提高预防组织沾粘能力及(5)改善传输医药活性剂时的释放行为。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1