用于口腔黏膜给药的尖端载药可溶性微针贴片及其制备方法
1.本发明属于经黏膜给药系统领域,涉及用于口腔黏膜给药的尖端载药可溶性微针贴片及其制备方法。
背景技术:
2.口腔黏膜病是影响人类健康的常见疾病,如复发性口腔溃疡、口腔黏膜炎症、潜在口腔恶性疾病等,给患者带来疼痛、不适和焦虑,影响患者的生活质量。在口腔黏膜病的临床治疗中,糖皮质激素是首选治疗药物,其具有抗炎、免疫调节和镇痛等多重作用,有利于口腔黏膜病灶的愈合。局部治疗是许多口腔黏膜病重要的治疗手段,其中包括局部注射和局部经黏膜给药。注射需要专业的医务人员操作,会引起疼痛,降低患者依从性,并产生尖锐的医疗废物。经黏膜给药包括凝胶、软膏、漱口水和贴片等,但由于口腔黏膜上皮存在生理渗透屏障,影响局部给药效率;唾液的流动会降低药物制剂在口腔黏膜表面的黏附时间,造成药物过早被吞咽而导致无效给药。因此,研究开发可实现在口腔黏膜局部进行高效、无痛给药的新型口腔给药系统具有重要的意义。
3.在过去的二十年中,微针作为新型的药物递送系统受到了广泛的关注。随着技术的发展,微针已被用于对皮肤、眼睛、口腔、血管等部位进行药物或疫苗递送。微针是由一个或多个微米级别针尖组成的微型阵列,针尖高度一般介于25~2000μm之间。微针可以在口腔黏膜上制造微孔,打破生理屏障,将药物直接输送到黏膜下层组织,相比于传统的经黏膜给药的方式,微针给药可以提高药物渗透率,实现高效的局部或全身给药。由于微针的尺寸很小,在经黏膜给药的过程中不会刺激神经,与皮下注射相比,微针给药是无痛、微创的,能提高患者的依从性,避免针头恐惧。此外,微针给药操作简单,患者可自行开展治疗。
4.ma等开发了一种涂布金属微针的贴片用于治疗口腔癌,在金属微针贴片表面涂布装载阿霉素的聚乳酸纳米颗粒,以实现口腔内精确、均匀的药物输送(ma y,boese s e,luo z,nitin n,gill h s.drug coated microneedles for minimally
‑
invasive treatment of oral carcinomas:development and in vitro evaluation[j].biomed microdevices,2015,17(2):44.)。但是,该金属贴片可能会引起软组织的炎症反应。seon
‑
woo等开发了一种可溶性的聚合mn微针贴片用于治疗口腔炎,曲安奈德装载于整个微针贴片中,与普通口腔贴片相比,该聚合mn微针贴片将曲安奈德的给药效率提高了42%(seon
‑
woo h
‑
s,kim h j,roh j y,park j
‑
h.dissolving microneedle systems for the oral mucosal delivery of triamcinolone acetonide to treat aphthous stomatitis[j].macromolecular research,2019,27(3):282
‑
289.)。但是,黏膜的弹性会造成该聚合物mn微针贴片的微针无法完全刺入组织下层,其底部所载药物无法递送完全而造成药物浪费。因此,研发用于精确的药物输送以治疗口腔黏膜病的可溶性聚合物微针贴片仍是一个挑战。
技术实现要素:
[0005]
本发明的目的在于克服现有用于口腔给药的微针贴片存在的不足,提供用于口腔黏膜给药的尖端载药可溶性微针贴片及其制备方法,以提高微针贴片的生物相容性,并提高药物递送效率和药物利用率。
[0006]
为实现上述发明目的,本发明采用的技术方案如下:
[0007]
用于口腔黏膜给药的尖端载药可溶性微针贴片,该微针贴片由载药微针阵列和防水背衬组成,载药微针阵列由基底和在基底一侧上阵列分布的微针组成,微针呈棱锥状、由尖端部和底部组成,微针的尖端部载有药物,防水背衬由黏附层和防水层组成,防水背衬通过黏附层与基底的另一侧结合为一体;所述载药微针阵列的基体材料为水溶性生物相容高分子材料,微针的尖端部与底部的基体材料不同,微针的底部与基底的基体材料相同;所述黏附层的基体材料为水溶性生物相容性高分子材料,防水层的基体材料为水不溶性生物相容性高分子材料。
[0008]
上述尖端载药可溶性微针贴片的技术方案中,微针的尖端部位溶于水但不溶于有机溶剂,微针的底部能同时溶于水和有机溶剂。为了增加上述尖端载药可溶性微针贴片的安全性及其制备过程的环保性,所述的有机溶剂最好是无毒性的有机溶剂,因此所述有机溶剂优先为醇类,进一步地,所述有机溶剂为乙醇。
[0009]
进一步地,上述尖端载药可溶性微针贴片的技术方案中,微针的尖端部位的基体材料可是葡聚糖、透明质酸等多糖,也可以是聚乙烯醇、羧甲基纤维素等;微针底部的基体材料可为聚乙烯吡咯烷酮。
[0010]
根据实际应用时对给药速度或药物释放速率的要求,可以选用不同分子量的尖端部位的基体材料,通常尖端部位的基体材料的分子量越低,给药速度越快。透明质酸是一种天然多糖,具有良好的水溶性和生物相容性,是作为微针尖端部位的理想材料之一,通常根据给药速度需求的不同,可选不同分子量的透明质酸作为尖端部位的基体材料,低分子量的透明质酸在水中可以快速溶解,适用于制备可快速给药的尖端载药可溶性微针贴片,例如,可采用择分子量为10~100kda的透明质酸。聚乙烯吡咯烷酮的生物相容性好,其分子内的环状结构可增加载药微针阵列的机械性能,通常可选用聚乙烯吡咯烷酮k30作为微针底部和基底的基体材料,该规格的聚乙烯吡咯烷酮制备的载药微针阵列具有完整形貌、高机械性能和快速水溶性的特点。
[0011]
上述尖端载药可溶性微针贴片的技术方案中,之所以将载药微针阵列设计为由尖端部和底部组成、尖端部与底部的基体材料不同,以及将微针阵列分布于基底一侧的结构,主要的作用是将药物集中负载于微针尖端部,而不是分散在整个载药微针阵列中,克服由于黏膜弹性而导致微针无法完全刺入黏膜组织而造成药物浪费的问题,提高药物利用度,实现高效、精准的药物递送;同时,基底起到力学支撑作用,能增加尖端载药可溶性微针贴片的机械强度。微针的尖端部与底部的相对高度,可根据对载药量的需求以及在应用时微针刺入口腔粘膜的深度进行确定和调整,基底的厚度只要满足能为微针阵列提供力学支撑即可。
[0012]
上述尖端载药可溶性微针贴片的技术方案中,防水背衬至少应完全覆盖住基底,防水背衬的作用是防止唾液快速溶解基底以及防止唾液流动带走局部药物,提高药物递送效率,防水背衬的厚度满足防水需求即可,在给药结束后,吐出水不溶解的防水层材料即
可。本发明中,只要满足黏附层的基体材料为水溶性生物相容性高分子材料,防水层的基体材料为水不溶性生物相容性高分子材料即可,本发明对黏附层与防水层的基体材料没有特殊要求,可参照现有技术进行选择,例如,一种可行的防水层可由乙基纤维素组成,一种可行的黏附层可由聚乙烯醇、羧甲基纤维素钠、甘油和乙基纤维素组成。
[0013]
上述尖端载药可溶性微针贴片的技术方案中,微针的形状和微针阵列中微针的密度等可根据实际应用需求通过调整微针模具的尺寸进行调整,例如,相邻微针的针尖与针尖之间的距离可为400~600μm。微针的形状通常只要满足微针呈棱锥状,比如圆锥和正棱锥状,为了增加微针的机械强度,微针优选呈正四棱锥状。微针的高度应确保微针在插入口腔粘膜后不触碰到神经,考虑到口腔黏膜具有弹性,微针无法完全进入到口腔黏膜内,因此,优选的微针高度为400~800μm。对于微针呈正四棱锥状的情况,为了确保微针具有较好的力学强度,微针的底面边长与微针高度之比最好为1:(2~3)。
[0014]
上述尖端载药可溶性微针贴片的技术方案中,微针的尖端部所载的药物为亲水性的口腔黏膜病治疗药物,例如,糖皮质激素,常见的包括倍他米松磷酸钠等,微针尖端的载药量可参照实际应用中腔黏膜病治疗药物的剂量进行确定。
[0015]
本发明还提供了一种上述用于口腔黏膜给药的尖端载药可溶性微针贴片的制备方法,包括以下步骤:
[0016]
(1)配制溶液
[0017]
将微针尖端部基体材料与药物溶于水中,静置脱除气泡,得到载药针尖溶液;载药针尖溶液中,微针尖端部基体材料的浓度为100~300mg/ml;
[0018]
将基底基体材料溶于有机溶剂中,静置脱除气泡,得到基底溶液;基底溶液中基底基体材料的浓度为100~600mg/ml;
[0019]
将黏附层基体材料与水混匀,静置脱除气泡,得到黏附层溶液;
[0020]
将防水层基体材料溶于有机溶剂中,静置脱除气泡,得到防水层溶液;
[0021]
(2)制备载药微针阵列
[0022]
采用微针模具制备微针,微针模具包括阵列分布的针尖空腔和与针尖空腔的开口端连通的基底空腔;将载药针尖溶液加入微针模具中,在1~4℃充分离心,使载药针尖溶液填满针尖空腔,回收未进入针尖空腔的载药针尖溶液,干燥除去微针模具内的载药针尖溶液中的水分,形成微针的尖端部;然后向微针模具中加入基底溶液,在1~4℃充分离心使基底溶液填满微针模具,干燥除去基底溶液中的有机溶剂,脱模,得到载药微针阵列;
[0023]
(3)制备防水背衬
[0024]
将黏附层溶液涂覆于玻璃板表面,干燥,得到黏附层,将防水层溶液涂覆于黏附层上,干燥,得到防水背衬;
[0025]
(4)制备尖端载药可溶性微针贴片
[0026]
向防水背衬的黏附层上喷洒黏附层溶液将黏附层湿润,将载药微针阵列不带微针的一侧置于润湿后的黏附层上将二者粘结为一体,即得尖端载药可溶性微针贴片。
[0027]
上述尖端载药可溶性微针贴片的制备方法的技术方案中,步骤(2)(3)在进行干燥操作时,干燥温度均不超过30℃。
[0028]
上述尖端载药可溶性微针贴片的制备方法的技术方案中,一种可行的黏附层溶液的配制方法为:将聚乙烯醇、羧甲基纤维素钠与甘油加入水中,混合均匀,静置脱除气泡,得
到黏附层溶液;黏附层溶液中,聚乙烯醇、羧甲基纤维素钠和甘油的浓度分别为50~100mg/ml、5~10mg/ml和10~15mg/ml。
[0029]
上述尖端载药可溶性微针贴片的制备方法的技术方案中,一种可行的防水层溶液的配制方法为:将乙基纤维素溶于乙醇,静置脱除气泡,得到防水层溶液;防水层溶液中,乙基纤维素的浓度为100~300mg/ml。
[0030]
上述尖端载药可溶性微针贴片的制备方法的技术方案的步骤(1)中,溶解基底基体材料的有机溶剂不溶解微针尖端部基体材料。
[0031]
与现有技术相比,本发明提供的技术方案产生了以下有益的技术效果:
[0032]
1.本发明提供了一种用于口腔黏膜给药的尖端载药可溶性微针贴片,该微针贴片由载药微针阵列和防水背衬组成,载药微针阵列由基底和在基底一侧上阵列分布的微针组成,微针呈棱锥状、由尖端部和底部组成,微针的尖端部载有药物,防水背衬由黏附层和防水层组成,防水背衬通过黏附层与基底的另一侧结合为一体;载药微针阵列的基体材料为水溶性生物相容高分子材料,微针的尖端部与底部的基体材料不同;黏附层的基体材料为水溶性生物相容性高分子材料,防水层的基体材料为水不溶性生物相容性高分子材料。与现有的口腔贴片相比,本发明提供的可溶性微针贴片的基体材料均为生物相容性的,可解决金属贴片引起组织炎症反应的问题,同时,本发明仅在微针的尖端载药,微针的其他部位不载药,可克服由于黏膜弹性而导致微针无法完全刺入黏膜组织而造成药物浪费的问题,提高药物利用度,实现高效、精准的药物递送。
[0033]
2.本发明提供的用于口腔黏膜给药的尖端载药可溶性微针贴片设计有防水背衬,防水背衬可防止唾液快速溶解基底并防止唾液流动带走局部药物,该设计可提高药物递送效率,在给药结束后,吐出水不溶解的防水层材料即可,使用方式简单。
[0034]
3.本发明通过实验证实,本发明提供的尖端载药的可溶性微针贴片的微针具有良好的机械强度,还具有快速溶解特性和抗潮性能,这些特点有利于该微针贴片刺穿口腔黏膜、快速释放药物,使用该微针贴片可有效替代黏膜下的局部注射,降低患者疼痛感,实现快速无痛的药物递送。同时,该微针贴片的基体材料为生物相容性良好的高分子材料,具有作为药物递送的安全载体的潜力,具有良好的临床应用前景。
[0035]
4.本发明还提供了上述尖端载药的可溶性微针贴片的制备方法,操作简单,条件温和,无需高温操作,有利于保护所负载的药物的活性,同时,载药量可根据实际应用需求灵活调整。
附图说明
[0036]
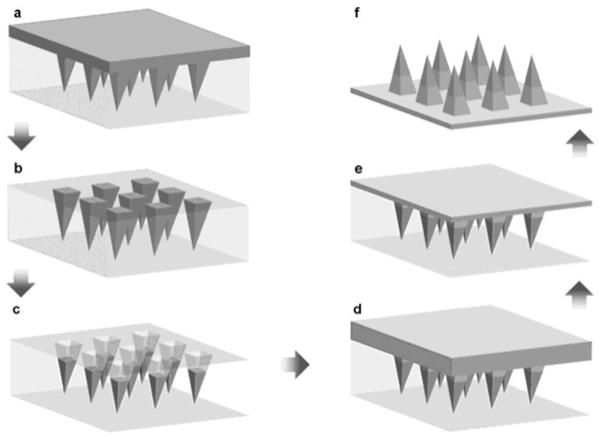
图1是载药微针阵列的制备过程示意图,其中,a图为将载药针尖溶液加入微针模具中,b图为离心并移除未进入针尖空腔的载药针尖溶液,c图为干燥形成微针的尖端部,d图为向微针模具中加入基底溶液,e图为离心并干燥,f图为脱模得到不带防水背衬的尖端载药微针。
[0037]
图2是实施例1制备的载药微针阵列在不同视角的扫描电镜图像。
[0038]
图3是防水背衬与尖端载药可溶性微针贴片的制备过程示意图,其中,a~b图为涂覆黏附层溶液并干燥,c~d图为涂覆防水层并干燥,e图为向黏附层喷洒黏附层溶液,f图为将防水背衬与载药微针阵列连接为一体,g图为得到尖端载药可溶性微针贴片。
[0039]
图4是实施例7制备的防水背衬断面的扫描电镜照片。
[0040]
图5是实施例8制备的尖端载药可溶性微针贴片的照片。
[0041]
图6是空白透明质酸微针阵列的制备过程示意图,其中,a图为微针模具示意图,b图为将透明质酸溶液加入微针模具中,c图为离心并干燥,d图为脱模得到空白透明质酸微针阵列。
[0042]
图7是对比例1~2、4制备的微针阵列的机械性能测试结果。
[0043]
图8是对比例1~2、4制备的微针阵列的在压缩过程中微针的变形情况。
[0044]
图9是对比例1~2、4制备的微针阵列在不同湿度下的机械性能稳定性测试结果。
[0045]
图10是实施例1、对比例3~4制备的微针阵列的形貌与药物分布情况。
[0046]
图11是实施例1制备的载药微针阵列的共聚焦显微镜图片。
[0047]
图12是bsp的hplc标准曲线(a图)与实施例2~6制备的载药微针阵列的载药量测定结果(b图)。
[0048]
图13是实施例5和对比例1制备的微针阵列的机械性能测试结果。
[0049]
图14是实施例5制备的载药微针阵列的体外穿刺照片(a,b图)及口腔黏膜组织切片(c,d图)。
[0050]
图15是实施例5制备的载药微针阵列的溶解的行为测试结果。
[0051]
图16是实施例5与对比例5制备的载药微针阵列与载药微针溶液的释药行为测试结果。
具体实施方式
[0052]
以下通过实施例对本发明提供的用于口腔黏膜给药的尖端载药可溶性微针贴片及其制备方法作进一步说明。有必要指出,以下实施例只用于对本发明作进一步说明,不能理解为对本发明保护范围的限制,所属领域技术人员根据上述发明内容对本发明做出一些非本质的改进和调整进行具体实施,仍属于本发明的保护范围。
[0053]
下述各实施例和对比例中:
[0054]
采用的微针模具包括阵列分布的针尖空腔和与针尖空腔的开口端连通的基底空腔,所述针尖空腔呈正四棱锥状,基底空腔是底面呈正方形的长方形空腔,基底空腔的底面尺寸为0.5cm
×
0.5cm,该微针模具中阵列分布(10
×
10矩阵)有100个针尖空腔,该微针模具的材质为聚二甲基硅氧烷(pdms)。离心操作采用的设备为平板离心机。采用的透明质酸(ha)的分子量为10~100kda,聚乙烯吡咯烷酮(pvp)为聚乙烯吡咯烷酮k30,平均分子量约为55000da。
[0055]
实施例1
[0056]
本实施例中,制备载药微针阵列,制备过程如图1所示,步骤如下:
[0057]
(1)配制溶液
[0058]
将ha与荧光标记药物倍他米松磷酸钠(fitc
‑
bsp)药物溶于去离子水中,静置脱除气泡,得到载药针尖溶液;载药针尖溶液中,ha的浓度为100mg/ml,fitc
‑
bsp的浓度为1mg/ml。
[0059]
将pvp溶于无水乙醇中,静置脱除气泡,得到基底溶液;基底溶液中pvp的浓度为300mg/ml。
[0060]
(2)制备载药微针阵列
[0061]
将载药针尖溶液加入微针模具中,在4℃以4000rpm的转速离心10min,将微针模具旋转180
°
,继续离心10min,使载药针尖溶液均匀填满针尖空腔,保留针尖空腔内的载药针尖溶液并回收未进入针尖空腔的载药针尖溶液,将微针模具放入30℃的鼓风干燥箱中干燥1h以除去水分形成微针的尖端部;然后向微针模具中加入基底溶液,在4℃以4000rpm的转速离心10min,使基底溶液填满微针模具,将微针模具取出,置于通风处,在室温干燥12h以除去无水乙醇,小心将所得产物从模具上剥离,得到载药微针阵列,置于干燥器中在室温避光保存。
[0062]
将本实施例制备的载药微针阵列粘贴在样品台上,喷金60s后进行氮气吹扫,使用扫描电镜观察其形貌并测量相关尺寸,结果如图3所示。图3的a、d两图展示了该载药微针阵列上具阵列排列的微针(100根,10
×
10矩阵),载药微针阵列中的各微针均呈实心的正四棱柱状,微针结构均一完整,针形尖锐。由图3的b~c及e~f图可以看出,微针的高度约为450μm,微针底部呈正方形,正方形的边长约为190μm,微针阵列的同一横排或纵排中相邻微针的针尖到针尖的距离约为475μm。由图3的b图可以看出微针由尖端部和底部组成,分层痕迹明显,上部为尖端部位载药ha部分,底部为为pvp部分。
[0063]
实施例2
[0064]
本实施例中,制备载药微针阵列,操作与实施例1基本相同,不同之处仅在于,载药针尖溶液中含有的药物为倍他米松磷酸钠(bsp),bsp的浓度为10mg/ml。
[0065]
实施例3
[0066]
本实施例中,制备载药微针阵列,操作与实施例1基本相同,不同之处仅在于,载药针尖溶液中含有的药物为bsp,bsp的浓度为30mg/ml。
[0067]
实施例4
[0068]
本实施例中,制备载药微针阵列,操作与实施例1基本相同,不同之处仅在于,载药针尖溶液中含有的药物为bsp,bsp的浓度为50mg/ml。
[0069]
实施例5
[0070]
本实施例中,制备载药微针阵列,操作与实施例1基本相同,不同之处仅在于,载药针尖溶液中含有的药物为bsp,bsp的浓度为70mg/ml。
[0071]
实施例6
[0072]
本实施例中,制备载药微针阵列,操作与实施例1基本相同,不同之处仅在于,载药针尖溶液中含有的药物为bsp,bsp的浓度为90mg/ml。
[0073]
实施例7
[0074]
本实施例中,制备防水背衬,制备流程如图3所示,步骤如下:
[0075]
(1)配制溶液
[0076]
将聚乙烯醇、羧甲基纤维素钠与甘油加入去离子水中,混合均匀,静置脱除气泡,得到黏附层溶液;黏附层溶液中,聚乙烯醇、羧甲基纤维素钠和甘油的浓度分别为67.5mg/ml、7.5mg/ml和12.5mg/ml。
[0077]
将乙基纤维素溶于乙醇中,静置脱除气泡,得到防水层溶液;防水层材料中,乙基纤维素的浓度为100mg/ml。
[0078]
(3)制备防水背衬
[0079]
将黏附层溶液刮涂在干净的玻璃板上,在通风橱中于室温干燥6h,然后,将防水层溶液刮涂在已干燥的黏附层上,在通风橱中于室温干燥6h,刮涂黏附层和防水层溶液时的刮膜高度均设为50μm;干燥完成后,将所得薄膜裁剪成1cm
×
1cm的正方形,即得到防水背衬。
[0080]
将防水背衬放入液氮中冷冻30s后脆断得到断面,将其黏贴于样品台喷金60s用氮气吹扫,使用扫描电镜观察防水背衬的断面结构,结果如图4所示,由图可知,防水背衬具有双层结构,其中致位于上方的密结构为黏附层,位于下方的多孔结构为防水层,多孔结构是因为防水层的溶剂乙醇挥发速度快而产生的。
[0081]
实施例8
[0082]
本实施例中,连接载药微针阵列与防水背衬制备尖端载药可溶性微针贴片,制备流程如图3所示,步骤如下:
[0083]
使用压缩式雾化器向防水背衬的黏附层上均匀喷洒黏附层溶液将黏附层湿润,将载药微针阵列不带微针的一侧置于润湿后的黏附层上,按压微针阵列边缘1min使防水背衬与载药微针阵列粘结为一体,即得尖端载药可溶性微针贴片。使用该方法,分别将实施例1~7制备的载药微针阵列与防水背衬连接为一体,得到一系列尖端载药可溶性微针贴片。尖端载药可溶性微针贴的照片如图5所示。
[0084]
当黏附层处于湿润状态时具有黏附性,利用黏附性可将载药微针阵列与防水背衬粘结为一体。防水背衬的防水层不溶于水,可防止唾液的侵袭,减少药物因进入唾液而被吞入体内的量。当药物递送结束后,将不溶解的防水层材料吐出即完成给药,过程简单快速。
[0085]
对比例1
[0086]
本对比例中,制备空白微针阵列,步骤如下:
[0087]
(1)配制溶液
[0088]
将ha溶于去离子水中,静置脱除气泡,得到浓度为100mg/ml的ha溶液。
[0089]
将pvp溶于无水乙醇中,静置脱除气泡,得到浓度为300mg/ml的pvp溶液。
[0090]
(2)制备空白微针阵列
[0091]
将ha溶液加入微针模具中,在4℃充分离心以4000rpm的转速离心10min,将微针模具旋转180
°
,继续离心10min,使ha溶液均匀填满针尖空腔,保留针尖空腔内的ha溶液并回收未进入针尖空腔的ha溶液,将微针模具放入30℃的鼓风干燥箱中干燥1h以除去水分形成微针的尖端部;然后向微针模具中加入pvp溶液,在4℃以4000rpm的转速离心10min,使pvp溶液填满微针模具,将微针模具取出,置于通风处在室温干燥12h以除去无水乙醇,小心将所得产物从模具上剥离,得到空白微针阵列,置于干燥器中在室温避光保存。
[0092]
对比例2
[0093]
本对比例中,制备空白ha微针阵列,制备过程如图6所示,步骤如下:
[0094]
(1)配制ha溶液
[0095]
将ha溶于去离子水中,静置脱除气泡,得到浓度为100mg/ml的ha溶液。
[0096]
(2)制备空白ha微针阵列
[0097]
将ha溶液加入微针模具中,在4℃充分离心以4000rpm的转速离心10min,将微针模具旋转180
°
,继续离心10min,使ha溶液均匀填满针尖空腔和基底空腔,然后将微针模具放入30℃的鼓风干燥箱中干燥12h以除去水分,小心将所得产物从模具上剥离,得到空白ha微
针阵列,置于干燥器中在室温避光保存。
[0098]
对比例3
[0099]
本对比例中,制备载药ha微针阵列,操作与对比例2基本相同,不同之处仅在于,将ha溶液替换为含fitc
‑
bsp的ha溶液,该溶液中,ha的浓度为100mg/ml,fitc
‑
bsp的浓度为1mg/ml。
[0100]
对比例4
[0101]
本对比例中,制备空白pvp微针阵列,操作与对比例2基本相同,不同之处仅在于:步骤(1)是将pvp溶于无水乙醇中,混匀后静置脱除气泡,得到浓度为300mg/ml的pvp溶液;步骤(2)将ha溶液替换为pvp溶液,在离心后将微针模具置于通风处,在室温干燥12h以除去无水乙醇。
[0102]
实施例9
[0103]
本实施例中,考察对比例1~2、4制备的微针阵列的机械性能。
[0104]
通过万能拉力试验机测定对比例1~2、4制备的产品的机械强度。将对比例1~2、4制备的微针阵列水平放置于不锈钢平台上,保持微针的针尖垂直向上。使用100n的压力传感器以恒定速度(10μm/s)垂直向下移动,向微针连续施加压力,达到预设载荷(80n)后停止施压。持续记录压缩过程中的微针针尖的压缩位移和微针承受压力的变化。
[0105]
结果如图7所示,由图可知,对比例1、4制备的微针阵列的机械性能接近,对比例2制备的微针阵列的机械性能与前两者有较大区别,说明微针阵列的机械强度主要由pvp基底支撑部分提供,而ha部分的机械强度对微针阵列的机械强度影响较小。
[0106]
实施例10
[0107]
本实施例中,考察对比例1~2、4制备的微针阵列在压缩过程中的变形情况。
[0108]
将万能拉力试验机的预设载荷分别设定为10n、20n和30n,以恒定速度(10μm/s)垂直向下移动并压缩微针阵列;将压缩后的微针阵列固定在样品台上,喷金60s后进行氮气吹扫,使用扫描电镜观察产品的微针的形貌,结果如图8所示,由图可知,三种微针阵列的微针均为连续变形,无断裂现象,对比例1制备的微针阵列的微针结合了对比例2的韧性和对比例4的刚性,具有优异的机械性能。
[0109]
实施例11
[0110]
本实施例中,考察对比例1~2、4制备的微针阵列的微针在不同湿度下的机械性能稳定性。
[0111]
将恒温恒湿箱的相对湿度分别设定为20%、40%、60%和80%,将对比例1~2、4制备的微针阵列别放入各相对湿度条件的恒温恒湿箱中保存30min。通过万能拉力试验机测定各微针阵列在不同湿度保存30min后的机械强度,连续记录压缩过程中微针针尖的位移和压力的变化情况。
[0112]
使用立体显微镜拍摄了在80%相对湿度下保存前后的微针阵列的光学图片,结果如图9所示。由图9的a图可知,对比例2制备的空白ha微针阵列具有良好的抗潮能力,随着相对湿度的增加,机械强度变化较小,仅当相对湿度为80%时,机械强度出现了较明显的下降,微针的形态没有变化;由图9的b图可知,对比例4制备的空白pvp微针阵列的机械强度受湿度变化的影响非常明显,当相对湿度达到40%时,机械强度明显下降,当相对湿度达到80%时,光学图片显示微针已经开始变形,微针的针尖失去了尖锐形状,这会造成丧失刺入
能力;由图9的c图可知,对比例1制备的空白微针阵列具有一定的稳定性,在相对湿度为40%的环境下保存30min后依旧具备较好的机械强度,当相对湿度增加至80%时形貌不变,说明该空白微针阵列具有一定的防潮能力,但仍需要保存在干燥环境中。
[0113]
实施例12
[0114]
本实施例中,观察实施例1、对比例3~4制备的微针阵列的形貌与药物分布情况。
[0115]
在体视显微镜下观察实施例1、对比例3~4制备的微针阵列的形貌。在共聚焦显微镜下观察实施例1制备的微针阵列的荧光药物分布情况。图10的a,a’两图展示了对比例3制备的载药ha微针阵列内的药物分布情况,黄色为fitc
‑
bsp,可以看出药物分布在整个载药ha微针阵列中;图10的b,b’两图是对比例4制备的空白pvp微针阵列的图像;图10的c,c’两图是实施例1制备的载药微针阵列的图像,图中显示黄色仅分布在微针的尖端部,而pvp部分则没有药物分布。图11是共聚焦图像,图中的绿色代表fitc
‑
bsp荧光,从荧光场b和叠加场c可以看出,荧光标记药物的绿色荧光信号主要分布在微针的尖端部(约微针针尖上端2/3处),进一步验证了实施例1制备的载药微针阵列中,fitc
‑
bsp仅分布在微针的尖端部(即ha部分),而微针的底部(pvp部分)没有药物分布。这种现象的产生是由于ha与pvp存在溶解性差异,ha和pvp都具有良好的水溶性,但pvp能溶于乙醇而ha不溶于乙醇。在制备过程中,向微针模具中加入pvp的乙醇溶液前,处于微针模具的针尖空腔内的ha溶液已经过充分干燥,药物被锁定在ha中;当加入pvp的乙醇溶液后,ha部分未发生物质转移,药物不会扩散到由pvp组成的微针底部。药物在微针尖端部的聚集有助于提高药物递送效率,可避免黏膜弹性造成基底无法插入而产生药物浪费的问题。
[0116]
实施例13
[0117]
对实施例,采用高效液相色谱法(hplc),测定实施例2~6制备的载药微针阵列中bsp的含量测定,步骤如下:
[0118]
(1)色谱条件参照《中国药典》(2015),测定bsp的hplc参数是:使用c18色谱柱;以甲醇
‑
0.05mol/l磷酸二氢钾溶液(体积比1:1)为流动相;检测波长254nm;柱温30℃;流速1.0ml/min;进样量20μl。
[0119]
(2)标准曲线测定:使用精密天平称取30mg bsp,取适量去离子水充分溶解制成母液,将母液分别稀释成bsp浓度为3.75μg/ml、7.5μg/ml、15μg/ml、30μg/ml、60μg/ml、和120μg/ml的标准液。使用hplc测定并绘制峰面积,得到标准曲线。
[0120]
(3)载药量测定:将实施例2~6制备的载药微针阵列分别浸入10ml去离子水中充分溶解,完全溶解后使用0.22μm的过滤器过滤,取续滤液保存至离心管。使用hplc测定并绘制峰面积,最后根据标准曲线得到bsp的浓度并计算载药量。
[0121]
图12的a图是bsp的标准曲线图,以bsp峰面积对浓度(μg/ml)进行线性回归。图12的b图是载药微针阵列的载药量随着载药针尖溶液中药物浓度的增加而增加的变化趋势。由于微针模具的空腔体积是固定的,所以经过离心后装入pdms模具中的载药针尖溶液的体积是固定的,因此可以通过提高载药针尖溶液的药物含量来提高产品的载药量。临床上,用于一些口腔黏膜病病局部注射治疗的常用剂量为在病损部位注射约0.46mg bsp。实施例5制备的载药微针阵列(100根微针)的载药量约为0.48mg,适合临床给药。
[0122]
实施例14
[0123]
对实施例5和对比例1制备的微针阵列的机械性能进行表征,操作同实施例9,结果
如图13所示。由图13可知,在干燥状态下,载药微针阵列与空白微针阵列的针尖压缩位移
‑
压力曲线都是连续上升的曲线,表示二者所受压力持续增加,在实验过程中未发生断裂。当微针的针尖的压缩位移达到0.3mm时,载药微针阵列承受的压力为0.268n/针,空白微针阵列则为0.339n/针,药物装载会略降低产机械性能,但该载药微针阵列仍然具有足够的机械强度。
[0124]
实施例15
[0125]
对实施例5制备的载药微针阵列刺入口腔黏膜的能力进行研究。
[0126]
取出冷冻离体兔口腔黏膜,浸入生理盐水中恢复至室温,使用纱布轻轻擦除黏膜表面水分。使用50n的力将载药微针阵列垂直刺入兔口腔黏膜,保持1min,将其移除,立即用台盼蓝溶液对黏膜表面染色,3min后使用生理盐水冲洗表面,去除表面残留的台盼蓝溶液;将处理后的黏膜组织在4%多聚甲醛中浸泡1h,用立体显微镜观察载药微针阵列刺入前后的黏膜表面。采用手术刀切取黏膜的载药微针阵列处理区域,将分离的黏膜组织在
‑
35℃下冷冻包埋,使用冷冻切片机将样品制为厚度30μm的切片,在光学显微镜下观察组织截面并测量刺入深度。
[0127]
图14的a,c两图展示了未经处理的口腔黏膜表面是光滑且完整的,由图14的b图可知,与未经处理的离体组织相比,载药微针阵列处理后的兔口腔黏膜出现了整齐排列的微孔,载药微针阵列的刺入率超过95%。口腔黏膜组织切片图像如图14的c,d两图所示,载药微针阵列在黏膜部位的穿透深度约为200μm,穿透了黏膜的上皮屏障。刺入深度小于微针高度(450μm),原因是黏膜弹性导致微针不能完全刺入组织内部,并且在压缩过程中针尖会变形,进一步造成深度降低,因此组织刺入深度小于微针的高度。
[0128]
实施例16
[0129]
本实施例中,研究实施例5制备的载药微针阵列的溶解的行为。
[0130]
通过测定载药微针阵列刺入黏膜的溶解速率来确定临床给药时间。将载药微针阵列压入离体兔口腔黏膜,保持不同的时间后取出,时间间隔分别为5s、10s和20s。将取出的载药微针阵列置于立体显微镜下观察,通过测量剩余微针的高度来评价其溶解能力。结果如图15所示,微针的高度在刺入离体兔口腔粘膜20s后下降至原有高度的23%,药物几乎全部递送结束,说明该载药微针阵列具有快速溶解性能。
[0131]
对比例5
[0132]
将实施例5制备的载药微针阵列溶解在1ml人工唾液中,混合均匀,得到载药微针溶液。
[0133]
实施例17
[0134]
本实施例中,研究实施例5制备的载药微针阵列和对比例5制备的载药微针溶液的释药行为。
[0135]
使用透皮扩散池模拟口腔黏膜水环境进行体外药物释放实验,使用含水量80%的明胶水凝胶膜来模拟上层组织屏障。释药实验设置微针组(实验组)和溶液组(对照组),分别对应局部微针给药实施例5制备的载药微针阵列和局部经黏膜给药对比例5制备的载微针溶液。
[0136]
微针组:将实施例5制备的载药微针阵列的微针插入明胶水凝胶膜并保持1min,把经过该处理的明胶膜安装于5ml扩散池,分别向受体池加入5ml人工唾液、向供给池加入1ml
人工唾液。明胶膜的微针处理面朝向供给池,另一面朝向受体池。
[0137]
溶液组:在扩散池中放置完整明胶水凝胶膜,将对比例5中的尖端载药微针溶液加入供给池,同时受体池中加入5ml人工唾液。
[0138]
将扩散池放置在37℃水浴中,以400rpm/min的速度搅拌。在设定的时间间隔内,收集1ml受体池溶液同时补加1ml人工唾液。取样完成后,使用hplc测定两组样品中bsp的含量并绘制药物释放曲线。结果如图16所示,微针组在1h内药物释放总量>90%,溶液组释放量仅为4%。当扩散时间达到12h,溶液组释放量达到32%,被动扩散药物渗透的速率远低于微针主动递送药物的速率。爆炸性的药物释放行为一方面是因为载药微针阵列制造的孔隙打破了药物递送屏障,另一方面是由于药物会随着载药微针阵列的溶解而加速释放。体外药物释放曲线证明了微针给药起到了加速药物递送的效果,是高效、快速的给药系统。
[0139]
实施例18
[0140]
本实施例中,制备用于口腔黏膜给药的尖端载药可溶性微针贴片,步骤如下:
[0141]
(1)配制溶液
[0142]
将ha与bsp溶于去离子水中,静置脱除气泡,得到载药针尖溶液;载药针尖溶液中,ha的浓度为300mg/ml,bsp的浓度为80mg/ml。
[0143]
将pvp溶于无水乙醇中,静置脱除气泡,得到基底溶液;基底溶液中pvp的浓度为600mg/ml。
[0144]
(2)制备载药微针阵列,操作同实施例1。
[0145]
(3)制备防水背衬,操作同实施例7。
[0146]
(4)制备尖端载药可溶性微针贴片,操作同实施例8。
[0147]
实施例19
[0148]
实施例18
[0149]
本实施例中,制备用于口腔黏膜给药的尖端载药可溶性微针贴片,步骤如下:
[0150]
(1)配制溶液
[0151]
将ha与bsp溶于去离子水中,静置脱除气泡,得到载药针尖溶液;载药针尖溶液中,ha的浓度为200mg/ml,bsp的浓度为70mg/ml。
[0152]
将pvp溶于无水乙醇中,静置脱除气泡,得到基底溶液;基底溶液中pvp的浓度为100mg/ml。
[0153]
(2)制备载药微针阵列,操作同实施例1。
[0154]
(3)制备防水背衬,操作同实施例7。
[0155]
(4)制备尖端载药可溶性微针贴片,操作同实施例8。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1