一种塞来昔布乳状注射液及其制备方法与流程
1.本发明涉及一种塞来昔布乳状注射液及其制备方法,属于药物制剂领域。
背景技术:
2.塞来昔布是一种治疗急性期或慢性期骨关节炎及类风湿性关节炎的药物,其英文名为celecoxib,是一种特异性环氧化酶-2(cox-2)抑制剂,结构如下:
[0003][0004]
环氧化酶-2的生成会引起炎性前列腺素类物质(如前列腺素e2等)的产生和聚积,从而导致炎症。塞来昔布作为一种环氧化酶-2抑制剂,可以有效地抑制环氧化酶-2的生成,达到抗炎止痛的作用。
[0005]
塞来昔布属于生物药学分类系统(bcs)ⅱ类药物,其特点是在水中溶解度及生物利用度均很低。生物利用度由多种因素决定,包括药品的剂型及有效物质的理化特性等。化学药物的生物利用度很大程度上取决于有效物质的溶解度,因此,塞来昔布的低溶解度是造成其低生物利用度的主要原因。
[0006]
目前,塞来昔布只有口服制剂上市(例如商品名为西乐葆的塞来昔布胶囊),而塞来昔布口服制剂的缺点很突出。一方面,塞来昔布的低溶解度导致其口服制剂的生物利用度低,口服吸收慢;另一方面,塞来昔布口服制剂利用胃肠代谢吸收,所以不能使药物长期存于体内,必须每天至少服药一次,而每天服药导致塞来昔布血药浓度在服药期间产生波动,无法保持平缓的血药浓度。
[0007]
脂肪乳制剂是临床治疗中广泛使用的肠外营养剂,安全性好,对静脉无刺激。它不仅可以为患者快速提供高能量,还与氨基酸、维生素、电解质等治疗性输液有很好的兼容性,可以同时配合使用。脂肪乳的粒径小且分布均匀,稳定性好,具有一定的靶向性,能明显降低药物的毒副作用,减少药物的刺激性,提高药物的生物利用度,已经成为提高药物疗效的重要制剂研究方向。
[0008]
塞来昔布注射剂有望能克服口服制剂的缺点,然而目前现有技术中公开的塞来昔布注射剂较少,脂肪乳注射液更少。一方面,由于非甾体抗炎药水溶性一般较差,开发相应的注射剂有较大困难;另一方面,目前还缺乏足够的临床研究,来充分论证塞来昔布注射液的有效性和安全性。
[0009]
因此,提供一种能够克服塞来昔布口服制剂缺点、增加塞来昔布的生物利用度、安全有效的脂肪乳注射剂具有很高的市场价值。
技术实现要素:
[0010]
为了解决上述技术问题,本发明提供了一种塞来昔布乳状注射液及其制备方法,该注射液能够提高塞来昔布的溶解度,提升其在人体内的生物利用度,稳定性好,同时成本低廉,工艺简单,适于工业化生产。
[0011]
本发明提供了一种塞来昔布乳状注射液,所述注射液含塞来昔布、油相介质、乳化剂、渗透压调节剂和注射用水。
[0012]
进一步地,所述塞来昔布的含量为5-20mg/ml。
[0013]
更进一步地,所述塞来昔布的含量为5-12mg/ml。
[0014]
更进一步地,所述塞来昔布的含量为8-10mg/ml。
[0015]
更进一步地,所述塞来昔布的含量为8mg/ml。
[0016]
进一步地,所述油相介质为中链甘油三酸酯或单亚油酸甘油酯。
[0017]
更进一步地,所述油相介质为中链甘油三酸酯。
[0018]
更进一步地,所述中链甘油三酸酯的含量为100-300mg/ml。
[0019]
更进一步地,所述中链甘油三酸酯的含量为150-250mg/ml。
[0020]
更进一步地,所述中链甘油三酸酯的含量为200mg/ml。
[0021]
进一步地,所述乳化剂为卵磷脂和/或泊洛沙姆。
[0022]
更进一步地,所述乳化剂为蛋黄卵磷脂。
[0023]
更进一步地,所述蛋黄卵磷脂的含量为10-15mg/ml。
[0024]
更进一步地,所述蛋黄卵磷脂的含量为12mg/ml。
[0025]
进一步地,所述注射液还含稳定剂。
[0026]
更进一步地,所述稳定剂为油酸、油酸盐、胆酸、胆酸盐中的一种或多种。
[0027]
更进一步地,所述稳定剂为油酸。
[0028]
更进一步地,所述油酸的含量为200-400μg/ml。
[0029]
更进一步地,所述油酸的含量为300μg/ml。
[0030]
进一步地,所述注射液还含抗氧化剂。
[0031]
更进一步地,所述抗氧化剂为依地酸二钠、维生素e、抗坏血酸、亚硫酸钠、l-半胱氨酸中的一种或多种。
[0032]
更进一步地,所述抗氧化剂为依地酸二钠。
[0033]
更进一步地,所述依地酸二钠的含量为40-75μg/ml。
[0034]
更进一步地,所述依地酸二钠的含量为50-60μg/ml。
[0035]
进一步地,所述注射液还含ph调节剂。
[0036]
更进一步地,ph调节剂为盐酸溶液、柠檬酸溶液、氢氧化钠溶液中的一种或多种。
[0037]
进一步地,所述渗透压调节剂为甘油。
[0038]
更进一步地,所述甘油的含量为10-30mg/ml。
[0039]
更进一步地,所述甘油的含量为20-30mg/ml。
[0040]
本发明还提供了上述塞来昔布乳状注射液的制备方法,所述制备方法包括以下步骤:
[0041]
(1)取塞来昔布溶解于预热后的油相介质中,得到油相;将注射用水加热后,加入乳化剂、稳定剂、渗透压调节剂、抗氧化剂,得到水相;
[0042]
(2)将油相加入水相制备初乳,得到乳白色乳液,即为初乳;
[0043]
(3)调初乳ph至9.0-10.5,将初乳循环交替均质使得物质均匀,得到终乳。
[0044]
进一步地,所述步骤(1)中将油性介质预热至70-80℃,将注射用水加热至70-80℃。
[0045]
进一步地,所述步骤(1)和步骤(2)均在高速剪切条件下进行。
[0046]
更进一步地,所述高速剪切条件为:制备油相时,转速为3000-4000rpm,溶液温度为70-80℃;制备水相时,转速为1000-2000rpm,溶液温度为70-80℃;制备初乳时,转速为3000-4000rpm,溶液温度为70℃-80℃。
[0047]
进一步地,所述循环交替均质的条件为:(a)50-100bar均质一次,150-250bar均质一次;(b)再150-250bar均质一次,600-800bar均质一次;重复(b)2-3次。
[0048]
更进一步地,所述循环交替均质的条件为:(a)80bar均质一次,200bar均质一次;(b)再200bar均质一次,700bar均质一次;重复(b)2-3次。
[0049]
进一步地,所述终乳的ph为7.0-9.5。
[0050]
进一步地,所述制备方法还包括:得到终乳后,进行(4)封口灭菌。
[0051]
更进一步地,步骤(4)中,所述灭菌的条件为116-126℃灭菌10-20min。
[0052]
更进一步地,步骤(4)中,所述灭菌的条件为121℃灭菌15min。
[0053]
有益效果
[0054]
本发明制得的塞来昔布乳状注射液为分布均匀、半透明、不黏稠的乳液,在长期、加速条件下放样的结果显示,经过4-5天,主成分含量稳定,稳定性好,且塞来昔布乳状注射液能够提升塞来昔布在人体内的生物利用度,且成本低廉,工艺简单,适于工业化生产。
具体实施方式
[0055]
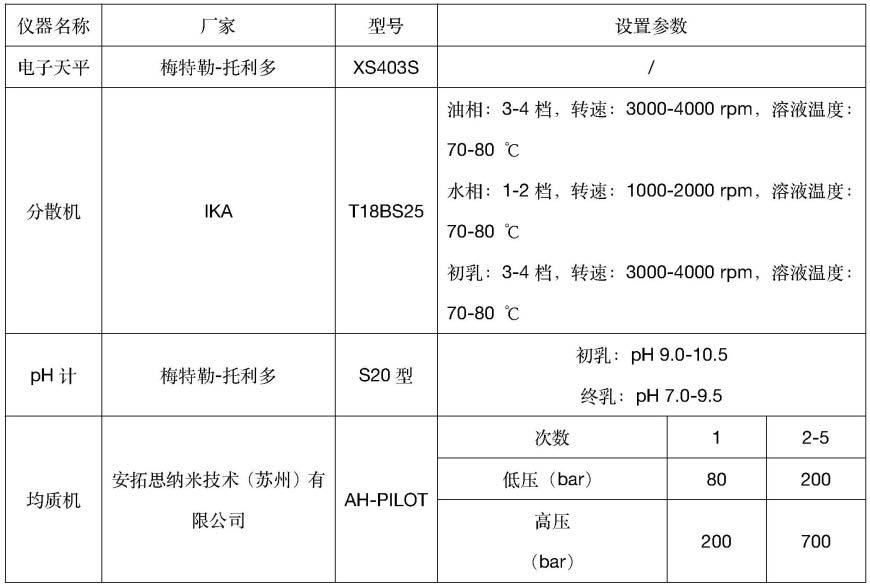
(一)仪器设备(见表1)
[0056]
表1仪器设备
[0057][0058]
(二)实施例中使用的原辅料(见表2)
[0059]
表2实施例中使用的原辅料的作用
[0060][0061][0062]
(三)塞来昔布乳状注射液的制备方法
[0063]
(1)预先将油相介质加热至70-80℃,取塞来昔布溶解于预热后的油相介质中,得到油相;将注射用水加热至70-80℃,加入乳化剂、稳定剂、渗透压调节剂、抗氧化剂,得到水相;
[0064]
(2)将油相缓慢加入水相制备初乳,得到乳白色乳液,即为初乳;所述步骤(1)和步骤(2)均在高速剪切条件下进行;所述高速剪切条件为:制备油相时,转速为3000-4000rpm,溶液温度为70-80℃;制备水相时,转速为1000-2000rpm,溶液温度为70-80℃;制备初乳时,转速为3000-4000rpm,溶液温度为70℃-80℃;
[0065]
(3)调初乳ph至9.0-10.5,在高压均质机中高低压循环交替均质4-5次,得到乳白色乳液,即为终乳灌装入注射用容器中;所述高低压循环交替均质的条件为:(a)80bar均质一次,200bar均质一次;(b)再200bar均质一次,700bar均质一次;重复(b)2-3次;
[0066]
(4)封口,121℃灭菌15min。
[0067]
(四)塞来昔布乳状注射液中有关物质的检测方法
[0068]
色谱柱:以苯基键合硅胶为填充剂;
[0069]
流动相:以0.02mol/l磷酸盐溶液(称取约2.7g磷酸二氢钾,加水溶解并稀释至1000ml,用磷酸调节ph值至3.0)为流动相a;以甲醇-乙腈(30:10)为流动相b,按表3进行梯度洗脱;
[0070]
表3梯度洗脱条件
[0071]
时间(分钟)流动相a(%)流动相b(%)0.0604020.0406030.0307040.0604050.06040
[0072]
流速:每分钟1ml;
[0073]
柱温:60℃;
[0074]
检测波长:215nm;
[0075]
进样量:10μl;
[0076]
供试品溶液浓度:1.0mg/ml。
[0077]
以下实施例中提及的“室温”指代20-25℃。
[0078]
下面结合实施例对本发明作进一步说明,实施例用于描述本发明的一些具体实施方案,而非用于限制本发明的保护范围。
[0079]
实施例1大豆油作为油相介质时对注射液性能的影响
[0080]
1.1一种塞来昔布乳状注射液,处方如下:
[0081][0082]
上述处方以大豆油为油相介质,塞来昔布含量为10mg/ml。
[0083]
按上述处方配制塞来昔布乳状注射液,终乳配制完成后未灭菌,分装入50ml西林瓶中常温储存。1天后观察到瓶底有白色糊状物沉积,剧烈振摇后消失,静置4小时后又有糊状物沉积在底部。
[0084]
1.2一种塞来昔布乳状注射液,处方如下:
[0085][0086]
上述处方以大豆油为油相介质,塞来昔布含量为50mg/ml。
[0087]
按上述处方配制塞来昔布乳状注射液,初乳有白色颗粒物挂壁,均质初期有沉淀,多次后沉淀消失,分装入50ml西林瓶中常温储存。静置3小时后有白色糊状物沉积在瓶底。
[0088]
1.3一种塞来昔布乳状注射液,处方如下:
[0089][0090][0091]
上述处方以大豆油为油相介质,油相占比30%(m/v)。
[0092]
按上述处方配制塞来昔布乳状注射液,终乳均匀无沉积。有关物质检测结果如表4所示,高温(40℃、60℃)、光照条件下放样2天后,主峰峰面积显著减小,说明注射液中主成分含量显著减少,稳定性差。
[0093]
表4实施例1中1.3有关物质检测结果
[0094] 第0天(初始)主峰峰面积第1天主峰峰面积第2天主峰峰面积终乳30178.2714//终乳(60℃)/17910.86910532.3198终乳(40℃)/13486.536811713.0890终乳(光照)/16595.320611072.3638
[0095]
1.4一种塞来昔布乳状注射液,处方如下:
[0096][0097]
上述处方以20%的大豆油与甘油三酸酯(m/v,大豆油与甘油三酸酯的质量比为1:1)为油相介质。
[0098]
按上述处方配制塞来昔布乳状注射液,初乳停止分散后立刻分层,高压均质后不分层。样品在室温和影响因素条件下放样4天,出现颗粒状固体挂壁现象。有关物质检测结果如表5所示,高温(40℃、60℃)、光照条件下放样4天后,主峰峰面积显著减小,说明注射液中主成分含量显著减少,稳定性差。
[0099]
表5实施例1中1.4有关物质检测结果
[0100] 第0天(初始)主峰峰面积第4天主峰峰面积终乳46389.4250/终乳/17763.7699终乳(60℃)/24012.1706终乳(40℃)/16021.1392终乳(光照)/19460.2880
[0101]
1.1-1.4说明,以大豆油为油相介质时,制备的塞来昔布制剂的溶解性及其检测结果均未达到预期。
[0102]
1.5塞来昔布在不同油溶液中的溶解度测试
[0103]
1.5.1芝麻油、蓖麻油、中链甘油三酸酯、单亚油酸甘油酯
[0104]
称取塞来昔布原料药10mg于2ml离心管(ep管)中,加入不同的油溶液,在震荡机中水浴70-80℃振摇,每5分钟,将ep管拿出摇晃后观察性状,结果如表6所示。
[0105]
表6塞来昔布在芝麻油、蓖麻油、中链甘油三酸酯、单亚油酸甘油酯中的溶解度测试
[0106][0107]
注:a表示“未溶解,摇晃后未有明显变化,api聚集在ep管底部”;
[0108]
b表示“未溶解,摇晃后api分散在溶剂中,静置后api聚集在ep管底部”;
[0109]
c表示“部分溶解,摇晃后可见api固体变少,静置后api聚集在ep管底部”;
[0110]
d表示“完全溶解,未见明显固体颗粒,静置未见固体在在ep管底部聚集”。
[0111]
结果显示,蓖麻油的流动性不好,塞来昔布在其中完全不溶解,在单亚油酸甘油酯中溶解,但溶解所需时间较长,在中链甘油三酸酯中的溶解性最好,溶解时间最短,故油相介质采用中链甘油三酸酯。
[0112]
现有文献资料中常用中链甘油三酸酯与大豆油联合作为油相介质,因此我们按照油相介质占比20%(中链甘油三酸酯与大豆油等质量添加)进行实验(具体见1.4)。实验发现,这种油相配比方式在制备初乳时会产生油水相分层的结果,后续尝试了中链甘油三酸酯和大豆油的多种其他配比方式(1:9、2:8),结果显示无论哪种配比都会导致初乳分层,因此油相介质单采用中链甘油三酸酯。
[0113]
1.5.2花生油、玉米油
[0114]
称取塞来昔布原料药8mg于ep管中,加入不同的油溶液,在超声仪中水浴70-80℃超声,每5分钟,将ep管拿出摇晃后观察性状。在离心机中5000rpm离心5min后观察性状,结果如表7所示,塞来昔布在花生油、玉米油中的溶解性均不好。
[0115]
表7塞来昔布在花生油、玉米油中的溶解度测试
[0116][0117]
1.5中分别以芝麻油、蓖麻油、中链甘油三酸酯等不同油溶液为溶剂,溶解塞来昔布,发现塞来昔布在中链甘油三酸酯中的溶解效果最好,在其他油溶液中的溶解效果较差,因此后续将油性介质更换为中链甘油三酸酯。
[0118]
对比例将蛋黄卵磷脂加在油相中对注射液性状的影响
[0119]
按照如下处方制备塞来昔布注射液:
[0120][0121][0122]
制备时,将蛋黄卵磷脂与塞来昔布先后加在预热后的油相介质而非水相中,其余制备过程同“(三)塞来昔布乳状注射液的制备方法”一致。实验发现,初乳70-80℃高速分散时,快速形成膏状物,无法用于注射。
[0123]
实施例2不添加抗氧化剂、ph调节剂对注射液性能的影响
[0124]
2.1一种塞来昔布乳状注射液,处方如下:
[0125][0126]
上述处方以甘油三酸酯(20%,m/v)为油相介质,塞来昔布含量为8mg/ml,考虑到减少处方组成,因此删去了处方中的依地酸二钠。
[0127]
按上述处方配制塞来昔布乳状注射液,高压均质后乳液流动性好,121℃灭菌15分钟后,未见溶液分层。放样长期(25℃
±
2℃/60rh%
±
5rh%)、加速(40℃
±
2℃/75rh%
±
5rh%)试验考察稳定性,在长期和加速条件下放样6天,出现颗粒状固体挂壁现象。有关物质检测结果如表8所示,在长期和加速条件下放样6天后,主峰峰面积减小,说明注射液液体中主成分含量减少,且灭菌后的终乳主峰峰面积最小,说明灭菌后的终乳主成分含量减少最多,相对于未灭菌的终乳,稳定性更差。
[0128]
表8实施例2中2.1有关物质检测结果
[0129]
[0130][0131]
2.2一种塞来昔布乳状注射液,处方如下:
[0132][0133]
上述处方以甘油三酸酯(20%,m/v)为油相介质,塞来昔布含量为10mg/ml。
[0134]
实验现象结果:按上述处方配制塞来昔布乳状注射液,高压均质后乳液流动性好,121℃灭菌15分钟,未见溶液分层。放样长期(25℃
±
2℃/60rh%
±
5rh%)、加速(40℃
±
2℃/75rh%
±
5rh%)试验考察稳定性,在长期和加速条件下放样5天,出现有颗粒状固体挂壁现象。有关物质检测结果如表9所示,在长期和加速条件下放样5天,主峰峰面积减小,说明注射液液体中主成分含量减少,且加速条件下相对于长期条件下,样品稳定性更差。
[0135]
表9实施例2中2.2有关物质检测结果
[0136] 第0天(初始)主峰峰面积第5天主峰峰面积终乳37696.1806/终乳灭菌39141.6191/终乳灭菌(25℃)/32374.6933终乳灭菌(40℃)/27801.6555
[0137]
2.3一种塞来昔布乳状注射液,处方如下:
[0138][0139]
上述处方以甘油三酸酯(20%,m/v)为油相介质,塞来昔布含量为9mg/ml。
[0140]
实验现象结果:按上述处方配制塞来昔布乳状注射液,高压均质后乳液流动性好,121℃灭菌15分钟,未见溶液分层。放样长期(25℃
±
2℃/60rh%
±
5rh%)、加速(40℃
±
2℃/75rh%
±
5rh%)试验考察稳定性,在长期和加速条件下放样4天,出现有颗粒状固体挂壁现象。有关物质检测结果如表10所示,在长期和加速条件放样4天,主峰峰面积减小,说明注射液液体中主成分含量减少,且加速条件下相对于长期条件下,样品稳定性更差。
[0141]
表10实施例2中2.3有关物质检测结果
[0142] 第0天(初始)主峰峰面积第4天主峰峰面积终乳灭菌35224.2918/终乳灭菌(25℃)/33546.1042终乳灭菌(40℃)/26194.8342
[0143]
实施例2在稳定性试验过程中发现样品出现由乳白色变为乳黄色的现象。
[0144]
实施例3添加抗氧化剂、ph调节剂对注射液性能的影响
[0145]
3.1一种塞来昔布乳状注射液,处方如下:
[0146][0147]
上述处方以甘油三酸酯(20%,m/v)为油相介质,塞来昔布含量为8mg/ml,终乳灭菌前ph 8.5,灭菌后ph 8.0。
[0148]
实验现象结果:按上述处方配制塞来昔布乳状注射液,高压均质后乳液流动性好,121℃灭菌15分钟,未见溶液分层。放样冷藏(2℃-8℃)、长期(25℃
±
2℃/60rh%
±
5rh%)、加速(40℃
±
2℃/75rh%
±
5rh%)试验考察稳定性,有关物质检测结果如表11所示,在影响因素条件下放样5天后,主峰峰面积未发生显著变化,且不同影响因素条件下主峰峰面积相差较小。且样品经过ph调节后,在长期和加速条件下放样5天,溶液颜色不发生变化。
[0149]
表11实施例3中3.1有关物质检测结果
[0150][0151]
3.2一种塞来昔布乳状注射液,处方如下:
[0152][0153]
上述处方以甘油三酸酯(20%,m/v)为油相介质,塞来昔布含量为8mg/ml,终乳灭菌前ph 7.79,灭菌后ph 7.30。
[0154]
实验现象结果:按上述处方配制塞来昔布乳状注射液,高压均质后乳液流动性好,121℃灭菌15分钟,未见溶液分层。放样长期(25℃
±
2℃/60rh%
±
5rh%)、加速(40℃
±
2℃/75rh%
±
5rh%)试验考察稳定性。有关物质检测结果如表12所示,在影响因素条件下放样4天后,主峰峰面积未发生显著变化,且不同影响因素条件下主峰峰面积相差较小。且样品经过ph调节后,在长期和加速条件下放样4天,溶液颜色不发生变化。
[0155]
表12实施例3中3.1有关物质检测结果
[0156] 第0天(初始)主峰峰面积第4天主峰峰面积终乳未灭菌36514.8082/终乳灭菌36972.0794/终乳灭菌(25℃)/35080.9617终乳灭菌(40℃)/35937.4042
[0157]
综上所述,使用实施例3的处方制备得到的塞来昔布乳状注射液分布均匀、半透明、不黏稠,适于注射。放样长期(25℃
±
2℃/60rh%
±
5rh%)、加速(40℃
±
2℃/75rh%
±
5rh%)试验结果显示,经过4-5天,其主峰峰面积未发生显著变化,稳定性好。该塞来昔布乳状注射液能够提升塞来昔布在人体内的生物利用度,且成本低廉,工艺简单,适于工业化生产。
[0158]
应当说明的是,以上所述仅为本发明的较佳实施例而已,并不用于限制本发明的范围,凡在本发明的精神和原则之内所作出的任何修改、等同的替换和改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1