组织工程软骨-骨复合体及其构建方法与应用
1.本发明涉及组织工程与再生医学领域,尤其是涉及一种组织工程软骨-骨复合体及其构建方法与应用。
背景技术:
2.临床上,关节软骨损伤通常伴有软骨下骨损伤,例如骨性关节炎(oa)不仅是关节软骨发生退行性变,软骨下骨也会发生变化。通常地,骨的自我修复能力较好,软骨由于组织结构简单,无血管神经长入,自身修复能力有限。常见的骨软骨复合缺损包括膝(髋)关节、肩胛骨、颌关节髁突的损伤,这类损伤都面临着软骨-骨组织一体化再生难题。近年来,组织工程理念的兴起为软骨-骨复合体的构建提供了全新的思路。简而言之,组织工程是通过应用工程学和生命科学的原理和技术,研究、开发用于修复、维护、促进人体各种组织或器官损伤后的功能和形态替代物的新兴学科。作为新一代组织工程支架材料,水凝胶以其高度含水、合适的力学强度,被认为是最理想的组织再生材料。目前,应用水凝胶材料构建双层软骨-骨复合支架的纯材料修复,或者混合自体细胞直接进行骨软骨复合缺损修复已有报道。但是,纯材料修复往往依靠有限的内源性细胞,无法解决大尺寸缺损的修复问题;混合细胞直接修复也存在一定的局限性,例如细胞存活率低,组织稳定性差,材料降解速率与组织再生速率不匹配等。
技术实现要素:
3.基于目前纯材料修复及混合细胞直接修复存在的缺陷,本发明提供一种组织工程软骨-骨复合体及其构建方法与应用。
4.本发明的目的可以通过以下技术方案来实现:
5.本发明的第一个目的是,提供一种组织工程软骨-骨复合体的构建方法。
6.本发明所述组织工程软骨-骨复合体的构建方法:
7.将具有成软骨分化潜力的细胞包裹于水凝胶材料内,构建软骨相材料;
8.将具有成骨分化潜力的细胞包裹于水凝胶材料内,构建骨相材料;
9.将软骨相材料和骨相材料组合成软骨-骨一体化结构;
10.通过一定的培养方式对软骨-骨一体化结构培养一段时间,即可获得成熟的组织工程软骨-骨复合体。
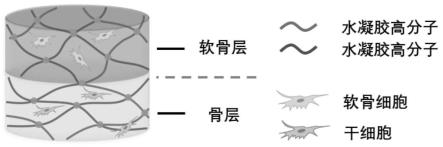
11.本发明提供的组织工程软骨-骨复合体的构建方法示意图如1所示。
12.在本发明的一个实施方式中,所述成软骨分化潜力的细胞选自软骨细胞、间充质干细胞、脂肪干细胞或胚胎干细胞等。
13.在本发明的一个实施方式中,所述成软骨分化潜力的细胞优选为软骨细胞或间充质干细胞。
14.在本发明的一个实施方式中,所述软骨细胞选自透明软骨细胞、纤维软骨细胞或弹性软骨细胞。
15.在本发明的一个实施方式中,所述成骨分化潜力的细胞选自成骨细胞、间充质干细胞、脂肪干细胞或胚胎干细胞等。
16.在本发明的一个实施方式中,所述成骨分化潜力的细胞优选为成骨细胞或间充质干细胞。
17.在本发明的一个实施方式中,所述水凝胶材料是由水溶性高分子通过物理交联或化学交联或光交联的一种或多种交联方式,或单一交联方式的多种材料组合交联形成。
18.在本发明的一个实施方式中,所述水溶性高分子选自天然高分子材料或合成高分子材料。
19.在本发明的一个实施方式中,所述天然高分子材料包括天然多糖类物质及其修饰物或降解物,蛋白及其修饰物或降解物。
20.在本发明的一个实施方式中,所述天然多糖类物质包括透明质酸、羧甲基纤维素、甲基纤维素、羟乙基纤维素、羟丙基纤维素、海藻酸、葡聚糖、琼脂糖、肝素、硫酸软骨素、乙二醇壳聚糖、丙二醇壳聚糖、壳聚糖乳酸盐、羧甲基壳聚糖或壳聚糖季铵盐。
21.在本发明的一个实施方式中,所述蛋白包括各种亲水或水溶性动植物蛋白、胶原蛋白、血清蛋白、丝素蛋白、弹性蛋白。
22.在本发明的一个实施方式中,所述蛋白降解物包括明胶或多肽。
23.在本发明的一个实施方式中,所述合成高分子材料包括两臂或多臂聚乙二醇、聚乙烯亚胺、树枝体、合成多肽、聚赖氨酸、聚谷氨酸、聚丙烯酸、聚甲基丙烯酸、聚丙烯酸酯、聚甲基丙烯酸酯、聚丙烯酰胺、聚甲基丙烯酰胺、聚乙烯醇、聚乙烯吡咯烷酮。
24.在本发明的一个实施方式中,所述水凝胶材料优选为天然多糖类或蛋白类高分子,进一步优选为透明质酸、明胶。
25.所述水凝胶材料可以是由单一交联方式形成的水凝胶材料,称为单网络水凝胶;或者是由两种或两种以上交联方式形成的水凝胶材料,称为互穿网络水凝胶,或双网络水凝胶;或者是由同一交联方式的多种材料复合交联而成,称为复合交联水凝胶。
26.在本发明的一个实施方式中,所述水凝胶材料优选为光交联水凝胶材料,进一步优选为复合光交联水凝胶材料。
27.其中,物理交联是通过高分子链间的缠结或非共价键交联(参考文献xiangyu liang,pingguo duan,jingming gao,et al.acs biomater.sci.eng.2018,4,3506.)。化学交联是通过高分子链间的共价键交联(参考文献luping cao,bin cao,chengjiao lu,et al.j.mater.chem.b 2015,3,1268.)。光交联是通过发生光化学反应形成共价键交联(参考文献huitang xia,dandan zhao,hailin zhu,et al.acs appl.mater.interfaces 2018,10,31704.)。
28.在本发明的一个实施方式中,物理交联构建的水凝胶材料涉及的物理交联反应包括热缩合(温敏性):聚异丙基丙烯酰胺(pnipaam)、嵌段共聚物(peo-ppo-peo、plga-peg-plga、peg-plla-peg、pcl-peg-pcl等);自组装作用:亲疏水作用、氢键作用、主客体相互作用;离子交联:海藻酸与钙离子;静电相互作用:壳聚糖与磷酸类物质。
29.在本发明的一个实施方式中,物理交联水凝胶采用海藻酸与钙离子的交联,即海藻酸与钙离子通过络合作用交联制备水凝胶,即海藻酸水凝胶。所述海藻酸水凝胶可实现的实施方式:将海藻酸高分子溶于生物相容性介质,配成一定浓度的水凝胶前体溶液,加入
一定量的钙离子溶液搅拌均匀后,即可获得物理交联的海藻酸水凝胶。
30.在本发明的一个实施方式中,化学交联构建的水凝胶材料涉及的化学交联反应包括巯基-迈克尔加成反应、酰胺缩合反应、席夫碱反应等。
31.在本发明的一个实施方式中,化学交联水凝胶采用席夫碱反应制备,即含醛基的高分子衍生物与含氨基的高分子衍生物通过席夫碱反应交联制备水凝胶。所述席夫碱水凝胶可实现的实施方式:将含醛基的高分子衍生物和含氨基的高分子衍生物分别溶于生物相容性介质,配成一定浓度的水凝胶前体溶液,混合均匀后,即可获得化学交联的席夫碱水凝胶。
32.所述含醛基的高分子衍生物的制备方法为邻二醇氧化法,即利用高碘酸钠氧化含邻二醇结构的高分子衍生物得到醛基官能团(参考文献brendan p.purcell,david lobb,jason a.burdick,et al.nat.mater.2014,13,653.)。所述含醛基的高分子衍生物可实现的实施方式:将含有邻二醇结构的水溶性高分子衍生物于蒸馏水中溶解,加入一定量的高碘酸钠,室温下搅拌反应5-12h,加入乙二醇淬灭反应。然后将反应液倒入透析袋中透析2-3d,然后冷冻干燥,即可得到所述的含醛基的高分子衍生物。反应中,水溶性高分子中的邻二醇结构与高碘酸钠的摩尔比优选为1:0.1-2;高分子溶液的质量浓度优选为1.0%-10%w/v。
33.所述含醛基的高分子衍生物的制备方法中,含有邻二醇结构的水溶性高分子衍生物可以为多糖类(如葡聚糖、透明质酸、羧甲基纤维素、海藻酸、硫酸软骨素等),优选为透明质酸、硫酸软骨素。
34.所述含胺基的高分子衍生物可以是天然含胺基多糖类亲水或水溶性高分子及其修饰物或降解物(如乙二醇壳聚糖、丙二醇壳聚糖、壳聚糖乳酸盐、羧甲基壳聚糖、壳寡糖等);也可以是生物或经微生物表达后提取的蛋白及其改性物或降解物(如胶原,血清蛋白及明胶等)。优选为明胶、羧甲基壳聚糖。
35.在本发明的一个实施方式中,所述水凝胶材料选择为光交联水凝胶材料时,光交联构建的水凝胶材料是通过光引发聚合交联反应制备,即光引发剂在光源照射下生成的自由基,引发含甲基丙烯酸酯基的高分子衍生物上双键官能团的聚合反应,从而制备光交联水凝胶。
36.在本发明的一个实施方式中,所述光交联水凝胶可实现的实施方式:将含甲基丙烯酸酯基的高分子和光引发剂溶于生物相容性介质,配成一定浓度的水凝胶前体溶液,在一定波长的光源照射下,即可获得光交联水凝胶。
37.在本发明的一个实施方式中,所述由单一交联方式的多种材料组合交联构建的水凝胶可实现的实施方式:将多种含甲基丙烯酸酯基的高分子和光引发剂溶于生物相容性介质,配成一定浓度的水凝胶前体溶液,在一定波长的光源照射下实现光交联,即可获得复合光交联水凝胶。所述多种含甲基丙烯酸酯基的高分子优选为甲基丙烯酸酯化明胶(gelma)和甲基丙烯酸酯化透明质酸(hama)的复合光交联水凝胶材料。
38.上述光交联水凝胶可实现的实施方式中,用于构建光交联水凝胶材料的光引发剂可以选用i 2959(2-羟基-4'-(2-羟乙氧基)-2-甲基苯丙酮)或lap(苯基-2,4,6-三甲基苯甲酰基膦酸锂)。
39.在本发明的一个实施方式中,所述生物相容性介质选自蒸馏水、生理盐水、缓冲液
或细胞培养基溶液。根据不同的应用,可选取不同的生物相容性介质。
40.在本发明的一个实施方式中,所述一定浓度的水凝胶前体溶液可以为0.1%w/v-60%w/v,优选为1%w/v-20%w/v。
41.在本发明的一个实施方式中,所述一定波长的光源为254nm-450nm,优选为365nm或405nm。
42.在本发明的一个实施方式中,所述水凝胶材料可选自以下结构式
ⅰ‑
1~式
ⅰ‑
7中的结构:
[0043][0044][0045]
其中,n≥2。
[0046]
式
ⅰ‑
1为丙烯酸酯修饰的葡聚糖衍生物;式
ⅰ‑
2为丙烯酸酯修饰的羧甲基壳聚糖衍生物;式
ⅰ‑
3为丙烯酸酯修饰的透明质酸衍生物;式
ⅰ‑
4为丙烯酸酯修饰的羧甲基纤维素衍生物;式
ⅰ‑
5为丙烯酸酯修饰的海藻酸衍生物;式
ⅰ‑
6为丙烯酸酯修饰的硫酸软骨素衍生物;式
ⅰ‑
7为丙烯酸酯修饰的明胶衍生物。
[0047]
在本发明的一个实施方式中,所述软骨相水凝胶和骨相水凝胶可以是同种水凝胶材料,也可以是不同种水凝胶材料。
[0048]
在本发明的一个实施方式中,所述组合成软骨-骨一体化结构的方法是通过软骨相材料和骨相材料间的交联反应而实现的。具体实施方式是首先将具有成骨分化潜力的细胞包裹于水凝胶前体溶液内,并将该骨相水凝胶前体溶液置于模具中,交联形成骨相水凝胶材料;将具有成软骨分化潜力的细胞包裹于水凝胶前体溶液内,将该软骨相水凝胶前体溶液置于预先形成的骨相材料上,交联形成软骨相水凝胶材料。由于骨相表面剩余的活性官能团能够参与软骨相水凝胶的交联反应,使得两相间能够形成一体化结构。
[0049]
也可以先将具有成软骨分化潜力的细胞包裹于水凝胶前体溶液内,并将该软骨相水凝胶前体溶液置于模具中,交联形成软骨相水凝胶材料;将具有成骨分化潜力的细胞包裹于水凝胶前体溶液内,再将该骨相水凝胶前体溶液置于预先形成的软骨相材料上,交联形成骨相水凝胶材料。由于软骨相表面剩余的活性官能团能够参与骨相水凝胶的交联反应,使得两相间能够形成一体化结构。
[0050]
在光交联水凝胶可实现的实施方式中,两相间的结合是通过光引发自由基聚合反应实现的。具体实施方式是首先将负载具有成骨分化潜力细胞的光交联水凝胶前体溶液置于模具中,光照形成骨相水凝胶材料,进而将负载具有成软骨分化潜力细胞的光交联水凝胶前体溶液置于预先形成的骨相水凝胶材料上,光照形成软骨相水凝胶材料,从而构建软骨-骨一体化结构。
[0051]
也可以首先将负载具有成软骨分化潜力细胞的光交联水凝胶前体溶液置于模具中,光照形成软骨相水凝胶材料,进而将负载具有成骨分化潜力细胞的光交联水凝胶前体溶液置于预先形成的软骨相水凝胶材料上,光照形成骨相水凝胶材料,从而构建软骨-骨一体化结构。
[0052]
在本发明的一个实施方式中,所述培养方式包括:体外诱导分化、培养;或体内皮下植入培养,或体外/体内联合培养方式。
[0053]
在本发明的一个实施方式中,所述体外诱导分化、培养方式可以为静态培养或动态培养,静态培养方式即将包裹细胞的水凝胶放置于培养皿中培养,动态培养方式即将包裹细胞的水凝胶放置于生物反应器中搅拌或加压培养,以促进水凝胶中的营养物质交换。
[0054]
在本发明的一个实施方式中,所述体内皮下植入培养是将经过所述体外诱导分化、培养后获得的组织工程骨植入动物体的皮下培养。所述动物体可以为裸鼠、sd大鼠、兔子、羊、狗、猪,优选为裸鼠、羊。
[0055]
在本发明的一个实施方式中,所述体外/体内联合培养方式是首先在体外诱导培养成相对成熟的软骨-骨复合体(col2,aggrecan,sox9软骨相关基因达到正常软骨组织的10%-30%;alp,runx2,col1骨相关基因达到正常骨组织基因水平的10%-30%),然后植入皮下进一步培养为成熟的软骨-骨复合体(col2,aggrecan,sox9软骨相关基因达到正常软骨组织的80%-100%;alp,runx2,col1骨相关基因达到正常骨组织基因水平的80%-100%)。
[0056]
在本发明的一个实施方式中,所述培养时间为1周-24周,优选为4周-8周。
[0057]
本发明中,所述成熟的组织工程软骨-骨复合体,包括以下生物学与组织学特征:1)软骨相的dna、gags、胶原含量,以及骨相的dna、胶原、钙盐含量基本达到正常组织水平
(软骨相的dna含量约50-100ng/mg,gags约30-70mg/g,胶原含量约2-8mg/g;骨相的dna含量约50-100ng/mg,胶原含量约占总质量的25%-35%,钙盐含量约占总质量的65%-75%);2)生物力学强度基本达到软骨-骨组织的正常水平(软骨相的弹性模量大于1mpa;骨相的弹性模量大于5mpa);3)软骨相具有清晰的软骨陷窝结构,以及gags和二型胶原的软骨特异性表达;4)骨相具有清晰的骨小梁结构,以及masson和lap的成骨特异性表达。
[0058]
组织工程软骨-骨复合体构建的原理:水凝胶材料给细胞提供三维的培养环境,结合相应的培养方式(体外生物反应器培养或体内皮下植入培养),能够有效改善水凝胶内的营养物质交换,为细胞构建合适的三维培养体系。经过一段时间培养,成软骨分化潜力的细胞逐渐分化、增殖为成熟的成软骨细胞,成骨分化潜力的细胞逐渐分化、增殖为成熟的成骨细胞,并且分泌出丰富的细胞外基质,最终形成成熟的软骨-骨复合体。因此,运用本发明提供的构建方法基本可以通过任何水凝胶材料通过分别包裹具有成软骨/骨分化潜力的细胞培养出成熟的组织工程软骨-骨复合体。
[0059]
本发明的第二个目的是,提供基于上述构建方法获得的组织工程软骨-骨复合体。
[0060]
本发明的第三个目的是,提供组织工程软骨-骨复合体的应用。
[0061]
本发明提供了组织工程软骨-骨复合体在骨软骨复合缺损修复与再生领域的应用。
[0062]
具体而言,所述组织工程软骨-骨复合体在制备骨软骨复合缺损修复与再生材料上的应用。
[0063]
其中,骨软骨复合缺损包括膝关节、髋关节、肩胛骨、颌关节髁突的损伤。
[0064]
本发明结合组织工程的理念,应用水凝胶预先构建负载细胞的软骨-骨复合体,并通过体外或体内培养后形成较为成熟、稳定的组织工程软骨-骨,再应用于骨软骨复合缺损的修复。
[0065]
本发明结合水凝胶支架材料分层设计并构建软骨相和骨相,同时负载软骨细胞或干细胞,经体外诱导分化、培养,或体内皮下植入培养方式,即可获得成熟的组织工程软骨-骨复合体,可以应用于涉及骨软骨复合缺损的组织修复与再生领域。组织工程软骨-骨复合体的构建将有效解决临床上供体不足、修复效果不理想等问题,为骨软骨复合缺损修复提供全新的治疗方式。
[0066]
与现有技术相比,本发明具有如下创新点:
[0067]
(1)本发明提供的组织工程软骨-骨复合体是通过水凝胶材料来实现的,能够更好地模拟组织生长的微环境。水凝胶材料给细胞提供三维的培养环境,结合相应的培养方式(体外生物反应器培养或体内皮下植入培养),能够有效改善水凝胶内的营养物质交换,为细胞构建合适的三维培养体系,更加契合组织再生的微环境。
[0068]
(2)经体外或体内诱导培养后,组织工程软骨-骨复合体具备一定的力学强度、清晰的生物学结构、以及成熟的组织学特征。
[0069]
(3)本发明提供的组织工程软骨-骨复合体具有成熟、稳定的组织学特性,能够有效解决纯材料修复内源性细胞不足,以及混合细胞直接修复的细胞存活率低、组织稳定性差等问题。与传统的修复方式相比,组织工程软骨-骨复合体经体外或体内培养后,已经获得成熟的组织结构,可直接用于组织修复,无需依赖外加细胞促进修复效果。
附图说明
[0070]
图1为组织工程软骨-骨复合体的构建方法示意图。
[0071]
图2为组织工程软骨-骨复合体构建的直观图。
[0072]
图3为组织工程软骨-骨复合体培养8周的大体观图。
[0073]
图4为组织工程软骨-骨复合体培养8周的组织学图。
[0074]
图5为组织工程软骨-骨复合体修复骨软骨复合缺损的直观图。
[0075]
图6为组织工程软骨-骨复合体修复骨软骨复合缺损的组织学图。
具体实施方式
[0076]
以下用实施例对本发明作更详细的描述。下面结合附图以及实施例对本发明作进一步描述,但这些实施例仅仅是对本发明最佳实施方式的描述,并不对本发明的范围有任何限制。本领域技术人员在不背离本发明精神和保护范围的情况下作出的其它任何变化和修改,仍包括在本发明保护范围之内。
[0077]
实施例一:明胶/透明质酸复合光交联水凝胶材料(gelma/hama)的制备
[0078]
甲基丙烯酸酯化明胶(gelma)的合成:将明胶(1g)溶于10ml pbs(ph=7.4)中,加热至50℃搅拌至完全溶解,加入0.5ml甲基丙烯酸酐,反应2-3h,反应后用40ml pbs稀释反应液,然后倒入透析袋(mwco 7000)中,用去离子水透析2-3d,冷冻干燥即可得到甲基丙烯酸酯化明胶(0.9g)。根据核磁氢谱图,可计算出双键的含量大约为75%。
[0079][0080]
甲基丙烯酸酯化透明质酸(hama)的合成:将透明质酸(1g,340kda)溶于100ml去离子水,冷却至0-4℃,加入5ml甲基丙烯酸酐,再缓慢滴加5ml 5m naoh,反应24h,然后将反应液倒入透析袋(mwco 7000)中,用去离子水透析2-3d,冷冻干燥即可得到甲基丙烯酸酯化透明质酸(0.9g)。根据核磁氢谱图,可计算出双键的含量大约为60%。
[0081][0082]
明胶/透明质酸光交联水凝胶(gelma/hama)的制备:称取0.05g gelma,0.02g hama和2mg lap溶于1ml pbs溶液(ph=7.4)中,在37℃下配成5%gelma/2%hama/0.2%lap的水凝胶前体溶液,在365nm波长的光源照射下实现光交联,即可获得gelma/hama水凝胶材料。
[0083]
实施例二:氧化透明质酸/壳聚糖席夫碱水凝胶(hao/cs)的制备
[0084]
氧化透明质酸的合成:将透明质酸(2g,340kda)溶于100ml蒸馏水中至完全溶解,将高碘酸钠(naio4,1g)溶于5ml蒸馏水中,然后缓慢滴加上述溶液,于室温下搅拌反应12h。反应结束后,滴加1ml乙二醇继续搅拌30min,然后将反应液倒入透析袋(mwco 7000)中,用去离子水透析2-3d,冷冻干燥即可得到hao(1.82g)。根据盐酸羟胺滴定法,可以计算出醛基的含量大约为35%。
[0085][0086]
其中,n≥2.
[0087]
氧化透明质酸/壳聚糖席夫碱水凝胶(hao/cs)的制备:分别称取0.1g hao和0.1g cs高分子溶于1ml pbs溶液(ph=7.4)中,配成10%hao和10%cs水凝胶前体溶液,以1:1的体积比混合,灌注于预制的模具中,待反应5min后,即可制备5%hao/5%cs水凝胶。
[0088]
实施例三:海藻酸/明胶复合交联水凝胶(alg/gelma)的制备
[0089]
海藻酸/明胶复合交联水凝胶(alg/gelma)的制备:称取0.02g alg,0.05g gelma和2mg lap溶于1ml pbs溶液(ph=7.4)中,在37℃下配成2%alg/5%gelma/0.2%lap的水凝胶前体溶液,灌注于预制的模具中,在365nm波长的光源照射下实现光交联。将成型的水凝胶从模具中取出,浸泡于0.1m cacl2中,待物理交联2h后,即可获得复合交联的水凝胶材料。
[0090]
实施例四:组织工程软骨-骨复合体的构建
[0091]
从兔子耳朵处提取耳软骨,髂骨处抽取骨髓,常规分离培养扩增软骨细胞、以及bmscs。将10
×
106/ml软骨细胞包裹于由实施例一制备的复合光交联水凝胶前体溶液(5%gelma/2%hama),以及将10
×
106/ml bmscs包裹于由实施例一制备的复合光交联水凝胶前体溶液(5%gelma/2%hama)。然后,逐步光交联形成软骨-骨一体化组织结构(具体操作方法:首先将骨相水凝胶前体溶液置于模具中,光照交联形成骨相水凝胶,继而将软骨相水凝胶前体溶液置于骨相水凝胶上,光照交联形成软骨相水凝胶,从而构建软骨-骨一体化结构),植入裸鼠皮下进行培养(图2)。4周及8周后取材,观察体内复合组织的大体观、组织学、成软骨及成骨的各项定性定量指标,并观察软骨相和骨相的界面情况。实验结果表明,大体观上可以观察到明显的软骨相和骨相界线,具有明显的生物学结构(图3)。生物力学强度基本达到软骨-骨组织的正常水平(软骨相的弹性模量为5mpa;骨相的弹性模量为15mpa)。组织学上,软骨相具有清晰的软骨陷窝结构,以及gags和二型胶原的软骨特异性表达;骨相具有清晰的骨小梁结构,以及masson和lap的成骨特异性表达(图4)。
[0092]
实施例五:组织工程软骨-骨复合体的构建
[0093]
从兔子耳朵处提取耳软骨,髂骨处抽取骨髓,常规分离培养扩增软骨细胞、以及bmscs。将10
×
106/ml软骨细胞包裹于由实施例一制备的氧化透明质酸/壳聚糖席夫碱水凝胶前体溶液(5%hao/5%cs),以及将10
×
106/ml bmscs包裹于由实施例三制备的海藻酸/明胶复合交联水凝胶前体溶液(2%alg/5%gelma)。然后通过逐步交联形成软骨-骨一体化组织结构(具体操作方法:首先将骨相水凝胶前体溶液置于模具中,交联形成骨相水凝胶,继而将软骨相水凝胶前体溶液置于骨相水凝胶上,交联形成软骨相水凝胶,从而构建软骨-骨一体化结构),放入生物反应器中进行动态培养。4周及8周后取材,观察体内复合组织的大体观、组织学、成软骨及成骨的各项定性定量指标,并观察软骨相和骨相的界面情况。实验结构表明,大体观上可以观察到明显的软骨相和骨相界线,具有明显的生物学结构。生物力学强度基本达到软骨-骨组织的正常水平(软骨相的弹性模量为2mpa;骨相的弹性模量为12mpa)。组织学上,软骨相具有清晰的软骨陷窝结构,以及gags和二型胶原的软骨特异性表达;骨相具有清晰的骨小梁结构,以及masson和lap的成骨特异性表达
[0094]
实施例六:组织工程软骨-骨复合体应用于骨软骨复合缺损修复
[0095]
采用新西兰雄性大白兔,在兔子膝关节滑车部位制造直径为4mm、深3mm的关节软骨-骨复合缺损模型。实验中,分为两组进行兔子关节骨软骨复合缺损的修复实验:1.组织工程软骨-骨复合体修复组;2.不做处理的空白组。在实验中,首先按上述实施例四构建组织工程软骨-骨复合体,然后填充至缺损部位(图5)。在手术6周、12周后,通过静脉注射空气的方法处死实验中的兔子,并提取损伤关节对实验修复效果进行评价。实验结果表明,组织工程软骨-骨复合体能够有效实现骨软骨复合缺损修复(图6)。
[0096]
上述的对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1