一种仿生型“三明治”结构人工骨膜及其制备方法与流程
1.本发明涉及一种仿生型“三明治”结构人工骨膜及其制备方法,骨缺损修复再生研究领域。
背景技术:
2.目前,临床治疗中常采用骨膜移植术来补充缺失的骨膜。骨膜移植技术包括自体骨膜移植、异体骨膜移植和人工骨膜移植。自体骨膜移植存在二次损伤、供区骨膜不足以及引发并发症等问题;而异体骨膜又存在较大的病原体携带及免疫排斥风险等问题。因此,研发能够替代人体自身骨膜的新型人工骨膜具有十分重要的意义。
3.迄今为止尚未有“人工骨膜”产品用于临床,现有研究中用于替代人自体骨膜的物质主要包括细胞片层类、脱细胞支架类和人工合成支架类骨膜材料。细胞片层类人工骨膜主要通过体外培养目标细胞获得,以此模拟骨膜组织无疑是一种简单便捷的方式,但纯细胞片层转移至体内时操作难度大,且植入后细胞容易松散流失,因此可行性及预期效果均较差。有学者将两层细胞片层包覆在β
‑
tcp(β
‑
磷酸三钙)支架表面,使细胞片层有所依附的同时模拟骨膜的细胞构成(dan zhang,peng gao,qin li,et al.engineering biomimetic periosteum with β
‑
tcp scaffolds to promote bone formation in calvarial defects of rats.stem cell research&therapy,2017,8:134.)。但这种方法不能防止细胞片层在体内溃散,也不能阻隔组织的纤维细胞长入支架中。脱细胞支架类人工骨膜能够最大程度保留天然结构特征,但仍存在发生免疫排斥反应的风险,且其来源有限。因此,关于人工合成支架材料的研究日益增多。合成支架类材料来源丰富,获取方便,同时免疫排斥反应发生率低。但单纯支架材料的作用仅限于物理隔离和作为细胞爬行支架,缺乏生物学功能。有学者将静电纺丝纤维支架与添加无机纳米颗粒的水凝胶相结合制备复合材料,也能产生一定的促成骨效应(gaojie yang,haoming liu,yi cui,et al.bioinspired membrane provides periosteum
‑
mimetic microenvironment for accelerating vascularized bone regeneration.biomaterials,2020,268:120561.)。但这种方法因缺乏细胞成分,不能充分模拟骨膜的生物结构,因此也缺乏相应的生物功能。还有学者在静电纺丝pcl膜上接种bmscs,形成组织工程骨膜,达到促进骨修复的效果(tao wang,yuankun zhai,marc nuzzo,et al.layer
‑
by
‑
layer nanofiber
‑
enabled engineering of biomimetic periosteum for bone repair and reconstruction.biomaterials,2018,182:279
–
288.)。但这种方法包含的细胞种类单一,不能模拟骨膜不同分层的细胞结构。因此,需要提供一种能够最大程度地模拟天然骨膜的生物结构,在达到物理隔离和作为细胞粘附迁移支架的同时,充分发挥多种细胞的生物学功能的仿生型人工骨膜。
技术实现要素:
4.本发明的目的是提供一种仿生型“三明治”结构人工骨膜,由纳米纤维膜与含多种细胞的细胞片层组装得到,具体通过不同纤维膜层与不同细胞片层之间的组装,从而实现
模拟天然骨膜中不同的功能层区。
5.本发明所提供的仿生人工骨膜,包括纤维层电纺膜和生发层电纺膜;
6.所述纤维层电纺膜和所述生发层电纺膜之间铺设下述至少一种细胞片层,形成三明治结构:
7.成骨细胞前体细胞片层、间充质干细胞片层和血管内皮细胞片层;
8.所述细胞片层至少为一层;
9.所述纤维层电纺膜为以可降解高分子材料和天然高分子材料为基体材料经纺丝得到的纳米纤维膜;
10.所述生发层电纺膜为以天然高分子材料或所述天然高分子材料与可降解高分子材料的复合物为基体材料经纺丝得到的纳米纤维膜。
11.上述的仿生人工骨膜中,所述纤维层电纺膜中纤维的直径为0.15~4μm;
12.所述纤维层电纺膜的孔径为0.3~6μm,孔隙率为22~85%;
13.所述纤维层电纺膜的厚度约为100~650μm。
14.上述的仿生人工骨膜中,所述生发层电纺丝膜中纤维的直径为0.05~3μm;
15.所述生发层电纺膜的孔径为0.2~5μm,孔隙率为28~90%;
16.所述生发层电纺膜的厚度约为40~350μm。
17.上述的仿生人工骨膜中,所述可降解高分子材料可为聚酯;
18.所述聚酯可为聚己内酯、聚氨酯、聚乳酸、聚乳酸
‑
羟基乙酸共聚物和左旋聚乳酸中至少一种;
19.所述天然高分子材料可为胶原、明胶和壳聚糖中至少一种。
20.上述的仿生人工骨膜中,所述成骨细胞前体细胞片层具体可为mc3t3
‑
e1细胞片层;
21.所述间充质干细胞片层具体可为bmsc细胞片层;
22.所述血管内皮细胞片层具体可为vec细胞片层。
23.本发明进一步提供了所述仿生人工骨膜的制备方法,包括如下步骤:
24.s1、利用静电纺丝法分别制备所述纤维层电纺膜和所述生发层电纺膜;
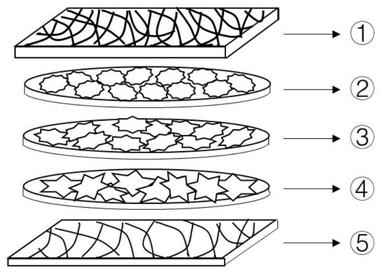
25.s2、制备所述成骨细胞前体细胞片层、所述间充质干细胞片层和所述血管内皮细胞片层中至少一种;
26.s3、在所述纤维层电纺膜与所述生发层电纺膜之间组装所述成骨细胞前体细胞片层、所述间充质干细胞片层和所述血管内皮细胞片层中至少一种。
27.上述的制备方法中,步骤s1中,制备所述纤维层电纺膜时的纺丝条件如下:
28.纺丝溶液中,所述可降解高分子材料的质量百分含量为2~18%,所述天然高分子材料的质量百分含量为0.4~10%;
29.纺丝电压为15~30kv,接收距离为7~15cm,注射速度为0.5~1.5ml/h;
30.利用紫外/钴60照射或环氧乙烷灭菌后备用。
31.上述的制备方法中,步骤s1中,制备所述生发层电纺膜时的纺丝条件如下:
32.纺丝溶液中,所述可降解高分子材料的质量百分含量为0~10%,所述天然高分子材料的质量百分含量为2~20%;
33.纺丝电压为20~30kv,接收距离为7~15cm,注射速度为0.3~1.5ml/h;
34.步骤s1还包括对所述生发层电纺膜进行交联的步骤,采用戊二醛蒸汽或碳二亚胺进行所述交联;
35.利用紫外/钴60照射或环氧乙烷灭菌后备用。
36.上述的制备方法中,步骤s2中,采用下述1)或2)的方式制备所述成骨细胞前体细胞片层、所述间充质干细胞片层和所述血管内皮细胞片层:
37.1)将细胞接种于细胞培养板中,在完全培养基中进行培养,所述完全培养基中添加维生素c;
38.所述完全培养基可α
‑
mem完全培养基、低糖dmem完全培养基或ecm完全培养基;
39.2)将细胞接种于温敏性培养板中,通过降温的方式脱落细胞片层。
40.上述的制备方法中,步骤s3中,采用下述a)或b)的方式组装所述成骨细胞前体细胞片层、所述间充质干细胞片层和/或所述血管内皮细胞片层
41.a)将所述成骨细胞前体细胞片层、所述间充质干细胞片层和/或所述血管内皮细胞片层层层铺设于所述纤维层电纺膜或所述生发层电纺丝膜上;
42.b)在温敏性培养板中采用转移膜将所述成骨细胞前体细胞片层、所述间充质干细胞片层和/或所述血管内皮细胞片层转移至所述纤维层电纺膜或所述生发层电纺丝膜上,然后层层组装。
43.现有技术中,通过可降解高分子膜材料替代骨膜促进骨缺损修复的机理主要是依赖膜引导组织/骨再生技术原理。虽然将膜覆盖于骨缺损区,既可阻止非成骨性细胞向缺损区侵入、创造修复局部微环境,促使骨生成细胞优先迁移到缺损区进行增殖与分化,又能够阻隔微生物侵入,达到减少感染等并发症的目的;以及膜引导组织再生技术能够促进颌面、颅骨和长管状骨缺损的修复。然而,这类膜材料基本只具有隔离组织细胞及引导骨再生的作用,本身不具备成骨及成血管的诱导活性。
44.现有技术中,将成骨、成血管的诱导物质(蛋白、小分子药物)加入膜中,以期能够进一步赋予膜骨诱导功能,从而进一步模拟天然骨膜的功效。但由于骨再生的周期较长,即使尝试采用各种缓释技术,始终无法使诱导物质达到长效释放的效果。此外,该方法还会带来新的问题,如外源性的诱导因子容易扩散到缺损部位周围的软组织中,从而导致异位骨化等问题发生。因此,单纯依靠材料学手段制备骨膜替代物具有难以逾越的瓶颈。
45.现有技术中有将细胞片层作为骨膜替代物的相关研究。由于细胞片层可来源于自体细胞,因此不会带来一般植入材料引发的排异反应。此外,片层中的细胞能够受缺损部位释放的多种生物因子影响,被适应性原位诱导分化成所在部位组织细胞。但是,首先由于细胞片层强度非常低,转移及使用过程中易破碎,因此限制了其实际应用;其次,片层中的细胞未固定,植入后容易迁移扩散,因此无法保证片层在植入部位精准发挥其原位分化及组织修复的功能,细胞利用率过低。
46.本发明克服了上述技术缺陷,具体体现在如下方面:
47.本发明利用纳米纤维膜与细胞片层复合,不但能够提高细胞片层的强度,满足缝合等手术操作的需求,而且能利用纳米纤维膜的细胞屏蔽作用,将细胞固定在纤维膜之间,从而有效防止植入体内后细胞扩散,有效提高细胞利用率。而通过纤维层对于不同细胞片层的隔离,可实现模拟人体骨膜组织不同的功能层区。此外,还可以推测:与直接在膜上种植细胞相比,将细胞片层与膜复合能够将二维平面培养拓展为三维立体培养,从而更有利
于增加承载细胞的数量,增加组织修复效率。通过选择不同的纺丝基体材料及过程工艺参数,获得纤维直径、孔径及孔隙率不同的纳米纤维膜,从而达到模拟天然骨膜中“生发层”及“致密层”中的不同纤维结构的目的;利用细胞片层技术,制备出模拟天然骨膜不同功能层中细胞构成的组合型多细胞片层;通过不同纤维膜层与不同细胞片层之间的组装,从而实现模拟天然骨膜中不同的功能层区,最终构建出具有“三明治型”仿生结构和功能的人工骨膜。
附图说明
48.图1为本发明仿生型“三明治型”人工骨膜的结构示意图,图中,
①
表示纤维层电纺膜;
②
表示vec片层;
③
表示bmsc片层;
④
表示mc3t3
‑
e1片层;
⑤
表示生发层电纺膜。
49.图2为本发明人工骨膜修复大鼠颅骨缺损后的骨密度。
50.图3为本发明人工骨膜修复大鼠颅骨缺损后的骨重。
具体实施方式
51.下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
52.下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
53.实施例1、仿生型“三明治”结构人工骨膜的制备
54.(一)纤维层电纺膜的制备
55.1.用移液器吸取20ml六氟异丙醇加入50ml锥形瓶中;
56.2.称取0.85g plga,加入上述溶剂中,在磁力搅拌器上搅拌8h使其溶解;
57.3.称取0.15g胶原,加入上述溶液体系中,继续在磁力搅拌器上搅拌4h,使plga和胶原完全溶解并形成均质溶液,其中,plga的质量含量为4.25%,胶原的质量含量为0.75%;
58.4.使用6ml注射器吸取6ml制备好的纺丝溶液,并将注射器、连通管和喷头安装在仪器的正确位置上,将纺丝参数调节电压为22kv,接收距离为15cm,注射速度为1.0ml/h,连续纺丝4h后停止,得到的纤维层电纺膜中纤维的直径为0.45μm左右,纤维层电纺膜的孔径为1.02μm左右,孔隙率为61%左右,厚度为552.39μm左右。
59.5.将纳米纤维膜根据实际需求进行裁剪,利用紫外/钴60照射或环氧乙烷灭菌后备用。
60.(二)生发层电纺膜的制备
61.1.用移液器吸取18ml六氟异丙醇和2ml冰乙酸加入50ml锥形瓶中;
62.2.称取0.3g壳聚糖,加入上述溶剂体系中,在磁力搅拌器上搅拌12h,以充分溶解壳聚糖;
63.3.称取0.9g明胶,加入上述溶液体系中,再向其中加入200μl吐温
‑
80溶液,继续在磁力搅拌器上混合12h,以溶解明胶并使明胶/壳聚糖纺丝溶液混匀,其中,明胶的质量含量为4.5%,壳聚糖的质量含量为1.5%;
64.4.使用6ml注射器吸取6ml制备好的纺丝溶液,并将注射器、连通管和喷头安装在仪器的正确位置上,将纺丝参数调节电压为28kv,接收距离为15cm,注射速度为1.0ml/h,连续纺丝2h后停止。
65.5.明胶/壳聚糖复合纳米纤维膜经真空干燥过夜后,放置在干燥器皿的多孔支架上,将10ml浓度为25%的戊二醛水溶液放入10cm培养皿中,再将培养皿放入干燥器皿底部,通过戊二醛蒸汽的挥发对纤维进行交联,并控制不同的交联时间。得到的生发层电纺膜中纤维的直径为0.21μm左右,生发层电纺膜的孔径为0.56μm左右,孔隙率为73%左右,厚度为284.98μm左右。
66.6.交联结束后,先将纤维放置在通风橱中2h,再放入真空干燥箱,尽量除去未交联的残余戊二醛。
67.7.将纤维膜根据实际需要进行裁剪,利用紫外/钴60照射或环氧乙烷灭菌后备用。
68.(三)成骨前体细胞(mc3t3
‑
e1)片层的制备
69.采用温敏性培养板制备细胞片层:
70.将mc3t3
‑
e1细胞分散于含10%fbs和1%青
‑
链
‑
两性霉素b的α
‑
mem培养基中,然后以5
×
104cells/ml的密度接种于温敏性6孔培养板中,在5%co2、37℃培养箱中培养7天,每3天更换一次培养基。待细胞融合≥90%时,将培养板置于20℃培养环境中,约10~20分钟后,孔内细胞即可脱落形成片层。然后将细胞片层转移至纤维膜上。
71.(四)间充质干细胞(bmsc)片层的制备
72.采用维生素c诱导法制备bmsc片层:
73.将bmsc细胞分散于含10%fbs和1%青
‑
链
‑
两性霉素b的低糖dmem培养基中,然后以1
×
105cells/ml的密度接种于6孔培养板中,待细胞达到融合后,将培养基换成含50mg/ml维生素c的高糖dmem培养基,继续在5%co2、37℃培养箱中培养7天。最后,用镊子将细胞片层揭下来,转移至纤维膜上。
74.(五)血管内皮细胞(vec)片层制备
75.采用温敏性培养板制备细胞片层:
76.将血管内皮细胞分散于含10%fbs和1%青
‑
链
‑
两性霉素b的ecm培养基中,然后以1
×
105cells/ml的密度接种于温敏性6孔培养板中,在5%co2、37℃培养箱中培养7天,每3天更换一次培养基。待细胞融合≥90%时,将培养板置于20℃培养环境中,约10
‑
20分钟后,孔内细胞即可脱落形成片层。然后将细胞片层转移至纤维膜上。
77.(六)纤维膜与细胞片层的组合
78.首先将形成的mc3t3
‑
e1细胞片层(一层或多层)转移至纤维层电纺膜上,再在其上铺一层或多层bmsc片层,然后在其上继续铺一层或多层vec片层,最后将生发层纤维膜覆盖在上面,如此便可形成两层纤维膜中间夹多层细胞片层的“三明治”人工骨膜结构,示意图如图1所示,图中,
②③④
可一种或几种组合,每种片层的顺序、层数均不限。
79.将本实施例制备的人工骨膜用于骨膜缺损修复:
80.以大鼠颅骨缺损模型为例,将骨膜覆盖于缺损区域,在植入后2周、4周和8周时,分别取材观察颅骨修复情况。缺损部位骨密度及新骨形成结果(骨重)分别如图2和图3所示(*p<0.05,与对照组相比)。
81.其中,细胞片层组采用的是骨膜包括3层bmsc片层;纤维膜组采用的骨膜包括一层纤维层电纺膜和一层生发层电纺膜;人工骨膜组采用的骨膜包括一层纤维膜电纺膜、3层bmsc片层和一层生发层电纺膜;以空白模型组为对照。
82.大鼠颅骨缺损模型的构建方法如下:
83.采用2%戊巴比妥钠40mg/kg腹腔注射麻醉,将大鼠俯卧位固定于操作台上,头部备皮,碘伏消毒。于正中切开皮肤约1~1.5cm,用直径5mm的钻头在颅骨上造成直径为5mm的圆形全层骨缺损,但不损伤硬脑膜。将细胞片层或电纺膜或人工骨膜覆盖到缺损处,缝合皮肤层,关闭切口。
84.具体修复效果如下:
85.1、术后2、4、8周时,细胞片层组缺损处骨密度均与对照组(空白模型组)相差无异;术后2周时,纤维膜组缺损处骨密度与对照组基本相同,而人工骨膜组缺损处骨密度约为对照组的1.6倍,差异有统计学意义;术后4周时,纤维膜组骨密度约为对照组的1.5倍,人工骨膜组缺损处骨密度约为对照组的1.9倍,差异均有统计学意义;术后8周时,纤维膜组骨密度约为对照组的1.3倍,人工骨膜组缺损处骨密度约为对照组的1.7倍,差异均有统计学意义。如图2所示。
86.2、术后2、4、8周时,细胞片层组缺损处新生骨量稍高于对照组(空白模型组),但无统计学差异;术后2周和4周时,与对照组相比,纤维膜组新生骨量稍增加,但差异均无统计学意义,而人工骨膜组新生骨量分别增加12%和13%,差异均有统计学意义;术后8周时,与对照组相比,纤维膜组新生骨量增加14%,人工骨膜组新生骨量增加28%,差异均有统计学意义。如图3所示。
87.上述结果表明,本发明人工骨膜能够明显促进骨再生,达到改善大鼠颅骨缺损修复的效果。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1