包含花鲈干扰素IFNd及其受体的抗病毒组合物及应用的制作方法
包含花鲈干扰素ifnd及其受体的抗病毒组合物及应用
技术领域
1.本发明涉及干扰素及其受体的应用,具体涉及包含花鲈干扰素ifnd及其受体的抗病毒组合物及应用。
技术背景
2.花鲈(lateorax maculatus)是我国重要海水经济鱼类,其养殖周期短、生长速度快、肉质鲜美、营养丰富,年生产量超过16万吨,位居海水养殖鱼类第二位。随着集约化、高密度养殖模式推广,鱼类病毒性疾病严重影响花鲈养殖业的发展。
3.干扰素(interferon,ifn)是一类具有抗病毒活性的ii类α
‑
螺旋细胞因子家族,通过诱导大量的ifn刺激因子(isgs)在各种细胞反应过程中发挥多种作用,其中在机体抗病毒反应中尤为重要。机体在受到病毒感染后,产生i型干扰素,并通过诱导一组具有调节或抗病毒功能的isgs来改变反应细胞,从而诱导细胞进入抗病毒状态。根据半胱氨酸数量和系统发育关系,i型ifns被明确分为i组和ii组,其中i组有2个半胱氨酸,ii组4个半胱氨酸,并进一步分别分为a、d、e、h和b、c、f等亚组。大多数鱼类的i型ifn包含a、c和d三个亚群,最近发现的一种ifnh,仅见于鲈形目。干扰素需通过与细胞膜上的干扰素受体结合,方能向下传递信号。在哺乳动物中,i型ifn介导的信号通路的启动依赖于i型ifn及其由 ifnar1和ifnar2组成的异二聚体受体复合物之间的相互作用。ifnar1被认为是低亲和力的受体链,包含四个fniii胞外区结构域和一个较短的胞质区结构域,而高亲和力受体链 ifnar2包含两个fniii胞外区结构域和一个较长的胞内区结构。ifnar1和ifnar2都属于 ii类细胞因子受体家族,在鱼类中被比较免疫学家称为鱼类细胞因子受体家族b(crfb)。全基因组序列分析显示,斑马鱼和河豚中至少存在17个crfb成员。在系统发育上,crfb1 和crfb2可能是哺乳动物ifnar2的同源基因,crfb5可能是哺乳动物ifnar1的同源基因。斑马鱼中两个i组ifn,分别为ifna和ifnd,它们通过由crfb1和crfb5组成的受体复合物发出信号,而ii组ifn,分类为ifnc,则通过由crfb2和crfb5组成的独特受体复合物发出信号。在花鲈中,i型ifn及其受体的互作方式和功能还不清楚。对花鲈i型干扰素免疫系统的研究有助于提高花鲈病毒性疾病的预防与控制。
技术实现要素:
4.本发明的目的之一是在于提供包含花鲈干扰素ifnd及其受体的抗病毒组合物。
5.具体地,包含花鲈干扰素ifnd及其受体的抗病毒组合物,包含花鲈干扰素ifnd和花鲈 i型干扰素受体,所述花鲈i型干扰素受体为crfb1、crfb2和crfb5中的一种或两种以上。
6.优选地,所述包含花鲈干扰素ifnd及其受体的抗病毒组合物包含花鲈干扰素ifnd、 crfb2和crfb5。
7.更优选地,所述包含花鲈干扰素ifnd及其受体的抗病毒组合物包含花鲈干扰素ifnd、 crfb1和crfb5。
isgs基因的表达量。ifnd表达质粒与pcdna3.1空载体共转染作为对照。
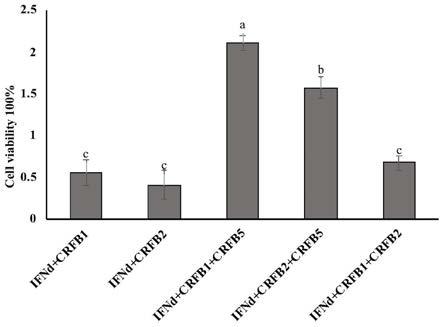
29.图6是ifnd表达质粒与crfb1,crfb2,crfb5不同受体组合共转染进fhm细胞后进行isknv攻毒,fhm细胞的活性检测。a、b、c代表差异显著性(p<0.05)。
具体实施方式
30.以下通过具体实施方式结合附图对本发明的技术方案进行进一步的说明和描述。
31.花鲈i型干扰素受基因crfb1、crfb2和crfb5的cdna,可以通过如下方法制备获得:
32.根据已构建的花鲈cdna文库中细胞因子家族b(crfbs)的est序列,在对目的基因的est序列进行验证后,设计pcr引物,结合race技术克隆分别得到花鲈crfb1、crfb2 和crfb5基因的全编码序列。花鲈crfb1基因cdna全长2730bp,包含172bp的 5’utr(untranslated region)、871bp的3’utr、1587bp的开放阅读框,编码529个氨基酸,预测花鲈crfb1编码蛋白分子量为58.14kd。花鲈crfb2基因orf长1572bp,编码524 个氨基酸,预测花鲈crfb2编码蛋白分子量为56.86kd。花鲈crfb5基因cdna全长1542 bp,包含99bp的5’utr(untranslated region)、171bp的3’utr、1272bp的开放阅读框,编码 424个氨基酸,预测花鲈crfb1编码蛋白分子量为47.21kd。花鲈i型干扰素受体crfb1、 crfb2和crfb5受到病毒刺激后在免疫器官中能诱导表达。
33.以下是lmcrfb1的cdna及氨基酸序列。起始密码子和终止密码子用方框圈出,加粗字体表示预测的信号肽,单划线表示ifn结合区,跨膜区用双划线标出。
34.[0035][0036]
以下是lmcrfb2的cdna及氨基酸序列。起始密码子和终止密码子用方框圈出,加粗字体表示预测的信号肽,单划线表示ifn结合区,跨膜区用双划线标出。
[0037][0038]
以下是lmcrfb5的cdna及氨基酸序列。起始密码子和终止密码子用方框圈出,加粗字体表示预测的信号肽,单划线表示ifn结合区,跨膜区用双划线标出。
[0039][0040]
1.组织总rna的提取和全长cdna模板制备
[0041]
1.1总rna的提取
[0042]
取体质量为20
±
5g,体长15
±
5cm健康鲜活的花鲈在中国水产科学研究院南海水产研究所珠海基地暂养一周(7d),暂养于500l的塑料桶中。每天更换2/3的养殖水。选取5尾健康花鲈,使用50mg/ml的ms222麻醉2min,分别取血细胞、脾脏、头肾、肝脏、鳃、心脏、肌肉、肠、皮肤、胃等组织并立即投入液氮中暂存,随后使用trizol试剂按照说明书提取各个组织的总rna。对提取的总rna进行浓度、纯度及完整性检测,检测合格后冻存于
‑
80℃冰箱中待用。
[0043]
1.2cdna模板制备
[0044]
使用smart 5’race和3’race试剂盒(takara,japan),根据说明书要求取1μg 总
rna在反转录酶的作用下42℃反映1h合成cdna的第一条链,以第一条链为模板,在dna聚合酶和dna连接酶的作用下在模板两端加入接头,最终获得可用于克隆全长cdna的模板。
[0045]
2.花鲈i型干扰素受体基因crfb1、crfb2和crfb5的cdna全序列的克隆
[0046]
2.1核心片段的验证
[0047]
在花鲈转录组数据库中,根据基因注释信息获得crfb1、crfb2和crfb5的拼接序列,根据拼接序列设计特异性引物,引物序列见下表,扩增大小分别为1587bp,1572bp,1272bp。
[0048][0049]
以上述合成的cdna作为模板,以特异性引物进行pcr扩增,反应体系为:cdna模板1μl,10nmol/l的上下游引物各1μl,10mmol/ldntp2μl,10xextaqbuffer2.5μl,超纯水17μl,共25μl。pcr反应条件为:94℃变性3min;94℃高温变性30s,58℃低温退火30s,72℃延伸1min30s,共33个循环;72℃延伸10min;4℃保温。所扩增的pcr产物经1.2%的琼脂糖凝胶电泳检测合格后,从凝胶中纯化回收目的片段的pcr产物。然后将纯化的pcr产物连接到pmd18
‑
t载体中,后转化到大肠杆菌感受态细胞dh
‑
5α中,根据蓝白斑筛选挑取阳性克隆单菌株,在37℃220rpm的细胞培养箱中,摇4h进行扩大培养,提质粒dna,用通用引物m13进行测序。
[0050]
2.2花鲈crfb1,crfb2和crfb5全长cdna的获得
[0051]
根据已得到的cdna片段序列设计特异性引物。利用cdna末端快速扩增(rapidamplificationofcdnaends,race)技术对目的基因的3’末端和5’末端进行pcr扩增。根据序列合成3’/5’race引物见下表:
[0052][0053]
采用上述合成的全长cdna为模板,采用降落式pcr和巢式pcr的方法,按照race5'/3'试剂盒(takara,japan)进行3’racepcr扩增。第一次反应体系为20μl,第一次扩增条件为:95℃预变性3min;94℃变性30s,72℃【
‑
1℃】退火30s,共10个循
环,每个循环的退火温度降低1℃;72℃延伸1.5h;95℃变性30s,65℃退火30s,72℃延伸1.5min,共25个循环;72℃延伸10min;4℃保存。第二次扩增体系为50μl,第二次扩增条件为:95℃预变性3min;95℃变性30s,60℃退火30s,72℃延伸1.5min,共30个循环;72℃延伸 10miin;4℃保存。获得的pcr产物用1.2%琼脂糖凝胶电泳进行分离,从凝胶中纯化回收目的产物,然后将其克隆到pmd18
‑
t载体中,m13进行测序反应获得3’和5’race片段。crfb1 3’utr长871bp,5’utr长172bp拼接后获得全长cdna为2730bp。crfb5 3’utr长171 bp,5’utr长99bp拼接后获得全长cdna为1542bp。
[0054]
2.3花鲈crfb1,crfb2和crfb5的生物信息学分析
[0055]
用blast(http://www.ncbi.nim.nih.gov/)进行同源性分析,结果显示,crfb1基因与鳜鱼、剑旗鱼、大口黑鲈、大黄鱼和荫平鲉等crfb1基因有高度同源性,揭示该基因是crfb1基因。crfb2基因与鳜鱼、鞍带石斑鱼、剑旗鱼、高体鰤射水鱼和大菱鲆等crfb2有高度同源性,揭示该基因是crfb2基因。crfb5基因与鳜鱼、点带石斑鱼、鞍带石斑鱼、大口黑鲈、白梭吻鲈和眼斑鳗狼鱼等crfb5基因有高度同源性,揭示该基因是crfb5基因。经signalip预测lmcrfb1蛋白n端前19个氨基酸(mnclplvvylmllldavhs)为信号肽。胞外域序列包含211个氨基酸,33个氨基酸的跨膜区序列,284个氨基酸的胞内域序列。功能域预测该蛋白前113
‑
212个氨基酸是干扰素结合区域,24
‑
99区域氨基酸和136
‑
200区域氨基酸是fn3蛋白超家族结构域。经signalip预测lmcrfb2蛋白n端前19个氨基酸 (mtaliwmltwlpqvlpavs)为信号肽。前223个氨基酸为胞外域序列,中间有23个氨基酸是跨膜区序列,胞内域序列有277个氨基酸。功能域预测该蛋白前119
‑
216个氨基酸是干扰素结合区域,23
‑
214区域氨基酸是fn3蛋白超家族结构域。经signal预测lmcrfb5蛋白n端前32个氨基酸(mgstwkpvpqkifamsaaflacflsaclqsna)为信号肽。1
‑
249 个氨基酸是胞外域序列,中间32个氨基酸的跨膜区序列,后面151个氨基酸为胞内域序列。功能域预测该蛋白140
‑
244个氨基酸是干扰素结合区域。37
‑
127区域氨基酸和142
‑
232区域氨基酸是fn3蛋白超家族结构域。
[0056]
3.pcr检测花鲈crfb1,crfb2和crfb5基因在花鲈不同组织中的分布
[0057]
分别取花鲈血细胞、脾脏、头肾、肝脏、鳃、心脏、肌肉、肠、皮肤、胃等组织的rna 1μg与反转录oligo
‑
(dt)(50μmol/l)0.5μl和random 6 mers(100μmol/l)0.5μl混合,然后加入5
×
primescript buffer 2μl,反转录酶混合液primescript rt enzyme mix i 0.5μl,加水补齐至10μl。反应过程为37℃15min,85℃5s,稀释10倍后作为模板使用。
[0058]
实时荧光定量pcr使用引物crfb1
‑
qf和crfb1
‑
qr扩增crfb1基因;使用引物 crfb2
‑
qf和crfb2
‑
qr扩增crfb2基因;使用引物crfb5
‑
qf和crfb5
‑
qr扩增crfb5 基因。扩增内参基因18s rna作为内参,以上述合成的cdna作为模板。反应总体系为12.5 μl,含有6.25μl的tb green premix ex taq ii(takara,dalian,china),2μl cdna模板, 0.5μl 10μmol/l的正向和反向引物,以及3.25μl去离子水。pcr反应条件为95℃预变性 30s;94℃变性5s,60℃退火30s,72℃延伸30s,共计40个循环。溶解曲线分析为65
‑
95℃,以确保每个单一产物的扩增。通过2
‑
δδct
方法分析花鲈crfb1,crfb2和crfb5的相对表达水平。结果见图1,可见在被检测的组织中均有表达。其中,crfb1在血细胞中表达量最高,其次是鳃和肠;crfb2在头肾中表达量最高,其次是脾脏和鳃;crfb5在脾脏中表达量最高,其次是头肾和鳃。
[0059]
引物:
[0060]
crfb1
‑
qf:5
’‑
cagcgcactggttgtatgtg
‑3’
;
[0061]
crfb1
‑
qr:5
’‑
tgtgtggctcaaagtccgtt
‑3’
。
[0062]
crfb2
‑
qf:5
’‑
acattaaccttcggcaggca
‑3’
;
[0063]
crfb2
‑
qr:5
’‑
acatctgtgcttaggtgccc
‑3’
。
[0064]
crfb5
‑
qf:5
’‑
gagtgtccagtcacgctacg
‑3’
;
[0065]
crfb5
‑
qr:5
’‑
gatctgccaccacggagtagcggtatc
‑3’
。
[0066]
18s
‑
f:5
’‑
gggtccgaagcgtttact
‑3’
;
[0067]
18s
‑
r:5
’‑
tcacctctagcggcacaa
‑3’
。
[0068]
4.pcr检测花鲈crfb1,crfb2和crfb5mrna在病毒感染下的表达分析
[0069]
向体质量为20
±
5g健康花鲈腹腔注射200μl isknv(2.9
×
10
2 copies/μl)病毒,对照组注射等量pbs,注射后,分别在0h,6h,12h,24h,48h,72h,96h时间点取头肾组织,速冻于液氮中。总rna抽提方法和逆转录方法如前所述。同时选用18s rna作为内参基因,内参基因引物见前述。定量体系以及反应程序见前所述。结果见图2。lmcrfb1和 lmcrfb5在病毒感染后72h表达显著上调,在96h lmcrfb1,lmcrfb2和lmcrfb5的表达量变化依然显著。
[0070]
5.花鲈ifnd及其受体crfb1,crfb2和crfb5重组蛋白的制备
[0071]
以cdna作为模板,利用pcr扩增ifnd及其受体crfb1,crfb2和crfb5的全部开放阅读框,引物前加有酶切位点,pcr引物分别为:
[0072]
rifnd
‑
f:5
’‑
ccggaattcctgagctgcagatggatggatc
‑3’
;
[0073]
rifnd
‑
r:5
’‑
cccaagcttgttggtggtgagtagagatgaaacc
‑3’
。
[0074]
rcrfb1
‑
f:5
’‑
cgcggatccgtgctcggcacccttcct
‑3’
;
[0075]
rcrfb1
‑
r:5
’‑
ccgctcgagagtgaagacacaattccaagtgctt
‑3’
。
[0076]
rcrfb2
‑
f:5
’‑
cgcggatccaaactccttcagcctgtcaacc
‑3’
;
[0077]
rcrfb2
‑
r:5
’‑
ccgctcgagagcgtctgccgtaaagatgc
‑3’
。
[0078]
rcrfb5
‑
f:5
’‑
cgcggatccgtggaagcggagctgcct
‑3’
;
[0079]
rcrfb5
‑
r:5
’‑
ccgctcgagccacggagtagcaccttcgg
‑3’
。
[0080]
pcr反应条件为94℃3min,94℃30s,60℃,30s,72℃,50s,共30个循环。将lmifnd pcr产物克隆到pet21a载体质粒中构成重组质粒pet21a
‑
lmifnd(其中lm指花鲈),将 lmcrfb1,lmcrfb2和lmcrfb5 pcr产物克隆到pgex
‑
4t载体质粒中,构成重组质粒。将重组质粒pet21a
‑
lmifnd,pgex
‑
lmcrfb1,pgex
‑
lmcrfb2和pgex
‑
lmcrfb5转化到大肠杆菌bl21(de3)菌株中。将四种大肠杆菌bl21细胞在含有100μg/ml氨苄青霉素的lb培养基中进行扩大培养。当大肠杆菌bl21细胞溶液的od600达到0.6
‑
0.8之间时,将异丙基
‑
β
‑
d
‑
硫代吡喃半乳糖苷(iptg)以终浓度为0.6mol/l加入lb培养基中,在37℃, 220rpm下诱导表达12h。根据his
‑
binding purification kit说明书(北京康为世纪),通过ni
‑
nta 亲和层析纯化重组lmifnd
‑
his蛋白。通过sds
‑
page和western blot对纯化蛋白进行验证,于22kda左右处有明显条带(图3
‑
1,3
‑
2),使用改良的bca蛋白测定试剂盒(takara)检测lmifnd
‑
his重组蛋白的浓度。后将纯化的lmifnd
‑
his重组蛋白储存在
‑
80℃超低温冰箱中备用。利用beyogold
tm gst
‑
tag purification resin纯化lmcrfb1
‑
gst,lmcrfb2
‑
gst和lmcrfb5
‑
gst重组蛋白,大约分别在49kd,49.9kd,52kd出现一条较粗的条带。 lmcrfb1
‑
gst,lmcrfb2
‑
gst,lmcrfb5
‑
gst三个蛋白的大小均和重组蛋白理论值接近 (图3
‑
3)。
[0081]
5.lmifnd
‑
his蛋白的免疫功能研究
[0082]
5.1lmifnd
‑
his蛋白诱导isgs的表达
[0083]
通过向花鲈腹腔注射lmifnd重组蛋白并在体外用重组蛋白孵育lmb细胞,分别分析 isgs在体内和体外诱导后的表达变化。体外实验:向实验花鲈注射lmifnd
‑
his重组蛋白 (2μg/g),分别在0h,12h,24h,48h,72h,96h取花鲈的头肾和脾脏。每个时间组取五条鱼,以减少个体差异。体内实验:向6孔板中加入终浓度4μg/ml的lmifnd进行诱导处理,对照组加入等体积的dpbs作为对照,所有实验设置3个平行,于28℃中培养。孵育0h,3h, 6h,12h,24h后取样,提取组织和细胞的总rna,通过rt
‑
pcr检测isgs基因表达。结果显示:在体内和体外,lmifnd
‑
his重组蛋白均可激活下游isgs基因的表达(图4
‑
1,4
‑
2)。
[0084]
5.2lmifnd
‑
his重组蛋白抗isknv免疫保护效果分析
[0085]
花鲈脑细胞铺满96孔板,每孔加入100μl10倍稀释浓度梯度的lmifnd蛋白(10
‑1‑
10
‑8),每个浓度3个平行。设置阴性对照组(每孔只加入等量pbs,不加ifnd蛋白)和空白调零对照组(不加细胞,只加等量培养基)。28℃培养12h后,每孔加入100μl isknv病毒稀释液 (1x 10
‑3tcid
50
/ml),28℃继续培养12h后用mtt还原法检测细胞活性。结果显示:随重组蛋白lmifnd
‑
his浓度升高,细胞活性也逐渐升高,表明重组蛋白lmifnd
‑
his对isknv 感染的细胞具有保护作用(图5
‑
1)。为了进一步确定lmifnd重组蛋白对花鲈的免疫保护作用,在花鲈暂养一周后,一组腹腔注射lmifnd重组蛋白(2μg/g),另一组腹腔注射pbs,6 h后,两组均腹腔注射100μl isknv(2.9
×
102copies/μl)病毒,每组30条鱼。分别在攻毒后12h,24h,48h,96h,128h取两组花鲈的头肾组织,用于检测isknv的拷贝数。结果显示:发现lmifnd
‑
his重组蛋白可显著降低头肾组织中isknv病毒的拷贝数(图4
‑
3,4
‑
4)。
[0086]
6.lmifnd与受体的互作和转录调控分析
[0087]
6.1lmifnd与受体的互作
[0088]
为了验证lmifnd是否能在体外与lmcrfb1,lmcrfb2,lmcrfb5的胞外域结合,本实验将lmifnd
‑
his蛋白与三个受体lmcrfb1
‑
gst,lmcrfb2
‑
gst和lmcrfb5
‑
gst 分别进行pull down实验。将100μl crfb1
‑
gst,lmcrfb2
‑
gst和lmcrfb5
‑
gst蛋白分别加到100μl平衡后的gst bead中,gst标签蛋白做为对照。4℃在侧摆摇床缓慢摇动1
‑
2h。 13000g,1min,离心弃上清。pbs洗涤三次。向2ml ep管中加入100μl lmifnd蛋白,吹打重悬。4℃在侧摆摇床缓慢摇动过夜。13000g,1min,弃上清。pbs洗涤三次。向beads 中直接加蛋白上样缓冲液,煮沸,跑sds
‑
page胶。结果显示,在lmcrfb1
‑
gst, lmcrfb2
‑
gst,和lmcrfb5
‑
gst融合蛋白的实验组均可以检测到目的蛋白lmifnd
‑
his,但在gst组(图5
‑
1中a)中没有检测到目的蛋白条带,表明目的蛋白lmifnd
‑
his和 lmcrfb1
‑
gst,lmcrfb2
‑
gst,lmcrfb5
‑
gst三个受体胞外域均可以在体外直接结合(图 5
‑
1)。
[0089]
6.2lmifnd优先受体的使用
[0090]
已经有实验证据表明,i型ifn配体与不同目鱼类的受体之间几乎不存在跨物种反应,例如,鲑科鱼类i型干扰素配体不能在鲤科鱼类的细胞系上发挥作用。然而,主要的i型ifn 受体下游信号通路jak
‑
stat通路在不同鱼类中相对保守,因此我们用鱼类的fhm细胞系来检测花鲈i型ifnd的受体使用情况。我们分别将ifnd,crfb1,crfb2,crfb5的orf 克隆到pcdna3.1
‑
myc
‑
his(
‑
)载体上,然后分别将ifnd配体与不同受体组合一起共转染进 fhm细胞。48h后,收集细胞,检测isgs的表达量变化。结果显示,lmifnd+crfb1+crfb5 组合和lmifnd+crfb2+crfb5组合均可诱导fhm细胞中isgs基因的转录,并且发现 lmifnd+crfb1+
crfb5组合具有更高的诱导效果,表明lmifnd可优先选择crfb1+ crfb5受体复合物组合进行信号传递(图5
‑
2)。可见,本发明提供的抗病毒组合物能够适用于各种鱼类,用以增强抗病毒能力。
[0091]
7.lmifnd与受体的不同组合在抗病毒中的应用
[0092]
基于以上研究结果,我们将ifnd配体与不同受体组合一起共转染进fhm细胞,转染24h 后,吸弃细胞培养液,向细胞中加入isknv病毒(2.6x 10
‑5tcid50/ml))对细胞进行攻毒,病毒孵育1h后,吸弃病毒,用dpbs清洗2次细胞后,添加新鲜细胞培养液,24h后用mtt 还原法检测细胞活性。结果表明,lmifnd+crfb1+crfb5组合和lmifnd+crfb2+ crfb5组和对细胞活性显著高于其他组合(图6)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1