荧光/PET双模态影像探针及其制备方法和应用与流程
荧光/pet双模态影像探针及其制备方法和应用
技术领域
1.本发明涉及生物医学技术领域,尤其是涉及一种荧光/pet双模态影像探针及其制备方法和应用。
背景技术:
2.癌症已经成为危害人类健康的主要杀手。高效治愈癌症的第一步是利用精确的影像技术定位肿瘤的位置,然后才能实施治疗。癌症早期诊断的影像技术包括磁共振(mri)、荧光、pet、ct扫描等。遗憾的是,目前临床上多是采用单一的影像模式寻找可疑的病灶区,无疑存在很多缺陷,导致诊断效果较差,诊断出的癌症患者多数属于中晚期,错过了有效治疗的时期。
3.有鉴于此,特提出本发明以解决上述技术问题中的至少一个。
技术实现要素:
4.本发明的第一目的在于提供一种荧光/pet双模态影像探针,以缓解现有技术中采用单一的影像模式寻找可疑的病灶区所存在诊断效果差等技术问题。
5.本发明的第二目的在于提供上述荧光/pet双模态影像探针的制备方法。
6.本发明的第三目的在于提供上述荧光/pet双模态影像探针的应用。
7.为了实现本发明的上述目的,特采用以下技术方案:
8.本发明提供了一种荧光/pet双模态影像探针,以可降解的空心介孔有机硅作为载体,所述空心介孔有机硅负载荧光素和核素。
9.进一步的,在本发明上述技术方案的基础之上,所述荧光素和核素嫁接在所述空心介孔有机硅上;
10.优选的,所述荧光素包括fitc、cy5.5、ir780或alexa488中的任意一种;
11.优选的,所述核素包括
64
cu、
89
zr、
68
ga或
86
y中的任意一种。
12.进一步的,在本发明上述技术方案的基础之上,所述空心介孔有机硅负载荧光素fitc和核素
64
cu;
13.优选的,所述荧光素fitc和核素
64
cu嫁接在所述空心介孔有机硅上;
14.优选的,所述空心介孔有机硅为含有双硫键的空心介孔有机硅;
15.优选的,所述空心介孔有机硅的水合动力学粒径为175
‑
225nm;
16.优选的,所述空心介孔有机硅负载药物;
17.优选的,所述药物负载在所述空心介孔有机硅的空腔内;
18.优选的,所述药物包括化疗药物;
19.优选的,所述荧光/pet双模态影像探针的粒径为150
‑
200nm。
20.本发明提供了上述荧光/pet双模态影像探针的制备方法,包括以下步骤:
21.将荧光素和核素负载在空心介孔有机硅上,得到荧光/pet双模态影像探针。
22.进一步的,在本发明上述技术方案的基础之上,所述荧光/pet双模态影像探针的
制备方法包括以下步骤:
23.(a)采用氨基硅烷偶联剂对空心介孔有机硅进行改性,得到氨基改性空心介孔有机硅;
24.(b)将氨基改性空心介孔有机硅、荧光素和第一溶剂混合,使进行避光反应,得到荧光素修饰的空心介孔有机硅;
25.(c)将荧光素修饰的空心介孔有机硅、双功能螯合剂p
‑
scn
‑
bn
‑
nota和第二溶剂混合,使进行反应,得到nota/荧光素修饰的空心介孔有机硅;
26.(d)将nota/荧光素修饰的空心介孔有机硅、核素溶液和第三溶剂混合,使进行反应,以使空心介孔有机硅上负载有荧光素和核素,得到荧光/pet双模态影像探针。
27.进一步的,在本发明上述技术方案的基础之上,步骤(a)中,步骤(a)中,所述氨基硅烷偶联剂包括(3
‑
氨丙基)三甲氧基硅烷和/或(3
‑
氨基丙基)三乙氧基硅烷;
28.优选的,所述氨基硅烷偶联剂的质量为空心介孔有机硅质量的0.1
‑
0.5%;
29.优选的,所述空心介孔有机硅的制备方法包括以下步骤:
30.将实心二氧化硅、造孔剂、催化剂和有机硅源反应,得到介孔有机硅包覆的实心二氧化硅,然后采用刻蚀剂对介孔有机硅包覆的实心二氧化硅进行刻蚀,得到空心介孔有机硅;
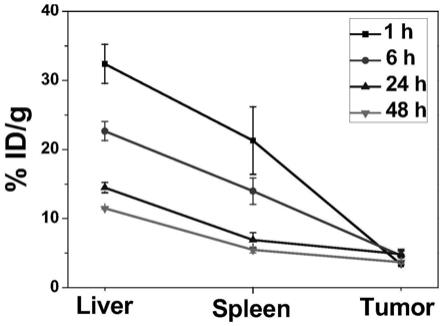
31.优选的,所述造孔剂包括十六烷基三甲基氯化铵和/或十六烷基三甲基溴化铵;
32.优选的,所述催化剂包括三乙醇胺或氨水;
33.优选的,所述有机硅源包括双
‑
[γ
‑
(三乙氧基硅)丙基]
‑
双硫化物和/或双
‑
[γ
‑
(三乙氧基硅)丙基]
‑
四硫化物;
[0034]
优选的,所述刻蚀剂包括氢氟酸、氢氧化钠、碳酸钠或氨水中的任意一种或至少两种的组合。
[0035]
进一步的,在本发明上述技术方案的基础之上,步骤(b)中,氨基改性空心介孔有机硅和荧光素的质量比为(99.0
‑
99.5):(0.5
‑
1.0);
[0036]
优选的,所述第一溶剂包括乙醇;
[0037]
优选的,避光反应的温度为20
‑
30℃,避光反应的时间为12
‑
24h。
[0038]
进一步的,在本发明上述技术方案的基础之上,步骤(c)中,荧光素修饰的空心介孔有机硅和双功能螯合剂p
‑
scn
‑
bn
‑
nota的质量比为(99.5
‑
99.9):(0.1
‑
0.5);
[0039]
优选的,所述第二溶剂包括pbs溶液或生理盐水;
[0040]
优选的,所述第二溶剂的ph值为8
‑
9,优选为8.5;
[0041]
优选的,反应的温度为20
‑
30℃,反应的时间为0.3
‑
1.0h。
[0042]
进一步的,在本发明上述技术方案的基础之上,步骤(d)中,nota/荧光素修饰的空心介孔有机硅和核素溶液的质量比为(99.5
‑
99.9):(0.1
‑
0.5);
[0043]
优选的,所述第三溶剂包括pbs溶液或生理盐水;
[0044]
优选的,所述第三溶剂的ph值为6.0
‑
6.8,优选为6.5;
[0045]
优选的,反应的温度为20
‑
30℃,反应的时间为0.3
‑
1.0h;
[0046]
优选的,使空心介孔有机硅上负载有荧光素和核素之后还包括负载药物的步骤;
[0047]
优选的,负载药物包括以下步骤:使负载有荧光素和核素的空心介孔有机硅形成水溶液后与含药物的水溶液混合,得到荧光/pet双模态影像探针。
[0048]
本发明提供了上述荧光/pet双模态影像探针或采用上述荧光/pet双模态影像探针的制备方法制得的荧光/pet双模态影像探针在制备肿瘤的精确诊断制剂或肿瘤的治疗制剂中的应用。
[0049]
与现有技术相比,本发明的有益效果为:
[0050]
(1)本发明提供了一种荧光/pet双模态影像探针,荧光素和核素同时负载在空心介孔有机硅上,可使得探针兼具荧光成像和pet成像两种成像模态,通过整合上述不同影像模态之间的优势,有利于在细胞和活体水平同时观察定位探针的分布,精确定位肿瘤的位置,有利于肿瘤早期的精确诊断,便于及早实施高效治疗。
[0051]
(2)本发明提供了一种荧光/pet双模态影像探针的制备方法,工艺简单易行、成本低、效率高,所制得的荧光/pet双模态影像探针具有良好的分散性和稳定性,在生物医学影像领域具有重要的研究意义和广阔的应用前景。
[0052]
(3)本发明提供了荧光/pet双模态影像探针的应用,鉴于上述荧光/pet双模态影像探针所具有的优势,使得其在制备肿瘤的精确诊断制剂或肿瘤的治疗制剂领域具有重要的研究意义和广阔的应用前景。
附图说明
[0053]
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0054]
图1为本发明提供的一种实施方式下的空心介孔有机硅hmon的合成示意图;
[0055]
图2为本发明提供的一种实施方式下荧光素fitc修饰的空心介孔有机硅的合成示意图;
[0056]
图3为本发明提供的一种实施方式下荧光/pet双模态影像探针hmon
‑
fitc/
64
cu的合成示意图;
[0057]
图4为本发明实施例1提供的实心二氧化硅sn、介孔有机硅包覆的实心二氧化硅sn@mon和空心介孔有机硅hmon的tem图,其中,图4中a为sn,b为sn@mon,c为hmon;
[0058]
图5为本发明实施例1提供的空心介孔有机硅hmon的水合动力学粒径图;
[0059]
图6为本发明实施例1提供的空心介孔有机硅hmon在还原性溶液(10mm gsh)中第3、7、15、30天的tem图,其中,图6中a为第3天,b为第7天,c为第15天,d为第30天;
[0060]
图7为u87mg细胞与不同浓度的空心介孔有机硅hmon(本发明实施例1)共培养24h后的存活率图;
[0061]
图8为本发明实施例1提供的空心介孔有机硅hmon通过尾静脉注射进入小鼠体内后第30天,小鼠主要器官(心、肝、脾、肺、肾)的h&e染色图;
[0062]
图9为本发明实施例1提供的hmon
‑
fitc与u87mg细胞共培养8h的共聚焦成像图,其中,图9中a为细胞核被dapi染色后发出的蓝光图,b为hmon
‑
fitc发出的绿光图,c为a和b的叠加图;
[0063]
图10为本发明实施例1提供的hmon
‑
fitc/
64
cu通过尾静脉注射进入u87mg荷瘤小鼠不同时间下的pet成像图;
[0064]
图11为图10提供pet成像图对应的hmon
‑
fitc/
64
cu在u87mg荷瘤小鼠的肝、脾、肿瘤部位的分布图。
具体实施方式
[0065]
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。术语“第一”、“第二”等仅用于区分描述,而不能理解为指示或暗示相对重要性。此外,实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
[0066]
荧光成像和pet成像分别适用于细胞和活体水平的影像定位观察,具有很高的灵敏度。其中荧光成像可以用于观察探针在细胞内各细胞器的分布,而pet成像可以用于观察探针在活体内各器官的分布,并且还能定量探针的体分布值。但是目前临床上多是采用单一的影像模式寻找可疑的病灶区,存在诊断效果差等缺点,故提出本发明。
[0067]
根据本发明的第一个方面,提供了一种荧光/pet双模态影像探针,以可降解的空心介孔有机硅(简写hmon)作为载体,hmon负载荧光素和核素。
[0068]
在本发明中,荧光/pet双模态影像探针中的“/”表示“和”的意思,是指该影像探针同时具有荧光成像和pet成像两种成像模态。
[0069]
hmon是指带有空腔结构的介孔有机硅。hmon由于其硅骨架中富含一些生物响应的有机官能团,不仅可以提高其生物相容性,还可以增强其生物可降解性,便于活体代谢排泄,从而有效避免了因长期滞留体内而造成的毒副作用。鉴于hmon所具有的生物可降解性,使得以其作为载体的荧光/pet双模态影像探针具有良好的生物安全性。
[0070]
荧光素可用于荧光成像,而核素可用于pet成像,荧光素和核素同时负载在hmon上,可使得探针兼具荧光成像和pet成像两种成像模态,通过整合上述不同影像模态之间的优势,有利于在细胞和活体水平同时观察定位探针的分布,也有利于肿瘤早期的精确诊断,便于及早实施高效治疗。
[0071]
需要说明的是,荧光素和核素可以装载在hmon的表面和/或者装载在hmon孔道内。
[0072]
作为本发明一种可选实施方式,荧光素和核素嫁接在空心介孔有机硅上。
[0073]
通过一些嫁接方法,可以使得荧光素和核素嫁接在空心介孔有机硅上。
[0074]
荧光素和核素的具体种类可以有多种,作为本发明一种可选实施方式,荧光素包括fitc、cy5.5、ir780或alexa488中的任意一种。
[0075]
作为本发明一种可选实施方式,核素包括
64
cu、
89
zr、
68
ga或
86
y中的任意一种。
[0076]
作为本发明一种优选实施方式,空心介孔有机硅负载荧光素fitc和核素
64
cu,可简写为hmon
‑
fitc/
64
cu。
[0077]
hmon
‑
fitc/
64
cu中的“/”表示“和”的意思,是指hmon同时负载fitc和
64
cu。
[0078]
荧光素fitc可用于荧光成像,而核素
64
cu可用于pet成像,荧光素fitc和核素
64
cu同时负载在hmon上,可使得探针兼具荧光成像和pet成像两种成像模态。
[0079]
需要说明的是,荧光素fitc和核素
64
cu可以装载在hmon的表面和/或者孔道内。
[0080]
作为本发明一种可选实施方式,荧光素fitc和核素
64
cu嫁接在空心介孔有机硅上。
[0081]
作为本发明一种可选实施方式,hmon为含有双硫键的空心介孔有机硅。
[0082]
hmon中双硫键杂化的硅骨架可以在还原性生理环境中坍塌而降解,便于代谢排泄,提高了其生物安全性。
[0083]
作为本发明一种可选实施方式,hmon上还负载有药物,从而实现针对肿瘤的诊疗一体化。药物在hmon上负载的方式有很多,例如,药物可负载在hmon的空腔内。
[0084]
作为本发明一种可选实施方式,hmon的水合动力学粒径为175
‑
225nm。hmon典型但非限制性的水合动力学粒径为175nm、180nm、185nm、190nm、195nm、200nm、205nm、210nm、215nm、220nm或225nm。
[0085]
通过对hmon的水合动力学粒径的进一步限定,使得hmon具有较大的比表面积和内部空腔,便于荧光素和核素的负载。另外,当hmon内部空腔装载药物时,还可以提高药物的装载量。
[0086]
作为本发明一种可选实施方式,药物包括化疗药物,包括但不限于基因药物、免疫药物或光敏剂等。
[0087]
作为本发明一种可选实施方式,荧光/pet双模态影像探针的粒径为150
‑
200nm。荧光/pet双模态影像探针典型但非限制性的粒径为150nm、155nm、160nm、165nm、170nm、175nm、180nm、185nm、190nm、195nm或200nm。
[0088]
根据本发明的第二个方面,还提供了上述荧光/pet双模态影像探针的制备方法,包括以下步骤:
[0089]
将荧光素和核素负载在hmon上,得到荧光/pet双模态影像探针。
[0090]
本发明提供的荧光/pet双模态影像探针的制备方法工艺简单易行、成本低、效率高,所制得的荧光/pet双模态影像探针具有良好的分散性和稳定性,在生物医学影像领域具有重要的研究意义和广阔的应用前景。
[0091]
作为本发明一种可选实施方式,荧光/pet双模态影像探针的制备方法包括以下步骤:
[0092]
(a)采用氨基硅烷偶联剂对空心介孔有机硅进行改性,得到氨基改性空心介孔有机硅;
[0093]
(b)将氨基改性空心介孔有机硅、荧光素和第一溶剂混合,使进行避光反应,得到荧光素修饰的空心介孔有机硅;
[0094]
(c)将荧光素修饰的空心介孔有机硅、双功能螯合剂p
‑
scn
‑
bn
‑
nota和第二溶剂混合,使进行反应,得到nota/荧光素修饰的空心介孔有机硅;
[0095]
(d)将nota/荧光素修饰的空心介孔有机硅、核素溶液和第三溶剂混合,使进行反应,以使空心介孔有机硅上负载有荧光素和核素,得到荧光/pet双模态影像探针。
[0096]
通过上述制备方法的限定,使得所制得的荧光/pet双模态影像探针具有良好的分散性、稳定性以及生物可降解性。
[0097]
需要说明的是,根据荧光/pet双模态影像探针上所需负载的荧光素和核素的种类确定所加入的荧光素和核素溶液的具体种类。
[0098]
当荧光/pet双模态影像探针上负载荧光素fitc和核素
64
cu时,作为本发明一种可选实施方式,荧光/pet双模态影像探针的制备方法包括以下步骤:
[0099]
(a)采用氨基硅烷偶联剂对hmon进行改性,得到氨基改性空心介孔有机硅(简写为hmon
‑
nh2);
[0100]
(b)将hmon
‑
nh2、荧光素fitc和第一溶剂混合,使进行避光反应,得到荧光素fitc修饰的空心介孔有机硅(简写为hmon
‑
fitc);
[0101]
(c)将hmon
‑
fitc、双功能螯合剂p
‑
scn
‑
bn
‑
nota和第二溶剂混合,使进行反应,得到nota/荧光素fitc修饰的空心介孔有机硅(简写为hmon
‑
fitc/nota);
[0102]
(d)将hmon
‑
fitc/nota、
64
cucl2(核素溶液)和第三溶剂混合,使进行反应,以使空心介孔有机硅上负载有荧光素fitc和核素
64
cu,得到荧光/pet双模态影像探针hmon
‑
fitc/
64
cu。
[0103]
通过上述制备方法的限定,使得所制得的hmon
‑
fitc/
64
cu具有良好的分散性、稳定性以及生物可降解性。
[0104]
具体的,步骤(a)中,为了实现荧光素(例如fitc)的负载,故对hmon进行氨基改性。
[0105]
需要说明的是,hmon的来源不作具体限定,可市购也可以通过自行制备得到。
[0106]
作为本发明的一种可选实施方式,hmon的制备方法包括以下步骤:
[0107]
将实心二氧化硅(简写为sn)、造孔剂、催化剂和有机硅源反应,得到介孔有机硅包覆的实心二氧化硅(简写为sn@mon),然后采用刻蚀剂对sn@mon进行刻蚀,得到hmon,合成示意图如图1所示。
[0108]
由于sn与包覆其表面的介孔有机硅存在“结构差异”,故采用刻蚀工艺,选择性刻蚀掉sn内核,制得具有空腔结构的hmon。
[0109]
其中,sn的来源不作具体限定,可市购也可以通过自行制备得到。例如,可采用法制备sn,具体包括以下步骤:在乙醇、超纯水和氨水组成的混合液中,快速滴入正硅酸乙酯(tetraethyl orthosilicate,缩写为teos),然后在30℃水浴中搅拌反应1h,得到sn。
[0110]
造孔剂可使得包覆在sn表面的有机硅形成孔道,从而形成介孔有机硅。作为一种可选实施方式,造孔剂包括十六烷基三甲基氯化铵(n
‑
hexadecyltrimethylammonium chloride,缩写为ctac)和/或十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide,缩写为ctab)。
[0111]
作为一种可选实施方式,催化剂包括三乙醇胺(triethylamine,缩写为tea)或氨水。
[0112]
有机硅源可采用双硫键桥联的有机硅源。作为一种可选实施方式,有机硅源包括双
‑
[γ
‑
(三乙氧基硅)丙基]
‑
双硫化物(4,4,13,13
‑
tetraethoxy
‑
3,14
‑
dioxa
‑
8,9
‑
dithia
‑
4,13
‑
disilahexadecane,缩写为btds)和/或双
‑
[γ
‑
(三乙氧基硅)丙基]
‑
四硫化物。选用上述特定的有机硅源,可使所形成的空心介孔有机硅的硅骨架中掺杂有双硫键,从而提升空心介孔有机硅的生物可降解性。
[0113]
刻蚀剂包括氢氟酸、氢氧化钠、碳酸钠或氨水中的任意一种或至少两种的组合。
[0114]
通过对hmon的制备方法的进一步限定,使得所制得的hmon具有良好的生物相容性和生物可降解性。
[0115]
作为本发明一种可选实施方式,氨基硅烷偶联剂包括(3
‑
氨丙基)三甲氧基硅烷(3
‑
aminopropyltrimethoxysilane,缩写为aptms)和/或(3
‑
氨基丙基)三乙氧基硅烷(3
‑
aminopropyltriethoxysilane,缩写为aptes)。
[0116]
作为本发明一种可选实施方式,氨基硅烷偶联剂的质量为空心介孔有机硅质量的
0.1
‑
0.5%。氨基硅烷偶联剂占空心介孔有机硅质量典型但非限制性的质量分数为0.1%、0.15%、0.2%、0.25%、0.3%、0.35%、0.4%、0.45%或0.5%。
[0117]
通过对氨基硅烷偶联剂种类以及用量的进一步限定,使得荧光素(例如fitc)可通过共价键装载于hmon上,避免脱落。
[0118]
步骤(b)主要将荧光素(例如fitc)引入到hmon
‑
nh2上,得到荧光素修饰的空心介孔有机硅(如荧光素为fitc,空心介孔有机硅可缩写为hmon
‑
fitc),具体合成示意图如图2所示。
[0119]
hmon
‑
nh2和荧光素的相对用量可根据实际需要进行设定。作为本发明一种可选实施方式,步骤(b)中,hmon
‑
nh2和荧光素(例如fitc)的质量比为(99.0
‑
99.5):(0.5
‑
1.0);hmon
‑
nh2和荧光素典型但非限制性的质量比为99:1、99.1:0.9、99.2:0.8、99.3:0.7、99.4:0.6或99.5:0.5。
[0120]
为了实现hmon
‑
nh2和荧光素(例如fitc)的均匀混合,故选用第一溶剂作为混合载体。作为本发明一种可选实施方式,第一溶剂包括乙醇。
[0121]
作为本发明一种可选实施方式,避光反应的温度为20
‑
30℃,避光反应的时间为12
‑
24h。典型但非限制性的避光反应的温度为20℃、22℃、24℃、25℃、26℃、28℃或30℃,典型但非限制性的避光反应的时间为12h、14h、15h、16h、18h、20h、22h或24h。
[0122]
步骤(c)中,双功能螯合剂p
‑
scn
‑
bn
‑
nota是用于螯合核素。
[0123]
作为本发明一种可选实施方式,步骤(c)中,荧光素修饰的空心介孔有机硅和双功能螯合剂p
‑
scn
‑
bn
‑
nota的质量比为(99.5
‑
99.9):(0.1
‑
0.5);荧光素修饰的空心介孔有机硅和双功能螯合剂p
‑
scn
‑
bn
‑
nota典型但非限制性的质量比为99:1、99.1:0.9、99.2:0.8、99.3:0.7、99.4:0.6或99.5:0.5。
[0124]
作为本发明一种可选实施方式,第二溶剂包括pbs溶液或生理盐水。
[0125]
作为本发明一种可选实施方式,第二溶剂的ph值为8
‑
9,优选为8.5。第二溶剂典型但非限制性的ph值为8、8.2、8.5、8.6、8.8或9。
[0126]
通过对第二溶剂的种类以及ph值的具体限定,使得双功能螯合剂p
‑
scn
‑
bn
‑
nota成功修饰于荧光素修饰的空心介孔有机硅上。
[0127]
作为本发明一种可选实施方式,步骤(c)中反应的温度为20
‑
30℃,反应的时间为0.3
‑
1.0h。典型但非限制性的反应的温度为20℃、22℃、24℃、25℃、26℃、28℃或30℃,反应的时间为0.3h、0.5、0.75h或1.0h。
[0128]
步骤(d)则实现了将核素(例如
64
cu)标记到nota/荧光素修饰的空心介孔有机硅上,使得空心介孔有机硅上同时负载荧光素(例如fitc)和核素(例如
64
cu),得到hmon
‑
fitc/
64
cu合成示意图如图3所示。
[0129]
作为本发明一种可选实施方式,根据核素种类的不同,所采用的核素溶液的种类也不同。例如,当核素为
64
cu,其对应的核素溶液可为
64
cucl2;当核素为
68
ga,其对应的核素溶液可为
68
gacl3。
[0130]
作为本发明一种可选实施方式,nota/荧光素修饰的空心介孔有机硅和核素溶液的质量比为(99.5
‑
99.9):(0.1
‑
0.5)。nota/荧光素修饰的空心介孔有机硅和核素溶液典型但非限制性的质量比为99:1、99.1:0.9、99.2:0.8、99.3:0.7、99.4:0.6或99.5:0.5。
[0131]
作为本发明一种可选实施方式,第三溶剂包括pbs溶液或生理盐水。
[0132]
作为本发明一种可选实施方式,第三溶剂的ph值为6.0
‑
6.8,优选为6.5;第三溶剂典型但非限制性的ph值为6.0、6.2、6.5、6.6或6.8。
[0133]
通过对第三溶剂的种类以及ph值的具体限定,使得核素可成功修饰于nota/荧光素修饰的空心介孔有机硅上。
[0134]
作为本发明一种可选实施方式,步骤(d)中反应的温度为20
‑
30℃,反应的时间为0.3
‑
1.0h。典型但非限制性的反应的温度为20℃、22℃、24℃、25℃、26℃、28℃或30℃,反应的时间为0.3h、0.5、0.75h或1.0h。
[0135]
上述荧光/pet双模态影像探针除了可实现精确影像诊断,还可以用于装载药物,从而实现荧光/pet双模态精准影像介导的高效化疗。
[0136]
作为本发明一种可选实施方式,步骤(d)使空心介孔有机硅上负载有荧光素和核素之后还包括负载药物的步骤。
[0137]
作为一种可选实施方案,负载药物包括以下步骤:使负载有荧光素和核素的空心介孔有机硅形成水溶液后与含药物的水溶液混合,室温搅拌,得到荧光/pet双模态影像探针。
[0138]
根据本发明的第三个方面,提供了上述荧光/pet双模态影像探针或采用上述荧光/pet双模态影像探针的制备方法制得的荧光/pet双模态影像探针在制备肿瘤的精确诊断制剂或肿瘤的治疗制剂中的应用。
[0139]
鉴于上述荧光/pet双模态影像探针所具有的优势,使得其在制备肿瘤的精确诊断制剂具有重要的研究意义和广阔的应用前景。
[0140]
由于荧光/pet双模态影像探针可负载药物,使得其可用于制备治疗肿瘤制剂,从而实现针对肿瘤的诊疗一体化。
[0141]
下面结合具体实施例,对本发明作进一步说明。
[0142]
实施例1
[0143]
本实施例提供了一种荧光/pet双模态影像探针,以可降解的空心介孔有机硅作为载体,空心介孔有机硅负载荧光素fitc和核素
64
cu。
[0144]
本实施例荧光/pet双模态影像探针的制备方法,包括以下步骤:
[0145]
(a)采用法制备实心二氧化硅sn,包括以下步骤:在74ml乙醇、10ml超纯水和3.14ml氨水组成的混合液中,快速滴入6ml teos,然后在30℃水浴中搅拌反应1h,离心收集产物,并用乙醇清洗三次,得到实心二氧化硅sn,将实心二氧化硅sn分散在60ml超纯水中,得到二氧化硅水溶液;
[0146]
介孔有机硅包覆的实心二氧化硅sn@mon的制备,包括以下步骤:将2g ctac和0.04g tea溶于90ml超纯水中,室温搅拌1.5h,然后加入上述制备的30ml二氧化硅水溶液,继续搅拌1.5h,随后,将反应体系转移至80℃油浴中,逐滴加入1.8mlbtds,继续反应1h,离心收集产物,并用乙醇清洗三次,得到介孔有机硅包覆的实心二氧化硅sn@mon,最后将介孔有机硅包覆的实心二氧化硅sn@mon分散在30ml超纯水中,得到sn@mon的水溶液;
[0147]
空心介孔有机硅hmon的制备,包括以下步骤:将上述制备的sn@mon的水溶液分散于800μl hf的水溶液中,并在60℃油浴中反应1h,选择性刻蚀掉sn内核,保留mon外壳,从而得到具有空腔结构的空心介孔有机硅hmon,离心收集产物,并用超纯水清洗三次,接着将hmon溶于质量分数为1wt%的nacl的甲醇溶液中,室温下搅拌12h,整个过程持续三遍,直至
ctac完全除去为止,最后,将hmon分散于15ml超纯水中备用;
[0148]
采用氨基硅烷偶联剂对空心介孔有机硅hmon进行改性,得到氨基改性空心介孔有机硅hmon
‑
nh2,包括以下步骤;将50mg hmon分散于100ml乙醇中,加入50μl aptes,然后在78℃油浴中回流12h,离心收集产物,并用乙醇清洗三次,得到氨基改性空心介孔有机硅hmon
‑
nh2;
[0149]
(b)将氨基改性空心介孔有机硅hmon
‑
nh2和荧光素fitc(hmon
‑
nh2和fitc的质量比为99:1)混合溶于50ml乙醇中,室温避光搅拌24h,离心收集产物,并用乙醇清洗三次,得到荧光素fitc修饰的空心介孔有机硅hmon
‑
fitc,最后将产物hmon
‑
fitc分散于5ml超纯水中形成hmon
‑
fitc的水溶液;
[0150]
(c)将hmon
‑
fitc的水溶液与p
‑
scn
‑
bn
‑
nota(hmon
‑
fitc与p
‑
scn
‑
bn
‑
nota的质量比为99.5:0.5)混合分散于ph=8.5的pbs溶液中,反应0.5h后,离心收集产物,得到hmon
‑
fitc/nota;
[0151]
(d)将hmon
‑
fitc/nota与
64
cucl2(148mbq)(hmon
‑
fitc/nota与
64
cucl2的质量比为99.5:0.5)混合分散于ph=6.5的pbs溶液中,反应0.5h后,得到荧光/pet双模态影像探针hmon
‑
fitc/
64
cu。
[0152]
实施例2
[0153]
本实施例提供了一种荧光/pet双模态影像探针,除了将荧光/pet双模态影像探针的制备方法步骤(a)中采用的氨基硅烷偶联剂由aptes替换为(3
‑
氨丙基)三甲氧基硅烷aptms,其余制备步骤与实施例1相同。
[0154]
实施例3
[0155]
本实施例提供了一种荧光/pet双模态影像探针,除了将荧光/pet双模态影像探针的制备方法步骤(b)中采用的荧光素fitc替换为荧光素ir780,所得到的荧光/pet双模态影像探针以可降解的空心介孔有机硅作为载体,空心介孔有机硅负载荧光素ir780和核素
64
cu,其余与实施例1相同。
[0156]
实施例4
[0157]
本实施例提供了一种荧光/pet双模态影像探针,除了将荧光/pet双模态影像探针的制备方法步骤(b)中采用的荧光素fitc替换为荧光素cy5.5,所得到的荧光/pet双模态影像探针以可降解的空心介孔有机硅作为载体,空心介孔有机硅负载荧光素cy5.5和核素
64
cu,其余与实施例1相同。
[0158]
实施例5
[0159]
本实施例提供了一种荧光/pet双模态影像探针,除了将荧光/pet双模态影像探针的制备方法步骤(d)中采用的
64
cucl2替换为
68
gacl3,所得到的荧光/pet双模态影像探针以可降解的空心介孔有机硅作为载体,空心介孔有机硅负载荧光素fitc和核素
68
ga,其余与实施例1相同。
[0160]
为验证实施例的技术效果,特进行以下实验。
[0161]
实验例1
[0162]
以实施例1为代表,对实施例1提供的制备方法中不同步骤所制得的产物进行检测,具体如下:
[0163]
(1)对实施例1中的实心二氧化硅sn、介孔有机硅包覆的实心二氧化硅sn@mon以及
空心介孔有机硅hmon进行电镜检测,具体如图4所示。其中,图4中a为sn,b为sn@mon,c为hmon。
[0164]
从图4中可以看出,每步合成的产物sn、sn@mon以及hmon均呈现规则均一的球形,且具有非常好的分散性和稳定性,便于后续的生物学效应研究。
[0165]
(2)对实施例1中的空心介孔有机硅hmon的水合动力学粒径进行检测,具体如图5所示。从图5中可以看出,hmon的平均水合动力学粒径大约为184.3nm。
[0166]
(3)对实施例1中的空心介孔有机硅hmon的还原响应型降解行为表征,具体方法包括:将5mg hmon分散于谷胱甘肽(gsh)的水溶液(10mm gsh、30ml)中,然后置于37℃的摇床中,分别在第3、7、15、30天取样,利用tem观察hmon在gsh的水溶液中降解的形貌,具体如图6所示,其中,图6中a为第3天,b为第7天,c为第15天,d为第30天。
[0167]
从图6中可以看出,hmon在还原性溶液(10mm gsh)中可以逐渐降解,在30天内基本上完全降解。这主要是因为hmon的有机硅壳中的双硫键可以被gsh等还原性介质打断,从而导致有机硅骨架坍塌和硅壳破裂。
[0168]
(4)对实施例1中的空心介孔有机硅hmon在细胞水平的生物相容性评价,包括以下步骤:将不同浓度(0、7.5、15.5、31.5、62.5、125、250、500μg/ml)的hmon与u87mg细胞共培养24h后,利用mtt试剂检测hmon的细胞相容性,具体如图7所示。
[0169]
从图7中可以看出,u87mg细胞与不同浓度的hmon共培养24h后,仍然保持90%以上的存活率,表明hmon具有良好的生物相容性。
[0170]
(5)对实施例1中的空心介孔有机硅hmon在活体水平的生物安全性进行评价,包括以下步骤:将hmon通过尾静脉注入小鼠体内,在第30天,解剖出小鼠的主要器官(心heart、肝liver、脾spleen、肺lung、肾kidney),进行h&e染色,然后在光学显微镜下观察有无组织细胞损伤,具体结果如图8所示。
[0171]
从图8小鼠的主要器官的h&e染色图中可以看出,hmon通过尾静脉注射入小鼠体内后30天,解剖出的心、肝、脾、肺、肾均没有发现明显的损伤,说明hmon具有良好的活体生物安全性。
[0172]
(6)对实施例1中的hmon
‑
fitc用于细胞水平的荧光成像性进行能表征,具体如图9所示,其中,图9中a为细胞核被dapi染色后发出的蓝光图,b为hmon
‑
fitc发出的绿光图,图c是图a和图b的叠加图。
[0173]
从图9中可以看出,hmon
‑
fitc与u87mg细胞共培养8h后,hmon
‑
fitc发出的绿光出现在蓝色的细胞核周围,说明hmon
‑
fitc可以被u87mg细胞吞噬入细胞质中,并且hmon
‑
fitc可以用于细胞水平的荧光定位追踪。
[0174]
(7)对实施例1中的hmon
‑
fitc/
64
cu用于活体水平的pet成像性能进行检测,检测方法包括:将hmon
‑
fitc/
64
cu通过尾静脉注入荷u87mg瘤小鼠的体内,分别在1h、6h、24h、48h时测量小鼠全身的pet影像信号,并且通过分析小鼠各主要器官所呈现的pet影像信号强度定量hmon
‑
fitc/
64
cu在小鼠体内的分布,具体如图10和图11所示。
[0175]
从图10中可以看出,hmon
‑
fitc/
64
cu通过尾静脉注入u87mg荷瘤小鼠的体内后,肿瘤区域的pet影像信号随着时间的延长先逐渐增强,然后又逐渐减弱,在24h时达到峰值,说明尾静脉注射后hmon
‑
fitc/
64
cu在24h时达到最高的肿瘤富集量。
[0176]
此外,可以利用小鼠各主要器官所呈现的pet影像信号强度定量hmon
‑
fitc/
64
cu在
小鼠体内的分布,具体如图11所示。从图11中可以看出,hmon
‑
fitc/
64
cu在肿瘤区的最高富集量(尾静脉注射后24h时)约为5%。
[0177]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1