一种非病毒载体及其制备方法与应用
1.本发明属于基因编辑技术领域,尤其涉及一种非病毒载体及其制备方法与应用。
背景技术:
2.crispr/cas9作为第三代基因编辑技术,具有强大的基因编辑能力,可在dna水平实 现基因沉默或修正,一旦编辑成功,作用效果永久,应用其治疗血液性疾病、遗传性视网膜 疾病和肿瘤性疾病的临床试验取得一定进展,在肿瘤靶向基因治疗中具有广阔的应用前景。
3.crispr/cas9系统共有三种实现形式,如递送同时编码cas9和sgrna的质粒、递送cas9 mrna和sgrna或者递送cas9蛋白和sgrna复合物,即核糖核蛋白复合体。基因编辑发 生在细胞核,递送质粒和核糖核蛋白复合物时,载体的细胞核靶向能力至关重要。
4.crispr/cas9系统递送方法包括物理方法、病毒载体和非病毒载体。物理方法包括微注 射、电穿孔、核感染和膜变形,主要用于体外或离体细胞和组织的基因编辑,其在体内生物 相容性较差;病毒载体,如:慢病毒、腺病毒、腺病毒等相关病毒等,目前已广泛应用于 crispr/cas9系统的体内外给药,但存在致癌性、插入突变、免疫原性等安全问题,且装载 能力有限,这些严重影响了病毒载体的临床转化;非病毒载体具有包载能力强、免疫原性低、 易于组装的优点,是较为理想的递送方法。
5.非病毒载体通过静电相互作用、范德华力、氢键和共价键等装载crispr/cas9系统,主 要为脂质体(lipsome)、聚合物、多肽或蛋白、囊泡、dna纳米线团、无机纳米粒等。为了 发挥基因编辑作用,非病毒载体需要将crispr/cas9系统高效递送到靶细胞的胞浆,对于 crispr/cas9质粒和核糖核蛋白复合物,将其递送到细胞核更有利于促进质粒表达cas9蛋 白和sgrna,提高编辑效率。但是现有的非病毒载体在递送过程中,还存在靶向性和稳定性 不高的问题。
技术实现要素:
6.为解决上述技术问题,本发明提供一种用于基因编辑的非病毒载体,本发明的非病毒载 体依靠被动靶向和主动靶向效应,可以在肿瘤组织高效蓄积,增加肿瘤细胞的摄取并且促进 核酸药物进入细胞核,加速后续的转录、翻译过程,为基因编辑质粒的递送提供了一种新的 候选体系。
7.本发明的第一个目的是提供一种非病毒载体,所述的非病毒载体包括压缩质粒药物的鱼 精蛋白,包覆在压缩了核酸药物的鱼精蛋白表面的阳离子脂质体,以及修饰在阳离子脂质体 表面的二硬脂酰基磷脂酰乙醇胺
‑
聚乙二醇
‑
透明质酸(dspe
‑
peg
‑
ha)聚合物。
8.进一步地,所述的阳离子脂质体为dope/dotap/chol。
9.进一步地,所述的质粒药物为基因编辑质粒。
10.进一步地,所述的基因编辑质粒为pcas9/sgmth1、pcas9/sgkras、pcas9/sgplk1、 pcas9/sgmettl3中的一种或几种。
11.本发明的第二个目的是提供所述的非病毒载体的制备方法,包括如下步骤:
12.s1、采用透明质酸和二硬脂酰基磷脂酰乙醇胺
‑
聚乙二醇为原料制备二硬脂酰基磷脂酰乙 醇胺
‑
聚乙二醇
‑
透明质酸聚合物;
13.s2、采用dotap、dope和胆固醇为原料制备阳离子脂质体;
14.s3、将鱼精蛋白溶液与质粒药物溶液混合孵育,制备鱼精蛋白/质粒药物复合物;
15.s4、将鱼精蛋白/质粒药物复合物与阳离子脂质体混合孵育,得到阳离子脂质体包覆的鱼 精蛋白/质粒药物复合物;
16.s5、将阳离子脂质体包覆的鱼精蛋白/质粒药物复合物与二硬脂酰基磷脂酰乙醇胺
‑
聚乙 二醇
‑
透明质酸聚合物的水溶液混合孵育,得到所述的非病毒载体。
17.在本发明中,s1步骤中,透明质酸(ha)经活化剂活化羧基后与二硬脂酰基磷脂酰乙 醇胺
‑
聚乙二醇(dspe
‑
peg
‑
nh2)发生反应。s3步骤中,鱼精蛋白溶液与质粒药物溶液通过 静电相互作用形成复合物。s4步骤中,阳离子脂质体通过静电相互作用包覆在复合物表面。 s5步骤中,二硬脂酰基磷脂酰乙醇胺
‑
聚乙二醇
‑
透明质酸聚合物(dspe
‑
peg
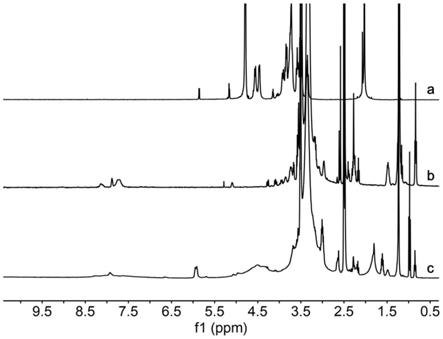
‑
ha)通过疏水 作用插入脂质体,修饰在非病毒载体表面。
18.进一步地,s3步骤中,孵育是在20~30℃孵育4
‑
6min,鱼精蛋白与质粒药物的质量比为 1.8
‑
2.2:1。
19.进一步地,s4步骤中,孵育是在20~30℃孵育15
‑
25min,鱼精蛋白/质粒药物复合物与 阳离子脂质体的质量比为3:11
‑
11.5。
20.进一步地,s5步骤中,孵育是在50
‑
60℃孵育15
‑
25min,二硬脂酰基磷脂酰乙醇胺
‑
聚乙 二醇
‑
透明质酸聚合物的水溶液中,二硬脂酰基磷脂酰乙醇胺
‑
聚乙二醇
‑
透明质酸聚合物的浓 度为19
‑
21mg
·
ml
‑1。
21.进一步地,s1步骤中,透明质酸通过活化剂活化后与二硬脂酰基磷脂酰乙醇胺
‑
聚乙二 醇进行反应,所述活化剂为1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐(edc
·
hcl)、n
‑ꢀ
羟基琥珀酰亚胺(nhs)和二环己基碳二亚胺(dcc)中的一种或几种。
22.本发明的第三个目的是提供所述的非病毒载体在递送crispr/cas9系统中的应用。
23.本发明所采用的鱼精蛋白具有压缩质粒和细胞核靶向功能,但单独使用不能保护核酸药 物在血液中稳定循环并把药物递送到肿瘤组织,为了解决这一问题,本发明在鱼精蛋白压缩 核酸药物形成负电复合物后在外层包覆阳离子脂质体,并在表面修饰dspe
‑
peg
‑
ha,从而 保护核酸药物在血液循环中免受核酸酶降解,减少载体与血液成分的相互作用,同时赋予载 体主动靶向性,对于高表达cd44受体的肿瘤细胞,发明所述载体可以增加载体在肿瘤部位 的蓄积并介导载体进入细胞。载体被细胞摄取后,依赖脂质体成分的相变实现内涵体逃逸, 将鱼精蛋白/核酸药物复合物释放到胞浆中,鱼精蛋白中的核定位信号(nls)序列可以介导 复合物通过核孔进入细胞核,从而促进核酸药物功能的发挥。以此构成的载体可实现一些核 酸药物的核递送,为质粒药物如crispr/cas9质粒,提供一种新型载体。
24.借由上述方案,本发明至少具有以下优点:
25.本发明的非病毒载体依靠被动靶向和主动靶向效应,可以在肿瘤组织高效蓄积,增加肿 瘤细胞的摄取并且促进核酸药物进入细胞核,加速后续的转录、翻译过程,为基因编辑质粒 的递送提供了一种新的候选体系。
孵育20min,得到脂质体包覆的鱼精蛋白/质粒复合物。
47.(5)将步骤(4)中得到的脂质体包覆的鱼精蛋白/质粒复合物与步骤(1)中的到的 dspe
‑
peg
‑
ha的水溶液混合,55℃孵育20min,得到ps@ha
‑
lip/pmth1。
48.下面对该实施例中的化合物进行表征以及非病毒载体的性能测定:
49.1、核磁表征
50.将ha溶于重水(d2o),将dspe
‑
peg、dspe
‑
peg
‑
ha溶于氘代二甲亚砜(d6
‑
dmso), 在400mhz核磁共振仪上测试,1h
‑
nmr图谱如图1所示:5.91ppm和4.50ppm处的峰为 ha糖环上次甲基氢的特征峰,1.24ppm处的峰为二硬脂酰基碳链上亚甲基氢的特征峰,3.50 ppm处为peg上亚甲基氢的特征峰,dspe
‑
peg
‑
ha氢谱中出现了ha、dspe
‑
peg的特征 峰,说明已经成功合成dspe
‑
peg
‑
ha。
51.2、红外表征
52.取适量ha、dspe
‑
peg、dspe
‑
peg
‑
ha的干燥粉末,上机分析,获取三种化合物的傅 立叶变换红外光谱。
53.dspe
‑
peg
‑
ha红外谱图如图2所示:2916cm
‑1、2868cm
‑1为peg亚甲基的伸缩振动峰; 由于反应生成新的酰胺键,dspe
‑
peg
‑
ha红外谱图中,3329cm
‑1处伯酰胺的伸缩振动峰强 度增大;1733cm
‑1处出现二硬脂酯的羰基伸缩振动峰,1637cm
‑1、1573cm
‑1处酰胺键羰基伸 缩振动峰增强,843cm
‑1处n
‑
h的面外弯曲振动消失,说明dspe
‑
peg
‑
ha已成功合成。
54.3、琼脂糖电泳考察载体对质粒的包覆
55.按照质量比2:1的制备质粒/鱼精蛋白复合物,按照n/p比2/1制备ps@ha
‑
lip/pmth1, 与6
×
dna上样缓冲液按比例充分混匀并上样,设置电压150v,30min后使用凝胶成像仪 观察结果,结果如图3所示。
56.制备ps与pmth1的复合物,将其与lip以0.5/1(w/w)比例混合,此时复合物呈负电 性,外层包覆lip,通过“后插入法”表面修饰ha,得到ps@ha
‑
lip/pmth1。琼脂糖电泳结 果表明ps@ha
‑
lip可以完全包覆pmth1。
57.4、载体的粒径电位
58.制备lip、p
‑
lip、ha
‑
lip、ps@ha
‑
lip,nano zs90纳米粒度及zeta电位分析仪测定载 体粒径、电位、多分散系数(polydispersity,pdi),结果如图4所示。
59.通过对装载pmth1载体lip、p
‑
lip、ha
‑
lip、ps@ha
‑
lip的粒径、电位进行测定,由 结果可知四种载体粒径适宜,分布均匀;lip具有较强的正电荷,按照n/p为2/1制备载体 时电位为37.2mv,peg和ha的修饰可以降低其正电荷,ps@ha
‑
lip相较ha
‑
lip略有升 高,归因于ps结合掉质粒的部分负电荷,psp制备成ps@ha
‑
lip整体电位略变大。peg和 ha可以降低载体表面电荷、减少与血浆蛋白的相互作用,有助于载体在血液中长循环。
60.5、载体的电镜下形态
61.将装载质粒的ps、ps@lip和ps@ha
‑
lip滴加到碳支持膜上,55℃烘干过夜,使用透 射电镜(transmission electron microscopy,tem)获取图片,观察载体形态,结果如图5所 示。
62.tem下可以观察到ps、ps@lip和ps@ha
‑
lip呈圆整的球形;包覆脂质体后,ps@lip 和ps@ha
‑
lip较ps粒径变大,可以看到ps表面均匀分布一层外壳,证明载体制备成功且 具有适宜粒径。
63.6、载体的血清稳定性
64.将体积为100μl的pbs溶液、lip、p
‑
lip、ha
‑
lip、ps@ha
‑
lip与100μl胎牛血清在 37℃下共孵育,以pbs组做对照,在预定时间点,测定各组样品在630nm处的吸光度,以 相对浊度(a
某一时间点
/a
0h
)对孵育时间作图,以混合物浊度变化评价载体血清稳定性,结果如 图6所示。
65.载体与胎牛血清共孵育,记录lip、p
‑
lip、ha
‑
lip、ps@ha
‑
lip在预定时间点的相对 浊度,评价载体的血清稳定性。由上图可以看出,lip由于具有较高的正电荷,易与血清中 的负电荷蛋白相互作用产生沉淀,导致相对浊度升高;peg的修饰有利于提高lip的血清稳 定性,显著降低混合体系的相对浊度;虽然ha
‑
lip和ps@ha
‑
lip电荷有差异,但相对浊度 相差不大,说明二者在血清中均可稳定存在,ha的修饰可以进一步减少载体与血清蛋白的 相互作用,提高载体稳定性,有利于体内长循环。
66.7、cck
‑
8实验考察载体的安全性
67.取对数生长的a549细胞和huvec细胞,培养于96孔板(3000个/孔),12h后,与 含不同浓度载体的培养基共培养24h,加入20μl cck
‑
8溶液,继续孵育4h后,使用多功 能酶标仪测定吸光度值od
450
。根据下式计算细胞活力,评价载体对正常细胞和肿瘤细胞的 安全性。给药不同浓度装载无药效的阴性对照质粒p
‑
null的lip、p
‑
lip、ha
‑
lip、ps@ha
‑
lip。
[0068][0069]
od
450(treated)
:有细胞,加载体和cck
‑
8溶液孔的吸光度;od0:无细胞,加培养基和 cck
‑
8溶液孔的吸光度;od
450(nontreated)
:有细胞,加cck
‑
8,不加载体孔的吸光度。
[0070]
测定a549细胞、huvec细胞在含有不同载体的培养基中生长24h后细胞存活率,评 价载体的安全性。结果如图7所示,可知,由于表面正电荷较高,lip对两种细胞具有明显 的细胞毒性,载体浓度250μg.ml
‑1时,两种细胞存活率约为20%;p
‑
lip对于肿瘤细胞和正 常细胞均呈现一定的细胞毒性,载体浓度最高时,细胞存活率约为60%,低浓度时,细胞存 活率略有升高,约为80%,说明peg修饰可以减轻表面电荷过高带来的细胞毒性;得益于 ha对载体电荷的进一步屏蔽,ha
‑
lip和ps@ha
‑
lip在较高浓度时细胞生存率也高于95%, 可以视作二者的存在对细胞各项生命活动没有影响,具有较高的安全性。
[0071]
8、激光共聚焦显微镜考察多功能非病毒载体的摄取与胞内分布
[0072]
考虑到pmth1本身不带荧光标记,以fam标记的sirna代替。取对数生长的a549 细胞,适量接种至共聚焦小皿,培养12h,与p
‑
lip/sirna
fam
、ha
‑
lip/sirna
fam
、 ps@ha
‑
lip/sirna
fam
、ha+ps@ha
‑
lip/sirna
fam
(sirna
fam
浓度:50nm)共孵育。2h 后用pbs洗3次,与溶酶体红染液(60nm)37℃孵育30min,pbs洗3次,4%甲醛溶液固 定10min,hoechst33258(10μg
·
ml
‑1)染细胞核,室温孵育10min,然后pbs洗3次,在 圆形盖玻片边缘滴加适量荧光淬灭封片液,缓慢将盖玻片盖到共聚焦小皿里,激光共聚焦显 微镜观察细胞内分布和内含体逃逸情况,结果如图8所示。
[0073]
孵育时间为2h时,p
‑
lip的绿色荧光信号主要分布在细胞的外部区域,而ha修饰的两 组,胞内有均匀的荧光分布,当ps@ha
‑
lip/sirna
fam
与游离透明质酸共孵育后,载体分布 和p
‑
lip/sirna
fam
呈现相近的情况,说明游离透明质酸可以与载体竞争细胞表面的cd44受 体,而cd44受体一旦饱和,载体进入细胞的量会显著减少,说明透明质酸
‑
cd44受体相互 作
用可以促进载体的细胞摄取。ps@ha
‑
lip/sirna
fam
组可以观察到溶酶体的红色信号和载 体的绿色荧光信号出现分离,提示我们载体成功从内涵体逃逸到胞浆中。
[0074]
9、流式细胞术定量考察多功能非病毒载体的细胞摄取
[0075]
取对数生长的a549细胞,适量接种至6孔板(约30万每孔),培养12h,与 p
‑
lip/sirna
fam
、ha
‑
lip/sirna
fam
、ps@ha
‑
lip/sirna
fam
、ha+ps@ha
‑
lip/sirna
fam (sirna
fam
浓度:50nm)共孵育。2h后用pbs清洗细胞3次,胰蛋白酶消化,再用pbs 清洗3遍,最后用0.3ml的pbs重悬细胞,使用流式细胞仪分析摄取情况。用mda
‑
mb
‑
231 细胞和hepg2细胞进行摄取实验,考察细胞cd44受体表达水平对载体细胞摄取的影响,结 果如图9所示。
[0076]
使用流式细胞仪对载体的细胞摄取进行定量分析。对于a549细胞,ha
‑
lip和 ps@ha
‑
lip细胞摄取显著高于p
‑
lip,ha同时存在时载体的细胞摄取与p
‑
lip组相近,说 明ha修饰可以促进载体进入a549细胞,与共聚焦图片结果一致;在高表达cd44受体的 mda
‑
mb
‑
231细胞上出现了相似的结果,而低表达cd44受体的hepg2细胞没有此现象, 说明透明质酸促进细胞摄取依赖于细胞cd44受体的表达,进一步证明ha
‑
lip和ps@ha
‑
lip 可以通过ha
‑
cd44受体相互作用促进载体进入细胞。
[0077]
10、激光共聚焦显微镜考察多功能非病毒载体的入核过程
[0078]
取对数生长的a549细胞适量接种于共聚焦小皿(15万每皿),培养12h,与 ha
‑
lip/sirna
fam
、ps@ha
‑
lip/sirna
fam
共孵育。4h、8h后,用pbs清洗细胞3次,加 入溶酶体红染液(60nm),37℃孵育30min,pbs洗3次,加入4%甲醛溶液固定10min, 再用pbs洗3次,hoechst33258(10μg
·
ml
‑1)染色细胞核,室温孵育10min,pbs洗3次, 滴加适量抗荧光淬灭封片液封片,置于4℃冰箱避光保存,使用共聚焦显微镜观察载体细胞 内分布情况,结果如图10所示。
[0079]
共聚焦显微镜考察给药4h和8h后,载体在a549细胞的胞内分布,由结果可以看出4 h后ha
‑
lip和ps@ha
‑
lip的绿色荧光信号均匀分布在胞浆中,红色荧光信号和绿色荧光信 号呈现一定的分离,提示部分载体从内涵体逃逸;8h后,ps@ha
‑
lip绿色荧光在细胞核内 也有分布,提示载体进入细胞核,ha
‑
lip组细胞核内没有明显的绿色荧光信号。综上可知, ps可以通过序列中的nls促进质粒进入肿瘤细胞的细胞核,这有利于质粒后续的转录、翻 译过程,提高基因编辑效率。
[0080]
以上仅是本发明的优选实施方式,并不用于限制本发明,应当指出,对于本技术领域的 普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和变型,这些 改进和变型也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1