一种托法替布缓释制剂及其制备方法与流程
1.本发明涉及一种托法替布缓释制剂及其制备方法。
背景技术:
2.枸橼酸托法替布是由美国辉瑞公司研发的一种新型口服janus激酶抑制剂,可有效抑制jak1和jak3的活性,阻断多中炎性细胞因子的信号传导。适用于甲氨蝶呤疗效不足或对其无法耐受的中度至重度活动性类风湿关节炎(ra)成年患者,可与甲氨蝶呤或其他非生物改善病情抗风湿药(dmard)联合使用。其化学名称为3-((3r,4r)-4-甲基-3-[甲基-(7h-吡咯并[2,3-d]嘧啶-4-基)-氨基]-哌啶-1-基)-3-氧代-丙腈,化学式为c
16h20
n6o,结构式如下:
[0003][0004]
专利cn202010347827.5公开了托法替布口服持续释放制剂,商品名为xeljanz xr,该剂型为每日一次的药物剂型,其疗效与立即释放剂型xeljanz保持一致。所述托法替布持续释放制剂存在一定吸收不完全的问题,为了与10mg速释制剂等效将规格调整为11mg。此外,该制剂为渗透泵打孔技术,工艺复杂,且制备过程中使用有毒有害的有机溶剂,易存在有机溶剂残留的问题,给产品的工业化生产过程带来一定挑战。
[0005]
专利cn202010119445.7公开了一种枸橼酸托法替布缓释片及其制备方法,其仅使用骨架。专利cn201811365133.3公开了一种托法替布控释片、制备方法及其应用,其仅使用膜控。这两篇专利分别采用了骨架技术和膜控技术制备托法替布持续释放制剂,但单一的骨架或膜控技术易存在较强的食物效应,可能会造成体内突释而影响安全性。
[0006]
专利cn202011512873.2公开了一种膜控与骨架双重缓释的枸橼酸托法替布缓释片剂。专利cn201911300186.1公开了枸橼酸托法替布片及其制备方法。这两篇专利均采用骨架与膜控的双重缓释技术,达到药物在体外的平稳释放,但均未涉及食物效应问题。
技术实现要素:
[0007]
本发明所要解决的技术问题是为了克服现有技术中托法替布缓释制剂的食物效应有待改善的缺陷,而提供一种托法替布缓释制剂及其制备方法。本发明的缓释制剂具有较好的缓释效果,能够减小食物效应,实现了每天服药一次即可达到治疗效果,与市售制剂生物等效。此外,本发明中的口服持续释放剂型制备工艺简单、成本低,易于生产放大。
[0008]
本发明提供了一种托法替布缓释制剂,其包括含药片芯和缓释衣膜,其中,所述含药片芯包含托法替布原料药、填充剂、骨架材料、崩解剂、粘合剂和润滑剂;所述缓释衣膜包含成膜材料和致孔剂;所述崩解剂包括羧甲基淀粉钠。
[0009]
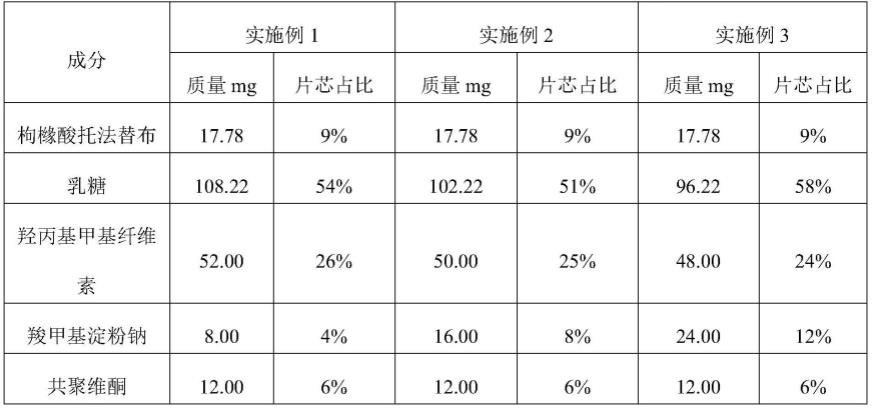
本发明中,所述崩解剂较佳地仅为羧甲基淀粉钠。所述崩解剂的质量较佳地为所述含药片芯质量的4-12%,例如4%、8%或12%。
[0010]
本发明中,所述缓释衣膜与所述含药片芯的质量比可为本领域常规的质量比,较佳地为(2-5):50,例如3:50、1:25或1:10。
[0011]
本发明中,所述托法替布原料药为托法替布或其药用衍生物,如托法替布(优选托法替布晶体)和/或托法替布药用盐。所述托法替布药用盐优选枸橼酸托法替布。所述托法替布原料药的用量为治疗有效量,一般可为所述含药片芯质量的5%-20%,例如9%。
[0012]
本发明中,所述填充剂可为本领域常规填充剂,较佳地选自乳糖、微晶纤维素、硅化微晶纤维素、甘露醇、预胶化淀粉、蔗糖、磷酸氢钙、淀粉和糊精中的一种或多种,更佳地为乳糖。所述填充剂的用量可按本领域填充剂的常规用量选择,较佳地为所述含药片芯质量的40-70%,例如48%、51%、54%、58%、60%或63%。
[0013]
本发明中,所述骨架材料可为本领域常规骨架材料,较佳地选自羟丙基甲基纤维素、羟丙基纤维素、羟乙基纤维素、聚氧乙烯和羧甲基纤维素钠中的一种或多种,更佳地为羟丙基甲基纤维素。所述骨架材料的用量可按本领域骨架材料的常规用量选择,较佳地为所述含药片芯质量的10-30%,例如17.5%、20%、22.5%、24%、25%或26%。
[0014]
本发明中,所述粘合剂可为本领域常规的粘合剂,较佳地选自共聚维酮、羟丙基纤维素、淀粉和预胶化淀粉中的一种或多种,更佳地为共聚维酮。所述粘合剂的用量可按本领域粘合剂的常规用量选择,较佳地为所述含药片芯质量的1-10%,例如6%。
[0015]
本发明中,所述润滑剂可为本领域常规的润滑剂,较佳地选自硬脂酸镁、滑石粉、胶态二氧化硅和硬脂酸钙中的一种或多种,更佳地为硬脂酸镁。所述润滑剂的用量可按本领域润滑剂的常规用量选择,较佳地为所述含药片芯质量的0.1-5%,例如1%。
[0016]
本发明中,所述成膜材料可为本领域常规的成膜材料,较佳地选自乙基纤维素水分散体、30wt%聚醋酸乙烯酯的水分散体、聚乙酸乙烯酯、丙烯酸甲酯共聚物、聚酰胺和聚乙烯中的一种或多种,更佳地为乙基纤维素水分散体。所述成膜材料的用量可本领域成膜材料的常规用量选择,较佳地为所述缓释衣膜质量的40-60%,例如45%、50%或53%。
[0017]
本发明中,所述致孔剂可为本领域常规致孔剂,较佳地为聚合物和/或水溶性赋形剂。所述聚合物较佳地选自羟丙基纤维素、羟乙基纤维素、羟丙基甲基纤维素、聚维酮、交联聚维酮、共聚维酮、聚乙二醇-聚乙烯醇、聚乙烯醇、低取代羟丙基纤维素、淀粉和预胶化淀粉中的一种或多种,更佳地为羟丙基甲基纤维素。所述水溶性赋形剂较佳地选自甘露糖醇、乳糖、山梨醇、木糖醇和麦芽糖醇中的一种或多种,更佳地为乳糖。所述致孔剂的用量可按本领域致孔剂的常规用量选择。所述聚合物的用量较佳地为所述缓释衣膜质量的20-50%,例如30%、35%或45%。所述水溶性赋形剂的用量较佳地小于或等于所述缓释衣膜质量的10%,例如3%、5%或8%。
[0018]
本发明中,所述缓释衣膜还可包括除成膜材料和致孔剂以外的其他本领域常规的赋形剂,较佳地还包括润滑剂、增塑剂、着色剂和表面活性剂中的一种或多种。
[0019]
其中,所述润滑剂可为本领域常规润滑剂,较佳地选自滑石粉、硬脂酸镁、硬脂酸钙、微粉硅胶、高岭土、二氧化硅和硬脂酸中的一种或多种,更佳地为滑石粉。所述润滑剂的用量可按本领域润滑剂的常规用量选择,较佳地为所述缓释衣膜质量的1-10%,更佳地为6%。
[0020]
其中,所述增塑剂可为本领域常规增塑剂,较佳地为甘油、丙二醇、聚乙二醇、苯二甲酸二甲酯、苯二甲酸二乙酯、苯二甲酸二丁酯、癸二酸二丁酯、枸橼酸三乙酯和枸橼酸三丁酯中的一种或多种,更佳地为枸橼酸三乙酯。所述增塑剂的用量可按本领域增塑剂的常规用量选择,较佳地为所述缓释衣膜质量的1-10%,更佳地为6%。
[0021]
其中,所述着色剂可为本领域常规着色剂。
[0022]
其中,所述表面活性剂可为本领域常规表面活性剂。
[0023]
本发明还提供了如前所述托法替布缓释制剂的制备方法,其包括如下步骤:按所述托法替布缓释制剂的各成分,进行压片、包衣,即可。
[0024]
其中,所述压片按本领域常规的压片操作进行,具体为:将除润滑剂外的成分(如包括托法替布原料药、填充剂、骨架材料、崩解剂和粘合剂)预混,再加入润滑剂总混,之后压片即得所述含药片芯。所述预混的时间较佳地为10-20min,更佳地为15min。所述总混的时间较佳地为4-6min,更佳地为5min。所述压片较佳地控制片芯硬度在8-12kg。
[0025]
其中,所述包衣按本领域常规的包衣操作进行,具体为:用包含水、成膜材料和致孔剂的包衣液,对所述含药片芯进行包衣。所述水较佳地为纯净水。所述水的用量为本领域常规水的用量。
[0026]
在不违背本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。本发明所用试剂和原料均市售可得。
[0027]
本发明的积极进步效果在于:本发明的托法替布缓释制剂能够减小食物效应,达到缓释效果,同时实现了每天服药一次即可达到治疗效果,与市售制剂生物等效。
附图说明
[0028]
图1为实施例13中两种制剂空腹给药后的药动学曲线;
[0029]
图2为实施例13中两种制剂进食后给药的药动学曲线。
具体实施方式
[0030]
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
[0031]
实施例中的百分含量为质量百分含量。
[0032]
实施例1-6
[0033]
本发明通过直接压片制备如下组成的片芯,单片含药片芯片重为200mg。
[0034]
表1实施例1-3的含药片芯组成(mg/片)
[0035][0036][0037]
表2实施例4-6的含药片芯组成(mg/片)
[0038][0039]
表3实施例1-6的包衣液组成
[0040][0041]
*为乙基纤维素水分散体中的固体成分。乙基纤维素水分散体为市售辅料,厂家为卡乐康,商品名为苏丽丝。
[0042]
制备工艺:
[0043]
(1)预处理:将原料药及各辅料分别过30目筛;
[0044]
(2)预混:称取除硬脂酸镁外的其他成分,混合15min;
[0045]
(3)总混:加入硬脂酸镁,混合5min;
[0046]
(4)压片:将总混后的物料进行压片,控制硬度在8-12kg;
[0047]
(5)包衣:将缓释衣膜成分配制成包衣液,包衣,增重为6%。
[0048]
实施例7-9
[0049]
本发明通过直接压片制备如下组成的片芯,单片含药片芯片重为200mg。
[0050]
表4实施例7-9的含药片芯组成(mg/片)
[0051][0052]
表5实施例7-9的包衣液组成(质量百分比(%))
[0053][0054]
*为乙基纤维素水分散体中的固体成分。
[0055]
实施例7、8和9中,纯化水:缓释衣膜的质量比分别为32:10、31:10和3:1。
[0056]
制备工艺:
[0057]
(1)预处理:将原料药及各辅料分别过30目筛;
[0058]
(2)预混:称取除硬脂酸镁外的其他成分,混合15min;
[0059]
(3)总混:加入硬脂酸镁,混合5min;
[0060]
(4)压片:将总混后的物料进行压片,控制硬度在8-12kg;
[0061]
(5)包衣:将缓释衣膜成分配制成包衣液,包衣,增重为6%。
[0062]
释放测定:
[0063]
根据《中国药典》2020版四部通则0931溶出度与释放度测定法(第二法,75rpm,溶出介质900ml),在10h时间间隔内测定片剂的释放特性,在37℃条件下测定ph6.8磷酸盐缓冲液中的释放度(以%计)。
[0064]
表6实施例1-9的释放(%)与时间(h)的关系
[0065]
时间(h)12.5410实施例18275096实施例212346097实施例315406899实施例410315998实施例512346397实施例612397098实施例712365897实施例810335796实施例913406499
[0066]
根据表6中实施例1-9的释放曲线,可表明本发明中的托法替布缓释制剂能够有效控制药物释放,达到缓释效果。
[0067]
实施例10-12
[0068]
本发明通过直接压片制备如下组成的片芯,单片含药片芯片重为200mg。
[0069]
表7实施例10-12的含药片芯组成(mg/片)
[0070][0071]
表8实施例10-12的包衣液组成
[0072][0073]
*为乙基纤维素水分散体中的固体成分。
[0074]
制备工艺:
[0075]
(1)预处理:将原料药及各辅料分别过30目筛;
[0076]
(2)预混:称取除硬脂酸镁外的其他成分,混合15min;
[0077]
(3)总混:加入硬脂酸镁,混合5min;
[0078]
(4)压片:将总混后的物料进行压片,控制硬度在8-12kg;
[0079]
(5)包衣:将缓释衣膜成分配制成包衣液,包衣,增重分别为4%(实施例10)、8%(实施例11)、10%(实施例12)。
[0080]
释放测定:
[0081]
根据《中国药典》2020版四部通则0931溶出度与释放度测定法(第二法,75rpm,溶出介质900ml),在10h时间间隔内测定片剂的释放特性,在37℃条件下测定ph6.8磷酸盐缓冲液中的释放度(以%计)。
[0082]
表9实施例10-12的释放(%)与时间(h)的关系
[0083]
时间(h)12.5410实施例1010295198实施例118244898实施例127214597
[0084]
根据表9中实施例10-12及表6中实施例2的释放曲线,可表明缓释衣膜增重在4%-10%之间,本发明中的托法替布缓释制剂体外释放均无显著差异,即本发明易于生产放大,重现性好,释放可控。
[0085]
对比例1
[0086]
本发明通过直接压片制备如下组成的含药片芯,单片含药片芯片重为200mg。
[0087]
表10对比例1的含药片芯组成(mg/片)
[0088][0089]
表11对比例1的包衣液组成(质量百分比(%))
[0090][0091]
*为乙基纤维素水分散体中的固体成分。
[0092]
制备工艺:
[0093]
(1)预处理:将原料药及各辅料分别过30目筛;
[0094]
(2)预混:称取除硬脂酸镁外的其他成分,混合15min;
[0095]
(3)总混:加入硬脂酸镁,混合5min;
[0096]
(4)压片:将总混后的物料进行压片,控制硬度在8-12kg;
[0097]
(5)包衣:将缓释衣膜成分配制成包衣液,包衣,增重为6%。
[0098]
释放测定:
[0099]
根据《中国药典》2020版四部通则0931溶出度与释放度测定法(第二法,75rpm,溶出介质900ml),在10h时间间隔内测定片剂的释放特性,在37℃条件下测定ph6.8磷酸盐缓冲液中的释放度(以%计)。
[0100]
表12对比例1的释放(%)与时间(h)的关系
[0101]
时间(h)12.5410对比例1的释放(%)9265398
[0102]
结合表12中对比例1及表6中实施例1的释放曲线可知:对比例1与实施例1在体外释放过程中并无显著性差异。
[0103]
实施例13比格犬体内药动学实验
[0104]
取健康成年比格犬,随机分成3组(实施例组,对比例组1,一次给药一片),交叉进行实验。单次给药实施例组给药为实施例1,对比例组1给药为对比例1。分别研究空腹及进食后的体内药动学实验,实验前禁食12h,实验时进食组给予脂质(半肥瘦猪肉末),每只150g,随后进行给药;空腹组给予100ml水,随后进行给药。给药8h后同时安排进食。各组犬于预定时间经大隐静脉采血3ml,肝素抗凝,低温离心取血浆样品,进行检测。以实施例组作为受试制剂t1,对比例组1作为受试制剂t2。
[0105]
表13两组制剂的体内药动学数据
[0106][0107]
根据表13中比格犬体内药动学实验结果可见:
[0108]
实施例组(t1)在空腹与进食状态下,其c
max
与auc均无显著性差异,其进食状态c
max
和auc分别为空腹状态的1.12和1.05倍。
[0109]
对比例组1(t2)在空腹与进食状态下,auc无显著性差异,其进食状态下的auc分别为空腹状态的1.10倍,但进食状态下,其c
max
明显高于空腹状态为空腹状态1.37倍。
[0110]
t1和t2的空腹和进食状态下的各时间段血液中药物含量测试结果如表14和图1-2所示。
[0111]
表14两组制剂的体内释放数据
[0112]
[0113][0114]
从表13-14、图1和图2可以看出,当崩解剂为羧甲基淀粉钠,其含量为4%时(t1)其食物效应得到明显的控制。t1释制剂在体内足够抵挡胃肠道及食物挤压,能够减小食物效应,同时能够实现每天服药一次即可达到治疗效果。
[0115]
由上述结果表明,实施例组在进食状态下表现出较小的食物效应,体内安全性高;对比例中的托法替布缓释片剂虽能在体外达到缓释效果,但进食后在体内突释,食物效应明显。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1