一种EGCG缓释片及其制备方法与流程
一种egcg缓释片及其制备方法
技术领域
1.本发明属于医药技术领域,提供了一种egcg缓释片及其制备方法。
背景技术:
2.表没食子儿茶素没食子酸酯(egcg)是从中国绿茶中提取的一种成份,它是绿茶主要的活性和水溶性成份,是儿茶素中含量最高的组分,占绿茶毛重的9%
‑
13%,因为具有特殊的立体化学结构,egcg具有非常强的抗氧化活性,在抗癌和心血管疾病方面担当了重要的角色。此外,它也用作肿瘤多药耐药性的逆转剂,能够改善癌细胞对化疗的敏感性并减轻对心脏的毒性。
3.表没食子儿茶素没食子酸酯(egcg)是绿茶中最有效的抗氧化多酚,具有抗氧化、抗癌、抗突变等活性。抗氧化活性至少是维生素c的100多倍,是维生素e的25倍,能够保护细胞和dna受损害,这种损害相信与癌症、心脏疾病和其他重大疾病有关,egcg 的这些功效归结于他们对氧自由基的清除(抗氧化)能力。
4.egcg:一种多酚化合物,提取自绿茶,宝利肤旅美医学专家在研究中发现,egcg虽无法透过表皮,但它可为表皮层最外部的细胞提供能量,使细胞再度分裂、分化、增强其活性,从而使皮肤表面的状态得以改善。因为自绿茶提取而来,还兼有溶解脂肪、化浊去油的功效。
5.许多研究表明egcg具有抗自由基dna损害,抗辐射和紫外线,阻止油脂过氧化,减少血清中低密度胆固醇、超低密度胆固醇和甘油三酯的含量,干扰癌细胞生存所需的信号传递,抑制饮食中的致癌物质,与肠、肝、和肺中的其他酶和抗氧化剂作用共同阻止某些致癌物质的活力,清除自由基,抵御污染、日晒和吸烟的影响,防治皮肤老化和起皱。
6.然而,由于egcg结构中含有不饱和键,其化学稳定性差,egcg的不稳定性也导致了其生物利用率降低而限制其在食品、医药行业的应用。局报道,禁食大鼠和人口服摄入 97mg的egcg,其血浆中仅能检测到摄入rgcg的0.32%。
技术实现要素:
7.本发明的目的在于提供一种egcg缓释片及其制备方法,本发明的缓释片是骨架型和膜控型结合的缓释制剂,释药徐缓,使血药浓度平稳,避免峰谷现象,并且能长时间维持有效血药浓度,发挥最佳治疗效果。由于减少了峰谷现象,故有利于降低药物的毒副作用,减少耐药性的发生。
8.本发明具体技术方案如下:
9.本发明所述的egcg缓释片主要由80%~95%含药片芯、5%~20%的缓释包衣层组成,所述含药片芯主要由egcg、填充剂、崩解剂、助流剂、润滑剂、缓释骨架材料组成;所述缓释包衣层主要由乙基纤维素水分散体、滑石粉组成。
10.优选的,所述的egcg缓释片由80
‑
85%含药片芯、15
‑
20%的缓释包衣层组成。
11.更有选的,所述的egcg缓释片由85%含药片芯、15%的缓释包衣层组成。
12.具体的,所述的含药片芯由以下组分组成:
13.egcg 20%~40%
14.填充剂30%~40%
15.崩解剂2%~5%
16.助流剂0.5%~1%
17.润滑剂0.5%~1%
18.缓释骨架材料10%~40%;
19.优选的,所述的含药片芯由以下组分组成:
20.egcg 35%
21.填充剂35%
22.崩解剂2.4%
23.助流剂0.8%
24.润滑剂0.8%
25.缓释骨架材料26%。
26.具体的,所述的缓释包衣层由以下组分组成:
27.乙基纤维素水分散体45%~52%
28.滑石粉3%~5%
29.纯化水45%~50%;
30.优选的,所述的缓释包衣层由以下组分组成:
31.乙基纤维素水分散体47.2%
32.滑石粉4.5%
33.纯化水48.3%。
34.上述的缓释骨架材料可以为羟乙基纤维素、羟丙甲纤维素、羧甲基纤维素钠、海藻酸钠中的一种或多种;优选的,所述的缓释骨架材料为海藻酸钠。
35.上述的填充剂可以为微晶纤维素、乳糖、淀粉、无水磷酸氢钙、预胶化淀粉、甘露醇中的一种或多种混合;优选的,所述填充剂为微晶纤维素、甘露醇;进一步优选的,微晶纤维素、甘露醇的比例为1:0.5
‑
1.5;更优选的,微晶纤维素、甘露醇的比例为1:0.9。
36.上述的崩解剂可以为低取代羟丙基纤维素、干淀粉、羧甲基淀粉钠、交联pvp中的一种或多种混合;优选的,所述的崩解剂为羧甲基淀粉钠。
37.上述的助流剂可以为微粉硅胶、二氧化硅的一种或两种混合。
38.上述的润滑剂可以为硬脂酸镁、微粉硅胶、氢化植物油、硬脂富马酸钠中的一种或多种混合;优选的,所述的润滑剂为硬脂酸镁。
39.与现有技术相比,本发明具有以下技术效果:
40.本发明所制备的egcg缓释片在消化液中释药徐缓,胃肠道转运时间相对恒定,避免剂量突释现象,保证临床用药安全性。药代动力学实验显示,本发明所制备德尔egcg缓释片可有效保持较高的血药浓度,药物的生物利用度高;同时制备工艺简单,技术难度低,批次间的差异小,释放曲线重现性好,利于工业化的大规模生产。
附图说明
41.图1为实施例1、2、3、4、5、6、7,对比实施例1、2所得egcg缓释片的体外累积释放 曲线图
具体实施例
43.实施例1:
44.含药片芯:
45.egcg 320g
46.微晶纤维素256g
47.甘露醇144g
48.羧甲基淀粉钠24g
49.二氧化硅8g
50.硬脂酸镁8g
51.海藻酸钠240g;
52.缓释包衣层:
53.乙基纤维素水分散体472g
54.滑石粉45g
55.纯化水483g;
56.取处方量的egcg、微晶纤维素、甘露醇混合均匀,再加入处方量的海藻酸钠、羧甲基淀粉钠、微粉硅胶混合均匀,最后加入处方量的硬脂酸镁混合均匀,压片机制得素片,备用。
57.取处方量的乙基纤维素水分散体、滑石粉加入水中,匀浆机匀化,过滤,得包衣液,备用。
58.将上述所得素片在包衣锅中以上述所得包衣液进行包衣(包衣增重为15%),即得 egcg缓释片。
59.实施例2
60.含药片芯:
61.egcg 320g
62.微晶纤维素305g
63.甘露醇95g
64.羧甲基淀粉钠24g
65.二氧化硅8g
66.硬脂酸镁8g
67.海藻酸钠240g;
68.缓释包衣层:
69.乙基纤维素水分散体472g
70.滑石粉45g
71.纯化水483g;
72.制备方法参考实施例1,包衣增重为15%。
73.实施例3
74.含药片芯:
75.egcg 320g
76.微晶纤维素206g
77.甘露醇194g
78.羧甲基淀粉钠24g
79.二氧化硅8g
80.硬脂酸镁8g
81.海藻酸钠240g;
82.缓释包衣层:
83.乙基纤维素水分散体472g
84.滑石粉45g
85.纯化水483g;
86.制备方法参考实施例1,包衣增重为15%。
87.实施例4
88.含药片芯:
89.egcg 200g
90.淀粉350g
91.交联pvp 50g
92.微粉硅胶5g
93.氢化植物油10g
94.羟丙甲纤维素385g;
95.缓释包衣层:
96.乙基纤维素水分散体520g
97.滑石粉30g
98.纯化水450;
99.制备方法参考实施例1,包衣增重为5%。
100.实施例5
101.含药片芯:
102.egcg 400g
103.乳糖415g
104.干淀粉20g
105.微粉硅胶10g
106.硬脂富马酸钠5g
107.卡波姆树脂150g;
108.缓释包衣层:
109.乙基纤维素水分散体450g
110.滑石粉50g
111.纯化水500g;
112.制备方法参考实施例1,包衣增重为20%。
113.实施例6
114.含药片芯:
115.egcg 214g
116.预胶化淀粉350g
117.低取代羟丙基纤维素20g
118.二氧化硅8g
119.微粉硅胶8g
120.羧甲基纤维素钠400g;
121.缓释包衣层:
122.乙基纤维素水分散体472g
123.滑石粉45g
124.纯化水483g;
125.制备方法参考实施例1,包衣增重为15%。
126.实施例7
127.含药片芯:
128.egcg 310.00g
129.无水磷酸氢钙500.00g
130.低取代羟丙基纤维素24.00g
131.二氧化硅8.00g
132.硬脂酸镁8.00g
133.海藻酸钠150.00g;
134.缓释包衣层:
135.乙基纤维素水分散体472g
136.滑石粉45g
137.纯化水483g;
138.制备方法参考实施例1,包衣增重为15%。
139.对比实施例1
140.含药片芯:
141.egcg 320g
142.微晶纤维素256g
143.甘露醇144g
144.羧甲基淀粉钠24g
145.二氧化硅8g
146.硬脂酸镁8g
147.海藻酸钠240g;
148.取处方量的egcg、微晶纤维素、甘露醇混合均匀,再加入处方量的海藻酸钠、羧甲基淀粉钠、二氧化硅混合均匀,最后加入处方量的硬脂酸镁混合均匀,压片,即得egcg 缓释片。
149.对比实施例2
150.含药片芯:
151.egcg 320g
152.微晶纤维素256g
153.甘露醇144g
154.羧甲基淀粉钠24g
155.二氧化硅8g
156.硬脂酸镁8g;
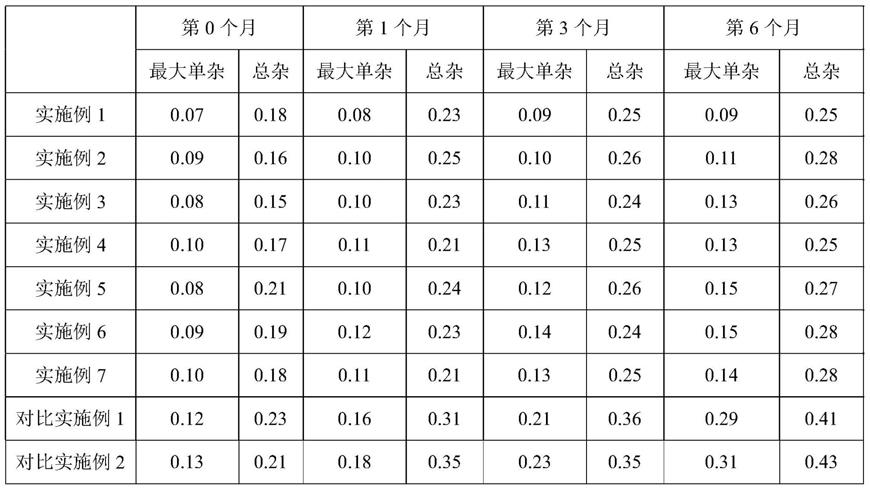
157.缓释包衣层:
158.乙基纤维素水分散体472g
159.滑石粉45g
160.纯化水483g;
161.取处方量的egcg、微晶纤维素、甘露醇混合均匀,再加入处方量的羧甲基淀粉钠、二氧化硅混合均匀,最后加入处方量的硬脂酸镁混合均匀,压片机制得素片,备用;
162.取处方量的乙基纤维素水分散体、滑石粉加入水中,匀浆机匀化,过滤,得包衣液,备用。
163.将上述所得素片在包衣锅中以上述所得包衣液进行包衣(包衣增重为15%),即得egcg缓释片。
164.释放度检测
165.释放度照溶出度与释放度测定法(中国药典2015年版四部通则0931第二法)测定。
166.将实施例1
‑
7、对比实施例1
‑
2所得egcg缓释片分别以0.1mol/l的盐酸溶液900ml 为溶出介质,转速每分钟50转,依法操作,经1小时、2小时、4小时、6小时、8小时、 10小时、12小时时分别取样10ml。滤过,并及时在操作容器中补充相同温度的溶出介质 10ml,精密量取续滤液5ml,置100ml量瓶中,用0.1mol/l的盐酸溶液稀释至刻度,分别作为供试品溶液;取egcg对照品适量,精密称定,加0.1mol/l盐酸溶液溶解并定量稀释制成每1ml中约含10μg的溶液,作为对照品溶液。分别取供试品溶液和对照品溶液,测定,计算每片在不同时间的释放量。测试结果如表1所示。
167.由实验结果可知,本发明所制备的egcg缓释片在14h内平稳释放,可有效避免突释现象。
168.表1 egcg缓释片体外累积释放度(%)
169.时间(h)12468101214实施例12835435867798796实施例22537456371839198实施例32937466069809398实施例43352596883859398实施例53554627183899598实施例63543556879899398实施例73146587179849598对比实施例16285969898989898
对比实施例25176899598989898
170.稳定性考察
171.1.加速试验
172.取实施例1
‑
7、对比实施例1
‑
2所得egcg缓释片,按市售缓释片包装,在温度40
±
2℃、相对湿度75
±
5%的条件下放置6个月。试验期间,分别在第0个月、第1个月、3个月、 6个月末取样,检测性状有关物质含量。结果如下表2所示。
173.表2 egcg缓释片加速试验有关物质检测结果
174.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1