4-脱氧-N-乙酰氨基葡萄糖作为革兰氏阳性菌抗菌添加剂的应用
4
‑
脱氧
‑
n
‑
乙酰氨基葡萄糖作为革兰氏阳性菌抗菌添加剂的应用
技术领域
1.本发明属于抗菌药物技术领域,尤其涉及4
‑
脱氧
‑
n
‑
乙酰氨基葡萄糖作为革兰氏阳性菌抗菌添加剂的应用。
背景技术:
2.近年来,临床上感染性疾病治疗所面临的一大挑战是细菌抗生素耐药性。英国jim o'neill发表的《全球抗菌药物耐药回顾》统计全球每年死于抗生素耐药的病人达到70万,到2050年将达到1000万。抗生素的使用降低了由传染病引起的人类发病率和死亡率。然而,多药耐药病原菌的出现使这一局面发生了极大的逆转,其中包括耐甲氧西林金黄色葡萄球菌、抗万古霉素肠球菌、耐碳青霉烯类鲍曼不动杆菌和耐碳青霉烯类肠杆菌等。抗生素耐药性已被世界卫生组织列为21世纪最重要的三大公众健康危害之一。因此,寻求有效抑制多重耐药和不产生耐药机制的新型抗菌剂和治疗方法,是全球公共健康事业亟需解决的问题。
3.肽聚糖(peptidoglycan,pgn)作为革兰氏阳性细菌细胞壁的主要结构成分,由n
‑
乙酰氨基葡萄糖(n
‑
acetylglucosamine,nag)和n
‑
乙酰胞壁酸(n
‑
acetylmuramic acid,nam)通过β
‑
1,4糖苷键交替连接,再通过nam残基的五肽侧链之间相互交联而成的网状大分子。细胞壁能够维持细菌形态,防止细菌因细胞内渗透压的改变而发生涨破,细胞壁结构的完整性对细菌的正常生理功能具有重要作用。因此,细菌细胞壁肽聚糖的生物合成一直是许多抗菌药物的作用靶点和广谱抗菌药物开发所备受关注的靶点。β
‑
内酰胺类抗生素中的青霉素和头孢菌素以及糖肽类中的万古霉素就是通过抑制细胞壁的合成进而导致细菌破裂死亡。然而,在药物与靶点的长期相互作用下,细菌通过抗生素靶标的改变,降低万古霉素与靶标的亲和力或者通过表达青霉素结合蛋白的突变体甲氧西林对抗生素产生耐药性。除此之外,细菌还可以产生灭活酶,通过酶降解和修饰方式使抗生素失活;通过产生外排泵和改变细胞膜的通透性使抗生素在胞内的浓度低于抑菌水平。由于多重耐药机制的产生,细菌耐药性问题愈演愈烈,为了应对这一挑战,科学家们提出了联合用药治疗方案。联合治疗主要是将抗生素与抗生素或者抗生素与非抗生素化合物联用,通过干扰细菌的耐药机制和提高细菌对抗生素的敏感性来再次发挥现有抗生素的抗菌活性。
4.我们前期工作开发了一种新型的小分子探针:1,3,6
‑
三乙酰基
‑4‑
脱氧
‑
叠氮乙酰氨基糖(4deo
‑
ac3glcnaz)(a 4
‑
deoxy analogue of n
‑
acetyl
‑
d
‑
glucosamine inhibits heparan sulphate expression and growth factor binding in vitro;interfering with udp
‑
glcnac metabolism and heparan sulfateexpression using a sugar analogue reduces angiogenesis),该探针在真核细胞中可以选择性地捕获o
‑
glcnac糖基化修饰的蛋白。4位羟基的缺失使得glcnac在其他糖链结构中(如n
‑
/o
‑
glycan)不能通过β
‑
1,4糖苷键进行延伸,从而可以高效选择性地对细胞质和细胞核蛋白进行o
‑
glcnac糖基化修饰。相关研究还发现4deo
‑
glcnac的特殊结构阻碍了糖链结构的延伸,作为糖链结构的终
端可以有效抑制磺酸肝素和几丁质的合成,在抗淀粉样蛋白和抗真菌等方面的治疗具有潜在的开发价值。udp
‑
4deo
‑
glcnac作为糖基供体前体,研究结果表明:4deo
‑
glcnac等glcnac衍生物可以被细菌来源相关的蛋白激酶(nahk)和焦磷酸酶(glmu)高效合成。此外,其他研究报道表明经100μl 4deo
‑
ac3glcnac培养的skvo3细胞裂解液中,通过lc
‑
ms分析能够检测到高含量的udp
‑
4deo
‑
glcnac,而udp
‑
glcnac/udp
‑
galnac水平显著下降,从某种程度上说,udp
‑
4deo
‑
glcnac本身或者某个中间体可以抑制udp
‑
glcnac或者udp
‑
galnac的生成。
技术实现要素:
5.针对现有技术存在的问题,本发明提供4
‑
脱氧
‑
n
‑
乙酰氨基葡萄糖作为革兰氏阳性菌抗菌添加剂的应用。
6.具体的,所述的4
‑
脱氧
‑
n
‑
乙酰氨基葡萄糖作为革兰氏阳性菌抗菌添加剂用于抗金黄色葡萄球菌、抗白葡萄球菌、抗耐氨苄金黄色葡萄球菌等。
7.进一步的,所述的4
‑
脱氧
‑
n
‑
乙酰氨基葡萄糖作为革兰氏阳性菌抗菌添加剂可以与黄芩素联合用药,用于抗金黄色葡萄球菌。
8.进一步的,所述的4deo
‑
glcnac分别与氨苄青霉素、卡那霉素、万古霉素联合应用于抗金黄色葡萄球菌,可降低原有抗生素用药剂量的4倍,几乎达到100%的抑菌效果。
9.本发明的显著技术效果。
10.在本课题中,我们基于革兰氏阳性菌细胞壁的连接方式以及细菌细胞壁的骨架结构特点,发现一种影响细胞壁合成的小分子化合物4
‑
脱氧
‑
n
‑
乙酰氨基葡萄糖(4deo
‑
glcnac),在细菌的培养基中加入5
‑
20mg/ml的4deo
‑
glcnac,该小分子化合物可以被细菌体内的合成酶转化为相应的糖基供体udp
‑
4deo
‑
glcnac,随着细菌的不断分裂、增殖,其细胞壁骨架在生长过程中会不断摄取培养基中的4deo
‑
glcnac,由于4位羟基的缺失,使得nam无法通过β
‑
1,4与之连接形成紧密的网状结构,最终导致细胞壁受损的细菌在高渗透压环境下会发生崩解而死亡,从而实现抑菌的目的。我们在这项工作中,通过体外抑菌实验初步测定了4deo
‑
glcnac对正常金黄色葡萄球菌株n315的最低抑菌浓度为20mg/ml,表明了4deo
‑
glcnac对正常金黄色葡萄球具有良好的抗菌活性,并发现其是通过细菌代谢合成到细菌细胞壁上,促使细菌细胞壁破损从而起到抑菌作用;4deo
‑
glcnac和黄芩素在体内外实验联合使用,可有效抑制金黄色葡萄球菌及其引起的皮肤感染,提示4deo
‑
glcnac可以作为一种潜在的抗菌添加剂,为今后新型小分子抗菌药物的开发提供新的研究思路。
附图说明
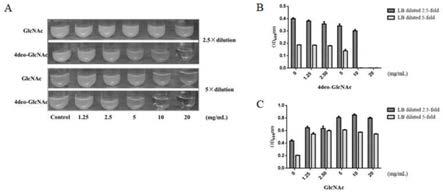
11.图1为4deo
‑
glcnac在不同浓度lb培养基中对金黄色葡菌球菌的mic值;其中a图:4deo
‑
glcnac和glcnac在不同倍数稀释的lb培养中的mic(直观图);b图:检测4deo
‑
glcnac在2.5倍和5倍稀释lb培养中的mic值;c图是检测glcnac在2.5倍和5倍稀释lb培养中的mic值。
12.图2为4deo
‑
glcnac在不同浓度的lb培养基中对金葡菌生长曲线的影响;其中,图a和b分别是金葡菌在含有不同浓度的4deo
‑
glcnac的2.5倍和5倍稀释的lb培养基中48h内的生长趋势;图c和d分别是金葡菌在含有不同浓度的glcnac的2.5倍和5倍稀释的lb培养基中48h内的生长趋势。
13.图3为4deo
‑
glcnac对细菌细胞壁作用的荧光定位及分析;其中,contrl组为未经任何处理的金黄色葡萄球菌(阴性对照组);glcnaz组为经glcnaz(10mg/ml)处理的金黄色葡萄球菌;4deo
‑
glcnaz组为经4deo
‑
glcnaz(10mg/ml)处理的金黄色葡萄球菌。
14.图4为4deo
‑
glcnac与黄芩素联合抑菌效果;图a:黄芩素对金黄色葡萄球菌mic值的测定;图b:5μg/ml黄芩素和不同浓度的4deo
‑
glcnac联合用药时细菌的生长趋势;图c:10μg/ml黄芩素和不同浓度的4deo
‑
glcnac联合用药时细菌的生长趋势;图d、e和f分别为5μg/ml、10μg/ml和20μg/ml黄芩素和不同浓度的glcnac联合用药时细菌的生长趋势。
15.图5为4deo
‑
glcnac与黄芩素联合对皮肤感染小鼠模型的体内疗效;图a:治疗小鼠皮肤感染模型的实验流程;图b:药物治疗组和未治疗组的感染皮肤样本的菌落单位计数;图c:药物治疗组和未治疗组的感染皮肤的伤口愈合结果。
16.图6为处理和未处理小鼠感染皮肤组织he染色结果;图a:未感染的正常小鼠背部皮肤组织样本he染色结果;图b:未经任何治疗的小鼠背部感染皮肤组织样本he染色结果;图c:经20mg/ml的4deo
‑
glcnac治疗的小鼠背部感染皮肤组织样本he染色结果;图d:经80μg/ml的黄芩素治疗的小鼠背部感染皮肤组织样本he染色结果;图e:经20mg/ml的4deo
‑
glcnac和40μg/ml黄芩素联合治疗的小鼠背部感染皮肤组织样本he染色结果。
17.图7为处理和未处理小鼠感染皮肤组织中性粒细胞免疫荧光染色结果;normal组为正常皮肤组织;untreated组为未经抗菌治疗的感染皮肤组织;baicalein(80μg/ml)组为经黄芩素(80μg/ml)治疗的感染皮肤组织;4deo
‑
glcnac(20mg/ml)组为经4deo
‑
glcnac(20mg/ml)治疗的感染皮肤组织;baicalein(40μg/ml)+4deo
‑
glcnac(20mg/ml)组为经黄芩素(40μg/ml)和4deo
‑
glcnac(20mg/ml)联合治疗的感染皮肤组织。
18.图8为4deo
‑
glcnac和amp
+
对金黄色葡萄球菌标准株和耐药菌株的mic;图a:amp
+
对san315和san315
‑
amp
+
的最低抑菌浓度测定值;图b:4deo
‑
glcnac对san315和san315
‑
amp
+
的最低抑菌浓度测定值。
19.具体实施方法
20.下面结合附图及具体实施方式对本发明技术方案做进一步详细描述,若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段,所用原料均为市售商品。
21.实施例1细菌菌株的复苏与平板制备。
22.(1)不同浓度稀释lb培养基与正常lb琼脂平板的制备:2.5倍稀释lb培养基(称取tryptone 1.6g、yeast extract 0.8g和nacl 2g)、5倍稀释lb培养基(称取tryptone 0.8g、yeast extract 0.4g和nacl 2g)各加400ml双蒸水进行溶解,进行120℃高压灭菌处理20min后,制得lb液体培养基,冷却后放于冰箱4℃保存;称取tryptone 4g、yeast extract 2g、nacl 2g和琼脂粉6g,加400ml双蒸水进行溶解,进行120℃高压灭菌处理20min后,得lb培养液,在无菌超净台中将液体倒于一次性培养皿中15ml,冷却凝固,得lb固体琼脂平板,紫外消毒后封口膜封闭放于冰箱4℃保存。
23.(2)金葡菌n315平板制作:于
‑
80℃取出冻存的标准菌株n315于室温进行解冻,在无菌超净台中用无菌接种环取少许菌液,在lb无抗固体培养板进行三区划线,放于37℃恒温细菌培养箱培养18h,取出后,肉眼可见平板上形状规则金黄色菌落即制作成功,进行封口膜封闭,冰箱4℃保存。
24.本发明通过体外实验和小鼠皮肤感染模型初步评价4deo
‑
glcnc对金黄色葡萄球菌的抗菌活性。
25.实施例2抗菌药物对金黄色葡萄球菌最低抑菌浓度测定
26.由于细菌在皮肤表面创伤所引起的感染是一个营养成分相对匮乏的微环境,因此,我们配制了稀释倍数为2.5倍和5倍的lb培养基,将金葡菌分别在含有终浓度为0、1.25、2.5、5、10、20mg/ml的4deo
‑
glcnac的两种培养基中培养24h后,分别测定不同药物浓度下的生长的菌液od
600
的值,探索营养成分匮乏的培养环境中,金葡菌通过大量摄取4deo
‑
glcnac对其生长的影响。
27.(1)菌液制备:于金葡菌n315平板用无菌枪尖挑取单个菌落到1ml lb培养基的试管中,置于37℃,220rpm摇床中,培养16h;将悬浊菌液进行标准化稀释,以lb空白培养基为对照,通过平板克隆计数与菌液光密度值之间的关系可得,测量od
600
=0.5时,菌液浓度为2
×
109cfu/ml,将调整后的菌液悬浮液稀释为1
×
106cfu/ml待用。
28.(2)抗菌剂制备:用dmso将黄芩素粉末溶解为终浓度为20mg/ml的溶液,以二倍稀释法将其稀释为640、320、160、80、40、20μg/ml待用;将化合物4deo
‑
glcnac用高压灭菌双蒸水溶解为终浓度为200mg/ml的溶液,以二倍稀释法将其稀释为40、20、10、5、2.5mg/ml待用;将已配制好的保存浓度为100mg/ml的amp
+
以二倍稀释法稀释成浓度梯度为0.25、0.5、1、2、4、8、16、32、64、128μg/ml待用;将阴性对照化合物glcnac用高压灭菌双蒸水溶解为终浓度为200mg/ml的溶液,以二倍稀释法将其稀释为40、20、10、5、2.5mg/ml待用。所用配备抗菌剂均用0.22μm的滤膜过滤除菌。
29.(3)加样:吸取已定量好的接种物1ml加入到每个含有1ml已稀释的抗菌剂的试管中和不含抗菌剂的阳性对照管中,并混合。这导致每个抗菌剂浓度的稀释为1:2,接种剂的稀释为1:2,使每个试管中黄芩素的终浓度分别为320、160、80、40、20、10μg/ml,使每个试管中4deo
‑
glcnac的终浓度分别为20、10、5、2.5、1.25mg/ml;使每个试管中glcnac的终浓度分别为20、10、5、2.5、1.25mg/ml;对于amp
+
我们使用肉汤微量稀释法,将已经定量好的菌液与药物浓度以1:1的比例各取50μl于96孔板中的每个孔中,使每个样品孔中amp
+
的终浓度分别为0.125、0.25、0.5、1、2、4、8、16、32、64μg/ml,并以不含amp
+
的孔作为阳性对照,只含有100μl lb培养基的孔作为阴性对照。
30.(4)测定mic结果:将待测试管样品于摇床内37℃,转速220rpm和96孔板放于恒温培养箱孵育培养24h,读取结果时,阴性对照为清澈透明,阳性孔呈现为悬浊菌液,待测样品中能够肉眼看不见明显菌落存在即为最低抑菌浓度。结果见图1:在稀释倍数为2.5倍的lb培养基中,随着药物浓度的升高,细菌的生长受到抑制,4deo
‑
glcnac对金葡菌n315的最小抑菌浓度为20mg/ml(图1
‑
a);在稀释倍数为5倍的培养基中,4deo
‑
glcnac的有效抗菌浓度为10mg/ml(图1
‑
b);而在阴性对照组中,不同浓度的glcnac在不同稀释倍数的lb培养基中对金葡菌的生长基本没有抑菌作用(图1
‑
c)。
31.实施例3 4deo
‑
glcnac对金黄色葡萄球菌生长趋势影响实验
32.为了更好地说明4deo
‑
glcnac对金黄色葡萄球菌的体外抑菌作用,我们监测了4deo
‑
glcnac对金黄色葡菌球菌生长曲线的影响。以glcnac作为对照组,将不同浓度的4deo
‑
glcnc和glcnac与金黄色葡萄球菌分别共培养48h,同时测定不同时间点的菌液在吸光度600nm的od值。
33.(1)菌液制备:于金葡菌n315平板用无菌枪尖挑取单个菌落到1ml lb培养基的试管中,置于37℃,220rpm摇床中,培养16h;将悬浊菌液进行标准化稀释,以lb空白培养基为对照,通过平板克隆计数与菌液光密度值之间的关系可得,测量od
600
=0.5时,菌液浓度为2
×
109cfu/ml。
34.(2)抗菌剂制备:将化合物4deo
‑
glcnac用高压灭菌双蒸水溶解为终浓度为200mg/ml的溶液,以二倍稀释法将其稀释为20、10、5、2.5、1.25、0mg/ml待用。以glcnac为阴性对照进行同样方法进行样品制备。所用配备抗菌剂均用0.22μm的滤膜过滤除菌。
35.(3)加样:将活化的细菌再次按1:1000分别接种在盛有1ml新鲜的2.5倍和5倍稀释的lb培养基的试管中,并按设计好的浓度梯度依次将药物加入试管中。
36.(4)测样品值:将样品放于摇床内37℃,220rpm孵育培养,固定时间点取100μl菌液于96孔板内进行od
600
检测,通过od值评价4deo
‑
glcnac的抑菌效果。结果见图2:在2.5倍稀释和5倍稀释但nacl浓度不变的lb培养基中,相应浓度的4deo
‑
glcnac在48h内有效抑制金黄色葡萄球菌的生长(图2
‑
a,b)。而阴性对照组中,不同浓度的glcnac在不同稀释倍数的lb培养基中对细菌的生长基本没有太大影响;与空白组(con)相比,在营养匮乏的培养环境中,glcnac可以作为营养物质促进细菌生长(图2
‑
c,d)。
37.实施例4分子探针荧光标记实验评估4deo
‑
glcnac对细菌细胞壁的影响。
38.为了探究4deo
‑
glcnac对金黄色葡萄球菌细胞壁的影响,我们使用化合物glcnaz和4deo
‑
glcnaz作为小分子探针作用于金黄色葡萄球菌。通过荧光标记实验,使用膜染料alk488和核染料pi对金葡菌进行处理,在共聚焦超分辨显微镜观察标记效果。
39.(1)菌株活化:于金葡菌n315平板用无菌枪尖挑取单个菌落到1ml lb培养基的试管中,置于37℃,220rpm摇床中,培养16h;菌液浑浊活化。
40.(2)制样:将过夜活化的金葡菌按1:1000稀释接种在1ml 2.5倍稀释的lb培养基中,并分别加入10mg相应的分子探针glcnaz和4deo
‑
glcnaz,使其终浓度为10mg/ml,于37℃摇床220rpm,培养6h后,然后测量od
600
值约为0.53。
41.(3)取100μl菌液至1.5ml离心管,6000g条件下离心5min后,弃掉上清液并用200μl 1
×
pbs清洗三遍,将菌液悬浮于100μl的pbs溶液中,分别加入终浓度为1mm cuso4溶液(现用现配),100μm tbta(100mm保存于dmso),1mm tcep(现用现配)和20μm的alk488,将反应液混匀于室温避光孵育30min。
42.(4)将反应完的样品于6000g离心5min,弃掉上清液,并用200μl pbs清洗两遍后定容于100μl pbs溶液中,在溶液中加入30μm碘化丙啶(pi),于室温避光孵育15min后,6000g离心5min弃掉过量的染料并用pbs清洗三遍。
43.(5)将荧光标记完的细菌定容于100μl pbs溶液中,取20μl菌液分别滴加在粘附载玻片中心,并用盖玻片盖好,指甲油封片。于超分辨共聚焦显微镜488nm和594nm下观察荧光标记的细菌。结果见图3,glcnaz和4deo
‑
glcnaz都可以代谢合成到细胞壁上,空白组由于没有引入叠氮标记的糖结构,故无绿色荧光(contrl组);glcnaz由于不影响细胞壁骨架的完整性,所以pi染料不能够通过细胞壁进入细菌内将核区染成红色,因此在波长594nm发射波长下观测不到红色荧光,融合之后也看不到红色荧光标记的核区(glcnaz组);基于前期的理论假设,4deo
‑
glcnaz可以通过细菌的生物合成途径被代谢标记到细胞壁上,并且会干扰细胞壁nam与nag之间的连接,使得细胞壁结构破损,而pi染料可以透过结构不完整的细胞
壁,使得细菌的核区呈现红色;融合之后可以看到绿色荧光标记的细胞壁包裹着pi红色染料着色的核区(4deo
‑
glcnaz组)。以上实验结果说明了经4deo
‑
glcnac处理的金黄色葡萄球菌细胞壁是破损的。
44.实施例5 4deo
‑
glcnac与黄芩素联合体外抑菌实验
45.根据化合物4deo
‑
glcnac对细菌细胞壁的作用方式以及分析抗菌药物的作用机理,我们选取了一种具有广谱抗菌活性的黄酮类化合物黄芩素,其对耐甲氧西林金黄色葡萄球菌的作用机制是通过影响细菌膜透性、抑制蛋白质合成、影响sdh和dna拓扑异构酶的活性发挥抗菌作用。首先配制系列浓度梯度的4deo
‑
glcnac,然后分别加入等量的黄芩素,在不同时间点测试样品od600,评价4deo
‑
glcnac和黄芩素联合用药的抑菌效果。
46.(1)菌液制备:于金葡菌n315平板用无菌枪尖挑取单个菌落到1ml lb培养基的试管中,置于37℃,220rpm摇床中,培养16h;将悬浊菌液进行标准化稀释,以lb空白培养基为对照,通过平板克隆计数与菌液光密度值之间的关系可得,测量od
600
=0.5时,菌液浓度为2
×
109cfu/ml,将调整后的菌液悬浮液稀释为1
×
106cfu/ml待用。
47.(2)抗菌剂制备:将化合物4deo
‑
glcnac用高压灭菌双蒸水溶解为终浓度为200mg/ml的溶液,以二倍稀释法将其在试管中以2.5倍稀释的lb培养基稀释终浓度为20、10、5、2.5、1.25、0mg/ml待用。以glcnac为阴性对照以同样方法进行样品制备。用dmso将黄芩素粉末溶解为终浓度为20mg/ml的溶液,向含有不同浓度的4deo
‑
glcnac或者glcnac的试管中加入等量的黄芩素,使其终浓度分别为5μg/ml、10μg/ml和20μg/ml待用。所用配备抗菌剂均用0.22μm的滤膜过滤除菌。
48.(3)加样:将标准化的菌液分别加入准备好的药物浓度梯度试管中。
49.(4)测样品值:将样品放于摇床内37℃,220rpm孵育培养,固定时间点取100μl菌液于96孔板内进行od
600
检测,通过od值评价4deo
‑
glcnac和黄芩素联合抑菌效果。结果见图4:当黄芩素单独作用于金黄色葡萄球菌时,其最低抑菌浓度为160μg/ml,与文献报道值相当(图4a);5μg/ml黄芩素与10mg/ml4deo
‑
glcnac在8h内可显著抑制细菌的生长(图4b),当黄芩素浓度为10μg/ml时抑制时长可延长至12h(图4c),而相同浓度黄芩素单独用药时,细菌od600值均可达到0.3左右(图4a),以上结果表明4deo
‑
glcnac与黄芩素联合用药可显著提高黄芩素靶向细胞内的药物活性。而glcnac阴性对照组,在不同浓度黄芩素联合作用下均没有表现出抑菌活性(图4d
‑
f)。
50.实施例6 4deo
‑
glcnac和黄芩素联合体内抗菌实验
51.以上实验结果表明4deo
‑
glcnac和黄芩素对金黄色葡萄球菌具有良好的体外抗菌效果。随后,为了评价4deo
‑
glcnac和黄芩素在体内的抗菌疗效。我们将构建成功的小鼠皮肤感染模型随机分为5组,每组5只,分别为glcnac组,空白组,黄芩素组,4deo
‑
glcnac,4deo
‑
glcnac/黄芩素联合用药组进行用药治疗,创伤部位皮下给药,3
×
20μl/天;40h后,通过拍照观察小鼠创伤表面愈合程度和取小鼠创伤皮肤进行cfu统计,评价各组药物的抗菌效果。
52.6.1小鼠皮肤感染模型构建与治疗实验
53.(1)实验选用25只8周龄雄性balb/c小鼠进行提前一天背部脱毛,并随机分为5组,每组5只,分为空白组,glcnac组,黄芩素组,4deo
‑
glcnac,4deo
‑
glcnac/黄芩素联合用药组。
54.(2)用无菌枪尖在金葡菌n315平板挑取单个菌落到1ml lb培养基的试管中,置于37℃,220rpm摇床中,培养16h;将悬浊菌液进行标准化稀释,以lb空白培养基为对照,通过平板克隆计数与菌液光密度值之间的关系可得,测量od
600
=0.5时,菌液浓度为2
×
109cfu/ml,将调整后的菌液悬浮液稀释为1
×
107cfu/ml。
55.(3)将培养的金黄色葡萄球菌20μl(1
×
107cfu/ml)用0.3
×
13rwlb一次性无菌注射器针头接种在小鼠背部皮肤,16h后观察小鼠造模情况。然后分别对各组小鼠进行相应的用药治疗,即创伤部位皮下给药,3
×
20μl/天,40h后进行拍照,观察小鼠模型造模以及治疗前后情况,评价各组药物的抗菌效果。结果见图5,与其他组相比,4deo
‑
glcnac(20mg/ml)与黄芩素(40μg/ml)联合用药可以有效抗菌,并且促使伤口结痂愈合(图5c)。取小鼠皮肤进行cfu统计,结果表明4deo
‑
glcnac和黄芩素联合治疗与空白组对照有明显的菌落数量级降低,并且相对于单独用药治疗也有明显的抑菌效果(图5b),表明了4deo
‑
glcnac和黄芩素联合治疗金葡菌感染创伤皮肤具有良好的治愈效果。
56.6.2小鼠感染创伤皮肤cfu计数
57.(1)将小鼠颈椎脱臼处死,取下小鼠感染部位的皮肤,剪碎后于3ml无菌lb培养基中充分研磨,稀释成不同梯度,并各取100μl均匀涂于lb固体培养板。
58.(2)将固体培养板放于37℃恒温培养箱孵育18h,取出进行单菌落计数。
59.6.3小鼠感染创伤皮肤he染色
60.随后,我们取小鼠背部感染皮肤区域通过组织学he染色进行病理学分析。
61.(1)小鼠感染皮肤组织固定:小鼠颈椎脱臼处死,取其皮肤,用pbs反复冲洗干净,放于4%多聚甲醛固定48h。
62.(2)石蜡切片制作:
63.(a)将皮肤组织展平放于白色包埋框里,然后铅笔标记清楚不同分组样品。
64.(b)细流水冲洗组织30min,然后将组织放于包埋框中,然后放于自动脱水机中进行脱水、透明和浸蜡。程序:75%乙醇1h、85%乙醇1h、90%乙醇1h、95%乙醇1h、100%乙醇i 1h、100%乙醇ii 1h、二甲苯i 45min、二甲苯ii 45min、石蜡i 1h,石蜡ii 1h,石蜡iii 45min。
65.(c)浸蜡结束后将组织取出,立即放入包埋机中融化的蜡中。先倒入一定量的蜡液,然后将组织在包埋模具中直立起来,等到蜡液半凝固状态时,再灌满蜡液。置于室温冷却,然后放于冷冻台进行快速凝固。
66.(d)用组织切片机进行切割蜡块组织,使每个切片为厚度5μm,放于37℃水浴锅中展平,轻轻贴于载玻片上,烘烤4h。
67.(3)组织he染色
68.(a)脱蜡:二甲苯i、ii、iii各10min,无水乙醇i、ii、95%乙醇、90%乙醇、80%乙醇、70%乙醇各5min;
69.(b)复水:流水缓慢冲洗10min;
70.(c)苏木素染核:将苏木素用移液枪滴于组织上,染色1min,流水冲10min;
71.(d)分化透明:1%盐酸酒精分化1s,流水冲洗返蓝10min,镜下观察染核;
72.(e)伊红染细胞质:将伊红用移液枪滴于组织上,染色3min,流水冲1min,
73.显微镜下观察细胞质染色情况;
74.(f)封片:中性树脂胶封片;
75.(g)全自动显微镜扫描切片进行镜下观察。
76.结果见图6:在正常(健康、未感染)的皮肤组织样本中,可以清楚地看到皮肤组织分层(图6a)。与对照组相比,金黄色葡萄球菌感染的皮肤表现出严重的炎症反应,真皮及皮下组织可见大量的炎性细胞浸润(图6b)。相反,4deo
‑
glcnac和黄芩素联合治疗的切片显示出最轻的炎症反应和极少的炎细胞浸润,并在受伤皮肤部位聚集了大量的脂肪细胞(图6e)。在4deo
‑
glcnac和黄芩素单独治疗的感染皮肤相对于未治疗的感染皮肤炎症反应较轻(图6c
‑
d)所示。数据表明,在该小鼠模型中,4deo
‑
glcnac和黄芩素联合用药更有效的降低了金黄色葡萄球菌的感染,表现出了良好的治愈效果。
77.6.4小鼠感染创伤皮肤免疫荧光染色
78.中性粒细胞是对抗突破上皮屏障的细菌病原体的第一道防线。在细菌入侵的短时间内,中性粒细胞对包括趋化因子和细胞因子在内的可溶性因子做出反应,并被招募到感染部位,开始吞噬病原体。为了进一步确定小鼠背部感染皮肤经药物治疗后的炎症细胞的变化,我们对小鼠创伤皮肤进行了免疫荧光染色分析,通过中性粒细胞特异性荧光抗体ly6g评价4deo
‑
glcnac和黄芩素的治疗效果。
79.(1)将已经制备好的石蜡切片放于65℃烘箱烤40min至干燥;
80.(2)切片脱蜡复水:二甲苯i、ii各15min,然后在通风橱中晾干。之后将切片按以下程序继续处理:无水乙醇i、ii、90%乙醇、85%乙醇、70%乙醇各5min,之后用ddh2o冲洗3次,每次5min;
81.(3)抗原修复:将切片浸入枸橼酸盐缓冲液(ph 6.0)中,然后在微波炉内煮沸后进行断电,然后每隔2min,用中高火加热20s,这个过程持续15min后结束;
82.(4)进行pbs洗3次,每次5min;
83.(5)利用2%bsa封闭缓冲液室温封闭2h;
84.(6)一抗:将一抗以说明书推荐比例用含有2%bsa,0.2%tritonx
‑
100的pbs稀释,4℃孵育过夜;
85.(7)用pbst洗涤3遍,每遍5min;
86.(8)二抗:用含有2%bsa,0.2%tritonx
‑
100的pbs稀释二抗,室温孵育60min;
87.(9)用pbst洗涤3遍,每遍5min;
88.(10)dapi染细胞核:将dapi用pbs按1:200稀释,室温孵育7min;
89.(11)用pbst洗涤3遍,每遍5min,再用ddh2o水洗两遍,每遍5min;
90.(12)封片,在荧光显微镜下观察分析。
91.结果见图7,在未经治疗的感染小鼠皮肤中强烈的绿色荧光表明有大量的中性粒细胞聚集(normal组);在药物治疗组中,4deo
‑
glcnac和黄芩素单独治疗组中性粒细胞逐渐减少(untreated);黄芩素和4deo
‑
glcnac联合治疗组中性粒细胞减少趋于正常组织(图7m);再次说明了黄芩素和4deo
‑
glcnac联合用药能有效的减轻小鼠背部感染皮肤的炎症反应。
92.实施例7耐amp+金黄色葡萄球菌菌株的诱导实验及mic值测定
93.上述实验结果已经表明4deo
‑
glcnac对正常金黄色葡萄球菌具有良好的抑菌作用以及与黄芩素联合能有效地治疗由金葡菌引起的皮肤感染。为了更好的说明4deo
‑
glcnac
是否对耐药菌株也具有同样的效果,我们首先诱导耐amp
+
金黄色葡萄球菌,即金黄色葡萄球菌在亚mic
‑
amp
+
的生长环境中不断培养,最终诱导出能在amp
+
终浓度为28μg/ml的环境中生长的耐药菌株,用肉汤微量稀释法对其mic测定。
94.(1)耐amp+菌株诱导:用无菌枪尖于金葡菌n315平板挑取单个菌落到1ml lb培养基的试管中,置于37℃,220rpm摇床中,培养16h;进行菌液活化。将菌液以1:100的比例接种于含有amp+的亚抑菌浓度(0.5
×
mic)的lb培养基中,37℃,220rpm,培养16h;以此方法持续培养11代作为最终耐药检测菌株。取菌液500μl和50%的甘油以1:1的比例混匀,冻存于
‑
80℃保存备用。
95.(2)最低抑菌浓度(mic)测定
96.(a)将上步耐药菌悬浊液进行标准化稀释,以lb空白培养基为对照,通过平板克隆计数与菌液光密度值之间的关系可得,测量od600=0.48时,菌液浓度约为2
×
109cfu/ml,将调整后的菌液悬浮液稀释为1
×
106cfu/ml待用。
97.(b)将已配制好的保存浓度为100mg/ml的amp+以二倍稀释法稀释成浓度梯度为0.25、0.5、1、2、4、8、16、32、64、128、256μg/ml待用;以二倍稀释法将终浓度为200mg/ml的4deo
‑
glcnac稀释为40、20、10、5、2.5mg/ml待用;
98.(c)将调整后的接种物50μl和50μl稀释系列抗菌剂以1:1加入96孔板中并轻轻混匀。4deo
‑
glcnac在孔中的最终浓度分别为20、10、5、2.5、1.25mg/ml,amp+在孔中的最终浓度分别为0.125、0.25、0.5、1、2、4、8、16、32、64、128μg/ml。
99.(d)盖上板盖,将96孔板放于电热恒温培养箱37℃培养18h,通过肉眼观察菌液未浑浊的浓度即为最小抑菌浓度,见表1。然后通过全波长酶标仪测量波长600nm处的od值。
100.表1 4deo
‑
glcnac对耐amp+金葡萄菌最低抑菌浓度测定。
101.表1 4deo
‑
glcnac对耐amp+金葡菌最低抑菌浓度测定
[0102][0103]
结果见图8:4deo
‑
glcnac对耐amp
+
金黄色葡萄球菌的最低抑菌浓度为20mg/ml(图8b),而amp
+
对其耐药菌株的最低抑菌浓度为64μg/ml(图8a)。初步表明相同mic的4deo
‑
glcnac对耐药菌株仍具有显著的抑菌效果,为临床治疗耐药菌株候选药物的选择提供新思路。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1