一种用于递送白藜芦醇药物的纳米脂质颗粒载体及其制备方法和应用与流程
1.本发明属于生物医学技术领域,具体涉及一种用于递送白藜芦醇药物的纳米脂质颗粒载体及其制备方法和应用。
背景技术:
2.近年来,随着生活水平的提高,人们的健康意识也逐渐增强,具备营养功效的白藜芦醇相关产品渐渐走俏,受到众多人群的关注。
3.白藜芦醇(反式白藜芦醇;反式
‑
3,5,4'
‑
三羟基半胱氨酸)属于一类多酚类物质,天然存在于葡萄、红葡萄酒、花生和其他花生制品中。近年来的研究发现,白藜芦醇具有广泛的生物学效应,包括抗炎和具有神经保护的特性,并能防止氧化应激和癌症。大量的流行病学和临床证据证实,白藜芦醇具有抗菌抗炎、抗氧化、保肝、保护心脑血管等作用。
4.然而,白藜芦醇在临床中的作用是有限的,在白藜芦醇的临床应用中,口服是其最主要的给药途径,而药物的水溶性、膜通透性和代谢稳定性决定了小分子药物的口服生物利用度。白藜芦醇作为脂溶性物质,在水中的溶解性很差(0.02
–
0.03mg/ml),所以通过口服的吸收率极低,并且其主要活性形式trans
‑
白藜芦醇在光下的稳定性非常差,容易异构为无活性的cis
‑
白藜芦醇。近年来,科学工作者们对白藜芦醇理化性质及代谢稳定性问题进行了各种制剂学研究:已有动物实验研究表明,胡椒碱可显著提高大鼠血清白藜芦醇的峰浓度(cmax)和药
‑
时曲线下面积(auc)。但人体试验发现,虽然胡椒碱可以增强白藜芦醇对脑血流量的影响,但并不能增加其生物利用度。而酪蛋白制成的酪蛋白
‑
白藜芦醇复合物可以提高白藜芦醇的稳定性,延长产品保质期并改善其水溶性,但酪蛋白与白藜芦醇亲和力不足,导致其包封率较低。在增加白藜芦醇水溶性的制剂方面,如环糊精(cyclodextrin,cd),对白藜芦醇增溶效果好,并可在一定程度上提高白藜芦醇的紫外照射稳定性,但并不能改善其药动学行为。
5.本发明使用基于脂质的纳米颗粒作为白藜芦醇药物的递送载体,显著提高了药物的水溶性,同时也能保证药物的稳定性。已经证明,纳米脂质颗粒作为一种载体可以提高白藜芦醇的口服生物利用度和治疗潜力。
技术实现要素:
6.本发明所解决的技术问题是:本发明以磷脂作为脂质载体,胆固醇作为稳定剂,用于封装白藜芦醇药物,制成纳米脂质体颗粒,以提高药物水溶性,稳定性,进而获得理想生物利用度的白藜芦醇口服药物。
7.为了解决上述技术问题,本发明提出了一种用于递送白藜芦醇药物的纳米脂质颗粒载体,所述纳米脂质颗粒以磷脂作为脂质载体,胆固醇作为稳定剂,封装白藜芦醇药物。
8.优选的,所述用于递送白藜芦醇药物的纳米脂质颗粒载体以甘露醇作为冷冻保护剂。
9.优选的,所述胆固醇和卵磷脂的质量比在约1:1至约1:10的范围内。
10.优选的,所述封装白藜芦醇药物与胆固醇质量比在约1:2至约1:10的范围内,白藜芦醇药物与卵磷脂的质量比在约1:5至约1:100的范围内。
11.优选的,所述纳米脂质颗粒直径为约70至约500nm。
12.上述用于递送白藜芦醇药物的纳米脂质颗粒载体的制备方法,步骤如下:
13.(1))将卵磷脂和胆固醇溶解在氯仿和甲醇的混合溶液中,得溶液i;(2)将白藜芦醇溶解在甲醇中,得溶液ii;
14.(3))混合溶液i和溶液ii,将得到的溶液旋转蒸发以去除有机溶剂,得到黄色薄膜;
15.(4)加水旋转使脂质薄膜沉淀,得到脂质体乳液,然后将该乳液冷却到后,超声处理,冷冻干燥后,得到纳米脂质颗粒。
16.所述步骤(1)卵磷脂和胆固醇质量比10:1,氯仿和甲醇体积比2:1,所述步骤(2)将白藜芦醇溶解在甲醇中时,白藜芦醇与甲醇的质量比1:3。
17.所述步骤(3)溶液i和溶液ii混合后在旋转蒸发器上于51℃、150rpm和500mbar的条件下去除溶剂。
18.本发明的有益效果是:本发明采用天然磷脂类化合物制备出具有双分子层结构的纳米级囊泡,磷脂作为细胞膜的主要组成成分,其结构可实现对水溶性和脂溶性活性药物的有效包裹,对活性药物有保护、运载及缓释等功能。本发明制备所得纳米脂质体颗粒使得白藜芦醇的溶解度大大提高,包封率高,简单易得,且方便保存,仅使用甲醇、氯仿作为有机溶剂,方法简便,重复率高。
附图说明
19.图1为本发明所述用于递送白藜芦醇药物的纳米脂质颗粒在水中乳化获得的乳浊液在室温放置48小时,7天,14天的液体分层状态
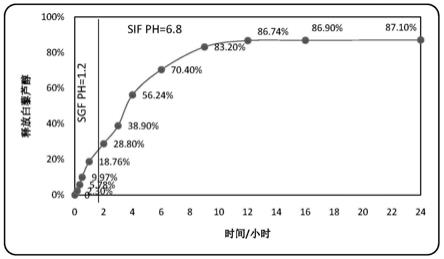
20.图2为本发明所述纳米脂质颗粒递送白藜芦醇药物时,在模拟胃液(sgf ph=1.2,0
‑
2小时)和模拟肠液(sif ph=6.8,2
‑
24小时)中的释放情况
具体实施方式
21.实施例1本发明所述用于递送白藜芦醇药物的纳米脂质颗粒载体的制备
22.将卵磷脂和胆固醇(质量比10:1)溶解在氯仿和甲醇(体积比2:1)的混合溶液中,得溶液i。将白藜芦醇溶解在甲醇中(质量比1:3),得溶液ii。取溶液i和溶液ii(体积比3:1),加入250ml圆底烧瓶中,得到淡黄色,有轻微浑浊的溶液。在旋转蒸发器(heidolph,hei
‑
vap core)上于51℃、150rpm和500mbar的条件下去除溶剂,得到淡黄色薄膜。在烧瓶中加入20ml水。51℃下旋转1小时使脂质薄膜沉淀下来,得到脂质体乳液。然后将这种轻微混浊的乳液在冰水浴中冷却到5℃,用超声波均质器(bandelinsonopuls hd 2070)以50%的功率强度超声处理5分钟。将脂质体冷冻干燥,得到纳米脂质颗粒,甘露醇作为冷冻保护剂。
23.实施例2纳米脂质颗粒作为白藜芦醇的载体可以显著提高水溶性和稳定性
24.1.水溶性分析
25.将上述制备获得的32.24mg上述纳米脂质颗粒(含0.575mg白藜芦醇)在1150μl水
中乳化并超声处理5分钟,得到牛奶状的乳剂,其白藜芦醇的总浓度为0.5mg/ml,对比现有技术中报道的白藜芦醇的溶解度(0.03mg/ml),提高了16倍。
26.2.稳定性分析
27.将上述制备获得的32.24mg纳米脂质颗粒(含0.575mg白藜芦醇)在1150μl水中乳化并超声处理5分钟,得到的乳液置于室温不遮光放置,观察其外观变化,结果显示7天内无明显变化。
28.将纳米脂质颗粒置于室温不遮光放置,在预定时间(24小时,7天,1个月)取纳米颗粒样品,进行粒径和粒度分布分析,zeta电位分析,包封效率分析,方法如下所示2.1—2.3,结果如表1所示。
29.2.1粒径和粒度分布分析
30.通过使用zetasizernano
‑
zs90(malvern instruments ltd.,worcestshire,uk)在25℃下的动态光散射(dls)测量获得的脂质纳米颗粒的尺寸和多分散指数(pdi)。将冻干的纳米粒子重新分散在纯水中,并进行适当稀释,搅拌10分钟。测量以一式三份的方式进行(进行三次读数)。
31.2.2zeta电位分析
32.测量制备的纳米脂质颗粒样品的zeta电位以评估其表面电荷和稳定性。纳米颗粒的zeta电位是通过使用zetasizernano
‑
zs90(malvern instruments ltd.,worcestershire,uk)在25℃下测定颗粒的电泳迁移率来评估的。将冻干的纳米粒子重新分散在纯水中作为分散介质来制备样品。对每个样品重复测量三次。
33.2.3包封效率(ee)测定
34.取实施例1中制备的2ml脂质体乳液,通过离心过滤器(ultra
–
2ml,mwco 3k,4000g centrifuge,40min)过滤。收集滤液,使用紫外可见光光谱仪(vwr uv3100
‑
pc)在306nm处测量吸光度,根据校准图计算未被包覆的白藜芦醇的浓度。包封效率ee根据以下公式计算并列于表1。
[0035][0036]
表1:白藜芦醇纳米脂质体颗粒的平均直径、多分散指数、zeta电位和包封率。
[0037][0038]
通过上述稳定性分析表明,本发明制备的白藜芦醇纳米脂质体颗粒在常规环境下稳定性良好,1个月内无明显变化。白藜芦醇在纳米脂质体中的包封效率非常高(超过
80%),表明它被优先分配到脂质体中。所开发的纳米颗粒可以被认为是物理稳定的,因为zeta电位的绝对值约为26mv,因此颗粒之间的静电排斥可以避免纳米颗粒的絮凝和聚集。此外,多分散指数为0.2,表明分散性分布是可以接受的,浮动较低。纳米颗粒的平均直径为190nm,适合于口服和胃肠道吸收,带负电荷的纳米颗粒可以与肠细胞相互作用,容易通过肠道屏障进行渗透。
[0039]
实施例3现有技术中复合纳米制剂在抗衰老去皱方面的应用与本发明所述作为白藜芦醇载体的纳米脂质颗粒区别
[0040]
现有技术中提供了一种抗衰老去皱复合纳米制剂及其制备方法和用途(申请号为202010155534),该纳米制剂含有羟丙基四氢吡喃三醇、视黄醇视黄酸酯和大豆异黄酮作为活性成分,表现出了明显的抗衰老、祛皱效果。该现有技术中所述复核纳米制剂及其应用与本发明所述作为白藜芦醇载体的纳米脂质颗粒区别如下所示:
[0041]
[0042][0043]
实施例4现有技术中一种姜黄素脂质载体与本发明所述作为白藜芦醇载体的纳米脂质颗粒区别
[0044]
现有技术中提供了一种姜黄素脂质载体及其制备方法(申请号为200810155819),该姜黄素脂质载体包含治疗有效剂量的姜黄素;脂质;适量的表面活性剂和助表面活性剂及附加剂。对于实验动物脑缺血再灌注后的神经元保护,维持血脑屏障的完整性,预防和治疗卒中后脑水肿有较好效果。然而该姜黄素脂质载体与本发明所述作为白藜芦醇载体的纳米脂质颗粒区别如下所示:
[0045]
[0046][0047]
实施例5纳米脂质体颗粒体外释放研究
[0048]
体外释放实验是在37℃的水槽条件下使用模拟胃液(sgf)和肠液(sif)进行的,其中含有0.5%的tween80以增加水溶性。在一个10.000mwco的透析盒(thermoscientific,rockford,il,usa)中加入事先分散在5ml的水中的含3mg白藜芦醇的纳米脂质体颗粒。在磁力搅拌下,将小盒放入一个含有500mlsgf(ph=1.2,37℃)的容器中。在sgf中2小时后,将盒子放入另一个含有500ml sif(ph=6.8,37℃)的容器中。在预定的时间(10min,20min,30min,1h,2h,3h,4h,6h,9h,12h,16h,24h)收集样品,并在定量前用0.45μm的膜过滤器(thermo,chino,ca,usa)过滤。通过hplc定量测定从制剂中释放的白藜芦醇的量。ph值为1.2和6.8的情况下,在含有0.5%的tween80的水中绘制游离白藜芦醇的校准曲线,范围为0.05
‑
6μg/ml。结果如图2所示,图2显示了白藜芦醇从脂质体纳米颗粒中的释放情况,即药物释放的累积百分比与时间的关系。在最初的2小时内,在sgf(ph 1.2)下,大约30%的负载白藜芦醇被释放。然后,6小时后(在sif),释放量超过白藜芦醇总含量的70%。实验开始12小时后,几乎所有被包裹的白藜芦醇都从纳米颗粒中释放出来。
[0049]
结果显示,在sif中培养9小时后,依旧有白藜芦醇药物从模拟肠液中纳米脂质体
颗粒中释放出来。在体外模拟胃液和肠液环境下,本发明对白藜芦醇起到了缓释作用,有利于其生物利用度的提高,更方便口服给药。
[0050]
以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1