替诺福韦酯的稳定药物组合物的制作方法
:
1.本发明属于药物制剂技术领域,涉及替诺福韦酯的稳定药物组合物,该药物组合物包含替诺福韦酯或其可药用盐和酸性化合物;以及制备稳定药物组合物的方法。
背景技术:
:
2.替诺福韦属于一类抗逆转录病毒药物,称为核苷酸类似物逆转录酶抑制剂,可通过阻断逆转录酶来发挥作用。替诺福韦通过与天然底物脱氧腺苷5'
‑
三磷酸竞争,并掺入dna后通过dna链终止来抑制hiv逆转录酶的活性。具体而言,这些药物是合成病毒dna所需的天然脱氧核苷酸的类似物,并且它们与天然脱氧核苷酸竞争并入到正在生长的病毒dna链中。
3.替诺福韦,由吉利德科学公司(gilead sciences)以商品名的富马酸替诺福韦酯(也称为替诺福韦df,替诺福韦酯,tdf,bis
‑
poc
‑
pmpa,9
‑
[(r)
‑2‑
[[双[[(异丙氧基羰基)氧基]甲氧基]氧膦基]甲氧基]
‑
丙基]腺嘌呤富马酸盐(1∶1),也与其他抗逆转录病毒药物联合销售。
[0004]
us5935946、us5922695、us5977089、us6043230、us6069249公开了替诺福韦、替诺福韦酯和富马酸替诺福韦。此外,us8049009公开了半富马酸替诺福韦酯及其制备方法。us20110009368公开了替诺福韦酯盐的各种盐形式,例如琥珀酸盐、酒石酸盐、糖精、柠檬酸盐、水杨酸盐。
[0005]
wo2010142761公开了替诺福韦酯的琥珀酸酯和含有替诺福韦酯的琥珀酸酯的各种剂型。
[0006]
ep2389929a1公开了通过直接压制制备的替诺福韦或其可药用盐的药物组合物,其包括占总重量5%
‑
15%的淀粉或淀粉混合物。
[0007]
wo2006135932公开了替诺福韦酯或其可药用盐高度不稳定并迅速降解。将另外两种药物与替诺福韦或其可药用盐简单地组合以制备通过湿法制粒制备的单一的、基本上均质的组合物不能产生化学稳定的片剂,因为替诺福韦会迅速降解。因此,需要开发稳定的替诺福韦酯或其可药用盐的药物组合物。
[0008]
本发明涉及一种稳定的药物组合物,其包含活性剂,替诺福韦酯或其可药用盐和酸性化合物。该组合物可以进一步包含用于制备该组合物的其他添加剂。本发明还涉及使用酸性化合物作为稳定剂制备替诺福韦酯或其可药用盐的稳定药物组合物的方法。
技术实现要素:
[0009]
本发明的一个方面涉及一种稳定的药物组合物,其包含活性剂和酸性化合物,替诺福韦酯或其可药用盐。
[0010]
本发明的另一方面涉及一种制备稳定的药物组合物的方法,替诺福韦酯或其可药用盐的活性剂和酸性化合物。
[0011]
本发明涉及稳定的药物组合物及其制备方法,所述药物组合物包含含有有效量的
替诺福韦酯或其可药用盐的活性剂。本发明的组合物可以给予需要用于治疗hiv或aids的药物的患者。
[0012]
本文术语“替诺福韦酯或其可药用盐”包括各种形式的替诺福韦酯或其可药用盐,例如水合物、溶剂化物、多晶型物、异构体、立体异构体、对映异构体、外消旋体、酯、前药、复合物或其混合物,以及本领域已知的所有其他形式。替诺福韦酯或其可药用盐可以不同的物理形式存在,例如无定形形式、一种或多种晶体形式(例如无水、溶剂化或水合形式)、不同晶体形式的混合物(例如无水、溶剂化或水合形式)或无定形混合物和晶体形式(例如无水、溶剂化或水合形式)。这些形式中的每一种都包括在本发明中所用的术语“替诺福韦酯或其可药用盐”中。
[0013]
本文术语“可药用盐”是指对于患者例如哺乳动物可接受的盐(例如,某种在一定剂量下对哺乳动物安全的盐)。这种盐可以衍生自可药用的无机或有机碱以及可药用的无机或有机酸。
[0014]
制剂中包含的治疗化合物可以配制成其可药用盐。如本文所用,“可药用盐”是指所公开化合物的衍生物,其中母体治疗化合物通过制备其酸式或碱式盐而被修饰。可药用盐的实例包括但不限于碱性残基例如胺的无机或有机酸盐;酸性残基的碱金属或有机盐,例如羧酸等。可药用盐包括由无毒的无机酸或有机酸形成的母体化合物的常规无毒盐或季铵盐。例如,这种常规的无毒盐包括衍生自无机酸,例如盐酸、氢溴酸、硫酸、磺酸、氨基磺酸、磷酸、硝酸等;由有机酸,例如氨基酸、乙酸、丙酸、琥珀酸、糖精、乙醇酸、硬脂酸、乳酸、苹果酸、富马酸、糖精、酒石酸、柠檬酸、抗坏血酸、巴莫酸、马来酸、羟基马来酸、苯乙酸、谷氨酸、苯甲酸、水杨酸、磺胺酸、2
‑
乙酰氧基苯甲酸(2
‑
acetoxybenzoic)、氟萘酸、甲苯磺酸、甲磺酸、乙烷二磺酸、草酸、羟乙磺酸、油酸、甲酸、三氟乙酸邻苯二甲酸、甲磺酸、对甲苯磺酸等。替诺福韦酯的优选盐是盐酸盐、硝酸盐、磷酸盐、硫酸盐、富马酸盐、琥珀酸盐、草酸盐、酒石酸盐、抗坏血酸盐、苯甲酸盐、拉卡酸盐、苹果酸盐、马来酸盐、柠檬酸盐、二氮杂酸盐、硬脂酸盐。
[0015]
本发明的可药用盐可以通过常规化学方法由含有碱性或酸性部分的母体治疗性化合物合成。通常,这些盐可以通过使上述化合物的游离酸或碱形式与预定量的合适的碱或酸在水中或在有机溶剂中或在两者的混合物中反应来制备。还有,理想为选择非水性介质。本文提及可用盐的清单可参照1985年由宾夕法尼亚州州伊斯顿市mack publishing company出版社出版的《雷明顿药物科学》(remington's pharmaceutical sciences),第17版,第1418页。
[0016]
本文的活性成分,活性剂和药物可以互换使用。
[0017]
如本文所用,除非另有说明,否则“%”是指物质相对于整个组成的重量百分比。
[0018]
术语“包含”在本文中与“包括”,“包含”或“由...表征”同义,定义为包括性或开放性的,并且不排除其他未叙述的要素或方法步骤,除非上下文明确指出。
[0019]
本发明的涉及一种药物组合物,其包含活性剂,所述活性剂包含有效量的热熔挤出的替诺福韦酯或可药用盐。该组合物可以进一步包含用于制备该组合物的其他添加剂。
[0020]
酸性化合物的ph值根据以下条件测量。具体而言,使用市售的ph计在25℃下将酸性化合物以1%w/v溶解或分散在水中而得到的水溶液或分散液的ph值进行测定。在本发明的一个实施方案中,酸性化合物的水溶液的ph小于7,优选ph<5.5,更优选ph<5或ph<4。
[0021]
本发明中使用的“酸性化合物”,无机酸例如盐酸、氢溴酸、硝酸、硫酸、磷酸等,或有机酸,特别优选的实例包括可食用的有机酸,例如氨基酸、乙酸、己二酸、丙酸、丁酸、抗坏血酸、苯甲酸、油酸、琥珀酸、糖精、乙醇酸、硬脂酸、酒石酸、山梨酸、富马酸、戊二酸、戊酸酸、己酸、苯甲酸、乳酸、苹果酸、马来酸、羟基马来酸、丙二酸、柠檬酸、棕榈酸、马来酸酐、邻苯二甲酸酐、苯乙酸、谷氨酸、水杨酸、磺胺酸、2
‑
乙酰氧基苯甲酸酸、氟丁酸、甲苯磺酸、甲磺酸、乙烷二磺酸、草酸、异乙酸、油酸、甲酸、三氟乙酸邻苯二甲酸、甲磺酸、对甲苯磺酸等。有机酸可以是盐。与有机酸形成的盐的实例包括抗坏血酸钠、富马酸钠,并且与上述各个有机酸相似的具有有机酸的盐是优选的。这些有机酸及其盐可以单独使用,也可以同时使用两种以上。在制剂中用作稳定剂的酸性化合物可以与用于替诺福韦酯的可药用盐的化合物相同或不同。
[0022]
可药用有机酸优选具有至少约2的pk
a
,优选其中可药用有机酸具有约5.4或更小的pk
a
。可药用有机酸优选具有至少约2.5的pk
a
。尤其是,可药用有机酸的pk
a
为约2.5至约5.4。
[0023]
在一个实施方案中,要在制剂中用作稳定剂的酸性化合物须与用于替诺福韦酯的可药用盐的化合物相同。例如草酸的实例用作稳定含有草酸替诺福韦的制剂的稳定剂,富马酸用作稳定含有富马酸替诺福韦的制剂的稳定剂,丁二酸用作稳定含有琥珀酯替诺福韦的制剂的稳定剂。其他酸性化合物也可以组合使用。
[0024]
本发明的药物组合物中的酸性化合物的含量(%)优选为0.1~70%(更优选为0.5~50%),进一步优选为1~40%,特别优选为1~30%。在另一个实施方案中,其为0.01
‑
40%,优选0.05
‑
19%,更优选0.1
‑
10%。
[0025]
在本发明的药物组合物中,替诺福韦酯或其可药用盐与“酸性化合物”的混合比对替诺福韦酯或其可药用盐优选为药学活性成分:酸性化合物为1:0.001
‑
1:200,进一步优选1:0.015
‑
1:200,特别优选1:0.04
‑
1:100。
[0026]
本发明的另一个实施方案涉及富马酸替诺福韦、富马酸和一种或多种可药用辅料的稳定药物组合物。
[0027]
本发明的另一个实施方案涉及草酸替诺福韦、可药用辅料的稳定药物组合物。
[0028]
本发明的另一个实施方案涉及琥珀酸替诺福韦、可药用辅料的稳定药物组合物。
[0029]
本发明的另一个实施方案涉及酒石酸替诺福韦、酒石酸和一种或多种可药用辅料的稳定药物组合物。
[0030]
当制备本发明的药物组合物时,可以在制粒步骤或混合步骤中将“酸性化合物”作为粉末加入。另外,酸性化合物可通过在制粒步骤中溶解或分散在粘合剂溶液中或在薄膜涂覆步骤中溶解或分散在喷雾剂中进行喷洒。
[0031]
所述药物组合物包含活性剂,所述活性剂包含有效量的替诺福韦酯或可药用盐,其中所述活性剂的存在量基于所述药物组合物的总重量计大于重量的35%,优选为含量超过50%重量。
[0032]
根据本发明,该组合物还可包含润滑剂,例如硬脂酸、硬脂酸镁、硬脂酸钙、月桂基硫酸钠、氢化植物油、氢化蓖麻油、硬脂富马酸钠、大果酚或其混合物。优选的是,辅料包括至少一种选自硬脂酸、硬脂酸镁、硬脂酸钙和月桂基硫酸钠的润滑剂,更优选地选自硬脂酸、硬脂酸镁和硬脂酸钙。
[0033]
根据本发明,该组合物还可包含崩解剂。崩解剂的非限制性实例是交聚维酮,改性淀粉如淀粉羟乙酸钠,羧甲基纤维素如交联羧甲基纤维素钠、羧甲基纤维素钙及其混合物。崩解剂在组合物中的存在量为约1%至约20%,优选为约1%至约15%,更优选为约1%至约10%。
[0034]
根据本发明,该组合物还可包含表面活性剂。表面活性剂包括但不限于表面活性剂、环糊精及其衍生物、亲脂性物质或其任何组合。表面活性剂的非限制性实例包括非离子、阴离子、阳离子、两性或两性离子或其任何组合。优选使用非离子表面活性剂。
[0035]
根据本发明,该组合物还可包含粘合剂。根据本发明的组合物可以包含粘合剂,例如聚乙烯吡咯烷酮、聚乙烯吡咯烷酮/乙酸乙烯酯共聚物、聚乙烯醇、丙烯酸及其盐的聚合物、淀粉,纤维素和纤维素衍生物,例如甲基纤维素、乙基纤维素、羟乙基纤维素、羟丙基纤维素、乙基羟乙基纤维素,羟丙基甲基纤维素,羧甲基纤维素等,麦芽蛋白,蔗糖溶液,葡萄糖溶液,阿拉伯胶,黄cia胶,刺槐豆胶,明胶,瓜尔胶,淀粉,预胶化淀粉,部分水解的淀粉,藻酸盐,黄原胶或聚甲基丙烯酸甲酯,或其混合物。优选使用水溶性良好的粘合剂。在本发明的优选实施方案中,赋形剂包括至少一种选自羟丙基纤维素和聚维酮的粘合剂。粘合剂在组合物中的存在量为约1%至约25%,优选约1%至约15%,更优选约1%至约10%。
[0036]
根据本发明,其他輔料如稀释剂也用于制备药物组合物,例如微晶纤维素,粉状纤维素,乳糖(无水或一水合物)、可压缩糖、果糖、葡聚糖,其他糖例如甘露醇、山梨糖醇、乳糖醇、蔗糖或其混合物、硅化微晶纤维素、磷酸氢钙、碳酸钙、乳酸钙或其混合物。让片剂对用于压片的设备的粘附性降低的优选其他稀释剂是二氧化硅,优选使用胶体或热解法二氧化硅。辅料优选使用包括选自微晶纤维素和单水乳糖的至少一种稀释剂。
[0037]
该组合物还可以包含助流剂,例如胶体二氧化硅(例如)、三硅酸镁、粉末状纤维素、淀粉、滑石粉和磷酸三钙。
[0038]
可以使用药物组合物中常用的辅料,例如稀释剂、润滑剂和助流剂,本文引用大量合适物质相关的文献资料[详细请参见raymond c rowe,paul j sheskey和sian c owen编著的“药用辅料手册”(“handbook of pharmaceutical excipients”)(2006)]。
[0039]
考虑到药物组合物的特定期望性质,本领域技术人员可以在没有任何不适当的负担下通过常规实验选择并使用上述的一种或多种添加剂。每种添加剂的绝对量和相对于其他添加剂的量类似地取决于药物组合物的所需性质,并且也可以由技术人员在不会造成过多负担通过常规实验来选择。
[0040]
芯/片剂可以使用用于薄膜包衣的常规材料包衣。如graham cole编著的“药物包衣技术”(pharmaceutical coating technology)(1995年出版)中所述。薄膜涂料配方通常包含以下成分:聚合物,增塑剂,着色剂/遮光剂,媒介物。在薄膜包衣悬浮液中,可以使用少量的香精,表面活性剂和蜡。用于薄膜包衣的大多数聚合物是纤维素衍生物,例如纤维素醚,或丙烯酸类聚合物和共聚物。偶尔遇到的是高分子量聚乙二醇,聚乙烯吡咯烷酮,聚乙烯醇和蜡质材料。
[0041]
典型的纤维素醚是羟乙基纤维素、羟丙基纤维素、羟丙基甲基纤维素和甲基纤维素。丙烯酸类聚合物包括一组具有各种功能的合成聚合物。为了确保护膜完全崩解/溶解,可以通过掺入诸如水溶性纤维素醚和淀粉之类的材料来进一步改良其中一些以增强溶胀和渗透性。
[0042]
常用的增塑剂可分为三类:多元醇(甘油,丙二醇和大果酚)、有机酯(邻苯二甲酸酯、癸二酸二丁酯、柠檬酸酯和三醋精)和油/甘油酯(蓖麻油、乙酰化甘油单酯和分馏椰子油)。
[0043]
助色剂/遮光剂分为几类:有机染料及其色淀、无机颜料、天然颜料。每组不同材料的组合可以按定义的比例组合。薄膜包衣悬浮液可在市场上购买现成的制剂。
[0044]
可以通过使用不同的溶剂(水,醇,酮,酯,氯代烃),优选用水来制备薄膜包衣分散体。
[0045]
涂料悬浮液的组成(以干燥材料计算),理想的情况是包含:1
‑
99%重量的聚合物,优选为1
‑
95%的聚合物;和1
‑
50%重量的增塑剂,优选为1
‑
40%的增塑剂;0.1
‑
20%的着色剂/遮光剂,优选为0.1
‑
10%的着色剂/遮光剂,上述所有百分比均基于涂料的总重量计算。
[0046]
包含含有有效量的替诺福韦酯或其活性盐的活性剂的药物组合物可以任选地包含一种或多种抗hiv药物。另外的活性成分优选是另一种抗hiv剂,如阿巴卡韦、齐多夫定、拉米夫定、依非韦伦、依替卡他汀、利比韦林、考比司他、依维格韦和/或吉西他滨。
[0047]
本发明的一个实施方案涉及一种药物组合物,其包含活性剂,所述活性剂包含有效量的草酸替诺福韦、草酸、乳糖、微晶纤维素、预糊化淀粉、聚维酮和滑石粉。
[0048]
本发明的一个实施方案是一种制备包含活性剂的药物组合物的方法,所述活性剂包含有效量的替诺福韦酯或其可药用盐。该过程包括以下步骤:
[0049]
a)将有效量的替诺福韦酯或其可药用盐与一种或多种可药用辅料混合,
[0050]
b)通过湿法制粒或干法制粒将上述混合物制粒,
[0051]
c)筛分颗粒以减小颗粒的尺寸,
[0052]
d)将颗粒与酸性化合物和其他辅料混合,
[0053]
e)将步骤d的混合物压制成片剂或将混合物填充到胶囊中。
[0054]
药物制剂可以以多种方式提供。药物制剂可以通过多种方法来施用。这些方法包括但不限于:口服、经鼻、经颊、直肠、眼科、耳道、尿道、阴道或舌下给药。
[0055]
本文所述的药物制剂可以配制成可以口服、经颊和舌下给药的固体药物剂型。口服药物剂型可以是个体化或多单位剂量的形式,例如片剂包括混悬剂片剂、可咀嚼片剂、速溶片剂、泡腾片;囊片;粉末,包括泡腾粉;胶囊,包括单壳或双壳明胶胶囊、片剂填充胶囊;微丸或颗粒。
[0056]
尽管本文描述的实施方案考虑了适合于口服给药的任何固体剂型,但是特别优选片剂、胶囊剂、填充片剂的胶囊剂和囊片。当将本发明的药物组合物制成片剂或囊片时,应当理解,可以对片剂或囊片进行刻痕,并且它们可以具有任何合适的形状和大小,例如圆形、正方形、矩形、椭圆形、钻石形、五边形、六边形或三角形,只要不破坏本发明的目的。还应理解,当选择填充有片剂的胶囊时,与其一起使用的片剂可以形成为(a)对应于胶囊的形状,以允许通过胶囊进行包衣或包封,或者(b)容易装入胶囊内部。当本文所述的药物制剂形成固体口服药物剂型时,此类制剂还可包含可药用添加剂。
[0057]
该剂型优选适合口服。术语“单位剂型”是指适合作为人类受试者和其他哺乳动物的单位剂量的物理上离散的单位,每个单位包含经计算预定量的替诺福韦酯或其可药用盐,并加上合适的药物辅料,可产生所需的治疗效果。本发明的药物组合物优选是可以包衣或可以不包衣的片剂。所述剂量可以方便地以单位剂型存在,并且可以通过药学领域公知
的任何方法制备。
[0058]
考虑到药物组合物的特定期望性质,本领域技术人员可以在没有任何不适当的负担下通过常规实验选择并使用上述的一种或多种添加剂。每种添加剂的绝对量和相对于其他添加剂的量类似地取决于药物组合物的所需性质,并且也可以由技术人员在不会造成过多负担通过常规实验来选择。
[0059]
由于草酸替诺福韦是水溶性的,因此api的粒径对本发明组合物的溶解和生物利用度没有任何影响。所以,对本发明的药物组合物中所含药物的平均粒径没有特别限制。但是使用具有均匀直径的药物颗粒对于处理和制备组成是有利于制备。在另一个方面,本发明涉及包含草酸替诺福韦药物组合物,其特征在于,所述替诺福韦酯或可药用盐的d
50
应小于1000μm,理想为小于200μm,175μm更佳。
[0060]
含有替诺福韦酯或可药用盐的本发明的组合物优选每天以10至300mg/天的量施用。活性剂的确切剂量和要施用的特定制剂取决于许多因素,例如:治疗条件、所需治疗时间和活性剂释放速率。例如,可以基于已知的体外或体内技术确定所需活性剂的量及其释放速率,确定血浆中特定活性剂浓度在保持治疗效果水平下可以维持多长时间。
[0061]
本发明的药物组合物可用于掺入特定活性剂治疗已知适应症,包括治疗hiv、肝炎或两者。在一个实施方案中,本发明涉及一种通过向有需要的患者给药来治疗hiv或肝炎的方法,该药物组合物包含替诺福韦酯或可药用盐,以及制备用于治疗hiv和肝炎的治疗剂的方法。
[0062]
包含有效量的本发明的草酸替诺福韦酯的药物组合物具有与商业形式的替诺福韦酯或可药用盐相当的生物利用度(bioavailability)。在一个优选的实施方案中,包含草酸替诺福韦酯的药物组合物与商业形式的草酸替诺福韦酯生物等效。
具体实施方式
[0063]
以下实验细节有助理解本发明,并且无意且不应解释为以任何方式限制其后的权利要求书中提出的本发明。本领域技术人员将容易认识到在不改变本发明范围的情况下可以进行的各种修改和变化。这样的修改和变型包含在本发明的范围内,并且这些实施例决不以任何方式限制本发明的范围。
[0064]
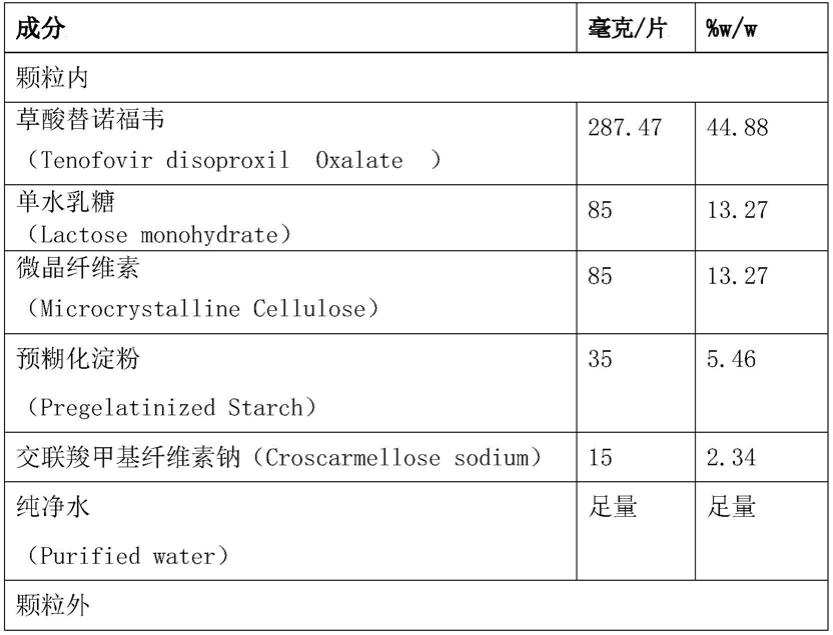
比较实例1
[0065][0066][0067]
制备步骤
[0068]
1.使用#40astm(425μm)筛子筛分所有颗粒内物质。
[0069]
2.将步骤1的成分装入快速混合制粒机(rmg),并用叶轮以100rpm的转速混合10分钟,然后切碎。
[0070]
3.使用纯净水作为粘合剂,在快速混合制粒机(rmg)中将步骤2的物料制粒。
[0071]
4.在55℃
±
5℃的快速干燥机中干燥步骤3的湿料,以达到lod nmt 2.5%w/w(lod@65℃自动模式)。
[0072]
5.使用#20astm(850μm)将步骤4的干燥颗粒过筛。
[0073]
6.使用#40astm筛网筛分微晶纤维素和交联羧甲基纤维素钠等颗粒外材料,并使用#60astm(250μm)筛分硬脂酸镁。
[0074]
7.将步骤5和步骤6的物料在搅拌机中混合5分钟。
[0075]
8.使用16.8x10.30 mm杏仁形冲头压缩润滑的混合物。
[0076][0077][0078]
比较实例2
[0079][0080][0081]
制备步骤
[0082]
1.使用#40astm(425μm)筛子筛分所有颗粒内物质。
[0083]
2.将步骤1的成分装入快速混合制粒机(rmg),并用叶轮以100rpm的转速混合10分钟,然后切碎。
[0084]
3.使用纯净水作为粘合剂,在快速混合制粒机(rmg)中将步骤2的物料制粒。
[0085]
4.在55℃
±
5℃的快速干燥机中干燥步骤3的湿料,以达到lod nmt 2.5%w/w(lod@65℃自动模式)。
[0086]
5.使用#20astm(850μm)将步骤4的干燥颗粒过筛。
[0087]
6.使用#40astm筛分超细颗粒材料,例如微晶纤维素和聚乙烯吡咯烷酮
(plasdone
–
xl 10),并使用#60astm(250μm)筛分滑石粉。
[0088]
7.将步骤5和步骤6的物料在搅拌机中混合5分钟。
[0089]
8.使用16.8x10.30 mm杏仁形冲头压缩润滑的混合物。
[0090][0091][0092]
实例1
[0093][0094]
制备步骤
[0095]
1.使用#40astm(425μm)筛子筛分所有颗粒内物质。
[0096]
2.将步骤1的成分装入快速混合制粒机(rmg),并用叶轮以100rpm的转速混合10分钟,然后切碎。
[0097]
3.使用纯净水作为粘合剂,在快速混合制粒机(rmg)中将步骤2的物料制粒。
[0098]
4.在55℃
±
5℃的快速干燥机中干燥步骤3的湿料,以达到lod nmt 2.5%w/w(lod@65℃自动模式)。
[0099]
5.使用#20astm(850μm)将步骤4的干燥颗粒过筛。
[0100]
6.使用#40astm筛分超细颗粒材料,例如微晶纤维素、草酸和聚乙烯吡咯烷酮(plasdone
–
xl 10),并使用#60astm(250μm)筛分滑石粉。
[0101]
7.将步骤5和步骤6的物料在搅拌机中混合5分钟。
[0102]
8.使用16.8x10.30 mm杏仁形冲头压缩润滑的混合物。
[0103][0104][0105]
实例2:
[0106][0107]
制备步骤
[0108]
1.使用#40astm(425μm)筛子筛分所有颗粒内物质。
[0109]
2.将步骤1的成分装入快速混合制粒机(rmg),并用叶轮以100rpm的转速混合10分钟,然后切碎。
[0110]
3.使用纯净水作为粘合剂,在快速混合制粒机(rmg)中将步骤2的物料制粒。
[0111]
4.在55℃
±
5℃的快速干燥机中干燥步骤3的湿料,以达到lod nmt 2.5%w/w(lod@65℃自动模式)。
[0112]
5.使用#20astm(850μm)将步骤4的干燥颗粒过筛。
[0113]
6.使用#40astm筛分超细颗粒材料,例如微晶纤维素、草酸和聚乙烯吡咯烷酮(plasdone
–
xl 10),并使用#60astm(250μm)筛分滑石粉。
[0114]
7.将步骤5和步骤6的物料在搅拌机中混合5分钟。
[0115]
8.使用16.8x10.30 mm杏仁形冲头压缩润滑的混合物。
[0116][0117]
实例3:
[0118]
[0119][0120]
制备步骤
[0121]
1.使用#40astm(425μm)筛子筛分所有颗粒内物质。
[0122]
2.将步骤1的成分装入快速混合制粒机(rmg),并用叶轮以100rpm的转速混合10分钟,然后切碎。
[0123]
3.使用纯净水作为粘合剂,在快速混合制粒机(rmg)中将步骤2的物料制粒。
[0124]
4.在55℃
±
5℃的快速干燥机中干燥步骤3的湿料,以达到lod nmt 2.5%w/w(lod@65℃自动模式)。
[0125]
5.使用#20astm(850μm)将步骤4的干燥颗粒过筛。
[0126]
6.使用#40astm筛分超细颗粒材料,例如微晶纤维素、草酸和聚乙烯吡咯烷酮(plasdone
–
xl 10),并使用#60astm(250μm)筛分滑石粉。
[0127]
7.将步骤5和步骤6的物料在搅拌机中混合5分钟。
[0128]
8.使用16.8x10.30 mm杏仁形冲头压缩润滑的混合物。
[0129]
[0130][0131]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1