一种促进骨结合的钛基种植体及其制备方法和应用
1.本发明涉及生物种植体领域,特别是涉及一种促进骨结合的钛基种植体及其制备方法和应用。
背景技术:
2.人工种植牙已成为牙列缺损、缺失的首选修复方法。目前,种植牙面临的一大难题,是因种植体初期稳定性不足,持续微动引起骨结合失败,最终导致种植体的早期脱落。在老年骨质疏松、糖尿病、牙周病以及吸烟人群中,多种系统性疾病引起的种植体骨结合率降低,成为目前人工种植牙失败的主要风险。因此,如何提高种植体骨结合率,扩大种植牙适应症,仍是人工种植牙治疗亟待解决的问题。
3.近年来,胰岛素在非糖尿病状态下的促成骨作用引起了学者们的广泛关注。在骨缺损动物模型局部周围周期性注射胰岛素,可显著加速缺损区及种植体周围的骨形成。然而,胰岛素在体内半衰期较短,可随血液进入全身循环代谢,难以维持局部的有效浓度。胰岛素局部浓度过低导致其促成骨分化作用不足,浓度过高会引起骨再生减弱、低血糖或高胰岛素血症等全身不良反应,胰岛素在种植体骨结合中的研究和应用存在技术壁垒。
4.外泌体是20
‑
140纳米大小的细胞外囊泡,携带着多种生物活性分子,可以诱导组织再生、免疫、自噬等多种生物学行为。研究表明,胰腺β细胞不仅可分泌胰岛素,其分泌的外泌体能产生类胰岛素的促成骨作用,同时可避免高胰岛素血症和胰岛素抵抗的发生。外泌体作为天然的胞间信息交换的载体,具有良好的生物相容性;同时其分子结构小,利于存储和定量,在骨组织再生领域有巨大的研究和应用价值。
5.目前,尚未有在种植体表面负载牛胰腺β细胞外泌体,形成ti
‑
exo
‑
tio2复合结构,以提高种植体骨结合率的相关报道。
技术实现要素:
6.本发明的目的是提供一种促进骨结合的钛基种植体及其制备方法和应用,以解决上述现有技术存在的问题,开发一种负载牛胰腺β细胞外泌体从而提升骨结合性能的钛基种植体。
7.为实现上述目的,本发明提供了如下方案:
8.技术方案之一,提供了一种钛基种植体,所述钛基种植体上负载有牛胰腺β细胞外泌体。
9.优选的,所述的钛基种植体表面结合牛胰腺β细胞外泌体得到exo
‑
ti,再在所述exo
‑
ti表面制备tio2薄膜。
10.优选的,所述的二氧化钛薄膜由原子层沉积技术制备得到。
11.技术方案之二,提供了一种所述的钛基种植体的制备方法,包括以下步骤:
12.(1)将牛胰腺β细胞外泌体固定在种植体钛基表面,得到exo
‑
ti种植体;
13.(2)在步骤(1)得到的exo
‑
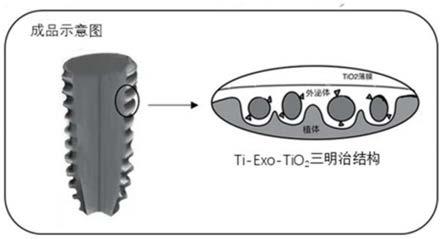
ti种植体表面沉积tio2纳米薄膜,得到所述钛基种植
体。
14.优选的,步骤(1)中所述固定的方法为化学固定法;步骤(2)中所述沉积的方法为原子层沉积技术。
15.优选的,所述化学固定法的具体步骤为:
16.(1)将纯钛种植体进行酸蚀,得到酸蚀后的种植体,将所述酸蚀后的种植体和cd63适配体置于醋酸缓冲液中,以三(2
‑
羧乙基)膦盐酸盐为还原剂,在避光条件下旋转,清洗,得到负载cd63适配体的种植体;
17.(2)将牛胰腺β细胞的外泌体与所述负载cd63适配体的种植体混合孵育,得到负载牛胰腺β细胞外泌体的种植体。
18.优选的,所述孵育具体为:在4℃,ph7.4,5%co2,95%相对湿度的条件下,将所述牛胰腺β细胞的外泌体与所述负载cd63适配体的种植体混合置于100rpm摇床,孵育过夜,得到负载牛胰腺β细胞外泌体的种植体。
19.优选的,所述原子层沉积技术的金属前体为四(二甲氨基)钛,氧气的前体为去离子水。
20.技术方案之三,提供了所述的钛基种植体在医用植入人体材料制备中的应用。
21.优选的,所述的医用植入人体材料为人工种植牙。
22.本发明公开了以下技术效果:
23.本发明利用化学固定法和原子层沉积技术开发制备了一种负载牛胰腺β细胞外泌体的钛基种植体(titanium implant with pancrease exosomes surface,简称pes种植体),其表面沉积的ti
‑
exo
‑
tio2纳米层状薄膜纳米层状薄膜均匀且高度共形,具有更好的亲水性、抗菌性能和耐腐蚀性。
24.在体外实验中,pes种植体表面培养的骨髓间充质干细胞(bone marrow mesenchymal stem cells,简称bmscs)bmscs增殖能力增加(图3a),成骨关键基因alp(图3b)及ocn(图3c)表达增强,茜素红染色的矿化结节(图4)显著增加。可见与现有钛基底及传统ald喷涂钛种植体相比,pes种植体可显著增加bmscs的增殖及成骨分化能力,提升种植体表面的成骨速度。
25.在体内实验中,pes种植体可有效加速钛种植体周围的骨再生,从而降低种植体的早期失败率。与现有纯钛种植体及传统ald喷涂钛种植体相比,其能够显著改善骨
‑
种植体接触率(bone
‑
to
‑
implant contact ratio,bic%)及种植体的移除扭矩(removal torque,rtq)。
26.本发明制备的钛基种植体通过负载牛胰岛β细胞外泌体,显著改善了种植体的性能,为医用植入人体材料领域提供了新的产品。本发明适合在产业上推广应用,具有巨大潜在商业价值。
附图说明
27.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
28.图1为制备pes种植体的示意图;
29.图2为pes种植体成品示意图;
30.图3不同种植体的体外生物学活性图;图中a不同种植体中bmscs的增殖情况;b为不同种植体中alp浓度;c为不同种植体中ocn浓度;
31.图4为不同种植体的茜素红染色图;图中a为纯钛种植体;b为ald喷涂钛种植体;c为pes种植体;d为不同种植体的光密度比较图;
32.图5为种植体周围骨形成的组织学评价;图中a为第4周时不同种植体的bic比较;b为种植体植入四周内,不同种植体间rtq差异图;c为第4周时不同种植体周围新骨形成的染色图。
具体实施方式
33.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
34.应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。
35.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。
36.本发明所使用的材料、仪器及试剂如无特殊说明,均可由商业途径获得;所使用的实验方法如无特殊说明,均为本领域常规实验方法。
37.制备pes种植体的示意图如图1所示,pes种植体成品示意图如图2所示。
38.实施例1钛基种植体的制备与性能
39.1.1牛胰腺β细胞外泌体的制备
40.①
牛胰腺β细胞的分离和培养
41.a.屠宰场取牛胰腺,冰盒低温保存,6h内送至生物安全实验室。
42.b.无菌环境下,用75%酒精冲洗牛胰腺三次后,切取重量为10g的牛胰腺浸泡于20ml标准磷酸平衡盐缓冲溶液(ph=7.4)。
43.c.将洗干净的胰腺置于6cm培养皿中,剪碎,加入ⅳ型胶原酶5ml,37℃消化45min,期间用1ml枪头吹打样品数次,将上述样品置于恒温孵育摇床,37℃下30rpm摇动10分钟,使酶与样品充分接触达到最佳消化效果。
44.d.加入5ml培养基终止消化,移液枪吹散细胞悬液,200目筛子过滤。
45.e.收集滤过液,1000rpm离心10min。
46.f.弃上清,加入4ml新鲜的10%dmem培养基(其中包含10%血清,90%的dmem培养基),吹打混匀。接种于6cm培养皿中,置于培养箱中,5%co2、37℃培养24h后全量更换培养基,之后每2天换液,细胞达80
‑
90%汇合时传代。
47.②
牛胰腺β细胞外泌体的提取和纯化
48.a.p2
‑
5代牛胰腺β细胞培养至70%融合时,去除培养基上清液,pbs清洗3次,换外泌体专用无血清培养基,继续在37℃,co2培养箱中培养48h,收集细胞上清液。
49.b.将收集的上清液300g
×
10min,2000g
×
10min离心去除沉淀(去除漂浮细胞及细
胞碎片),收集上清液。
50.c.将收集的上清液在4℃条件下10000g
×
30min离心去除沉淀(去除细胞残骸),收集上清液。
51.d.使用超高速离心机将收集的上清液在4℃条件下100000g离心70min收集沉淀。用pbs重悬沉淀。
52.e.将步骤d所得沉淀小心铺放于30%(w/v)蔗糖重水垫上方,使形成清晰的界面层。4℃条件下150000g离心70min,弃离心管中的pbs层,保留蔗糖重水层,加入至少5倍体积的pbs以100000g离心70min洗涤,用pbs重悬沉淀得到纯化的外泌体。
53.f.使用0.22μm滤菌膜将纯化的外泌体过滤除菌后装入无菌ependorf管内,
‑
80℃冻存。
54.③
牛胰腺β细胞外泌体的鉴定
55.a.取一滴外泌体悬液,载于200目铜网上,常温放置10min,用滤纸将液体从铜网边缘轻轻吸去。将3%磷钨酸溶液滴于铜网上,室温环境下负染5min。使用无菌去离子水洗涤两遍后,在白炽灯下烘干2min。置于透射电镜下观察外泌体的大小及形态,并拍摄电镜照片。
56.b.使用抗tsg101和抗cd63抗体标记外泌体进行免疫蛋白印迹,表征外泌体表面特异性蛋白。
57.c.使用nanosight分析仪器测定外泌体的粒径。
58.1.2将牛胰腺β细胞外泌体固定在种植体钛基表面
59.①
将纯钛种植体进行酸蚀,得到酸蚀后的种植体。
60.②
在37℃下,将酸蚀后的种植体和cd63适配体置于ph5.0的醋酸缓冲液中,以三(2
‑
羧乙基)膦盐酸盐为还原剂,在避光条件下旋转14小时,清洗3
‑
4次,得到负载cd63适配体的种植体。
61.③
将纯化牛胰腺β细胞的外泌体用dmem培养基稀释至4
×
10
10
个颗粒/ml。
62.④
向放置在96孔板中的负载cd63适配体的种植体(直径1mm,长度2mm)中添加50微升的外泌体溶液。
63.⑤
在4℃,ph7.4,5%co2,95%相对湿度的条件下,将96孔板置于100rpm摇床,种植体在外泌体溶液中孵育过夜。
64.⑥
重复步骤
⑤
,得到负载牛胰腺β细胞外泌体的种植体。
65.1.3利用ald技术,制备tio2薄膜固定exo
‑
ti结构
66.①
将exo
‑
ti种植体置于直径13mm的玻璃片上。
67.②
在37℃恒温下,使用异丙醇中对exo
‑
ti种植体进行洗涤,然后在去离子水中洗涤两次,每次5min。之后再使用纯度为5.0%的n2干燥载体。
68.③
tio2薄膜沉积exo
‑
ti表面的过程在原子层沉积系统反应器中进行。
69.④
将四(二甲氨基)钛和去离子水交替引入反应室。四(二甲氨基)钛作为金属前体,去离子水是氧气的前体。每次使用前体后,通过纯度为5.0%的n2净化反应室。在金属前体引入0.2s后,等待3s,n2净化15s,然后引入o2前体0.04s,等待3s,n2净化体15s。
70.⑤
该过程重复操作1220次,在恒温40℃,大气压66pa下进行,同时将金属前体的环境温度预热到70℃。反应室真空度为20mtorr,当n2注入反应室时,反应器出口压力稳定在
364mtorr。
71.⑥
反应室和前体的加热器在工艺开始前一小时打开,以确保达到正确的温度,并保证tio2薄膜固定在钛基表面期间保持稳定。
72.⑦
tio2薄膜理化性能分析。
73.a.用x射线衍射分析tio2薄膜的结晶度。
74.b.根据帕拉特的理论,使用panalytical软件确定最终tio2涂层的厚度、电子密度和粗糙度。
75.c.使用场发射扫描电镜(sem)、原子力显微镜(afm)和透射电镜(tem)观察分析涂层表面形貌和内部结构。
76.d.通过测量沉积在表面的水接触角来评估tio2薄膜亲水/疏水性能。使用dataphysik的oca 25测角仪获得沉积在盖板上的tio2表面上流体的接触角,测试液体为水,测量在正常条件下进行的(温度:25℃;空气湿度:50%)。所有的测试都在样品上的不同位置重复三次。
77.⑧
.进行原子层沉积后,载牛胰腺β细胞外泌体的钛基种植体制作完成(图1a),在真空中包装并转移。
78.1.4载牛胰腺β细胞外泌体钛基种植体性能检测
79.1.4.1体外性能测试
80.①
实验步骤:
81.a.在基本培养基中培养pes种植体表面的骨髓间充质干细胞(bone marrow mesenchymal stem cells,简称bmscs),该培养基包括具有15%胎牛血清的基本α培养基。
82.b.每星期更换两次新鲜培养基。
83.c.分别在3、7和14天后,收集上清液,用等量的新鲜基本培养基替代。
84.d.使用roche diagnostics alp试剂盒在cobas e602平台上检测培养基中的成骨关键基因碱性磷酸酶(alkaline phosphatase,alp)活性。
85.e.使用n
‑
mid骨钙蛋白试剂盒用电化学发光免疫分析技术测定骨钙素(osteocalcin,ocn)活性。
86.f.共进行了3次测试,所有数据均在cobas 8000平台上进行分析和测量。同样,1
×
105bmscs在基本培养基中培养。
87.g.第14天,2.5%戊二醛固定细胞,茜素红染色。用10%的十六烷基吡啶氯化钠(w/v)溶液(ph 7.0)在室温下提取沉淀2小时。在560nm处溶液的光密度测定萃取缓冲液中茜素红的含量。
88.h.采用mts法测定纯钛种植体、传统ald喷涂钛种植体与pes种植体中bmscs增殖情况,alp以及ocn的表达。
89.②
实验结果:结果如图1所示:pes种植体表面培养的bmscs增殖能力增加(图3a),成骨关键基因alp(图3b)及ocn(图3c)表达增强。
90.通过茜素红染色检查矿化形成,结果如图4所示,纯钛种植体组,ald喷涂种植体组的光密度低于pes种植体组,pes种植体表面bmscs的成骨分化显著高于钛种植体及传统ald喷涂钛种植体。
91.1.4.2体内性能测试
92.①
实验步骤:
93.a.选择体重为2.90
±
0.32kg的新西兰大白兔(6个月)用于建立下颌骨植入模型。根据不同种植体将所有兔子分为三组。
94.b.2%的戊巴比妥钠(30mg/kg)用于静脉麻醉。在右下颌骨下缘切开10mm的切口,使用astra植入系统从颊侧至舌侧垂直于骨表面植入种植体。
95.c.手术后第4周,处死所有兔子,将下颌骨样品切除,固定,脱水并包埋在甲基丙烯酸甲酯中。沿着种植体的长轴,将组织切片研磨至15μm厚,并用亚甲蓝/酸性品红进行染色。
96.d.在每个种植体中观察到十个连续的切片,并使用leica显微镜进行组织学评估。选择种植体的中央横截面进行分析,并通过骨与种植体的接触比(bone
‑
to
‑
implant contact ratio,bic%)确定每个区域中已形成的种植体周围的骨量。
97.e.在手术后的第1、2、3和4周,使用ag
‑
is通用测试仪测试包含种植体的下颌骨标本。记录采样的峰值扭矩值,直到种植体旋转90度为止。
98.②
实验结果:
99.通过在体内释放牛胰腺β细胞的外泌体,pes种植体可有效加速钛种植体周围的骨再生,从而降低种植体的早期失败率。与现有纯钛种植体及传统ald喷涂钛种植体相比,其显著改善的体内指标包括,骨
‑
种植体接触率(bone
‑
to
‑
implant contact ratio,bic%)(图5a),种植体的移除扭矩(removal torque,rtq)(图5b),及种植体周围骨的形成(图5c)。
100.对比例1钛基种植体的制备
101.钛基种植体的制备方法同实施例1,唯一不同之处在于外泌体为骨髓间充质干细胞(bmsc)外泌体。
102.对比例2钛基种植体的制备
103.钛基种植体的制备方法同实施例1,唯一不同之处在于纯钛种植体不进行酸蚀。
104.对比例3钛基种植体的制备
105.钛基种植体的制备方法同实施例1,唯一不同之处在于不添加cd63适配体。
106.对比例4钛基种植体的制备
107.钛基种植体的制备方法同实施例1,唯一不同之处在于原子沉积过程中的温度为50℃。
108.对上述对比例1
‑
4制备的钛基种植体进行体内及体外性能测定,测定结果如下表:
109.为了量化骨形成,将第8周pes种植体和对比组种植体周围骨再生的百分比用骨矿物质密度(bmd)和骨体积/总体积(bv/tv)表示。
110.表1:五种种植体周围新骨再生的比较
[0111][0112]
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出
的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1