一种双靶向肿瘤的超声分子复合成像方法
1.本发明属于超声分子影像学技术领域,具体涉及一种双靶向肿瘤的超声分子复合成像方法。
背景技术:
2.乳腺癌是我国女性最常见的恶性肿瘤之一,目前其死亡率已经超越肺癌跃升至第1位。由于女性早癌筛查项目在全国范围内的普及、各种肿瘤标志物测定灵敏度的升高和各种影像学技术的飞速发展,特别是超声分子成像技术在早期诊断乳腺无痛性结节上的应用,期望在无症状和体征的亚临床阶段早期诊断乳腺癌,为乳腺癌患者的早期治疗以及预后带来了显著的发展。
3.目前临床上所使用的常规影像学检查由于缺乏特异性和灵敏性,对早期诊断和预测肿瘤的生物学行为有较大的局限性。超声分子成像为提高肿瘤血池造影的靶向特异性带来新的愿景。目前,为了实现超声分子成像检测肿瘤的高灵敏度和高特异性,识别两个及以上生物标志物作为潜在的分子成像靶点是至关重要的。然而,在所有最近的研究中,使用多种血管分子靶标设计mbs进行分子成像的方法虽然呈现肿瘤血管化的程度,但是却不能将每种血管分子靶标所表达的信号单独提取出来,我们所能知道的肿瘤血管分子每个靶标表达情况的量化就得到了限制。因此,设计一种针对肿瘤血管双靶向成像剂并能将两种靶标信号进行分离的超声分子复合成像新技术,将为乳腺癌肿瘤的早期诊断、精准治疗甚至预测肿瘤的生物学行为提供重要帮助。
技术实现要素:
4.为了解决上述背景技术中所提出的问题,本发明的目的在于提供一种双靶向肿瘤的超声分子复合成像方法。实现肿瘤血管生成过程无创性超声分子成像监测,为肿瘤的早期诊断、精准治疗甚至预测肿瘤的生物学行为提供重要帮助。
5.为了达到上述目的,本发明所采用的技术方案为:一方面,本发明提供了一种肿瘤血管双靶向成像剂,包括两种壳硬度不同且能耐受不同超声声压阈值的超声造影剂;
6.所述两种壳硬度不同且能耐受不同超声声压阈值的超声造影剂分别为软壳泡ss
‑
mbs(mbs with soft shell,ss
‑
mbs)和硬壳泡hs
‑
mbs(mbs with hard shells,hs
‑
mbs)。
7.进一步地,所述软壳泡的组成包括磷脂材料,所述软壳泡组成中以磷脂材料为主;优选地,所述磷脂材料为dspc和dspe
‑
peg2000的组合;更优选地,所述dspc和dspe
‑
peg2000的摩尔比为9:0.5;
8.所述硬壳泡的组成包括plga聚合物、磷脂材料,所述硬壳泡组成中以plga聚合物为主、磷脂材料为辅;优选地,所述磷脂材料为dspc;优选地,所述plga和dspc的质量比为20:1。
9.进一步地,所述软壳泡ss
‑
mbs和硬壳泡hs
‑
mbs的超声临界声压耐受性能测定方法包括以下步骤:
10.(1)制备琼脂糖仿体管道,将所述软壳泡ss
‑
mbs和硬壳泡hs
‑
mbs分别稀释;
11.(2)使用超声诊断系统进行超声分子成像,启动造影模式,依次在不同声压条件下进行爆破;
12.(3)通过时间
‑
强度曲线分析软件人工勾勒出感兴趣区(roi),生成tic曲线,计算不同浓度的两种微泡在不同声压下的击碎比例,计算公式为:
[0013][0014]
进一步地,所述击碎前信号由五部分组成:(a)粘附在受体1上的靶向硬壳泡信号;(b)血液中自由循环的靶向硬壳泡信号;(c)粘附在受体2上的靶向软壳泡信号;(d)血液中自由循环的靶向软壳泡信号;(e)成像视野内组织背景信号;
[0015]
所述软壳泡ss
‑
mbs临界声压击碎后信号由三部分组成:(a)粘附在受体1上的靶向硬壳泡信号;(b)血液中自由循环的靶向硬壳泡信号;(e)成像视野内组织背景信号;
[0016]
所述硬壳泡hs
‑
mbs临界声压击碎后信号由一部分组成:(e)成像视野内组织背景信号。
[0017]
另一方面,本发明提供了一种双靶向肿瘤的超声分子复合成像方法,利用上述任一所述的肿瘤血管双靶向成像剂依次在软壳泡ss
‑
mbs和硬壳泡hs
‑
mbs临界声压下进行爆破,利用血池再灌注信号,分别得到两个靶向血池成像信号。
[0018]
进一步地,所述击碎前信号由五部分组成:(a)粘附在受体1上的靶向hs
‑
mbs信号;(b)血液中自由循环的靶向hs
‑
mbs信号;(c)粘附在受体2上的靶向ss
‑
mbs信号;(d)血液中自由循环的靶向ss
‑
mbs信号;(e)成像视野内组织背景信号;
[0019]
所述软壳泡ss
‑
mbs临界声压击碎后再灌注信号由以下部分组成:(a')粘附在受体1上的靶向hs
‑
mbs信号;(b')第一次再灌注后血液中自由循环的靶向hs
‑
mbs信号;(d')第一次再灌注后血液中自由循环的靶向ss
‑
mbs信号;(e')成像视野内组织背景信号;
[0020]
所述硬壳泡hs
‑
mbs临界声压击碎后再灌注信号由以下部分组成:(b”)第二次再灌注后血液中自由循环的靶向hs
‑
mbs信号;(d
″
)第二次再灌注后后血液中自由循环的靶向ss
‑
mbs信号;(e
″
)成像视野内组织背景信号。
[0021]
进一步地,所述两个靶向血池成像信号处理计算公式为:
[0022]
ss
‑
mbs超声信号强度c=a+b+c+d+e
‑
a
′‑
b
′‑
d
′‑
e
′
[0023]
hs
‑
mbs超声信号强度a=a
′
+b
′
+d
′
+e
′‑
b
″‑
d
″‑
e
″
[0024]
进一步地,所述方法在早期无创在体表征肿瘤血管生成中的应用。
[0025]
进一步地,所述方法能有效分离不同靶标的超声信号,为早期肿瘤的诊断、肿瘤所处阶段的血管化程度以及辅助治疗开辟了新的思路。
[0026]
本发明的有益效果:本发明双靶向肿瘤的超声分子复合成像方法,能有效分离不同靶标的超声信号,为早期肿瘤的诊断、肿瘤所处阶段的血管化程度以及治疗效果的评估开辟了新的思路;本发明双靶向肿瘤的超声分子复合成像方法,能实现肿瘤血管生成过程无创性超声分子成像监测,为肿瘤的早期诊断、精准治疗甚至预测肿瘤的生物学行为提供重要帮助。
附图说明
[0027]
图1为本发明实施例1的两种超声造影剂的浓度与超声分子成像信号强度之间的量效关系图。
[0028]
图2为本发明实施例2的两种超声造影剂的体外声压耐受性能测定结果图,箭头后边的图代表击碎前减去击碎后的减图。
[0029]
图3为本发明实施例3的两种靶向超声造影剂与bend.3细胞的黏附结果图。
[0030]
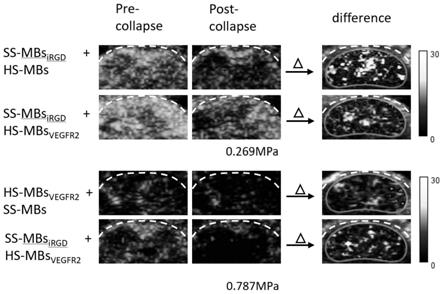
图4为本发明实施例4的两种靶向超声造影剂的在体复合成像结果图,箭头后边的图代表击碎前减去击碎后的减图。
具体实施方式
[0031]
为更好地说明本发明的目的、技术方案和优点,下面将结合具体实施例对本发明进一步说明。本领域技术人员应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
[0032]
实施例中,所使用的实验方法如无特殊说明,均为常规方法,所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0033]
在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见得的。本发明说明书和实施例仅是示例性的。
[0034]
实施例1两种超声造影剂的体外超声显像
[0035]
1、dspc:dspe
‑
peg2000以摩尔比9:0.5用薄膜水化法制备软壳泡ss
‑
mbs;plga(50mg):dspc(2.5mg)用水/油/水(w1/o/w2)复乳法制备硬壳泡hs
‑
mbs。
[0036]
2、分别将两种制备好的造影剂用磷酸盐缓冲溶液稀释至1
×
106个/ml、5
×
106个/ml、1
×
107个/ml。
[0037]
3、将稀释至各个浓度的两种超声造影剂移入制备好的2%(质量百分数)琼脂糖仿体孔中。
[0038]
4、用小动物活体成像仪vevo2100检测不同浓度下两种超声造影剂成像效果,获取超声造影信号。
[0039]
5、结果:两种超声造影剂在不同浓度下具有良好的成像性能。(图1)
[0040]
实施例2两种超声造影剂的体外声压耐受性能测定
[0041]
1、dspc:dspe
‑
peg2000以摩尔比9:0.5用薄膜水化法制备软壳泡ss
‑
mbs;plga(50mg):dspc(2.5mg)用水/油/水(w1/o/w2)复乳法制备硬壳泡hs
‑
mbs。
[0042]
2、制备2%(质量百分数)琼脂糖仿体管道,将两种制备好的超声造影剂用磷酸盐缓冲溶液稀释至1
×
107个/ml。
[0043]
3、使用迈瑞resona 7高端彩色多普勒超声诊断系统进行超声分子成像,使用5.6mhz的非线阵探头,启动造影模式,依次用不同的声压进行爆破。
[0044]
4、通过迈瑞resona 7内置的时间
‑
强度曲线分析软件人工勾勒出感兴趣区(roi),生成tic曲线,计算两种微泡在不同声压下的击碎比例。
[0045]
5、结果:在低声压下ss
‑
mbs几乎能被完全击碎,而hs
‑
mbs几乎不受震荡。提高声压,两种造影剂均能被完全击碎。(图2)
[0046]
实施例3两种超声造影剂的靶向修饰
[0047]
1、dspc:dspe
‑
peg2000以摩尔比9:0.5用薄膜水化法制备软壳泡ss
‑
mbs
irgd
;plga(50mg):dspc(2.5mg)用水/油/水(w1/o/w2)复乳法制备硬壳泡hs
‑
mbs
vegfr
‑2。
[0048]
2将培养好的bend.3细胞分别与制备好的硬壳泡hs
‑
mbs
vegfr
‑2和软壳泡ss
‑
mbs
irgd
靶向微泡和无靶向作用的两种无靶向作用的普通微泡反应5min;
[0049]
3、使用磷酸盐缓冲液清洗细胞,重复3次;
[0050]
4、放置于倒置荧光显微镜下观察;
[0051]
5、结果:可见bend.3细胞表面有较多的靶向微泡黏附(图3),而非靶向微泡未见明显黏附现象。
[0052]
实施例4两种靶向超声造影剂的在体复合成像
[0053]
1、建立6
‑
8周龄雌性裸鼠mda
‑
mb
‑
231乳腺癌皮下移植瘤模型,每隔3天观察并用手指触摸肿瘤体积大小,2周后待肿瘤长至适宜大小并用彩色多普勒超声确定瘤内无明显坏死区域。
[0054]
2、将荷瘤小鼠在加热垫上用浓度为2%(质量百分数)异氟醚在氧气中(2l/min)麻醉。用离心后的超声凝胶作为偶联剂涂在小鼠肿瘤区域裸露的皮肤上,探头始终维持切面不变。
[0055]
3、dspc:dspe
‑
peg2000以摩尔比9:0.5用薄膜水化法制备软壳泡ss
‑
mbs
irgd
;plga(50mg):dspc(2.5mg)用水/油/水(w1/o/w2)复乳法制备硬壳泡hs
‑
mbs
vegfr
‑2。将制备好的两种靶向微泡hs
‑
mbs
vegfr
‑2和ss
‑
mbs
irgd
的组合与单靶向对照组微泡(靶向硬壳泡hs
‑
mbs
vegfr
‑2+非靶向软壳泡ss
‑
mbs和靶向软壳泡ss
‑
mbs
irgd
+非靶向硬壳泡hs
‑
mbs)分别用磷酸盐缓冲溶液稀释至1
×
107个/ml,双盲法取200μl通过尾静脉注射,进行超声分子成像。两组微泡注射时间间隔30min。
[0056]
4、通过tic曲线读出击破之前和击破之后信号的平均值,两者相减,分别得到粘附在vegfr2受体和整合素αvβ3受体上的靶向微泡信号,减去的信号被涂成彩色,然后覆盖在b模式图像上。
[0057]
5、结果:双靶点超声造影剂依次在临界声压下击碎与对照组单靶向超声造影剂靶向超声信号具有较好的一致性。(图4)
[0058]
综上所述,本发明一种双靶向肿瘤的超声分子复合成像方法可以通过调节两种外壳硬度不同的超声造影剂的临界击碎电压早期无创在体表征肿瘤血管靶标分子的表达情况。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1