一种海藻酸钠/胶原复合骨支架及其制备方法与应用
本发明属于再生医学
技术领域:
,具体涉及一种海藻酸钠/胶原复合骨支架及其制备方法与应用。
背景技术:
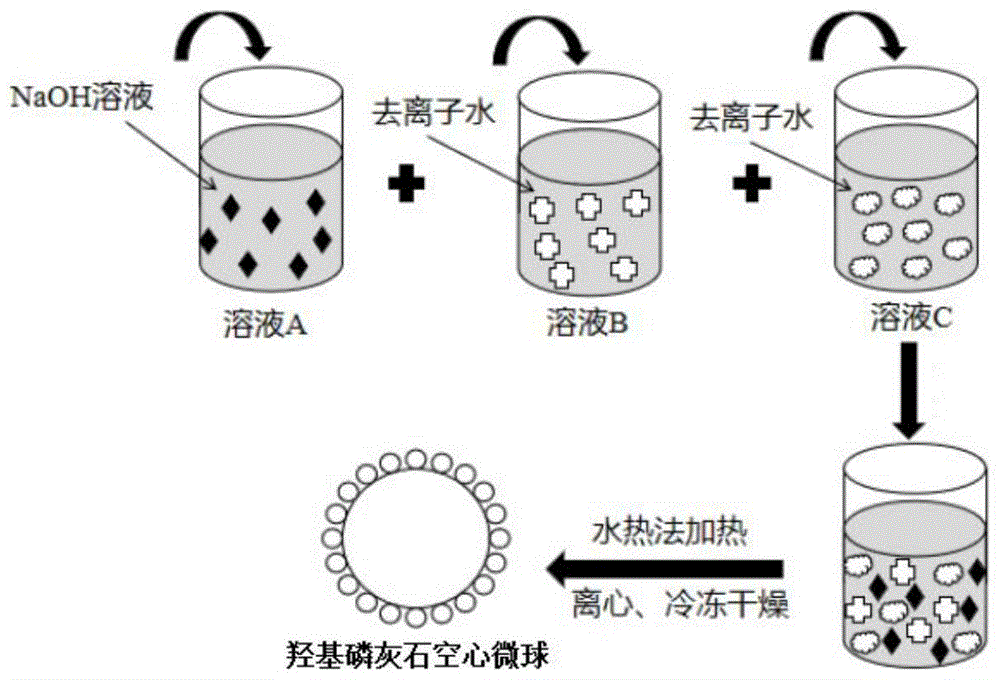
:感染性骨缺损是一种极为严重的并发症,多数情况下是由创伤、肿瘤切除和先天疾病等引起的。对于大规模的骨缺损,人体没有办法完全自我愈合,在大多数情况下,需要外部手术干预来恢复正常。在骨创伤手术期间,骨髓炎等植入物相关的骨感染经常发生,这阻碍了骨的修复。所以,感染性骨缺损一直是一个具有挑战性的临床问题。目前,治疗骨缺损的方法包括自体骨移植、同种异体骨移植和生物材料支架移植。自体骨移植存在骨供应不足和二次伤害的缺点;同种异体骨移植存在免疫排斥和潜在的感染风险等问题。生物材料支架移植具有良好的生物相容性、生物降解性和骨诱导能力的优点,且随着3d打印在生物支架制备方面的应用与骨组织工程的不断发展,生物材料支架移植用于骨修复的研究越来越多。目前,生物材料支架移植的材料主要为胶原水凝胶骨支架。但是,单纯的胶原水凝胶骨支架存在力学性能较差、结构不够稳定的问题。技术实现要素:为了解决现有技术中存在的问题,本发明提供了一种海藻酸钠/胶原复合骨支架及其制备方法与应用。利用本发明提供的制备方法得到的海藻酸钠/胶原复合骨支架具有良好的力学性能,结构较为稳定。为了实现以上目的,本发明提供了以下技术方案:本发明提供了一种海藻酸钠/胶原复合骨支架的制备方法,包括以下步骤:提供载有抗菌药物的羟基磷灰石空心微球;将水、羟基磷灰石纳米粒子、胶原交联剂、胶原、d-葡萄糖酸内酯、海藻酸钠和所述载有抗菌药物的羟基磷灰石空心微球进行预交联反应,得到预交联反应混合料;将所述预交联反应混合料进行打印,得到初级骨支架;将所述初级骨支架和二价铜离子进行再交联反应,得到所述海藻酸钠/胶原复合骨支架。优选地,所述载有抗菌药物的羟基磷灰石空心微球的制备方法包括以下步骤:将羟基磷灰石空心微球、抗菌药物和水混合,进行负载,得到载有抗菌药物的羟基磷灰石空心微球。优选地,所述胶原交联剂包括京尼平、戊二醛、1,6-己二异氰酸酯、1-乙基-3(3-二甲丙氨基)碳化二亚胺、环氧乙烷、环氧氯丙烷、叠氮二苯磷酸二苯酯、1,4-二(3,4-羟基苯)-2或3-二甲基丁烷。优选地,所述抗菌药物包括阿莫西林、万古霉素、银、庆大霉素或布洛芬。优选地,所述羟基磷灰石空心微球和抗菌药物的质量比优选为10~40:1。优选地,所述羟基磷灰石纳米粒子、海藻酸钠、d-葡萄糖酸内酯、胶原交联剂和胶原的质量比为(0.5~0.7):(1.0~1.4):(0.2~0.4):(0.08~0.12):(0.2~0.4)。优选地,所述二价铜离子由可溶性铜盐提供,所述可溶性铜盐包括氯化铜、硝酸铜、硫酸铜和乙酸铜中的一种或几种。优选地,所述初级骨支架与二价铜离子的质量比优选为120~180:1。本发明还提供了上述技术方案制备得到的海藻酸钠/胶原复合骨支架。优选地,所述海藻酸钠/胶原复合骨支架的孔径为80~120μm,孔隙率为70%~90%。本发明还提供了上述技术方案制备得到的海藻酸钠/胶原复合骨支架在制备感染性骨缺损修复材料中的应用。本发明提供了一种海藻酸钠/胶原复合骨支架的制备方法,包括以下步骤:提供载有抗菌药物的羟基磷灰石空心微球;将水、羟基磷灰石纳米粒子、胶原交联剂、胶原、d-葡萄糖酸内酯、海藻酸钠和所述载有抗菌药物的羟基磷灰石空心微球进行预交联反应,得到预交联反应混合料;将所述预交联反应混合料进行打印,得到初级骨支架;将所述初级骨支架和二价铜离子进行交联反应,得到所述海藻酸钠/胶原复合骨支架。本发明以羟基磷灰石空心微球作为抗菌药物的载体,羟基磷灰石纳米粒子中含有钙离子,可以同海藻酸钠(sa)进行交联,形成交联网络结构(sa-ca2+);同时,胶原和胶原交联剂也可以形成交联网络结构,双交联网络结构可以实现复合材料中的应力分散,大大改善复合骨支架的力学性能;另外,cu2+与海藻酸钠有较强的结合力,使得sa-ca2+进一步与cu2+交联,形成cu2+-sa-ca2+交联结构,进一步改善复合骨支架的力学性能。此外,双交联网络致密,水分子无法顺利地扩散进入海藻酸钠/胶原复合水凝胶骨支架中的水凝胶结构的内部,故经过交联后的复合水凝胶溶胀率较低,结构稳定。本发明所使用的制备材料均为无毒的、可降解的生物材料,在新骨组织长出的同时骨支架也在不断地降解并被人体排出体外,以便给新骨组织留出生长的空间。本发明的制备工艺流程简单,对设备的要求较低,制备周期短,成本低。进一步地,由于羟基磷灰石空心微球相比羟基磷灰石纳米粒子,具有更高的比表面积和更好的孔结构,且孔结构可调节,所以具有较高的载药量、更好的药物缓释性能和更长的药物释放时间,抗菌性能优异。同时,本发明所使用的羟基磷灰石具有良好的生物相容性,与人体骨组织细胞的黏附性较好,孔隙率较高,便于细胞的附着与增殖,可作为治疗感染性骨缺损的材料。本发明还提供了上述制备方法制备得到的海藻酸钠/胶原复合骨支架,本发明所制备得到的海藻酸钠/胶原复合骨支架与单纯的胶原水凝胶骨支架相比,力学性能较好、结构稳定。本发明还提供了上述制备方法制备得到的海藻酸钠/胶原复合骨支架在感染性骨缺损修复材料中的应用。由于羟基磷灰石具有良好的生物相容性,因此,以羟基磷灰石作为原料制备得到的复合骨支架的生物相容性和与人体骨组织细胞的黏附性较好,便于细胞的黏附生长及增殖,从而促进骨组织再生,有利于作为治疗感染性骨缺损的材料。附图说明图1为实施例1中羟基磷灰石空心微球的制备流程示意图;图2为实施例1中海藻酸钠/胶原的复合骨支架的制备示意图;图3为实施例1中海藻酸钠/胶原的复合骨支架的局部放大结构示意图;图4和图5为不同角度的羟基磷灰石空心微球的扫描电镜图像;图6为实施例1海藻酸钠/胶原复合骨支架的实物图。具体实施方式本发明提供了一种海藻酸钠/胶原复合骨支架的制备方法,包括以下步骤:提供载有抗菌药物的羟基磷灰石空心微球;将水、羟基磷灰石(hap)纳米粒子、胶原交联剂、胶原(col)、d-葡萄糖酸内酯、海藻酸钠(sa)和所述载有抗菌药物的羟基磷灰石空心微球进行预交联反应,得到预交联反应混合料;将所述预交联反应混合料进行打印,得到初级骨支架;将所述初级骨支架和二价铜离子进行再交联反应,得到所述海藻酸钠/胶原复合骨支架。在本发明中,如无特殊说明,本发明所用原料均优选为市售产品。本发明提供载有抗菌药物的羟基磷灰石空心微球。本发明中,所述载有抗菌药物的羟基磷灰石空心微球优选通过以下步骤制备得到:将羟基磷灰石空心微球、抗菌药物和水混合,进行负载,得到载有抗菌药物的羟基磷灰石空心微球。本发明中,所述抗菌药物优选包括阿莫西林、万古霉素、银、庆大霉素和布洛芬中的一种或几种,进一步优选为阿莫西林。本发明中,所述抗菌药物优选以抗菌药溶液的形式与羟基磷灰石空心微球进行混合。本发明中,所述抗菌药物溶液的浓度优选为4~10mg/ml,进一步优选为10mg/ml。在本发明中,所述水优选为去离子水。本发明中,所述羟基磷灰石空心微球的直径优选为0.5~1.5μm,进一步优选为1.0μm。本发明中,所述羟基磷灰石空心微球的壁厚优选为150~250nm,进一步优选为200nm。在本发明中,所述抗菌药物与羟基磷灰石空心微球的质量比优选为1:10~40,进一步优选为1:12。本发明中,羟基磷灰石空心微球作为抗菌药物的载体。由于羟基磷灰石空心微球具有更高的比表面积和更好的孔结构,且孔结构可调节,所以其具有更高的载药量、更好的药物缓释性能和更长的药物释放时间。本发明中,所述羟基磷灰石空心微球优选通过包括以下步骤的方法制备得到:将聚天冬氨酸、氢氧化钠、四水合硝酸钙、磷酸氢二铵和水混合,进行水热反应,得到所述羟基磷灰石空心微球。在本发明中,所述水优选为去离子水。在本发明中,所述氢氧化钠优选以氢氧化钠水溶液的形式加入,所述氢氧化钠水溶液的浓度优选为0.08~0.12mol/l,进一步优选为0.1mol/l。本发明中,所述四水合硝酸钙优选以四水合硝酸钙水溶液的形式加入;所述四水合硝酸钙水溶液的浓度优选为0.08~0.12mol/l,进一步优选为0.1mol/l。本发明中,所述磷酸氢二铵优选以磷酸氢二铵水溶液的形式加入,所述磷酸氢二铵水溶液的浓度优选为0.03~0.10mol/l,进一步优选为0.06mol/l。本发明中,所述聚天冬氨酸、四水合硝酸钙、磷酸氢二铵的质量比优选为(2~3):(2~2.5):(0.7~0.9)。本发明中,所述聚天冬氨酸、氢氧化钠、四水合硝酸钙、磷酸氢二铵混合的顺序优选为:将聚天冬氨酸依次和氢氧化钠水溶液、四水合硝酸钙水溶液和磷酸氢二铵水溶液混合,得到混合溶液。本发明中,磷酸氢二铵水溶液混合的时间优选为20~40min,进一步优选为30min,混合方式优选为搅拌,本发明对所述搅拌优选为恒磁搅拌。在本发明中,所述混合所得混合体系的ph值优选为5.0。本发明中,所述混合体系的ph值的调节试剂优选为稀硝酸。本发明中,所述水热反应的温度优选为170~190℃,进一步优选为180℃。本发明中,所述水热反应的时间优选为3~5h,进一步优选为3h。本发明中,所述水热反应的设备优选为内衬特氟龙的不锈钢高压釜。所述水热反应后,本发明优选还包括将所述水热反应体系进行固液分离,所得固体依次进行洗涤和冷冻干燥,得到所述羟基磷灰石空心微球。在本发明中,所述固液分离的方式优选为离心,所述离心的转速优选为3500~4500rmp,时间优选为8~12min。本发明中,所述洗涤的洗涤剂优选为去离子水;所述洗涤的次数优选为1~3次,进一步优选为3次。本发明中,所述冷冻干燥的温度优选为-75~-85℃,进一步优选为-80℃。本发明中,所述冷冻干燥的时间优选为12~30h,进一步优选为24h。图1为羟基磷灰石空心微球的制备流程示意图,具体为:将聚天冬氨酸和氢氧化钠溶液进行第一级混合,得到溶液a;将四水合硝酸钙溶液和溶液c进行第二级混合,得到溶液b;将磷酸氢二铵溶液和溶液b进行第三级混合,得到混合溶液。(图1中的溶液b即为四水合硝酸钙溶液,图1中的溶液c即为磷酸氢二铵溶液)。然后,将所述混合溶液依次进行加热、离心、冷冻干燥,得到羟基磷灰石空心微球。在本发明中,所述羟基磷灰石空心微球、抗菌药物和水混合的顺序优选为:将羟基磷灰石空心微球和部分水分散,得到羟基磷灰石空心微球分散液;将抗菌药物和余量的水混合形成抗菌药物水溶液;将所述抗菌药物水溶液滴加到所述羟基磷灰石空心微球分散液中。在本发明中,所述羟基磷灰石空心微球分散液的浓度优选为0.01g/ml。在发明中,所述分散的方式优选依次进行超声分散和搅拌,所述超声分散的频率优选为30~50khz,进一步优选为40khz。本发明中,所述分散的时间优选为4~6min,进一步优选为5min。本发明中,所述搅拌的转速优选为800r/min,搅拌的温度优选为25℃。在本发明中,所述抗菌药物水溶液的浓度优选为4~10mg/ml。在本发明中,所述滴加的速度优选为25~35d/min,进一步优选为30d/min;所述滴加的时间优选为15~30min,进一步优选为20min。在本发明中,所述负载的温度优选为37℃,时间优选为12~30h,进一步优选为24h;所述负载优选在搅拌的条件下进行。所述负载后,本发明优选还包括将所述负载体系进行固液分离,所得固体进行洗涤、过滤、干燥,得到所述载有抗菌药物的羟基磷灰石空心微球。本发明中,所述固液分离的方式优选为离心,所述离心的转速优选为3500~4500r/min,进一步优选为4000r/min;所述离心的时间优选为8~12min。本发明中,所述洗涤的洗涤液优选为去离子水,所述洗涤的次数优选为2~4次,进一步优选为3次。本发明中,所述洗涤能够洗掉吸附在羟基磷灰石空心微球表面的抗菌药物,得到载有抗菌药物的羟基磷灰石空心微球浆液。本发明中,所述干燥优选为真空干燥,所述真空干燥的真空度优选为6.0~10.0pa,进一步优选为8.0pa;所述干燥的温度优选为-75~-85℃,进一步优选为-85℃;所述干燥时间优选为12~30h,进一步优选为24h。本发明中,所述冷冻干燥后,所得载有抗菌药物的羟基磷灰石空心微球的粒径优选为0.5~1.5μm,进一步优选为1.0μm。本发明所述载有抗菌药物的羟基磷灰石空心微球优选在4℃的温度下保存备用。本发明将水、羟基磷灰石纳米粒子、胶原交联剂、胶原、d-葡萄糖酸内酯、海藻酸钠和所述载有抗菌药物的羟基磷灰石空心微球进行预交联反应,得到预交联反应混合料。本发明中,所述水优选为去离子水。本发明中,所述羟基磷灰石纳米粒子的粒径优选为40nm。本发明中,所述羟基磷灰石纳米粒子的作用是提供ca2+,使其与海藻酸钠形成交联网络,实现应力分散,提高海藻酸钠/胶原复合水凝胶的力学性能,其充当了稳定剂的作用。本发明中,所述水和羟基磷灰石纳米粒子的用量比优选为40~60ml:1g,进一步优选为50ml:1g。在本发明中,所述胶原交联剂优选包括京尼平、戊二醛、1,6-己二异氰酸酯、1-乙基-3(3-二甲丙氨基)碳化二亚胺、环氧乙烷、环氧氯丙烷、叠氮二苯磷酸二苯酯、1,4-二(3,4-羟基苯)-2或3-二甲基丁烷中的一种或多种,进一步优选为京尼平。本发明中,所述羟基磷灰石纳米粒子、海藻酸钠、d-葡萄糖酸内酯、胶原交联剂和胶原的质量比优选为(0.5~0.7):(1.0~1.4):(0.2~0.4):(0.08~0.12):(0.2~0.4),进一步优选为0.6:1.2:0.3:0.3:0.1。本发明中,所述d-葡萄糖酸内酯的作用是促进羟基磷灰石纳米粒子释放ca2+,进而形成sa-ca2+交联网络,有助于获得高粘度的水凝胶,便于打印出成型的复合海藻酸钠/胶原水凝胶骨支架。本发明中,所述预交联反应的步骤优选为:将水、羟基磷灰石纳米粒子、胶原交联剂和胶原进行初级混合,得到浆料a;将所述浆料a与海藻酸钠进行二级混合,得到浆料b;将所述浆料b与d-葡萄糖酸内酯和载有抗菌药物的羟基磷灰石空心微球进行三级混合。本发明中,所述初级混合的温度优选为30~40℃,进一步优选为37℃。本发明中,所述初级混合的时间优选为20~40min,进一步优选为30min。本发明中,所述初级混合的方式优选为搅拌。本发明中,所述二级混合的温度优选为30~40℃,进一步优选为37℃。本发明中,所述二级混合的时间优选为80~120min,进一步优选为120min。本发明中,所述二级混合的方式优选为搅拌。本发明中,所述三级混合的温度优选为24~27℃,进一步优选为25℃;所述三级混合的时间优选为100~150min,进一步优选为120min;所述三级混合的方式优选为搅拌。得到预交联反应混合料后,本发明将所述预交联反应混合料进行打印,得到初级骨支架。本发明中,所述打印的供料压力优选为0.2~0.4mpa,进一步优选为0.3mpa。本发明中,所述打印的平台运动速度优选为10~20mm/s,进一步优选为15mm/s。本发明中,所述打印优选在聚丙烯注射器中进行,所述聚丙烯注射器螺纹针的直径优选为0.6~1.2mm。得到初级骨支架后,本发明将所述初级骨支架和二价铜离子进行再交联反应,得到海藻酸钠/胶原复合骨支架。本发明中,所述二价铜离子优选由可溶性铜盐提供,所述可溶性铜盐优选包括氯化铜、硝酸铜、硫酸铜和乙酸铜中的一种或几种,进一步优选为氯化铜。本发明中,所述cu2+的浓度优选为4~12mg/ml,进一步优选为12mg/ml;本发明中,所述初级骨支架与cu2+的质量比优选为120~180:1。本发明中,cu2+与海藻酸钠有较强的结合力,本发明采用cu2+作为复合水凝胶骨支架进一步交联的交联剂,能进一步改善复合骨支架的力学性能,同时,铜作为人体必需的一种微量元素,能促进骨组织细胞的生长与矿化,具有一定的抗菌作用,也能促进细胞的黏附和伸展。本发明中,所述再交联反应的步骤优选为将初级骨支架浸泡于含二价铜离子的溶液中。本发明中,所述再交联的时间优选为20~40min,进一步优选为30min。所述再交联反应结束后,本发明优选还包括将再交联反应后的体系进行冷冻干燥,得到海藻酸钠/胶原复合骨支架。本发明中,所述冷冻干燥的温度优选为-75~-85℃,进一步优选为-80℃。本发明中,所述干燥的时间优选为400~600min,进一步优选为480min。图2为海藻酸钠/胶原的复合骨支架的制备流程示意图,具体为:制备载有抗菌药物的羟基磷灰石空心微球;将羟基磷灰石纳米粒子、京尼平、胶原、d-葡萄糖酸内酯、海藻酸钠和所述载有抗菌药物的羟基磷灰石空心微球进行预交联反应,得到预交联混合料;将所述预交联混合料进行打印,得到初级骨支架;将所述初级骨支架和二价铜离子进行再交联反应,得到海藻酸钠/胶原复合骨支架。本发明还提供了上述制备方法制备得到的海藻酸钠/胶原复合骨支架。本发明中,所述海藻酸钠/胶原复合骨支架的形状优选为“井”字格形状。本发明中,所述海藻酸钠/胶原复合骨支架的打印单层层高优选为0.6~1.2mm,进一步优选为0.84mm。本发明中,所述复合骨支架的孔径为80~120μm,进一步优选为100μm。本发明中,所述复合骨支架的孔隙率优选为70%~90%,进一步优选为80%。图3为海藻酸钠/胶原的复合骨支架的局部放大结构示意图,从图中可以看出:本发明制备得到的海藻酸钠/胶原的复合骨支架具有海藻酸钠-ca2+/cu2+、胶原-胶原交联剂双交联结构,同时,载有抗菌药物的羟基磷灰石空心微球均匀分散其中。本发明还提供了上述制备方法制备得到的复合骨支架在制备感染性骨缺损修复材料中的应用。下面结合实施例对本发明提供的海藻酸钠/胶原复合骨支架及其制备方法与应用进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。实施例1提供载有抗菌药物的羟基磷灰石空心微球:(1)羟基磷灰石空心微球的制备,包括如下步骤:将2.5g的聚天冬氨酸和200ml0.1mol/l的氢氧化钠溶液进行第一级混合,得到溶液a;将四水合硝酸钙溶液(2.365g四水合硝酸钙溶于100ml的去离子水)与溶液a进行第二级混合,得到溶液b;将磷酸氢二铵溶液(0.792g磷酸氢二铵溶于100ml的去离子水)与溶液b进行第三级混合,混合方式为恒磁搅拌,时间为30min,得到混合溶液;将混合溶液用稀硝酸调节ph值至5.0;将混合溶液转移到内衬特氟龙的不锈钢高压釜中,在180℃下加热3h,于4000rpm离心和去离子水洗涤收集沉淀,最后在-80℃下冷冻24h,得到羟基磷灰石空心微球。(2)载有抗菌药物(阿莫西林)的羟基磷灰石空心微球的制备方法,包括如下步骤:将0.1g羟基磷灰石空心微球超声分散,于10ml的去离子水中,25℃下恒速800r/min搅拌得到羟基磷灰石空心微球悬浮液,其中所述超声分散的频率为40khz,分散的时间为5min;将30ml4mg/ml的阿莫西林溶液在20min内滴加到羟基磷灰石空心微球悬浮液中,滴加完毕后,继续搅拌24h,离心,弃去上清液,用去离子水重复清洗3次,得到载有阿莫西林的羟基磷灰石空心微球浆液;将浆液进行过滤处理,弃去过滤液,得到滤饼;将滤饼-80℃下真空(真空度为8pa)干燥24h,研磨,得到粒径为1.0μm的载有阿莫西林的羟基磷灰石空心微球,于4℃冰箱保存备用。(3)初级骨支架的制备方法,包括如下步骤:将30ml去离子水中和0.6g羟基磷灰石纳米粒子、0.1g京尼平和0.3g胶原进行初级混合,初级混合的方式为搅拌,时间为30min,温度为37℃,得到浆料a;将浆料a与1.2g海藻酸钠进行二级混合,二级混合的方式为搅拌,时间为2h,得到浆料b;将0.3gd-葡萄糖酸内酯、0.3g载有阿莫西林的羟基磷灰石空心微球和浆料b进行三级混合,得到预交联混合料。将预交联混合料注入装有0.84mm螺纹针的聚丙烯注射器中,利用打印挤出成形工艺,其挤出成形的供料压力优选为0.3mpa,挤出成形的平台运动速度优选为15mm/s,制成具有“井”字格形状的初级骨支架。海藻酸钠/胶原复合骨支架的制备:将制得的初级骨支架浸泡于cu2+浓度为4mg/ml的cucl2溶液中,30min后将其取出,在-80℃的温度下冷冻干燥480min,得到海藻酸钠/胶原复合骨支架。实施例2按照实施例1的方法制备海藻酸钠/胶原复合骨支架,区别仅在于:阿莫西林的浓度为10mg/ml。实施例3按照实施例1的方法制备得到海藻酸钠/胶原复合骨支架,区别仅在于:cucl2溶液中cu2+的浓度为12mg/ml。对比例1(1)载有抗菌药物(阿莫西林)的羟基磷灰石纳米粒子的制备方法与实施例1的区别仅仅在于将羟基磷灰石空心微球替换为羟基磷灰石纳米粒子,其余步骤与实施例1中的步骤(2)保持一致。(2)骨支架的制备方法,包括如下步骤:与实施例1步骤(3)中的区别仅仅在于省略原料海藻酸钠、d-葡萄糖酸内酯、京尼平,其余步骤保持一致,得到载有抗菌药物(阿莫西林)的羟基磷灰石纳米粒子的胶原骨支架。本发明对实施例1~3制备得到的海藻酸钠/胶原复合骨支架的载药率和力学性能进行了测试,测试方法为:利用wdw-1万能材料试验机对复合骨支架的压缩性能进行测试,记录支架在70%的应变下的压应力,具体测试结果见表1。将实施例1~3所得复合骨支架和对比例1的样品进行称重,得到相应的支架干重ws0g;在37℃的温度下浸入去离子水和磷酸盐缓冲溶液(pbs,ph=7.4)中一段时间。然后,从溶液中取出样品,用滤纸干燥并再次称重,记录膨胀的支架的重量(ws1g),然后利用公式:s=[(ws1-ws0)/ws0]×100%,得到溶胀率。结果如表1所示。表1实施例1~3以及对比例1的各项测试结果实施例1实施例2实施例3对比例1压应力(mpa)1.8871.7752.7250.304药物持续释放时间(h)400400400200药物装载量(mg/g)40604020磷酸盐缓冲溶液中的溶胀率(%)7507506001000去离子水中的溶胀率(%)60605090通过对比实施例1~3可以发现:本发明所制备得到的海藻酸钠/胶原复合骨支架具有良好的力学性能,压应力可达2.725mpa,在磷酸盐缓冲溶液中的溶胀率为600~750%,在去离子水中的溶胀率为50~60%,均小于对比例1中的溶胀率,证明其支架的结构较为稳定。其载药率为羟基磷灰石纳米粒子载药量的2~3倍,且药物缓释性能较好,药物持续释放时间高达400h。图4、图5为羟基磷灰石空心微球不同角度的扫描电镜图像,从图4和5中可以看出:羟基磷灰石空心微球的直径为0.5~1.5μm,且为中空结构。图6为实施例1制备的海藻酸钠/胶原复合骨支架的实物图。以上所述仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1