过表达CTLA-4Ig/PD-L1的宫内膜干细胞在制备治疗肺纤维化的药物中的应用的制作方法
过表达ctla
‑
4ig/pd
‑
l1的宫内膜干细胞在制备治疗肺纤维化的药物中的应用
技术领域
1.本发明属于生物药物技术领域,具体涉及过表达ctla
‑
4ig/pd
‑
l1的宫内膜干细胞在制备治疗肺纤维化的药物中的应用。
背景技术:
2.肺纤维化是一种以肺部永久性损伤为特征的、伴随着高死亡率的严重疾病,通常是由于严重的外部创伤、自发免疫反应或药物不良副反应等因素引起肺的永久性损伤。研究表明,肺纤维化的进程大致分为以下3个阶段:第一阶段,肺脏受到损伤或其他有害刺激,成纤维细胞的细胞外基质(ecm)产生细胞被活化;第二阶段,活化的ecm产生细胞发生结构和表型的改变,产生大量ecm,胞内的促分裂素原活化蛋白激酶和核转录因子通路被激活,同时t细胞被激活,产生各种细胞因子;第三阶段,损伤因素持续存在,成纤维细胞继续被激活,产生更多的ecm,细胞因子持续不断的引起组织炎症和胶原过度表达,ecm不断沉积,肺纤维化逐渐形成,最终导致特发部位肺功能丧失
1.。
3.肺纤维化发病过程是一个复杂的病理过程,且有多种细胞及细胞因子参与。tnf
‑
α和tgf
‑
β是临床检验肺纤维化的一个重要指标,研究发现,在纤维化的肺部组织中,tnf
‑
α和tgf
‑
β的mrna水平显著高于正常肺组织
2.,抑制tnf
‑
α和tgf
‑
β的合成及功能可减轻或调节肺纤维化进程,延缓进入肺纤维化急性期。也有研究表明,il
‑
6能促进肺纤维化的发生,il
‑
6的表达增加可引起严重的炎症反应,导致肺组织某些区域结构被破坏,造成严重损伤,ecm不断沉积,逐渐形成肺纤维化。
4.近些年,虽然随着技术手段的进步,肺纤维化机制和治疗药物的研究取得一定进展,但是发病机理尚未完全阐释清楚,并且缺乏有效的治疗方法。有学者指出,在损伤
‑
炎症
‑
修复三期过程中,任何一项或多项过程的失调,均可以导致肺纤维化的发生,提示我们可通过干预以上过程预防纤维化的形成
3.。目前,肺维化的主要治疗策略有:抗炎,抗纤维化和抗氧化等,治疗手段主要有药物治疗、手术治疗等。但是,药物治疗具有较大的副作用,而肺移植作为目前治疗肺纤维化最有效的手段,则由于捐献器官资源缺乏、排斥反应、感染、并发症和费用昂贵等缺陷,限制了其应用。最近有文献报道干细胞如脐带间充质干细胞、胚胎干细胞、脐血间充质干细胞等治疗可改善博来霉素诱导的肺纤维化症状,但干细胞的治疗往往存在机体免疫细胞的清除的作用,不仅增加干细胞的用量而且降低了干细胞治疗的效果。
5.参考文献
6.[1]潘有禄,黄文海,沈正荣等.肺纤维化发生机制及治疗研究进展[j].中国药学杂志.2012,47(23):1873
‑
76.
[0007]
[2]higgins df,kimura k,bernhardt wm,et al.hypoxia promotes fibrogenesis in vivo via hif
‑
1 stimulation of epithelial
‑
to
‑
mesenchymal transition[j].j clin invest.2007,117(12):3810
‑
20.
[0008]
[3]wilson ms,wynn ta.pulmonary fibrosis:pathogenesis,etiology andregulation.[j].mucosal immunol.2009,2(2):103
‑
21.
技术实现要素:
[0009]
有鉴于此,本发明的目的在于提供一种过表达ctla
‑
4ig/pd
‑
l1的宫内膜干细胞(简称cp emscs)在制备治疗和/或预防肺纤维化的药物中的应用,该细胞不仅可以用于有效治疗和/或预防肺纤维化,同时可减少emscs的使用量。
[0010]
本发明提供了过表达ctla
‑
4ig/pd
‑
l1的宫内膜干细胞在制备预防和/或治疗肺纤维化的药物中的应用。
[0011]
优选的,所述过表达ctla
‑
4ig/pd
‑
l1的宫内膜干细胞的构建方法,包括以下步骤:
[0012]
1)提取动物脾脏的rna,经反转录得到cdna;
[0013]
2)以所述cdna为模板,分别扩增ctla
‑
4ig基因和pd
‑
l1基因,得到ctla
‑
4ig基因片段和pd
‑
l1基因片段;
[0014]
3)将所述ctla
‑
4ig基因片段和pd
‑
l1基因片段克隆至plenti cmv gfp puro(658
‑
5)载体上,得到重组载体plenti cmv ctla
‑
4ig ires pd
‑
l1 puro;
[0015]
4)将所述重组载体plenti cmv ctla
‑
4ig ires pd
‑
l1 puro、pmd2和pspax2混合,在转染试剂的作用下处理真核细胞,经培养,收集上清;
[0016]
5)将所述上清感染宫内膜干细胞,经细胞培养得到过表达ctla
‑
4ig/pd
‑
l1的宫内膜干细胞。
[0017]
优选的,步骤2)中所述扩增ctla
‑
4ig基因的引物为核苷酸序列如seq id no:1所示的正向引物和核苷酸序列如seq id no:2所示的反向引物;
[0018]
扩增pd
‑
l1基因的引物为核苷酸序列如seq id no:3所示的正向引物和核苷酸序列如seq id no:4所示的反向引物。
[0019]
优选的,步骤4)中所述重组载体plenti cmv ctla
‑
4ig ires pd
‑
l1 puro、pmd2和pspax2的质量比为3:1.5~2.5:2.5~3.5。
[0020]
优选的,步骤5)中所述宫内膜干细胞选自原代至第十代的宫内膜干细胞中任意一代。
[0021]
优选的,步骤5)中所述感染在转染增强剂的作用下进行;所述转染增强剂包括polybrene试剂。
[0022]
优选的,所述肺纤维化包括由药物诱导所致的肺纤维化;
[0023]
所述药物包括博来霉素和/或脂多糖。
[0024]
优选的,所述药物包括注射剂;所述注射剂为含过表达ctla
‑
4ig/pd
‑
l1的宫内膜干细胞的氯化钠溶液;
[0025]
所述氯化钠溶液的质量体积百分比为0.8%~1.0%。
[0026]
本发明提供了一种用于预防和/或治疗肺纤维化的细胞制剂,包括含过表达ctla
‑
4ig/pd
‑
l1的宫内膜干细胞的氯化钠溶液;
[0027]
所述氯化钠溶液的质量体积百分比为0.8%~1.0%。
[0028]
优选的,所述过表达ctla
‑
4ig/pd
‑
l1的宫内膜干细胞的密度独立为2.0
×
105~4.0
×
105个/ml。
[0029]
本发明提供了过表达ctla
‑
4ig/pd
‑
l1的宫内膜干细胞在制备预防和/或治疗肺纤维化的药物中的应用。实验表明,博来霉素诱导肺纤维化的小鼠尾静脉注射宫内膜干细胞(emscs)或cp emscs后,均可明显改善小鼠肺纤维化现象,下调肺组织α
‑
sma蛋白表达水平,但cp emscs治疗效果优于等剂量的宫内膜干细胞。同时cp emscs能有效降低肺纤维化中炎症反应。本发明以cp emscs为细胞成分,与宫内膜干细胞相比,更有效地抑制博来霉素诱导的小鼠肺组织il
‑
6、il
‑
1β和mcp
‑
1等的表达。由此可见,cp emscs可有效降低肺损伤后纤维化以及炎症水平,为临床治疗肺纤维化提供了新思路。
附图说明
[0030]
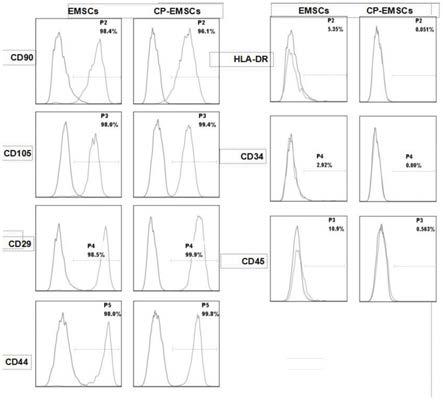
图1为本发明实施例中细胞表面标记物的检测结果;
[0031]
图2为本发明实施例中实时荧光定量pcr检测cp emscs中ctla
‑
4ig和pd
‑
l1的基因和蛋白表达结果;
[0032]
图3为本发明实施例中cp emscs对肺组织纤维化的治疗情况;
[0033]
图4为本发明实施例中模型组小鼠肺组织纤维化标志物α
‑
sma蛋白表达水平检测结果;
[0034]
图5为本发明实施例中emscs对肺组织纤维化相关基因表达量的检测结果。
具体实施方式
[0035]
本发明提供了过表达ctla
‑
4ig/pd
‑
l1的宫内膜干细胞在制备预防和/或治疗肺纤维化的药物中的应用。
[0036]
在本发明中,所述肺纤维化包括但不限于外部创伤、自发免疫反应或药物不良副反应等因素引起肺的永久性损伤。本发明实施例中,所用的博来霉素诱导肺纤维化的动物模型是一种经典的肺纤维化动物模型。在对博来霉素诱导肺纤维化的小鼠尾静脉注射cp emscs后,可明显改善小鼠肺纤维化现象,同时下调肺组织α
‑
sma蛋白表达水平,且治疗效果优于等剂量的emscs。
[0037]
在本发明中,所述肺纤维化还优选包括肺纤维化炎症反应。在所述肺纤维化炎症反应中,cp emsc比emsc更有效地抑制博来霉素诱导的小鼠肺组织il
‑
6、il
‑
1β和mcp
‑
1等炎症因子的表达,表明cp emsc比emsc更有效地降低肺纤维化的炎症反应。
[0038]
在本发明中,所述过表达ctla
‑
4ig/pd
‑
l1的宫内膜干细胞的构建方法,优选包括以下步骤:
[0039]
1)提取动物脾脏的rna,经反转录得到cdna;
[0040]
2)以所述cdna为模板,分别扩增鼠源ctla
‑
4ig基因和pd
‑
l1基因,得到ctla
‑
4ig基因片段和pd
‑
l1基因片段;
[0041]
3)将所述ctla
‑
4ig基因片段和pd
‑
l1基因片段克隆至plenti cmv gfp puro(658
‑
5)载体上,得到重组载体plenti cmv ctla
‑
4ig ires pd
‑
l1 puro;
[0042]
4)将所述重组载体plenti cmv ctla
‑
4ig ires pd
‑
l1 puro、pmd2和pspax2混合,在转染试剂的作用下处理真核细胞,经培养,收集上清;
[0043]
5)将所述上清感染宫内膜干细胞,经细胞培养得到过表达ctla
‑
4ig/pd
‑
l1的宫内膜干细胞。
[0044]
本发明提取动物脾脏的rna,经反转录得到cdna。
[0045]
本发明对提取动物脾脏的rna的方法没有特殊限制,采用本领域所熟知的提取rna方案即可,例如采用动物rna提取试剂盒即可。本发明对所述反转录的方法没有特殊限制,采用本领域所熟知的反转录方法即可。在本发明实施例中,以小鼠为实验对象,因此,以小鼠脾脏的rna为材料制备过表达细胞。
[0046]
得到cdna后,本发明以所述cdna为模板,分别扩增ctla
‑
4ig基因和pd
‑
l1基因,得到ctla
‑
4ig基因片段和pd
‑
l1基因片段。
[0047]
在本发明实施例中,以小鼠为实验对象,因此,扩增ctla
‑
4ig基因和pd
‑
l1基因均为鼠源ctla
‑
4ig基因和pd
‑
l1基因。扩增鼠源ctla
‑
4ig基因的引物优选为核苷酸序列如seq id no:1(5
’‑
actctcctggtaaatgattaattaacccctctccctccccccccc
‑3’
)所示的正向引物和核苷酸序列如seq id no:2(5
’‑
cgccggatccggcgcgcctgttaacttatcatcgtgtttttcaaa
‑3’
)所示的反向引物。扩增鼠源pd
‑
l1基因的引物为核苷酸序列如seq id no:3(5
’‑
ttgaaaaacacgatgataaggatccatgaggatatttgctggcat
‑3’
)所示的正向引物和核苷酸序列如seq id no:4(5
’‑
taccgataagcttgatatcgaattcttacgtctcctcgaattgtgtat
‑3’
)所示的反向引物。所述扩增的反应程序优选为95℃5min;95℃10s,61℃45s,70℃1min,39个循环;70℃5min;16℃保存。所述扩增的反应体系优选为kod dna聚合酶(日本,toyobo)反应体系,体系体积为50μl,主要由模板1μl,kod buffer 5μl,2mm dntp 5μl,10μm正反向引物1.5μl,kod用mgso43μl,kod聚合酶1μl以及33.5μl纯水构成。
[0048]
得到ctla
‑
4ig基因片段和pd
‑
l1基因片段后,本发明将所述ctla
‑
4ig基因片段和pd
‑
l1基因片段克隆至plenti cmv gfp puro(658
‑
5)载体上,得到重组载体plenti cmv ctla
‑
4ig ires pd
‑
l1 puro。
[0049]
在本发明中,所述克隆的方法没有特殊限制,采用本领域所熟知的克隆方法即可。所述plenti cmv gfp puro(658
‑
5)载体的克隆位点优选为sali和bamhi。
[0050]
克隆后,对得到的重组载体进行鉴定。本发明对所述鉴定方法没有特殊限制,采用本领域所熟知的鉴定方法即可,例如将所述重组载体导入大肠杆菌中经培养,菌落检测目标基因,得到阳性转化子,提取质粒,得到重组载体。
[0051]
得到重组载体plenti cmv ctla
‑
4ig ires pd
‑
l1 puro后,本发明将所述重组载体plenti cmv ctla
‑
4ig ires pd
‑
l1 puro、pmd2和pspax2混合,在转染试剂的作用下处理真核细胞,经培养,收集上清。
[0052]
在本发明中,所述重组载体plenti cmv ctla
‑
4ig ires pd
‑
l1 puro、pmd2和pspax2的质量比优选为3:1.5~2.5:2.5~3.5,更优选为3:2:3。本发明对所述pmd2和pspax2质粒的来源不做任何特殊限制,采用本领域所熟知的pmd2和pspax2质粒来源即可。所述转染试剂优选包括pei转染试剂。在本发明实施例中,所述真核细胞为293ft细胞。所述培养进行8h后更换新鲜培养液。所述新鲜培养液为本领域常见的用于培养293ft细胞的培养液。更换新鲜培养液后,继续培养72h,收集上清,浓缩得到重组慢病毒。
[0053]
得到上清后,本发明将所述上清感染宫内膜干细胞,经细胞培养得到过表达ctla
‑
4ig/pd
‑
l1的宫内膜干细胞。
[0054]
在本发明中,所述宫内膜干细胞优选选自原代至第十代的宫内膜干细胞中任意一代,更优选为第6代或第7代。所述感染优选在转染增强剂的作用下进行;所述转染增强剂优
选包括polybrene试剂。所述polybrene试剂的使用浓度优选为10μg/ml。所述细胞培养进行24h后更换新鲜培养液。于换液后48h收集细胞。将收集的细胞进行鉴定。所述鉴定优选包括细胞表面标记物鉴定和外源基因表达量及其蛋白表达的鉴定。外源基因表达量的鉴定采用实时荧光定量pcr进行,优选采用核苷酸序列seq id no:5的正向引物和核苷酸序列seq id no:6的反向引物检测ctla4
‑
igg基因的表达量,采用核苷酸序列seq id no:7的正向引物和核苷酸序列seq id no:8的反向引物检测pd
‑
l1基因的表达量。
[0055]
在本发明中,所述药物优选包括注射剂。所述注射剂优选为含宫内膜干细胞或过表达ctla
‑
4ig/pd
‑
l1的宫内膜干细胞的氯化钠溶液。所述氯化钠溶液的质量体积百分比优选为0.8%~1.0%,更优选为0.9%。所述过表达ctla
‑
4ig/pd
‑
l1的宫内膜干细胞的密度优选为2.0
×
105~4.0
×
105个/ml,更优选为3.0
×
105个/ml。
[0056]
本发明提供了一种用于预防和/或治疗肺纤维化的细胞制剂,包括含宫内膜干细胞或过表达ctla
‑
4ig/pd
‑
l1的宫内膜干细胞的氯化钠溶液;所述氯化钠溶液的质量体积百分比为0.8%~1.0%。所述过表达ctla
‑
4ig/pd
‑
l1的宫内膜干细胞的密度优选为2.0
×
105~4.0
×
105个/ml。
[0057]
在本发明中,所述细胞制剂的制备方法,优选包括以下步骤:
[0058]
将上述技术方案制备的过表达ctla
‑
4ig/pd
‑
l1的宫内膜干细胞培养至细胞汇合度达到90%~95%时,用胰蛋白酶消化,收集细胞;
[0059]
将收集的细胞重悬于含0.8%~1.0%的氯化钠溶液中,得到细胞制剂。
[0060]
在本发明中,所述细胞制剂的制备过程需全程在无菌条件下进行,环境温度和/或氯化钠溶液的温度优选为20~26℃。所述细胞制剂的给药方式为静脉注射和/或腹腔注射。所述静脉注射和/或腹腔注射的剂量为500μl细胞悬液。所述细胞制剂能够有效改善肺纤维化情况以及降低肺纤维化过程中炎症反应。
[0061]
下面结合实施例对本发明提供的宫内膜干细胞或过表达ctla
‑
4ig/pd
‑
l1的宫内膜干细胞的应用进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
[0062]
实验材料来源及涉及引物序列的说明
[0063]
1实验动物:c57bl/6小鼠,spf级,6~8周龄,雄性;购买于广东省实验动物中心,合格证号:no.44007200042765。
[0064]
2.主要试剂
[0065]
博来霉素(bleomycin,国药集团药业股份有限公司);emscs培养基(赛业(广州)生物科技有限公司,huxub
‑
90011);氯化钠(美国sigma公司);磷酸盐缓冲液(pbs,美国gibco公司);二甲基亚砜(美国gibco公司);0.25%胰酶(美国thermo fisher公司);bca蛋白浓度测定试剂盒(beyotime biotechnology);抗α
‑
sma抗体(英国abcam公司);抗β
‑
actin抗体(美国cst公司);抗pd
‑
l1抗体(美国abcam公司),二抗(山羊抗兔,美国cst公司);primerscript
tm
rt reagent kit with gdna eraser反转录试剂盒(大连宝生物有限公司);premix ex taq
tm
ii(大连宝生物有限公司);其他试剂均为国产分析纯。
[0066]
3主要仪器
[0067]
超净工作台、co2培养箱(美国thermo公司);倒置显微镜(重庆奥特光学仪器有限责任公司);低速离心机、高速离心机(德国eppendorf公司);chemidoc
tm touch imaging system、电泳装置(美国bio
‑
rad公司);荧光定量pcr仪(美国应用生物系统公司)。
[0068]
4.本发明实施例中所涉及的引物序列见表1。
[0069]
表1各基因扩增或检测用引物序列
[0070][0071][0072]
实施例1
[0073]
表达鼠源ctla
‑
4ig基因和pd
‑
l1基因的重组慢病毒的构建方法
[0074]
1.过表达鼠源ctla
‑
4ig基因与pd
‑
l1基因的重组载体的构建方法
[0075]
取正常小鼠脾脏研磨提取rna后,再反转录为cdna文库。将此cdna文库作为pcr模板,设计鼠源ctla
‑
4ig基因的扩增引物(见seq id no:1和seq id no:2)和pd
‑
l1基因过表达pcr扩增引物(seq id no:3和seq id no:4,具体序列见表1)。经pcr扩增出鼠源ctla
‑
4ig基因与pd
‑
l1基因序列,反应程序为95℃5min;95℃10s,61℃45s,70℃1min,39个循环;70℃5min 7、16℃保存。反应体系为kod dna聚合酶(日本,toyobo)反应体系,体系体积为50μl,主要由模板1μl,kod buffer 5μl,2mm dntp 5μl,10μm正反向引物1.5μl,kod用mgso43μl,kod聚合酶1μl以及33.5μl纯水构成。再利用分子克隆基因重组手段将两段序列克隆在plenti cmv gfp puro(658
‑
5)(addgene,plasmid#17448)载体上(使用限制性内切酶sali和bamhi酶切),得到plenti cmv ctla
‑
4ig ires pd
‑
l1 puro重组载体。
[0076]
2.鼠源ctla
‑
4ig基因与pd
‑
l1基因过表达慢病毒制备及细胞感染
[0077]
将上述制备的重组载体经质粒中提试剂盒提取后进行慢病毒包装。具体如下:将293ft培养于15cm培养皿中,待密度达到80
‑
90%时,于慢病毒包装前2h换入新鲜培养基于
孵箱中培养。病毒包装时,取1ml无血清培养基opti
‑
mem(thermo fisher)于1.5ep管中,加入10μg pmd2、15μg pspax2和15μg plenti cmv ctla
‑
4ig ires pd
‑
l1 puro或plenti cmv ires puro质粒(对照质粒),上下颠倒混匀。然后加入58μl 1mg/ml pei转染试剂,快速于振荡仪上振荡10s,避光室温静置15min。然后加入上述293ft细胞中,8h后换成新鲜培养液。换液后72h收取上清,离心后加入病毒浓缩液于4℃浓缩过夜,离心收集沉淀后冻存于
‑
80℃备用,得到过表达ctla
‑
4ig和pd
‑
l1基因的重组慢病毒。
[0078]
实施例2
[0079]
含emscs或cp emscs的细胞制剂1
[0080]
(1)终产物的配料比例:emscs或cp emscs(第六代),2.0
×
105个/ml;氯化钠溶液浓度0.9%。
[0081]
(2)制备方法:将emscs接种于10cm细胞培养皿,用emscs培养基在37℃、co2浓度为5%的细胞培养箱中培养。待细胞长至60%~70%密度,使用实施例1制备的过表达ctla
‑
4ig和pd
‑
l1基因的慢病毒感染细胞,48小时用0.25%胰蛋白酶消化3min。消化后的细胞用灭菌的质量体积百分数为0.9%的氯化钠重悬细胞,分装至1ml注射器,得到cp emscs的细胞制剂1备用。
[0082]
对照组emscs细胞制剂是待细胞长至90%~95%密度,用胰蛋白酶消化后,各用灭菌的质量体积百分数为0.9%的氯化钠重悬细胞,分装至1ml注射器,得到emscs的细胞制剂1备用。
[0083]
实施例3
[0084]
含emscs或cp emscs的细胞制剂2
[0085]
(1)终产物的配料比例:emscs或cp emscs(第六代),4.0
×
105个/ml;氯化钠,0.9%。
[0086]
(2)制备方法:将emscs接种于10cm细胞培养皿,用emscs培养基在37℃、co2浓度为5%的细胞培养箱中培养。待细胞长至60%~70%密度,使用实施例1制备的过表达ctla
‑
4ig和pd
‑
l1基因的慢病毒感染细胞,48小时用0.25%胰蛋白酶消化3min。消化后的细胞用灭菌的质量体积百分数为0.9%的氯化钠重悬细胞,分装至1ml注射器,得到cp emscs的细胞制剂2备用。
[0087]
对照的emscs待细胞长至90%
‑
95%密度,用0.25%胰蛋白酶消化3min后,各用灭菌的质量体积百分数为0.9%的氯化钠重悬细胞,分装至1ml注射器,得到emscs的细胞制剂2备用。
[0088]
实施例4
[0089]
含emscs或cp emscs的细胞制剂3
[0090]
(1)终产物的配料比例:emscs或cp emscs(第七代),2.0
×
105个/ml;氯化钠,0.9%。
[0091]
(2)制备方法:将emscs接种于10cm细胞培养皿,用emscs培养基在37℃、co2浓度为5%的细胞培养箱中培养。待细胞长至60%~70%密度,使用实施例1制备的过表达ctla
‑
4ig和pd
‑
l1基因的慢病毒感染细胞,48小时用0.25%胰蛋白酶消化3min。消化后的细胞用灭菌的质量体积百分数为0.9%的氯化钠重悬细胞,分装至1ml注射器,得到cp emscs的细胞制剂3备用。
[0092]
对照组emscs待细胞长至90%~95%密度,用0.25%胰蛋白酶消化3min后,各用灭菌的质量体积百分数为0.9%的氯化钠重悬细胞,分装至1ml注射器,得到emscs的细胞制剂3备用。
[0093]
实施例5
[0094]
含emscs或cp emscs的细胞制剂4
[0095]
(1)终产物的配料比例:emscs或cp emscs(第七代),4.0
×
105个/ml;氯化钠,0.9%。
[0096]
(2)制备方法:将emscs接种于10cm细胞培养皿,用emscs培养基在37℃、co2浓度为5%的细胞培养箱中培养。待细胞长至60%~70%密度,使用实施例1制备的过表达ctla
‑
4ig和pd
‑
l1基因的慢病毒感染细胞,48小时用0.25%胰蛋白酶消化3min。消化后的细胞用灭菌的质量体积百分数为0.9%的氯化钠重悬细胞,分装至1ml注射器,得到cp emscs的细胞制剂4备用。
[0097]
对照组emscs待细胞长至90%~95%密度,用0.25%胰蛋白酶消化3min后,各用灭菌的质量体积百分数为0.9%的氯化钠重悬细胞,分装至1ml注射器,得到emscs的细胞制剂4备用。
[0098]
实施例6
[0099]
含emscs或cp emscs的细胞制剂5
[0100]
(1)终产物的配料比例:emscs或cp emscs(第八代),2.0
×
105个/ml;氯化钠,0.9%。
[0101]
(2)制备方法:将emscs接种于10cm细胞培养皿,用emscs培养基在37℃、co2浓度为5%的细胞培养箱中培养。待细胞长至60%~70%密度,使用实施例1制备的过表达ctla
‑
4ig和pd
‑
l1基因的慢病毒感染细胞,48小时用0.25%胰蛋白酶消化3min。消化后的细胞用灭菌的质量体积百分数为0.9%的氯化钠重悬细胞,分装至1ml注射器,得到cp emscs的细胞制剂5备用。
[0102]
对照组emscs待细胞长至90%~95%密度,用0.25%胰蛋白酶消化3min后,各用灭菌的质量体积百分数为0.9%的氯化钠重悬细胞,分装至1ml注射器,得到emscs的细胞制剂5备用。
[0103]
实施例7
[0104]
含emscs或cp emscs的细胞制剂6
[0105]
(1)终产物的配料比例:emscs或cp emscs(第八代),4.0
×
105个/ml;氯化钠,0.9%。
[0106]
(2)制备方法:将emscs接种于10cm细胞培养皿,用emscs培养基在37℃、co2浓度为5%的细胞培养箱中培养。待细胞长至60%~70%密度,使用实施例1制备的过表达ctla
‑
4ig和pd
‑
l1基因的慢病毒感染细胞,48小时用0.25%胰蛋白酶消化3min。消化后的细胞用灭菌的质量体积百分数为0.9%的氯化钠重悬细胞,分装至1ml注射器,得到cp emscs的细胞制剂6备用。
[0107]
对照组emscs待细胞长至90%~95%密度,用0.25%胰蛋白酶消化3min后,各用灭菌的质量体积百分数为0.9%的氯化钠重悬细胞,分装至1ml注射器,得到emscs的细胞制剂6备用。
[0108]
实施例8
[0109]
含emscs或cp emscs的细胞制剂7
[0110]
(1)终产物的配料比例:emscs或cp emscs(第九代),2.0
×
105个/ml;氯化钠,0.9%。
[0111]
(2)制备方法:将emscs接种于10cm细胞培养皿,用emscs培养基在37℃、co2浓度为5%的细胞培养箱中培养。待细胞长至60%~70%密度,使用实施例1制备的过表达ctla
‑
4ig和pd
‑
l1基因的慢病毒感染细胞,48小时用0.25%胰蛋白酶消化3min。消化后的细胞用灭菌的质量体积百分数为0.9%的氯化钠重悬细胞,分装至1ml注射器,得到cp emscs的细胞制剂7备用。
[0112]
对照组emscs待细胞长至90%~95%密度,用0.25%胰蛋白酶消化3min后,各用灭菌的质量体积百分数为0.9%的氯化钠重悬细胞,分装至1ml注射器,得到emscs的细胞制剂7备用。
[0113]
实施例9
[0114]
含emscs或cp emscs的细胞制剂8
[0115]
(1)终产物的配料比例:emscs或cp emscs(第九代),4.0
×
105个/ml;氯化钠,0.9%。
[0116]
(2)制备方法:将emscs接种于10cm细胞培养皿,用emscs培养基在37℃、co2浓度为5%的细胞培养箱中培养。待细胞长至60%~70%密度,使用实施例1制备的过表达ctla
‑
4ig和pd
‑
l1基因的慢病毒感染细胞,48小时用0.25%胰蛋白酶消化3min。消化后的细胞用灭菌的质量体积百分数为0.9%的氯化钠重悬细胞,分装至1ml注射器,得到cp emscs的细胞制剂8备用。
[0117]
对照组emscs待细胞长至90%~95%密度,用0.25%胰蛋白酶消化3min后,各用灭菌的质量体积百分数为0.9%的氯化钠重悬细胞,分装至1ml注射器,得到emscs的细胞制剂8备用。
[0118]
实施例10
[0119]
实施例2~9的制备的重组细胞的鉴定
[0120]
利用流式细胞仪对上述实施例2~9的制备的重组细胞和emscs细胞中细胞表面标记物进行检测。该细胞在标记物检测中符合以下要求:标记物cd29、cd44、cd90、和cd105表达阳性;标记物cd34、cd45、hla
‑
dr表达阴性,见附图1。
[0121]
提取上述实施例2~9的制备的重组细胞的rna,经反转录,得到cdna。以cdna为模板,采用ctla
‑
4ig基因引物(seq id no:5和seq id no:6)和pd
‑
l1基因引物(seq id no:7和seq id no:8)进行荧光定量pcr检测,以β
‑
actin基因为内参基因。另外,提取实施例2~9的制备的重组细胞的总蛋白,采用常规方法进行蛋白免疫印记检测。
[0122]
实时荧光定量pcr显示,ctla
‑
4ig和pd
‑
l1基因的mrna表达相对于未进行基因修饰的emscs均升高了105倍以上;westernblotting也检测到pd
‑
l1基因的蛋白表达。结果见附图2。
[0123]
实施例11
[0124]
cp emscs细胞制剂1对博来霉素诱导的肺纤维化的治疗作用
[0125]
1肺纤维化模型的建立、分组及干预
[0126]
取6~8周龄雄性c57bl/6小鼠32只,其中24只给予腹腔注射1.5μg/ml博来霉素,每周1次,连续给药3周建立肺纤维化小鼠模型,通过检测肺组织α
‑
sma蛋白表达来判断模型构建是否成功。另外8只作为对照组给予腹腔注射生理盐水。24只给予腹腔注射1.5μg/ml博来霉素的小鼠于第一次给药3天后随机分成模型组、emscs组和cp emscs组,每组8只,emscs组和cp emscs给予尾静脉注射实施例2得到的细胞制剂1,对照组和模型组分别给予尾静脉注射灭菌的0.9%氯化钠,每周干预1次,连续干预3周。并于第21天颈椎脱臼处死后取材用于以下实验。并且采用相同方法微静脉注射实施例3~9制备的细胞制剂2~8,采用相同方法检测治疗结果。
[0127]
2蛋白免疫印记
[0128]
2.1蛋白提取及定量
[0129]
取肺组织进行组织研磨提取总蛋白,加入适量裂解液(含1%pmsf),冰上孵育30分钟;12000rpm冷冻离心30分钟,将上清液转移至新的离心管;取2μl进行蛋白定量,其余蛋白加入适量的loading buffer,混匀后至于100℃中加热变性5分钟,
‑
20℃保存。蛋白定量过程如下:用裂解液50倍稀释待测样品,取100μl加入96孔细胞培养板,按照bca法蛋白浓度测定试剂盒说明书,分别取a液、b液(a液和b液比例为1:50)于离心管中,用移液器轻轻吹打均匀后配成混合液,在上述加样孔中每孔加100μl混合液;盖上薄膜,37℃水浴孵育30分钟,于酶标仪570nm波长下检测吸光度值;根据吸光度值绘制标准曲线并计算各待测样品的蛋白浓度。
[0130]
2.2蛋白电泳及免疫印迹
[0131]
配制10%分离胶,待分离胶凝固后配制浓缩胶,加至分离胶上层,插入梳子,待胶体凝固后轻轻把梳子拔出;在10%sds
‑
page各孔分别加入蛋白marker和样品,80v电泳30分钟后,120v电泳1.5小时;在恒压100v室温条件下转膜(硝酸纤维素膜)90分钟;取下膜,标记正反面后用5%bsa室温封闭2小时;用1
×
tbs
‑
t清洗3次,每次5分钟;根据抗体说明书用5%bsa稀释至工作浓度,与硝酸纤维素膜4℃杂交过夜;用1
×
tbs
‑
t清洗3次,每次5分钟;1:1000稀释二抗后室温杂交1小时;用1
×
tbs
‑
t清洗3次,每次5分钟;曝光;扫描并用软件image j(v 1.45)计算各组蛋白条带灰度值。
[0132]
3.实时荧光定量pcr
[0133]
3.1总rna提取及反转录
[0134]
取少量组织,研磨后加入适量的trizol裂解;室温下放置3分钟,待液化后将裂解液移至干净的无酶微量离心管中。加入预冷的三氯甲烷0.2ml,迅速用力上下颠倒混匀,冰上静置5分钟,使蛋白复合体全部裂解,离心(4℃,13000g,15分钟)。吸取上层水相,转移到另一个无酶离心管中,加入400μl异丙醇,迅速用力上下颠倒混匀,
‑
20℃静置30分钟,沉淀rna。离心(4℃,13000g,10分钟),管底可见少许白色沉淀,去上清,加入1ml的70%乙醇,上下颠倒混匀后洗涤去杂,冰上放置5分钟。离心(4℃,7600g,5分钟),尽量吸干乙醇,室温下干燥5分钟,待残余的乙醇挥发完全至rna沉淀透明,最后加入30μl无核酸酶水,溶解rna。取1μl rna测定rna浓度及纯度,260/280比值介于1.8~2.0之间表明rna质量良好,然后根据反转录试剂盒说明书中的程序进行cdna的合成,用作实时荧光定量pcr的模板。
[0135]
3.2实时荧光定量pcr
[0136]
在15μl的实时反应体系中含有:7.5μl的sybr green(2
×
),肺组织il
‑
6、mcp
‑
1、
tgf
‑
β或il
‑
1β基因的上下游引物各0.6μl(10μmol/l),1:15稀释的cdna 1.5μl,4.5μl h2o,0.3μl rox。在荧光定量pcr仪内扩增40个循环,变性、退火、延伸所需温度、时间分别为95℃,30s;60℃,30s;72℃,90s。每个样品重复测定3次。mrna的相对量用ct值表示,平均相对表达量通过2
-
△△
ct
计算方法分析。
[0137]
4.肺组织苏木素
‑
伊红(hematoxylin
‑
eosin,he)染色
[0138]
取材后,肺组织用10%甲酸固定,常规脱水,石蜡包埋,制作蜡块,用石蜡切片机进行石蜡样本的切片,厚度3.5μm,连续切片,染色程序为烤片干燥20分钟,二甲苯2次
×
10分钟,无水乙醇2次
×
2分钟,95%乙醇1分钟,80%乙醇1分钟,70%乙醇1分钟,水洗1分钟,苏木素8分钟,苏木素10分钟,水洗2次
×
1分钟,0.5%盐酸酒精10秒,水洗10分钟,伊红2分钟,水洗1分钟,80%、85%、90%乙醇各5秒,95%乙醇1分钟,无水乙醇2次
×
2分钟,无水乙醇3分钟,二甲苯2次
×
2分钟,结束染色后直接中性树胶封片,镜检。
[0139]
5.统计学方法
[0140]
图片数据应用image j软件进行处理分析,其他数据应用统计软件spss17.0进行统计处理分析,p<0.05差异具有统计学意义。
[0141]
6.结果及分析
[0142]
6.1cp emscs细胞制剂1对肺组织纤维化情况的影响
[0143]
he染色结果显示,对照组小鼠肺组织结构清晰,未见肺泡间隔增宽。模型组小鼠肺组织结构破坏严重,部分肺泡融合,肺泡间隔明显增厚,肺间质内出现大量宽带状及片状胶原纤维,呈弥漫性肺纤维化。cp emscs组小鼠肺组织仍有纤维化形成,但纤维化程度明显比模型组和emscs组减少,且未见弥漫性纤维化,病变部位呈局灶性分布。结果附图3。
[0144]
6.2 cp emscs细胞制剂1对肺组织α
‑
sma表达的影响
[0145]
由附图4可见,与正常对照组比较,模型组小鼠肺组织纤维化标志物α
‑
sma蛋白表达水平显著升高,说明小鼠肺纤维化模型成功建立。与模型组和emscs组比较,cp emscs组小鼠整体肺组织α
‑
sma蛋白表达水平显著下降,表明cp emscs组合物可有效缓解肺纤维化,减少emscs用量。
[0146]
3.3 emscs细胞制剂1对肺组织纤维化相关基因
[0147]
由附图5可见,与对照组比较,模型组和emscs组小鼠肺组织各种炎性趋化因子的mrna表达水平显著升高,说明低剂量的emscs对缓解肺部炎症起到的作用有限。与模型组和emscs组比较,cp emscs组小鼠肺组织il
‑
6,mcp
‑
1,tgf
‑
β,il
‑
1β表达显著下调(*p<0.05,**p<0.01),表明cp emscs组合物在治疗肺纤维化炎症过程发挥着重要的作用,可明显降低emscs的使用剂量,增强治疗效果。
[0148]
细胞治疗领域,一般在一定范围内,细胞浓度高效果好。本技术选用实施例2制备的细胞制剂1由于早期的细胞比传代后期的细胞活力更好,而且细胞制剂1中细胞浓度低,与对照组相同浓度的emscs相比,能够很好的显示过表达抑制因子具有增强emscs治疗效果的作用。
[0149]
由上述实施例结果可知,博来霉素诱导的肺纤维化小鼠模型通过低剂量cp emscs细胞制剂干预处理,可显著改善肺纤维化症状,下调肺组织α
‑
sma蛋白表达水平。此外cp emscs组合物在治疗肺纤维化炎症过程发挥着重要的作用,具体表现为下调肺组织il
‑
6、mcp
‑
1、il
‑
1β和tgf
‑
β等基因表达。而等剂量的emscs组合物则完全没有显示出改善肺纤维
化的效果。因此,cp emscs在治疗肺纤维化中可降低emscs的使用量,增强治疗效果。
[0150]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1