强亲水型微针基材与载药微针及其在治疗疾病中的应用的制作方法
1.本发明涉及一种由强亲水型基材制成的微针,更具体地涉及一种使用聚乙烯醇和小分子多羟基化合物的组合物为基材,制备具有强亲水表面的微针与载药微针及其在治疗疾病中的应用。
背景技术:
2.药物微针作为载药释药的方式,近年发展迅速,但量产的实际应用还相对迟缓。虽然各种现有技术在微针的制备与载药方式等方面有所不同,其应用受制于微针的成型方式与释药方式。
3.药物微针的载药方式主要有两种,1、混合式载药:把药物与微针基材粉末混匀一体,再将含有药物的混合物料加工成微针;2、包裹式载药:先将微针基材物料单独加工成空白微针,再把药物在低温环境中装载到微针针尖部位。这两种载药方式各有优劣,混合式载药量不够大,包裹式载药量更小、甚至要小许多倍;尽管包裹式载药量更小且容易脱落,但所载药物位于微针针尖的表面,与人体组织直接接触,药物释放快且较充分,吸收完全,用药节省;混合式载药的药物包埋在整个微针体内,虽然载药量高于包裹式,但仅仅微针针尖部位的药物才能进入人体组织,其释药过程受到针尖基材的阻挡,药物释放慢,残留在针体远端不起药效的药物多;包裹式的药物容易从微针表面脱落,挤入皮孔后也容易受到挤压,部分药物被推出到皮外。这种包裹载药的易脱落、载药量小和被挤出皮外,通常是由于微针表面与药物之间的附着力(亲和力)不足所致。
4.药物微针的成型方式通常有两种,1、非模具成型(如拉丝法、3d打印法);2、模具成型。所述的模具成型方式有三种:1、混合物料热注法,物料中的药物要经受较高温度、不能用于绝大部分蛋白多肽类药物;2、混合物料浓溶液冷注法,此法可以低温进行、保证药物品质,但干燥过程耗时长,量产放大受限制;3、热压冷包法,先将热塑性基材热压制成空白微针,再进行低温包裹载药,此法工艺简便容易量产放大,但载药量很小,药物容易脱落,针尖推入皮肤后,部分药物还可能被挤出到皮外。
5.综上所述、药物微针的主要技术问题有:混合物料载药方式,药物利用率低,综合效益差;载药量偏小,尤其是包裹式载药量更小、容易脱落;许多案例要经高温,不适用于许多药物;工艺过程较为复杂,需要精密控制各种条件,难以量产放大。
技术实现要素:
6.本发明提供一种可以相对简易的工艺流程就可制备微针的微针基材组合物,利用所述基材组合物制备获得空白微针,及其利用所述空白微针接触担载药物,进而成为用于治疗疾病的药物制剂形式。
7.本发明采用如下技术方案:
8.一种强亲水型微针基材组合物,其是由小分子多羟基化合物与聚乙烯醇组成,所述的小分子多羟基化合物与聚乙烯醇的羟基比为0.1:1~1.3:1,所述的聚乙烯醇的聚合度
为300~3500,醇解度为80%以上。
9.所述的聚乙烯醇的聚合度为300~2600。
10.所述的聚乙烯醇的醇解度为88%以上。
11.所述的小分子多羟基化合物与聚乙烯醇的羟基比为0.15:1~1:1。
12.所述小分子多羟基化合物选自甘油、赤藓糖醇、苏糖醇、木糖醇、阿糖醇、核糖醇、山梨糖醇、甘露糖醇、半乳糖醇、艾杜糖醇、庚七醇、核糖、木糖、葡萄糖的一种或多种。
13.所述小分子多羟基化合物选自甘油、赤鲜糖醇、木糖醇、山梨糖醇、甘露糖醇的一种或多种。
14.一种强亲水型微针,微针基材是上述强亲水性微针基材组合物。
15.一种强亲水型微针基材,其是将强亲水性微针基材组合物混合为共混粉末、或者将强亲水性微针基材组合物混合热压为型材、或者将强亲水性微针基材组合物用共混机械热混熔融挤出为型料。
16.一种强亲水型微针的制备方法,其特征为包括以下步骤:
17.a)将强亲水性微针基材组合物在室温下进行共混形成共混粉末;
18.b)将所述的共混粉末热压成型料,将型料热压入模具形成空白微针;或将所述的共混粉末
19.在一定的温度下,用共混机械热混熔融挤出为型料,将型材热压入模具形成空白微针。
20.所述的模具为具有一组或多组微孔阵列的平板,所述微孔为通孔,所述平板的厚度为0.2~3mm;将所述型料热压入模具形成空白微针为将所述共混粉末或所述型材添加在所述模具板微孔阵列上方,经加热形成具有流动性的融流物,从物料的上方向下施加压力,或从模具下方抽真空减压,或从上方施加压力的同时下方抽真空,使融流物进入所述模具的微孔。
21.所述压力为28~32kg/cm2,所述热压或热混溶温度为所述基材成型下限温度至聚乙烯醇分解温度以下。
22.一种载药微针,所述的载药微针为将含有药物的溶液接触吸附于强亲水型微针的针尖表面、干燥而形成。
23.所述的药物为蛋白药物、多肽药物、小分子药。
24.所述的药物为胰岛素、艾塞那肽、人生长激素、非那雄安的一种。
25.所述的含有药物的溶液为当药物为水溶性时配制成水溶液,或当药物为非水溶性药物时均匀地悬浮在水中或溶解/悬浮在非水极性溶剂中制成的溶液或悬浊液。
26.当药物为水溶性时,所述的含有药物的溶液为由药物、聚维酮或聚乙烯醇、水组成,其中聚维酮或聚乙烯醇的浓度为0.5%~15%;当活性药物为非水溶性时,所述的含有药物的溶液为由药物、聚维酮聚或乙烯醇、水和/或非水极性溶剂组成,其中聚维酮或聚乙烯醇的浓度为4%~15%;所述非水极性溶剂为甲醇、乙醇和异丙醇的一种或混合溶剂。
27.所述接触吸附过程为:在一平板上设置深度为0.1~0.7mm的凹槽,向凹槽加入所述的含药物的溶液至一定高度,将所述的强亲水型微针针尖垂直向下,站立在圆槽中停留后,取出并干燥,获得所述载药微针。
28.一种联合给药载药微针,其是载药微针的两种或两种以上各自载有不同药物的微
针组合一体而成。
29.联合给药载药微针是选自胰岛素载药微针、艾塞那肽载药微针组合一体而成,所述的胰岛素载药微针、艾塞那肽载药微针分隔设置。
30.一种胰岛素载药微针,其是载药微针,其中药物为胰岛素。
31.一种艾塞那肽载药微针,其是载药微针,其中药物为艾塞那肽。
32.经过大量理论与试验研究,发现使用多羟基高分子物质聚乙烯醇与小分子多羟基化合物配伍,可以获得具有强亲水性表面的微针,只要接触药物即可强力吸附药物、不易脱落、工艺简易、容易量产,载药量明显增高,药物使用效率高,空白微针制备与载药分阶段进行,载药阶段避免了高温,能有效地应用于治疗疾病的载药与释药,易于量产,完成了本发明。
33.本发明的微针基材组合物以及由此制成的空白微针以及使用空白微针载药,提供在治疗疾病中的微针给药方案,具有以下显著特点与有益效果:
34.一、本发明的微针组合物基材,利用小分子多羟基化合物与聚乙烯醇的比例调节物性,改善了聚乙烯醇的热塑性,达成了热塑温度大大低于分解温度的结果。
35.二、保持了聚乙烯醇固有的表面强亲水极性,使得包裹式载药的载药量和进入体内的透过量明显提高。
36.三、由于载药借助于亲水极性吸附,空白微针制备与负载药物可以分步进行,载药过程可以在零度以上的低温度下进行,保证药物品质,适用于许多药物特别是蛋白多肽类等对温度敏感的药物的微针给药;
37.四、药物包裹在针尖的表面,直接与皮内组织接触,起效快,利用率高,具有成本优势;
38.五、针体硬度适宜,给药精度高,皮感温和;
39.六、微针基材韧性良好,满足机械加工的受力要求,工艺简明,操作简便,耗时极短,工艺放大潜力很大。
40.这些显著特点与有益效果都基于本发明所涉的微针组合物的属性特点,即:1、生物安全性;2、表面强附着性;3、良好热塑性;4、与水溶液特异的亲和关系;5、良好的冷缩性和韧性;6、自然降解性。基于这些属性特点,本发明所涉的微针组合物基材,有力地支撑了药物微针的药用前景、工业化量产前景和环境保护要求。
附图说明
41.图1是专用微针制备装置示意图;
42.图2是模具板示意图;
43.图3是共混粉末直接制成型材后制备微针流程示意图;
44.图4是共混粉末经器械热共混挤出为型材制备微针流程示意图;
45.图5是装置先预热至成型温度,再置入型材热压制微针的流程示意图;
46.图6是本发明的空白微针的高倍放大镜(30倍)下的图像;
47.图7是本发明的空白微针示意图;
48.图8是本发明的空白微针载药后,药物牢固吸附在针尖部位的高倍放大镜(30倍)下的图像;
49.图9是本发明的载药微针示意图;
50.图10是微针悬挂药液包裹微针针尖状态示意图;
51.图11是甘露醇标准氢谱;
52.图12是市售聚乙烯醇1788的自测氢谱;
53.图13是聚乙烯醇1788/甘露醇(1:0.6185w/w)微针片的氢谱;
54.图14是聚乙烯醇1788/甘露醇(1:0.6185w/w)微针片材水溶液铜离子沉淀部分聚乙烯醇为主的氢谱;
55.图15是聚乙烯醇1788/甘露醇(1:0.6185w/w)微针片材水溶液铜离子沉淀后上清液甘露醇为主的氢谱;
56.图16是市售聚乙烯醇1799自测氢谱;
57.图17是聚乙烯醇1799/甘露醇(1:0.689w/w)微针片材的氢谱;
58.图18是聚乙烯醇1799/甘露醇(1:0.689w/w)微针片材水溶液铜离子沉淀部分以聚乙烯醇为主的氢谱;
59.图19是聚乙烯醇1799/甘露醇(1:0.689w/w)微针片材水溶液铜离子沉淀后上清液甘露醇为主的氢谱;
60.图20是联合微针示意图;
61.图21是胰岛素微针的糖尿病模型猪药效图;
62.图22是艾塞那肽微针的糖尿病模型猪药效图;
63.图23是不同热挤出物料的预制圆片和/或微针成型温度表;
64.图24是进行试验的共混粉末即型材组成表;
65.图25是基材对氯化钠/聚维酮溶液形成斑点的附着力实验结果表;
66.图26是微针吸附受试溶液量结果表;
67.图27是高倍放大镜(30倍)观察药液滴挂在针尖的状态表;
68.图28一米高自由落体后,高倍放大镜(30倍)观察药物脱落情况表;
69.图29是微针基材的韧性与脆碎结果表;
70.图30是微针吸附水溶性物料受试溶液量表;
71.图31是微针吸附非水溶性物料受试溶液量表;
72.图32是胰岛素载药微针药效试验表;
73.图33是艾塞那肽载药微针的药效试验表;
74.图34是共混粉末料直接压成圆片型料表;
75.图35是挤出颗粒料压成圆片型料表;
76.图36是五种不同配比物料微针从模具板上解离时针体完整情况表;
77.图37是甘露糖醇/不同聚合度的xx99聚乙烯醇的热溶清除情况表;
78.图38是不同醇解度物料针体皮孔内保持形态的实验结果表。
具体实施方式
79.下面结合附图和具体实施例对本发明进行详细说明。
80.以下结合附图对本发明的具体实施方式进行说明,并不形成对本发明的限定。
81.本发明首先提供一种强亲水型微针基材组合物,其是由聚乙烯醇、小分子多羟基
化合物所组成,其中小分子多羟基化合物与聚乙烯醇的羟基比为0.1:1~1.3:1,所述的聚乙烯醇的聚合度为300~3500,醇解度为80%以上。
82.本发明所述聚合度是指聚合物分子中结构单元的总数,即有多少结构单元聚合而成的聚合物。聚乙烯醇一般由醋酸乙烯酯聚合、醇解得到,其中醋酸乙烯脂单元经醇解为乙烯醇单元,其中一部分醇解,留下一部分未醇解。因此,醇解的程度用醇解度表示,即醇解度是指聚乙烯醇分子中乙烯醇单元数所占的单元总数的百分比,其余未醇解的单元为醋酸乙烯酯。该醇解度与其物性密切相关,例如水溶性,亲水性,软化温度,机械强度等,当与其他物质配伍,例如多羟基物质,两种物质间能够形成氢键,依据混合比例不同,其氢键多少也不同,因而影响其物性。因此,本发明人经过锐意研究与试验,获得了制备强亲水型微针的基材组合物。
83.所述聚合度和醇解度用四位数字表示,前两位数表示聚合度、后两位表示醇解度,如3588聚乙烯醇的聚合度为3500个单元、醇解度为88%。在以下的说明中,除非特别说明,用四位数字标注的即为所述聚合度与醇解度的聚乙烯醇。相应的聚乙烯醇都可以从市场获得,为了试验本发明的性能需要特殊规格的聚乙烯醇时,按照现有技术的方法进行合成与表征后使用(参考文献:聚乙烯醇生产醇解度的控制、丘天荣、化学工程与装备、2009年第九期p66
‑
70)。
84.所述获得的基材的物性,主要依赖所述聚乙烯醇的聚合度与醇解度、添加小分子多羟基化合物的比例,较小程度地依赖小分子多羟基化合物的类型,这些因素影响程度可以从试验获得。
85.优选地,所述聚乙烯醇选自聚合度为300~3500、醇解度为88%~100%的更好。按照惯例,完全醇解的聚乙烯醇的醇解度表示为xx99,而非xx100。
86.优选地,所述的聚乙烯醇的聚合度为300~2600更好。
87.优选地,醇解度为88%以上更好。
88.优选地,选用羟基比为0.15:1~1:1更好。
89.所述的小分子多羟基化合物选自甘油、赤藓糖醇、苏糖醇、木糖醇、阿糖醇、核糖醇、山梨糖醇(山梨醇)、甘露糖醇(甘露醇)、半乳糖醇、艾杜糖醇、庚七糖醇、核糖、木糖、葡萄糖的一种或多种。
90.优选地,所述的小分子多羟基化合物选自甘油、赤鲜糖醇、木糖醇、山梨糖醇、甘露糖醇的一种或多种。
91.聚乙烯醇分子含有大量羟基(由醇解度表征其羟基的多寡),能形成紧密的分子内或分子间氢键,致使其熔融温度高于分解温度,几乎没有热塑性;小分子多羟基化合物混合其中后,部分松解弱化了聚乙烯醇分子内或分子间的氢键,增加了热塑性;小分子多羟基化合物受热转为液态后,增加了物料的融流性;即添加小分子多羟基化合物后,这两种作用均有利于混合物料的热塑成型。因此,调节小分子多羟基化合物的添加量,就能控制组合物的热塑性。
92.所述的添加量可以从分子水平进行估算:每个小分子羟基可与一个聚乙烯醇羟基作用,二者的羟基比例关系可以转换为重量关系。乙烯醇的单元分子量为44,未醇解的醋酸乙烯酯的单元分子量为86,根据醇解度,可以得出聚乙烯醇的单元平均分子量=乙烯醇分子量
×
醇解度+醋酸乙烯酯分子量
×
(1
‑
醇解度),如80%醇解度的单元分子量为:44
×
80%
2070605.4、zl 2018 2 2071901.6、zl 2018 2 2070604.x)
104.所述温度范围,例如图23的表格所列举的例子,在一定压力下,不同成分的基材组合物的热挤出物料,制作空白微针时的最低成型温度,可以经过试验获得,作为合适温度范围的温度下限,其温度的上限应低于所用聚乙烯醇的分解温度;在温度下限和上限的范围内,只要调整压力、缩短物料受热时间,即可有利于制备空白微针,不必特别限定;减少接触氧气,有利于防止聚乙烯醇分解。作为参考,文献报道醇解度为88%的聚乙烯醇的分解温度为240℃左右;99%的为245℃左右(参见:“高分解温度pva制备及性能研究”、金狲森、浙江工业大学硕士学位论文、导师钟明强、范萍、材料科学与工程学院、2019年1月)。
105.本发明的基材具有良好热塑性,具有良好的韧性,利于工艺受力,所制成的微针表面具有强亲水极性、利于药物牢固附着、增加载药量。
106.利用上述的空白微针,本发明还提供一种药物载药微针,其是将含有药物的溶液与本发明所述的空白微针接触、附着、干燥而成。只要药物能被吸附在强亲水性表面,都能通过本发明所制备的空白微针与配制的含药物溶液接触吸附负载、干燥而成。因此,可以广泛地应用于需要的药物给药,特别对于不能耐受较高温度的药物可以简便地使用本发明的空白微针进行载药;这样的载药微针能在给药部位的皮层形成药物富集,有利于相关的疾病治疗,而口服或注射的这些药物,需要经过消化吸收系统和/或分配在全身血液流通,局部皮肤的给药效率不高,至于药剂在皮肤外抹,受表皮隔档、渗透不足。例如已经知道非那雄胺纠正脱发促进生发,最好是较小剂量并集中在头皮浅层使用,通过微针给药,可以实现小剂量富集于头皮,减少对全身的有害影响,优势明显。又例如,使用胰岛素微针给药,将微针贴于皮肤即可,不必注射,减少痛苦等。这样的微针还可以容易地制成几种药物分别担载在不同部位的针尖上,组成几种药物联合一体的联合微针,以减少给药次数,例如把胰岛素微针做成圆形的大半部分,把艾塞那肽微针做成圆形的小半部分,将这两个部分圆形的背面粘合在另一个圆片上,组合成联合微针(见附图20:20为全针、201为微针大半圆载一种药、202为微针小半圆载另一种药、203为粘合用背板)。负载不同药物的微针相互隔离又拼合在一起、使用方便。
107.所述空白微针,在其针尖尖部可以担载上许多种类的药物,例如胰岛素类药物、艾塞那肽类药物、人生长素、非那雄胺、降钙素类药物、蛋白类药物、肽类药物等等;对药物进行选择的基本原则是,剂量合适的、其它给药方式不如微针方便的、需要在局部皮肤形成药物富集浓度的、药物在其它制剂形式中不稳定的、等等。本案微针制剂技术有两个突出的药剂学优点,药物不经受高温和包裹式载药量较大,再加上微针制剂的共性优点,只要所选择的药物能够实现这些优点的一个或几个,就是合适的选择。所述合适的选择,可以是单一药物,也可以是两种和两种以上药物混合接触的复方配伍。所述药物复方配伍,必须是几种药物混合接触后,互不影响品质,能够发挥药效的;优选的,应当是在其它制剂形式上,医药法规已经批准的,例如短效胰岛素与中效胰岛素混为一体的注射剂“诺和灵”。至于直接接触会影响品质的药物,如需同时配合施用,所述的联合微针是理想的一种安排。因此,不必在药物品种上做特别的限定,也不因为未做特别限定而失去对合适药物品种的本案微针制剂的知识产权保护。
108.所述的载药微针是通过空白微针与含药溶液接触、附着、干燥而成,即空白微针的制备与微针载药过程分段进行。这样的空白微针可以方便地进行规模化生产,其方便性表
现在:一、只是空白微针制备涉及高温,而后续载药的条件非常温和,药物品质保证;二、药物没有与微针材料混合一体,微针材质性质不受影响,空白微针材质的韧性、脆度等要素很容易进行调控;三、药物释放行为的调整,只需要调整药液中的辅料,就可以方便的实现。而混合式载药的微针,既要顾及材质的属性,又要顾及药物的释放行为,调控难度和涉及因素增加了许多;四、药液只是包裹在针尖表面,形成表面积较大、厚度较小的液膜,干燥耗时很短、温度很低,非常有利于工艺放大。
109.所述的含药溶液,只要利于药物的负载,且不影响药效发挥和不产生人体不良影响,就可以使用通常的相关药用辅料,帮助药物的负载与更好地发挥药效。
110.进一步,利用本发明制成的空白微针进行药物担载的方法,其特征在于,将水溶性药物直接配制成水溶液进行药物担载,加入适当适量的粘合剂进行药物担载更好;如果水溶性药物干燥形成的固体膜层与微针基材粘附力满意,不收缩产生裂纹,不在药物与微针的结合界面产生剪切力,就能够牢固地附着在针尖表面,因此一般不加或稍加粘合剂;将非水溶性药物均匀地悬浮在水中或溶解/悬浮在非水极性溶剂中进行药物担载,加入适量的粘合剂进行药物担载更好;所述非水极性溶剂,通常为甲醇、乙醇和异丙醇,以乙醇最常用,鉴于极性、溶解性和生物安全性。在特定的使用场合,例如需快速释放,可使用水溶性强、粘性合适的辅料,所谓粘性合适是指既能将药物粘合在微针之上,又能快速溶解,促使药物快速接触体液,通常可以选择的辅料有低分量聚维酮或聚乙二醇;如需缓速长效释放,通常可以用不同分子量的聚维酮或聚乙二醇进行比选,随着分子量的增大,其亲水性保持不变,但粘度增加,接触体液后,溶胀过程和溶胀后溶解进入体液的过程均放缓,药物释放亦随之放缓;辅料用量也与药物释放行为密切相关,在确保附着牢固的前提下,调节辅料用量,亦可调节药物释放。如果一种辅料不能同时兼顾粘性和水溶性的需要,还可以添加相关物质,以着重改变粘性或水溶性。在药剂学方面,改变药物释放行为的方法和能用的辅料较多,可通过实验进行药物释放行为的比选,达成药物、辅料、粘附和药物释放等要素的平衡。在特定的使用场合,例如既需要快速释放又需要维持长效,还可将速释和长释的两种药物混合一体制成微针(例如短效胰岛素与中效胰岛素混为一体的注射剂“诺和灵”),或制成所述的联合微针。故而,在本发明的微针上进行有利于载药和释放的辅料选择和用量比例选择,都属于本发明的发明构思与保护范围。
111.所述的药物的亲水性与疏水性可以通过例如成盐、成碱、调换酸根或碱基、调整药液ph值等方法进行改进,只要有利于药效和生物可接受的形式即可,例如多肽蛋白类药物,在等电点附近其亲水性与疏水性发生较大变化,可以根据需要进行调制使用。
112.在本发明的一优化的一组实施例中所述的水溶性药物的水溶液为氯化钠溶液(30%w/w),其中氯化钠作为模拟的水溶性药物;粘合剂为聚维酮k30(或聚乙二醇600),配制成3%
‑
15%的水溶液;非水溶性模拟药物为碳酸钙粉末(200目),此时粘合剂溶液浓度的选择还要照顾到比重合适,例如8%
‑
13%的聚维酮k30,振摇混匀、静置2小时后,碳酸钙粉末仍均匀地悬浮其中、不沉降不上浮。所述两种溶液在25℃、相对湿度85%的环境中,敞口放置10分钟,挥发减重不到1%,满足载药的精准度要求。
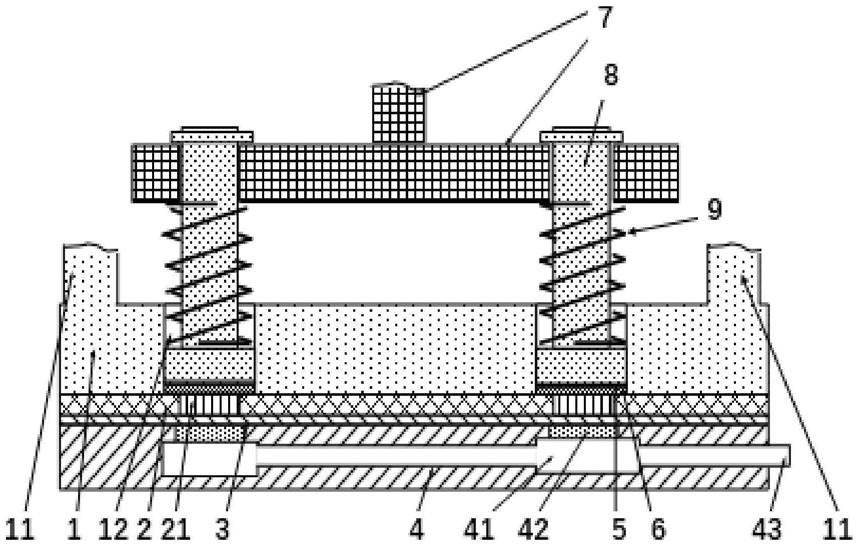
113.在本发明一组实施例中,使用聚维酮k30水溶液(10%w/w),将胰岛素粉末与聚维酮水溶液混合成含有胰岛素的溶液(20:80w/w),与空白微针接触而负载为胰岛素微针,将该胰岛素微针贴于糖尿病模型猪的耳朵上,具有显著的降糖效果。
114.在本发明一组实施例中,使用聚维酮k30溶液(10%w/w),将艾塞那肽粉末与聚维酮溶液混合成含有艾塞那肽的溶液(2:98w/w),与空白微针接触而负载为艾塞那肽微针,将该艾塞那肽微针贴于糖尿病模型猪耳朵上,具有显著的降糖效果。
115.总之,在调制含有药物的溶液时,可以通过实验来确认负载量与吸附强度,也可以添加有助于负载以及增加或减少吸附力的添加剂进行调节。添加剂可以是调整ph、粘度、离子强度、成膜性能等等的物质。
116.本发明所述制备微针,可以将所涉共混粉末热压成型料(圆片)、再热压成微针,即取共混粉末加入到专用的圆片制作装置中,将该装置放在热环境中,加热至热压温度(例如0599/甘露糖醇粉末(1:0.65w/w),200℃),热压一定时间后,冷却至室温,取出所制成的圆片。再将圆片放入空白微针制作装置中,将该装置放在热环境中,加热至热压温度(例如0599/甘露糖醇粉末(1:0.65w/w),200℃),热压一定时间后,冷却至室温,取出模具板,将微针脱离模具,获得空白微针。更好地,将器械热挤出的物料加工成型料(圆片),将圆片置入专用的空白微针制作装置中,将该装置放在热环境中,加热至热压温度数分钟后,热压一定时间,冷却至室温,取出模具板,将微针脱离模具获得微针。进一步,为了减少圆片受热时间,可以先将专用的装置预热至压制温度,将预制圆片放置在预热达温的模具上,保温数分钟,使圆片达到热压温度,加压数分钟,趁热取出模具板,冷却,将微针脱离模具获得微针。(详见:附图1和实施例2内容;参考文献:zl 2018 2 2070608.8、zl 2018 2 2068011.x、zl 2018 2 2070605.4、zl 2018 2 2071901.6、zl 2018 2 2070604.x)
117.本发明所述的基材与空白微针的组成,可以通过波谱方法进行鉴别,如用核磁共振谱等的特征峰来表征其成分为聚乙烯醇与小分子多羟基化合物所形成的组合物,也可通过聚乙烯醇和小分子多羟基化合物与二价铜离子的特有显色反应来进行定性检测。其特性可以通过测试其亲水性,吸附性,抗机械剥离等方式进行估计。例如配制含有氯化钠、聚维酮k30、水的受试溶液,制备疏水性的聚苯乙烯圆片、亲水性的乙烯
‑
乙烯醇共聚物圆片、强亲水性的本发明聚乙烯醇/小分子多羟基化合物圆片,将所述的受试溶液分别滴加在圆片上,放置干燥后,观察附着情况。本发明的基材圆片牢牢地吸附着受试溶液的固体斑点,用大头针剥离不了,仅仅在表面留下划痕;用电吹风吹不脱离。其他对照圆片上的斑点容易被剥离,被吹离。
118.例如本发明的空白微针,可以在将微针粉粹、进行预处理后,使用显色反应和氢质子核磁检测其中特征存在的聚乙烯醇和小分子多羟基化合物。
119.对于制成的负载药物的微针,可以用与空白微针同样的方法进行鉴别,如果所载药物对鉴别有影响,可先将载药微针的针尖部分剪除后再同法进行鉴别。
120.所述本发明空白微针制作,还有从模具板上解离微针和清除模具微孔内残留物料等操作方便与否的工艺事项。当小分子多羟基物与聚乙烯醇配比小于0.15:1时,基材脆度偏大,致使解离的难度加大,经常出现断针现象,配比大于0.15:1以后,都可以较轻易解离,保持针数完整;微针解离后的模具微孔尖端处,有时仍残留有微量的物料需要清除,否则可能会形成堵塞,致使模具失效,清除残留的最佳方法是水中煮沸溶出,然而当聚乙烯醇聚合度大于2600后,清煮时间明显过长,因为聚合度大于2600以后,物料虽能充分溶胀,但粘度过大,致使溶解进入水相的耗时过长,不利于量产工艺放大。另外,聚合度为78%~85%之间的聚乙烯醇在冷水中的溶解度最大,如此聚合度的针体进入皮孔吸收体液后,过渡溶胀
无序变形,致使药物释放行为变异过大,而聚合度88%以上的聚乙烯醇则未观察到如此现象。
121.实施例1:微针组合物基材成型温度范围测试与控制
122.根据本发明的微针组合物基材配料:小分子多羟基化合物与聚乙烯醇的比例,进行共混获得共混粉末,在实施例2的微针制备设备上,在一定压力范围(28
‑
32kg/cm2),为获得较好的预制圆片和/或微针成型,调节温度进行试验,获得操作性较好的下限温度,结果整理如图23中的表格所示,该表格显示的是在28
‑
32kg/cm2压力条件下,不同热挤出物料的预制圆片和/或微针成型温度,配比为重量比,单位为w/w。
123.加入小分子多羟基化合物例如甘露醇、山梨醇和赤藓糖醇后,聚乙烯醇的热塑温度远低于其分解温度。文献报道醇解度为88%的聚乙烯醇的分解温度为240℃左右,99%的为245℃左右(参见:“高分解温度pva制备及性能研究”、金狲森、浙江工业大学硕士学位论文、导师钟明强、范萍、材料科学与工程学院、2019年1月。
124.实施例2:预制圆片、空白微针及试验用的其他物料圆板的制备装置与过程方法
125.依据附图1所示为本发明所使用的微针制备装置一例的示意图。本发明的试验用空白微针以及试验用样品圆片都是在该装置上完成的。
126.如图1所示,专用微针制备装置包括从上到下依次为上压紧板1、模具板2、隔离层3和抽气板4,所述隔离层3为透气不透液材质,所述模具板2上设有与微针的针状物对应的微孔区21,所述微孔为通孔,所述抽气板4内设有空腔41,抽气板4上对应微孔区21的位置开设有与空腔41连通的抽气微孔42,抽气板4外设有与空腔连通的抽气管43,所述上压紧板1的上方设有手动或自动上提下压的附属压紧装置11(图中附属压紧装置11未详细绘出),以方便向下压紧和向上松开模具,所述上压紧板1上还开有通孔12,所述通孔12的位置与模具板微孔21位置一致,供加料加压和限定片径之用。所述上压紧板1上的通孔12还与上方的另一附属压力装置7(图中附属压力装置7未详细绘出)上的压力杆8位置一致,经通孔12,实现上方压力装置7经手动或电动的上提或下压,完成对微针的压制和解离。所述压力杆8通过套在其上弹簧9,对融流基材施加压力,弹簧9的作用在于使下压力控制在一定的范围。所述压力杆8与微针物料6之间安放有隔离层5,以防止相互粘粘,方便分离。所述压力杆8与通孔12和附属压力装置7为滑动紧配合关系,以保证定位、滑移和不溢出物料。
127.操作过程为:下行上压紧板1,压紧模具板2;上提压力杆8离开通孔12,经通孔12将型料放置在模具微孔区21上,下行压力杆8,将型料压制成微针;上提压力杆8解除弹簧9对物料的压力;上提压紧板1,解除对模具板2的压紧,再上提压力杆8,使其脱离微针;抽出模具板2,冷却,解离出模具板上的微针6;所有的上提与下行均通过附属压紧装置11和附属压力装置7实现。制作预制圆片时,只要将模具板2更换为相同材质的平板即可。所述弹簧9为市售的绿色模具矩形弹簧,其标示压强为32kg/cm2,经反复使用压强下降至28kg/cm2后弃用,故压力范围定为28
‑
32kg/cm2。以下如无特别说明,都为此种弹簧。同理可见,压力与温度的关系,在一定范围内会有所变动,如无特殊,无需严格限定。
128.使用该装置制作所述微针的过程较为简便(参见附图3流程、附图4流程),其操作过程为前文所述:将预先制备的型料(共混粉料热压成的圆片,或热共混机挤出的圆片或颗粒料)放置在装置内,将整体装置升温至热压温度(根据基材以及实施例1所决定的温度,一般温区在180℃~225℃之间),保温(10分钟)使装置温度均匀,开动抽气系统4和压力系统
7,使融流的物料计入微孔,制成微针,取出整个装置冷却,获得空白微针。空白微针的照片如图6所示,可以看出空白微针表面光滑无毛刺,形状规整尺寸均一。空白微针的结构如图7所示,图7中,700为空白微针整体,701为空白微针针体。
129.更好地,利用该装置进行制备微针的操作过程为(参见附图5流程):装置始终放置在热压温度环境中(烘箱;依据基材物料属性,温区约在180℃
‑
220℃之间),达温10分钟后,装置内部热平衡;将基材圆片置入,保温2分钟,圆片达到温度,抽气下压1分钟,制成微针;抽出带着微针的模具板,冷却,获得空白微针。本实施案例省去了整体装置加热和冷却的45分钟~55分钟,圆片仅受热2分钟升温和1分钟施压,撤出的模具板和上面的微针的热容量很小,降温速度很快,大大缩短了基材的受热时间,有利于微针的品质保证和工艺放大。
130.所述圆片制作的简易操作过程与上述空白微针过程十分类似,只是用同样材质的垫板代替所述的模具板,获得圆片。
131.实施例3:基材附着力测试
132.制备三种实验用圆片:(1)疏水性聚苯乙烯圆片(东莞兴旺塑胶原料有限公司的粉料,未标明分子量,但不妨碍附着力判断);(2)亲水性乙烯
‑
乙烯醇共聚物圆片(日本可乐丽(kuraray)的三种粉料,e105b(44mol/56mol)、f104b(32mol/68mol)、l171b(27mol/73mol),未透露透露分子量,但不妨碍附着力判断);(3)强亲水性的本发明聚乙烯醇/小分子多羟基化合物圆片(上海影佳实业发展公司的聚乙烯醇粉料,各小分子多羟基化合物购自多家厂商),所述聚乙烯醇/小分子多羟基化合物基材圆片细节见图24中的表格。
133.配制受试溶液:氯化钠、聚维酮k30、水组成的重量比为20/8/72溶液。该溶液在25℃、相对湿度85%的环境中,敞口放置10分钟,挥发减重不到1%,满足载药的精准度要求。
134.分别在圆片表面点蘸少量(约0.1mg)受试溶液,将表面蘸有药液点斑的圆片置于干燥器,室温24小时,获得斑点圆片,进行如下实验观察,基材对氯化钠/聚维酮溶液形成斑点的附着力实验结果如图25中的表格所示,结果显示本发明的基材均显示很好的吸附牢度。
135.手动针尖剥离实验:在高倍放大镜(30倍)下,用金属针尖触碰斑点,观察斑点变化情况。
136.电吹风吹离实验:斑点面朝上粘住圆片,电吹风冷吹3分钟,高倍放大镜(30倍)观察斑点被吹离否。
137.一米高自由落下实验:每一圆片经一米长玻管自由落下后,高倍放大镜(30倍)观察斑点脱落否。
138.实施例4:共混粉末基材热压成圆片后再热压成微针
139.根据上述实施例2所描述的方法,使用附图1所述的专用制作装置,按附图3流程进行操作,取0.65g聚乙烯醇0599与甘露糖醇粉末共混粉末(1:0.65w/w)加入到专用的制作装置中,将该装置放在热环境中,加热至热压温度(200℃),加压并保温27分钟后,装置冷却至室温获得圆片;再将圆片置入制作微针的装置中,升温至热压温度(200℃),加压并保温27分钟,冷却至室温获得空白微针。
140.实施例5:热共混挤出料热压成圆片后再热压成微针
141.根据上述实施例2所描述的方法,使用附图1所述的专用制作装置,按附图4流程进行操作,取0.65g聚乙烯醇0599与甘露糖醇粉末共混粉末(1:0.65w/w)的机械热挤出的颗粒
料加入到专用的制作装置中,将该装置放在热环境中,加热至热压温度(200℃),加压并保温27分钟后,装置冷却至室温获得圆片;再将圆片置入制作微针的装置中,升温至热压温度(200℃),加压并保温27分钟,装置冷却至室温获得空白微针。
142.实施例6:按缩短物料受热时间的方法,进行圆片和空白微针的制作
143.根据上述实施例2所描述的缩短物料受热时间的方法,使用附图1所述的专用制作装置,按附图5流程进行操作,将所述的专用制作装置预热至热压温度(200℃),10分钟装置整体温度平衡后,取0.65g聚乙烯醇0599与甘露糖醇粉末共混粉末(1:0.65)或0.65g同样配比的机械热挤出的颗粒料,加入到专用的制作装置中,继续受热2分钟后(使物料达温),热压1分钟,解除压力,抽出垫板冷却,获得圆片;将所述的专用制作装置预热至热压温度(200℃),10钟装置整体温度平衡后,将所述圆片置入装置中,继续受热2分钟后(使圆片达温),热压1分钟,解除压力,抽出模具板冷却,获得空白微针。
144.实施例7:微针载药量试验、药液附着形态观察与解析以及附着牢度实验
145.使用氯化钠、聚维酮k30、水组成的重量比为20:8:72溶液作为空白微针载药量试验溶液。空白微针载药后,药物牢固吸附在针尖部位的高倍放大镜(30倍)下的图像如图8所示,载药微针的结构如附图9所示,图9中,900为载药微针整体,901为载药微针针体,902为载药微针针体尖部的载药部分。
146.空白微针吸附受试溶液试验:在方形金属铝块(5cm
×
5cm
×
2cm)的表面上设置有直径30mm的浅圆槽,深度分别为0.1mm、0.15mm和0.2mm,向槽里加入受试溶液,用刮板平移刮去溢出液体,获得具有限定溶液高度的试验溶液。将精密称重(1/100000天平)各种配比材质的空白微针,针尖垂直向下,站立在圆槽中停留3秒钟,取出微针,精密称重,减重计算得出净增重量;高倍放大镜(30倍)观察药液滴挂在针尖上的形态;将载药微针悬挂在干燥器中(室温24h)后,进行一米高自由落下,用高倍放大镜(30倍)观察针尖药物的脱落情况。其结果如图26至28中的表格所示。
147.图26显示的是微针吸附受试溶液量,单位为mg;图27显示的是高倍放大镜(30倍)观察药液滴挂在针尖的状态,a表示珠状不露尖,b表示纺锤状不露尖,c表示珠状露尖,这三种形态如图10所示;
148.当微针离开液面后,立即用30倍放大镜观察滴挂在针尖端部的液滴形态,可见到不同基材的空白微针悬挂药液所呈现的药液包裹针尖的状态,见附图10:当挂液量足够小的时候,几种材质上的挂液呈滴珠状包裹在针尖上,见附图10的a,1001状态即珠状不露尖;随着挂液量增加,本发明的强亲水性基材微针针尖上的液体沿轴向铺展成纺锤状并将针尖包裹其中,如附图10的b所示,1002状态即纺锤状不露尖,说明固液两相间的亲和力大于液相表面收缩力;而对比用的基材即弱极性或非极性材质针尖上的液体则呈珠状向上部移动,暴露出针尖,如附图10的c所示,1003状态即珠状露尖,说明固液两项间的亲和力小于液体表面收缩力。
149.可以合理地推测当微针扎入时,本发明的强亲水性基材做成的微针能将强附着的药物带进皮孔,而对照微针的弱附着的药物会被部分推阻在皮外,具体的药效表现,在后续的药效实施例试验中也得到推证。
150.由于微针进入皮肤的深度限制,一般只有包裹在针尖部位0.3mm长度以内的药物才能稳定的产生药效,其后部位的药物逐渐远离了最容易吸收区段,故b型的纺锤状不露尖
的药液包裹是更好的状态。
151.图28的表格显示的是吸附药物的微针一米高自由落体后,高倍放大镜(30倍)观察药物脱落情况,图28中a表示未脱落,b表示脱落。
152.实施例8:微针基材的抗击打韧性实验
153.按实施例3中的本发明的基材制成直径1.9cm、厚度1mm、1.5mm、2mm的圆片,作为试验品;按同样尺寸将聚维酮(pvp k
‑
30)制成圆片,作为对照品。
154.在17℃、相对湿度46%的环境中,将试验品和对照品圆片分别平放在钢板上,用15.8g的钢质圆柱体,经内径2cm、长度55cm或84cm的玻管,垂直自由落在圆片针上,重复3次,所得碎裂情况如图29中表格所示。
155.选择聚维酮圆片作为对照试验品的原因是:1、可以热塑成型;2、作为许多微针案例的最常用基材,其韧性可以基本耐受后续工艺受力,如上表所示实验结果,本发明的基材具有更好的韧性,更适合微针加工。
156.实施例9:空白微针载药试验
157.根据本发明制成的空白微针进行担载药物,一般只要将水溶性药物直接配制成水溶液进行药物担载,或加入适当适量的粘合剂进行药物担载即可,如果水溶性药物干燥形成的固体膜层与微针基材粘附力满意,不收缩产生裂纹,不在药物与微针的结合界面产生剪切力,就能够牢固地附着在针尖表面,因此一般不加或稍加粘合剂;将非水溶性药物均匀地悬浮在水中或溶解/悬浮在非水极性溶剂中进行药物担载,或更好地加入适量的粘合剂,进行药物担载。
158.使用实施例7中的方形金属铝块(5cm
×
5cm
×
2cm)进行同样的试验。
159.所述水溶性药物的载药实验,使用氯化钠、聚维酮k30、水组成的重量比为20:8:72溶液作为受试溶液,所述溶液在25℃、相对湿度85%的环境中,敞口放置10分钟,挥发减重不到1%,满足载药的精准度要求。其载药结果如图30的表格所示,该表格显示了微针吸附水溶性物料受试溶液量,单位为mg。
160.所述非水溶性药物的载药实验,所使用的受试溶液为,20g碳酸钙粉末(200目)与80ml聚维酮k30水溶液(11%)混合成的混悬液,振摇混匀、静置2小时后,末见碳酸钙粉末沉降或上浮。所述溶液在25℃、相对湿度85%的环境中,敞口放置10分钟,挥发减重不到1%,满足载药的精准度要求。其载药结果如图31的表格所示,该表格显示了微针吸附非水溶性物料受试溶液量,单位为mg。
161.实施例10:微针的显色检测
162.本发明的微针可以利用显色反应检测其中特定存在的聚乙烯醇与多羟基化合物。一个具体操作实例如下:取0.15克聚乙烯醇或小分子多羟基化合物,分别置入1.8ml水中,加热溶解,冷至室温,加入10滴的硫酸铜水溶液(17.4%w/w),用氢氧化钠水溶液(10%w/w)调节溶液的ph值到14以上,此时聚乙烯醇溶液中出现粉绿色固体,因为聚乙烯醇与二价铜离子的粉绿色螯合物不溶于水,多羟基物溶液转为亮蓝色,因为多羟基物与铜离子的亮蓝色络合物溶于水。
163.将空白微针片粉粹后,取0.2g置于1.8ml水中,加热溶解后,冷至室温;加入6滴的硫酸铜水溶液(17.4%w/w),用氢氧化钠水溶液(10%w/w)调节溶液的ph值到8左右,此时出现粉绿色固体,而溶液部分依然保持二价铜离子的淡绿蓝色或转为基本无色。向分离出的
溶液部分继续加入4滴硫酸铜溶液,再加氢氧化钠溶液至ph14以上,此时溶液变为亮蓝色。所出现的粉绿色固体为聚乙烯醇与铜离子形成的螯合物,所出现的溶液亮蓝色为多羟基物质与二价铜离子形成的水溶性络合物。也可以一次加入10滴硫酸铜溶液,再加入氢氧化钠溶液至ph值14以上,此间同时产生粉绿色固体和亮蓝色液体。如分层现象观察不明显,可离心分层,或加入2~4ml水,摇匀、静置,直至现象明显。
164.本发明的载药微针可以用同样的方法进行鉴别,如果所载药物对鉴别有影响,可先将载药微针的针尖部分剪除后再同法进行鉴别。
165.实施例11:微针材质的氢质子核磁图谱检测
166.本发明的微针,可以利用氢质子核磁检测进行检测,具体操作举例如下:
167.将空白微针片粉碎后,取1g置于10ml水中,加热溶解后,冷至室温,得溶液1。
168.向另一份溶液1中,加入30滴17.4%w/w的硫酸铜溶液(或同样铜离子浓度的氯化铜溶液),用氢氧化钠水溶液(10%w/w)将ph值调至14以上,离心分层,分别得到聚乙烯醇/二价铜离子螯合物为主的固体部分和多羟基物质/二价铜离子络合物为主的液体部分。
169.向固体部分加入2ml水,形成混悬液,振摇下,向混悬液中滴加20%的盐酸,直至固体完全溶解,形成均一的绿蓝色溶液;振摇下,向溶液中分次加入少许锌粉(200目以上),直至铜离子被还原成铜元素析出、绿蓝色溶液变为无色;离心分离出无色溶液,将溶液ph值调至7,得溶液2。
170.向液体部分滴加盐酸至ph值1,振摇下,分次加入少许锌粉(200目以上),直至溶液转为无色;离心分离出无色溶液,将溶液ph值调至7,得溶液3。
171.将溶液1、溶液2和溶液3分别干燥,得固体1、固体2和固体3;用氘代水分别加热溶解3种固体(100℃/30分钟以上,并伴随充分振摇,以保证完全溶解,因为聚乙烯醇粘度大,水中分散很慢);对三种氘代水溶液进行核磁氢谱扫描,得图谱1(附图13和附图17)、图谱2(附图14和附图18)和图谱3(附图15和附图19)。
172.与相应的多羟基物质和聚乙烯醇氢质子核磁图谱(附图11、附图12和附图16)进行比对可见,图谱1的质子信号为聚乙烯醇和多羟基物质的加和(此处仅例举了甘露醇,其它的多羟基物质的氢质子化学位移与甘露醇氢质子极为类似,同样此处仅例举了1788聚乙烯醇和1799聚乙烯醇,其它的聚乙烯醇的氢质子化学位移与1788聚乙烯醇和1799聚乙烯醇的氢质子极为类似,故不做逐一例举)。
173.将图谱2、图谱3分别与图谱1进行比对可见,图谱2中多羟基物质的质子信号强度显著减弱,图谱3中聚乙烯醇质子信号强度显著减弱。
174.聚乙烯醇分子上
‑
ch2
‑
的化学位移为δ1.5
‑
1.7,与羟基相连
‑
ch
‑
的化学位移为δ4.1左右。多羟基物质上的每一个
‑
ch2
‑
和
‑
ch
‑
都与羟基相连,这些质子的化学位移在δ3.7
‑
3.9区间。当样品浓度、温度、样品管转速、扫场强度(核磁仪器的兆赫数)等因素综合匹配,获得较好分辨率时,聚乙烯醇上的—ch
‑
(δ4.1)与多羟基物质上的氢质子(δ3.7
‑
3.9)可以较好地区分,此时聚乙烯醇分子上
‑
ch2
‑
(δ1.5
‑
1.7)与多羟基物质上的
‑
ch2
‑
和
‑
ch
‑
(δ3.7
‑
3.9),通过积分推算,可获得聚乙烯醇与多羟基物质的大致配比的定量关系。
175.氢质子核磁图谱信号解析如下:
176.附图11为甘露醇标准氢谱,峰1101为
‑
ch3和
‑
ch2,溶剂是氘代二甲亚砜,比氘代水溶剂中的位置偏右一些,峰1102为
‑
oh(δ4以上)。
177.附图12为市售聚乙烯醇1788氢谱,峰1201为
‑
ch2
‑
(δ1.5
‑
δ1.7)、峰1202为
‑
ococh3(δ2.05)、峰1203为与
‑
oh和
‑
ococh3相连的
‑
ch
‑
(δ4.0
‑
δ4.1)、峰1204为水峰、峰1205为杂质醋酸根
‑
ococh3。
178.附图13为聚乙烯醇1788/甘露醇(1:0.6185w/w)微针片的氢谱,峰1301为聚乙烯醇1788
‑
ch2
‑
(δ1.5
‑
δ1.7)、峰1302为甘露醇
‑
ch2
‑
和
‑
ch
‑
(δ3.7
‑
3.9)、峰1303为聚乙烯醇1788与
‑
oh和
‑
ococh3相连的
‑
ch
‑
(δ4.0
‑
δ4.1)、峰1304为水峰、峰1305为聚乙烯醇1788的
‑
ococh3(δ2.05)。
179.附图14为聚乙烯醇1788/甘露醇(1:0.6185w/w)微针片材水溶液铜离子沉淀部分聚乙烯醇为主的氢谱,峰1401为聚乙烯醇1788
‑
ch2
‑
(δ1.5
‑
δ1.7)、峰1402为甘露醇
‑
ch2
‑
和
‑
ch
‑
(δ3.7
‑
3.9)、峰1403为聚乙烯醇1788与
‑
oh和
‑
ococh3相连的
‑
ch
‑
(δ4.0
‑
δ4.1)、峰1404为水峰、峰1405为聚乙烯醇1788的
‑
ococh3(δ2.05)。
180.附图15为聚乙烯醇1788/甘露醇(1:0.6185w/w)微针片材水溶液铜离子沉淀后上清液甘露醇为主的氢谱,峰1501为聚乙烯醇1788
‑
ch2
‑
(δ1.5
‑
δ1.7)、峰1502为甘露醇
‑
ch2
‑
和
‑
ch
‑
(δ3.7
‑
3.9)、峰1503为聚乙烯醇1788与
‑
oh和
‑
ococh3相连的
‑
ch
‑
(δ4.0
‑
δ4.1)、峰1504为水峰、峰1505为聚乙烯醇1788的
‑
ococh3(δ2.05)。
181.将附图14与附图15分别与附图13进行比较,可见附图14的受试物中的聚乙烯醇1788的占比显著增高,而附图15的受试物中的甘露醇占比显著增高。
182.附图16为市售聚乙烯醇1799自测氢谱,峰1601为
‑
ch2
‑
(δ1.7)、峰1602为
‑
ch
‑
(δ4.0)、峰1603为水峰、峰1604为杂质醋酸根
‑
ococh3、峰1605为杂质甲氧基
‑
och3。
183.附图17为聚乙烯醇1799/甘露醇(1:0.689w/w)微针片材的氢谱,峰1701为聚乙烯醇1799的
‑
ch2
‑
(δ1.7)、峰1702为甘露醇
‑
ch2
‑
和
‑
ch
‑
(δ3.7
‑
3.9)、峰1703为聚乙烯醇1799的
‑
ch
‑
(δ4.0)、峰1704为水峰、峰1705为残留的
‑
ococh3。
184.附图18为聚乙烯醇1799/甘露醇(1:0.689w/w)微针片材水溶液铜离子沉淀部分以聚乙烯醇为主的氢谱:峰1801为聚乙烯醇1799的
‑
ch2
‑
(δ1.7)、峰1802为甘露醇
‑
ch2
‑
和
‑
ch
‑
(δ3.7
‑
3.9)、峰1803为聚乙烯醇1799的
‑
ch
‑
(δ4.0)、峰1804为水峰、峰1805为残留的
‑
ococh3。
185.附图19为聚乙烯醇1799/甘露醇(1:0.689w/w)微针片材水溶液铜离子沉淀后上清液甘露醇为主的氢谱,峰1901为杂质醋酸根
‑
ococh3、峰1902为甘露醇
‑
ch2
‑
和
‑
ch
‑
(δ3.7
‑
3.9)、峰1903为水峰。
186.将附图18与附图19分别与附图17进行比较,可见,附图18的受试物中的聚乙烯醇1799的占比显著增高,而附图19的受试物中的甘露醇占比显著增高。
187.上述操作中,加入锌粉是将铜离子还原成铜元素沉淀分离除去,以免铜离子干扰氢谱扫场;将溶液ph值调至7左右,以确保溶液蒸干时,未完全醇解的聚乙烯醇分子上的乙酰基不被酸碱催化而水解脱落。
188.对于制成的负载药物的微针,可以用与空白微针同样的方法进行鉴别,如果所载药物对鉴别有影响,可先将载药微针的针尖部分剪除后再同法进行鉴别。
189.实施例12:胰岛素微针的药效试验
190.糖尿病模型猪:自购2月龄的雄性巴马猪三头(平均体重8.8kg),饲养三周后(平均体重11kg),按120mg/kg剂量,静脉注射链脲佐菌素(翌圣生物科技(上海)有限公司);一周
后,根据血糖升高情况,酌情静脉补充不低于50mg/kg的剂量,直至早晨空腹血糖高于11m mol/l,并空腹继续维持3h以上为糖尿病模型猪用于本发明的试验。
191.试验样品:1、对照品药物,胰岛素注射液(徐州万邦药业,试验编号b1与b2);2、实验用自制的胰岛素微针(试验编号a1至a6):将胰岛素粉末(徐州万邦药业)放置于3%的聚维酮水溶液中(胰岛素与水溶液的重量比为2:8),混匀;在材质为聚乙烯醇1799/赤藓糖醇(1:0.56w/w)微针针尖上,担载含有胰岛素的溶液;3、对比用自制的胰岛素微针(试验编号c1):在自制的材质为乙烯
‑
乙烯醇共聚物的微针的针尖上担载同样的含有胰岛素的溶液;实验用微针和对比用微针的平均载药量为9个单位(最大误差
±
9%),以防止计量过低影响药效观察。
192.试验过程:每次试验相隔正常饲养的一天。每次试验:早上八点测空腹血糖,给药(对照药皮下注射,胰岛素微针贴于模型猪耳,实验用自制胰岛素微针每次一片,对比用自制胰岛素微针每次两片),每小时测一次血糖,三小时结束实验,饲食。
193.试验结果作图如附图21,胰岛素载药微针药效试验结果如图32中的表格所示。
194.从图32中的表格中数据可见:每次一片聚乙烯醇1799/赤藓糖醇(1:0.56w/w)基材负载胰岛素微针给药,在糖尿病模型猪上的(重复试验六组次获得6组数据:a1至a6)三小时降糖均值为6.77;每次使用两片乙烯
‑
乙烯醇共聚物基材负载胰岛素微针(c1)给药,三小时的降糖值为5.4,每片的均值只有2.7;7.5个单位胰岛素注射(试验两次:b1至b2)的降糖均值为8.85。
195.即每片聚乙烯醇1799/赤藓糖醇基材负载胰岛素微针的有效药物剂量是乙烯
‑
乙烯醇共聚物基材负载胰岛素微针的2.5倍。可以推测胰岛素被相当牢固地被吸附在聚乙烯醇1799/赤藓糖醇基材微针的表面,当微针尖部挤入皮肤时较多的药物被带入皮内,而乙烯
‑
乙烯醇共聚物基材微针的表面吸附力不够,部分药物被挤推到了皮外;同理,微针进入皮内的药物吸收体液后有所软化,聚乙烯醇1799/赤藓糖醇基材微针依然能保持对软体药物的吸附,而乙烯
‑
乙烯醇共聚物基材微针对软体药物的吸附力不够,也有被挤出到皮外的可能。
196.实施例13:艾塞那肽载药微针及成药性试验
197.ii型糖尿病模型猪:自购2月龄的雄性巴马猪八头(平均体9.1kg),饲养三周后(平均体重12kg),按120mg/kg剂量,静脉注射链脲佐菌素(翌圣生物科技(上海)有限公司);一周后,根据血糖升高情况,酌情静脉补充不低于50mg/kg的剂量,直至早晨空腹血糖高于11mmol/l,并空腹继续维持3h以上为糖尿病模型。对这些糖尿病模型猪注射5ug艾塞那肽,观察血糖,选出了对艾塞那肽具有降血糖响应的一头,用于实验。
198.试验样品:1、对照品药物,艾塞那肽注射液(剂量:5ug,外购,商品名:百泌达);2、实验用自制的艾塞那肽微针(24针与120针两种):将艾塞那肽粉末(四川圣诺科技)放置于3%的聚维酮水溶液中(艾塞那肽:聚维酮水溶液的重量比为2:98),混匀;在材质为聚乙烯醇1799/赤藓糖醇(1:0.56w/w)微针针尖上,担载含有艾塞那肽的溶液;
199.试验过程:每次试验相隔正常饲养的一天。每次试验:早上八点测空腹血糖,给药(对照药皮下注射,艾塞那肽微针贴于模型猪耳),每小时测一次血糖,三小时结束实验,饲食。空腹状态不给药测试值为空白空腹对照。
200.试验结果作图如附图22,艾塞那肽载药微针的药效试验结果如图33中的表格所
示,试验数据说明:
201.1、针数24的微针与针数120的微针的药效完全一样,说明载药量方面的限制极小;
202.2、注射剂的后两个小时药效降低是因为艾塞那肽半衰期很短,而微针具有长效作用。
203.3、艾塞那肽载药微针与注射5ug药效相当。注射5ug的场合,开始1小时降血糖比较快,后面的2个小时降血糖程度降低较快。微针的场合,后面2小时降低程度缓慢。说明载药微针具有缓释药物的功效。120根针的与与24根针的,尽管针数很大差别,但药效(降血糖)程度相当,与报道的艾塞那肽降血糖功效与剂量依赖几乎无关的结果一致。
204.实施例14:胰岛素/艾塞那肽一体联合微针及其成药性、用药安全性和药物稳定性。
205.当ii型糖尿病人胰岛素分泌当量减少8iu后,医生非常鼓励使用胰岛素,分泌当量继续减少到一定程度后,医生又非常鼓励同时使用胰岛素和艾塞那肽,但是这两种注射剂不能混合在一起,只能分两次注射给药。ii型糖尿病人有一亿之多,胰岛素/艾塞那肽一体的联合微针应当是极具新意的重大改良型新药。鉴于胰岛素微针和艾塞那肽微针均已研制成功,表现出了良好的疗效,只要稍作模具变化就能分别制备出大半圆形的胰岛素载药微针和小半圆形的艾塞那肽载药微针片,然后机械粘贴固定在同圆尺寸的基板上,成为联合微针,供一次完成两种药物的施用。由于两种药物分别担载在不同针体之上,互不接触,其成药性、用药安全性和药物稳定性与各自单体药物微针一样,如附图20所示,图中20为全针,201为微针大半圆载一种药,202为微针小半圆载另一种药,203为粘合用背板。
206.这种联合微针给药构思具有普适性,可以用于其它需要联合用药的给药方案。
207.实施例15:共混粉末料直接压成圆片
208.共混粉料直接压成圆片型料的物料、配比、温度/压力以及亲水性和韧性的测试结果
209.所述基材圆片制作的简明操作过程为,首先按附图1的顺序搭建装置,搭建时用同样材质的垫板替模具板,将共混粉料放置进上板的通孔中,合上下压装置压紧;将装置升温至成型温度,加压并保温27分钟,冷却装置,解离出圆片。所压制的部分圆片的选料、配比、温度、压力、表面亲水性和韧性,如图34中的表格所示。
210.注:1、所使用的模具矩形绿色压簧压强为28
‑
32kg/cm2;
211.2、+表示好,++表示很好。
212.实施例16:共混粉料经机械热共混挤出成颗料后,再制成圆片
213.共混粉料经机械热共混挤出成颗料后,再制成圆片的物料、配比、温度/压力以及亲水性和韧性的测试结果。
214.所述基材圆片制作的简明操作过程为,首先按附图1的顺序搭建装置,搭建时用同样材质的垫板替模具板,将经机械热共混挤出的颗料放置进上板的通孔中,合上下压装置压紧;将装置升温至成型温度,加压并保温27分钟,冷却装置,解离出圆片。所压制的部分圆片的选料、配比、温度、压力、表面亲水性和韧性,如图35中的表格所示。
215.注:1、所使用的模具矩形绿色压簧的强为28
‑
32kg/cm2;
216.2、+表示好,++表示很好。
217.实施例17:空白微针与模具板的解离实验
218.在厚度为1.5mm的模具板上,分别用赤藓糖醇与1099聚乙烯醇羟基比为0.1:1、0.13:1、0.15:1、0.18:1和0.2:1的物料制作微针;微针圆形背板的厚度为1mm,以保证对针体的拉动受力。
219.解离方法:1、稳住模具板,用金属薄片撬动微针;2、稳住模具板,用吸盘吸住微针背面垂直拉动。完成解离后,30倍放大镜观察针体形态,五种不同配比物料微针从模具板上解离时针体完整情况结果图36中的表格所示,羟基比大于0.15:1以上物料配比的微针可以实现较满意的解离。
220.本试验选用赤藓糖醇和聚乙烯醇1099是因为二者配合物料的韧性较为理想。不同物料及配比的物料的韧性有所不同,不因这些不同而影响保护范围。
221.实施例18:模具板孔道残留物料清除实验
222.在厚度为1.5mm的模具板上,用甘露糖醇重量比为0.65:1的配比,分别与1099、1799、2499、2699、3299和3599六种聚乙烯醇配伍,制成微针;削去微针背层圆板,但针体仍埋藏在模具孔道中。
223.清除方法:1、常压沸水搅拌(100℃);2、加压沸水搅拌(118℃);模具板垂直站立在水中;水中热溶一定时间后,取出模具,挥干孔洞中的水分,30倍放大镜观察孔道的不透亮(堵塞)、透亮(堵塞减少)或全透光(清除)情况。甘露糖醇/不同聚合度的xx99聚乙烯醇(0.65:1w/w)的热溶清除情况结果如图37中表格所示,聚合度2600以下的聚乙烯醇的清煮实践是可以接受的。
224.甘露糖醇的水溶解度较低,xx99聚乙烯醇的溶解速度较慢,选择甘露糖醇和xx99聚乙烯醇是为了从严考察,不因这种从严考察而影响原理构思和保护范围。
225.实施例19:不同醇解度17xx聚乙烯醇物料针体皮孔内保持形态的实验
226.不同物料的针体,在皮孔内保持形态的能力有所不同。在温度37℃左右、相对湿度75%左右的温室中,将不同物料的空白微针贴于臂膀,适当包扎,插入温湿度探头得知微环境的温度为37℃、相对湿度为95%以上,分别保持1小时、2小时、3小时;30倍放大镜观察卸载后的微针形态,不同醇解度物料针体皮孔内保持形态的实验结果如图38中表格所示,醇解度88%以上的聚乙烯醇在皮孔中能较好地保持形态。
227.相同醇解度不同聚合度的聚乙烯醇的溶胀性有所不同,不因没做逐一例举而影响保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1