PPARG拮抗剂在肿瘤治疗药物中的应用
本发明属于肿瘤用药物技术领域,具体涉及pparg拮抗剂在肿瘤治疗药物中的应用。
背景技术:
髓母细胞瘤(medulloblastoma,mb)是最常见的儿童恶性脑肿瘤,约占儿童中枢神经系统肿瘤的20%,whoiv级,极易转移和复发,幸存者还常伴有多种后遗症。该肿瘤具有高度异质性,目前公认的分子亚型主要有4种:wnt型、shh型、group3型和group4型。其中,sonichedgehog(shh)亚型与shh信号通路的异常激活相关,约占总病例的30%。研究者针对shh信号通路的靶向抑制剂开展了大量临床实验,但仍存在严重药物不良反应和耐药性问题。肿瘤相关巨噬细胞和小胶质细胞(tumor-associatedmacrophagesandmicroglia,tams)被认为是脑肿瘤微环境中的重要组成成分,其在肿瘤进展和耐药性方面发挥的作用日益得到研究者重视。
肿瘤微环境(tumormicroenvironment,tme)是由肿瘤细胞、多种非癌细胞、细胞因、基质成分、血液和淋巴循环等组成的复杂系统。肿瘤微环境在肿瘤的发生和发展中扮演非常重要的角色,逐渐成为原发性和转移性恶性脑肿瘤进展的关键调节因子。tme中的细胞成分除了癌细胞,还包括局部的基质细胞、常驻的成纤维细胞、髓系细胞以及从远端招募的细胞,如免疫细胞(包括t淋巴细胞,b淋巴细胞,自然杀伤t细胞等),骨髓来源的前体细胞和循环血小板。tme中的基质细胞包括周细胞、内皮细胞等。tme中的髓系细胞有骨髓来源树突状细胞(bmdcs)、巨噬细胞、中性粒细胞、肥大细胞、髓系来源的抑制细胞(mdscs)、间充质干细胞(mscs)、表达tie2的单核细胞等。
肿瘤相关巨噬细胞和小胶质细胞(tumor-associatedmacrophagesandmicroglia,tams)是肿瘤组织中的浸润单核巨噬细胞和组织驻留小胶质细胞,是脑肿瘤微环境的重要组成。不同于起源于原始卵黄囊前体的肺泡和腹膜巨噬细胞,目前研究认为肿瘤相关巨噬细胞起源于骨髓或髓外造血样脾。肿瘤相关巨噬细胞会被许多生化因素,如单核细胞趋化因子(ccl2)、促炎信号分子、集落刺激因子1(csf1)、损伤相关分子模式(damps)、补体级联产物等募集进入肿瘤组织中。
一般,单核巨噬细胞可以极化为m1或m2型。m1型巨噬细胞,也被称为经典激活型,能够分泌大量炎症因子,如il-12、il-1β、il-6、il-23、tnf-α以及产生诱导型一氧化氮合酶(inos)、免疫刺激细胞因子,并参与辅助性t细胞清除细菌病毒感染等反应。而m2型巨噬细胞,也被称为交替激活型,其特征是分泌il-4、il-10、il-13,表达细胞标志物如精氨酸酶1(arg-1)、类抵抗素α(resistin-like-α,也称fizz1)、甘露糖受体(mannosereceptor,mrc1,也称cd206)、cd163等,能够参与组织修复和重构,释放趋化因子和抗炎细胞因子等。
m1极化和m2极化的巨噬细胞在大多数情况下是连续动态转化的状态。巨噬细胞暴露于不同信号环境下可发生"再极化",因而极少有真正维持在单向极化极端状态的巨噬细胞。许多证据显示在原发性肿瘤特定的tme下,浸润的tams往往起到促肿瘤作用,且通常与不良预后相关,一般认为tams更接近于m2样的活化状态。
tams在肿瘤微环境中具有不同的表型和功能:m1样tams具有抗肿瘤效应,会抑制血管生成,分泌促炎细胞因子等;m2样tams则具有免疫抑制作用,能诱导血管生成、组织重构修复和纤维化等,促进肿瘤生长和转移。
目前,针对hedgehog信号通路中关键调控分子smo的抑制剂已进入多种恶性肿瘤患者临床试验阶段。其中,四种高效且具有肿瘤靶向性的smo拮抗剂已进入第二阶段临床试验,包括sonidegib(别名nvp-lde225)、vismodegib(别名gdc-0449)、bms-833923(别名xl-139)和ipi-926。其中,sonidegib被报道在髓母细胞瘤小鼠模型中表现出抗肿瘤活性。然而,临床上shh型mb经常在smo下游发生如sufu、gli2和mycn等高频突变,这导致病人对smo抑制剂产生强烈的耐药性,并限制了用smo抑制剂单一治疗的疗效。
技术实现要素:
本发明的目的是提供一种pparg拮抗剂在肿瘤治疗药物中的应用,通过对直接抑制pparg的激活,控制mb细胞的外泌体促进tam的m2样极化,并解决smo抑制剂耐药性的问题。
为实现上述目的,本发明是通过以下技术方案实现的:
pparg拮抗剂在肿瘤治疗药物中的应用,为使用者施用有效治疗剂量的pparg拮抗剂,用于控制mb细胞的外泌体促进tam的m2样极化。
优选的,所述肿瘤为髓母细胞瘤。
优选的,pparg拮抗剂为gw9662。
优选的,pparg拮抗剂的剂型为液剂、片剂、粉剂或任一适于使用者施用的剂型。
优选的,还包括向使用者施用有效治疗剂量的一种或多种另外的治疗剂。
优选的,另外的治疗剂至少包括smo抑制剂。
本发明的有益效果是:
与单独使用传统smo抑制剂相比,smo抑制剂和pparg拮抗剂的联合治疗有效抑制了shh型mb的肿瘤生长,并减少了m2样tams的浸润数量。说明pparg拮抗剂能有效抑制tams的m2样极化,并有效增强了smo抑制剂的抗肿瘤活性。这提示,pparg拮抗剂与smo抑制剂可作为改善shh型mb治疗的联合疗法的一种选择。
附图说明
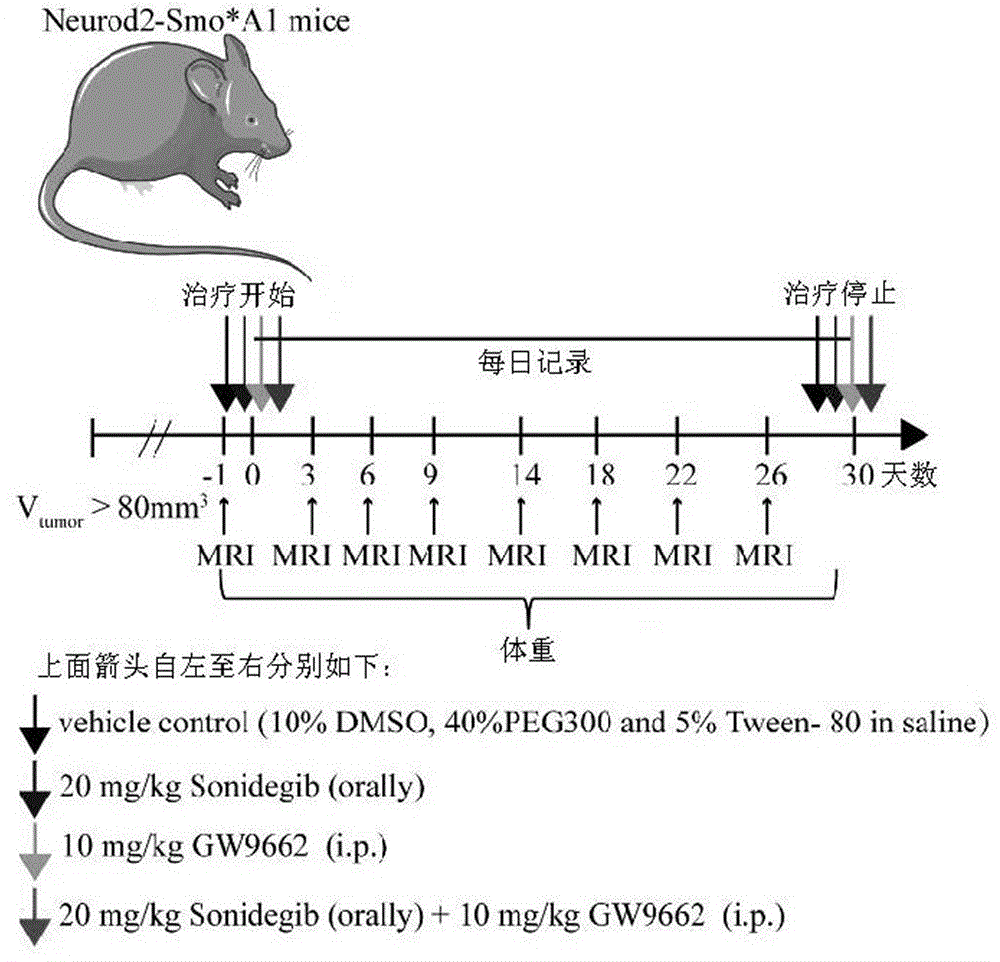
图1a至图1e均为sonidegib和gw9662对neurod2:smoa1小鼠的治疗效果;图1a为neurod2:smoa1模型小鼠给药方式及给药周期示意图,小鼠被随机分成4组,每组小鼠5-6只,每组小鼠的肿瘤大小,体重等生理条件相似,分为vehicle组,注射(10%dmso,40%peg300和5%tween-80insaline),单用smo抑制剂组(20mg/kgsonidegib,口服),单用pparg拮抗剂组(10mg/kggw9662,腹腔注射),联合应用smo和pparg组(口服20mg/kgsonidegib+腹腔注射10mg/kggw9662)。图1b为不同药物处理组shh型mb小鼠在不同时间点的磁共振成像图。橙红色信号指示检测到的肿瘤。图1c为4组shh型mb小鼠连续给药后的肿瘤体积。每周至少进行2次磁共振成像,vehicle组为对照组。图1d为4组shh型mb小鼠连续给药后的生存曲线,vehicle组为对照组。图1e为4组shh型mb小鼠连续给药后的体重变化。因为小鼠个体差异较大,图中没有显示误差线。n=21。图1a至图1e中,*:p<0.05,**:p<0.01,***:p<0.001,****:p<0.0001。
图2a至图2e为sonidegib和gw9662治疗对shh型mb小鼠tams的影响结果;其中,图2a为用多色流式细胞术分析不同药物处理下shh型mb小鼠中tams(cd11b和cd45双阳性)的数量。图2b为不同药物处理下shh型mb小鼠肿瘤内的小胶质细胞(cd11b+cd45int)和巨噬细胞(cd11b+cd45high)浸润率。图2c为4组小鼠肿瘤内m1型(表达cd80或cd86)tam细胞浸润率。图2d为不同药物处理下shh型mb小鼠肿瘤内m2型(表达cd163或cd206)tam细胞和m1型(表达cd80或cd86)tam细胞的浸润率。图2d为不同药物处理下shh型mb小鼠的tams组分及表型。图2e为不同药物处理下shh型mb小鼠tams表型的免疫荧光染色图。小胶质细胞和巨噬细胞广谱标记物iba1(红色荧光信号),m1标记物inos(绿色荧光信号)或m2标记物arg-1(绿色荧光信号)。dapi(蓝色信号)染细胞核。n=21。白标尺代表20μm。每个标本随机选取10个视野进行阳性细胞计数。图2a至图2e中*:p<0.05,***:p<0.001。
具体实施方式
以下通过实施例来详细说明本发明的技术方案,以下的实施例仅是示例性的,仅能用来解释和说明本发明的技术方案,而不能解释为是对本发明技术方案的限制。
在本申请的以下实施例中,所使用的材料、试剂及仪器等,除有特别说明,均能够通过商业获得。
本实施例使用neurod2:smoa1小鼠作为shh型mb模型,来探讨pparg拮抗剂(gw9662)和smo抑制剂(sonidegib)作为单一药物和联合药物对肿瘤生长和tams的影响,并通过流式细胞术和免疫荧光染色具体分析肿瘤微环境内tams的变化(图1a),同时使用磁共振成像(mri)实时监测模型小鼠体内的肿瘤生长情况(图1b)。据统计,在给药第27天,联合给药组小鼠的肿瘤体积显著小于对照组小鼠的肿瘤体积,sonidegib单独治疗组小鼠的肿瘤体积和gw9662单独治疗组小鼠的肿瘤体积相比对照组均有所减少。这与sonidegib或者gw9662单一疗法对mb小鼠有疗效相吻合。并首次发现,sonidegib和gw9662联合给药对肿瘤生长的抑制效果明显好于传统sonidegib的单独治疗(图1c)。kaplan–meier生存分析显示,当neurod2:smoa1小鼠被单独给予sonidegib处理,或者同时给予sonidegib和gw9662治疗时,小鼠生存寿命均显著延长。30天后,这两组小鼠的累计存活率分别比正常对照组提高了近67%。相比于正常对照组,给予gw9662单一治疗的小鼠的存活率也有所增加(图1d)。因为neurod2:smoa1小鼠发病的症状之一是体重减轻,所以每天都对实验小鼠进行了体重测试,结果显示,相比于对照组,sonidegib和gw9662的联合治疗可以促进肿瘤小鼠体重增加(图1e)。
为了进一步研究药物治疗下shh型mb小鼠肿瘤组织中tams的表型和组分变化,采用了多色流式细胞分析技术。首先,根据已有技术,我们采用cd11b和cd45双阳性的细胞作为tams的特定标记物,然后进一步分析tams中巨噬细胞和小胶质细胞的比例和表型。结果显示,sonidegib和gw9662联合给药组小鼠的tams显著减少,仅占总细胞的1.6%(图2a)。构成tams重要组成部分的巨噬细胞(cd11b+cd45hi双阳性细胞)也在联合给药处理下显著减少(0.95±0.8%),不到对照组(3.1±0.8%)的二分之一(图2b)。此外,药物治疗显著影响了shh型mb小鼠中m2样tams细胞群(cd163或cd206阳性),而对m1样tams细胞群(cd80或cd86阳性)没有影响。相比于对照组,gw9662组中m2样tam细胞数占总tams数量的百分比显著降低。单一sonidegib治疗对m2样tams没有影响。值得注意的是,联合给药组的m2样tam的比例也显著降低,说明gw9662和sonidegib联合治疗具有协同增效的作用(图2c)。此外,发现gw9662单独治疗和联合治疗下shh型mb小鼠的m2型巨噬细胞有所减少,虽然均没有统计学差异(图2d)。在免疫荧光成像中也观察到了类似现象。在20倍物镜视野下,gw9662治疗组shh型mb小鼠脑肿瘤切片的m2样tams(arg-1+iba1+共标)数量与对照组相比显著减少。sonidegib组的m2样tams数量与对照组无异。在叠加效应影响下,联合给药组小鼠的m2样tams数量显著少于对照组和sonidegib组。4组shh型mb小鼠脑肿瘤切片中的m1样tams(inos+iba1+共标)数量没有显著性差异(图2e)。
这些结果表明,与单独使用传统sonidegib相比,sonidegib和gw9662的联合治疗有效抑制了shh型mb小鼠的肿瘤生长,并减少了m2样tams的浸润数量。说明pparg拮抗剂(gw9662)能有效抑制tams的m2样极化,并有效增强了smo抑制剂(sonidegib)的抗肿瘤活性。这提示,pparg拮抗剂与smo抑制剂可作为改善shh型mb治疗的联合疗法的一种选择。
以上所述,仅是本申请的几个实施例,并非对本申请做任何形式的限制,虽然本申请以较佳实施例揭示如上,然而并非用以限制本申请,任何熟悉本专业的技术人员,在不脱离本申请技术方案的范围内,利用上述揭示的技术内容做出些许的变动或修饰均等同于等效实施案例,均属于技术方案范围内。
- 还没有人留言评论。精彩留言会获得点赞!