罗伊氏乳杆菌在制备治疗脑卒中的药物中的应用
本发明属于生物医药技术,特别是涉及罗伊氏乳杆菌在制备治疗脑卒中的药物中的应用。
背景技术:
脑卒中是全球主要的健康负担,脑动脉粥样硬化、心脏疾病、微栓塞、血流动力学改变和血液成分的改变等都是引起脑卒中主要原因。其高发病率、高死亡率及高致残率已经严重威胁人类健康。现临床上主要采用再通恢复脑血流的方法,但这种手术需要严格的时间窗,并且不适用于大多数缺血性脑卒中患者。目前,不少研究主要通过减少兴奋性毒性、氧化/亚硝化应激和炎症来保护缺血半暗带的神经,但几乎所有这些治疗方法在临床试验中都失败了,所以开发有效的脑卒中新疗法是一项迫切的挑战。罗伊氏乳杆菌是一种革兰氏阳性菌,常栖息于人和动物的肠道系统中。属于厚壁菌门,芽孢杆菌纲,乳杆菌科,乳杆菌属。本发明考察罗伊氏乳杆菌对脑卒中的治疗作用的可行性与可能性,促进罗伊氏乳杆菌的开发,也为肠道菌群对治疗中风的潜在干预作用提供新的证据。目前未见相关报道。
技术实现要素:
发明目的:针对上述现有技术,本发明提供了罗伊氏乳杆菌在制备治疗脑卒中的药物中的应用。
技术方案:本发明所述的罗伊氏乳杆菌在制备治疗脑卒中的药物中的应用。
其中,所述脑卒中为缺血性脑卒中。
进一步的,所述药物给药方式为灌胃。所述药物中罗伊氏乳杆菌含量不低于1*109cfu。
所述药物可改善大鼠生理状态和神经功能,减小脑梗死面积。
所述药物可明显下调病灶脑侧tnf-α、il-1β和il-6的表达。
有益效果:本发明通过建立脑缺血再灌注的大鼠模型以模拟脑卒中,结果发现,罗伊氏乳杆菌可改善造模后大鼠的生理状态和神经功能损伤;罗伊氏乳杆菌给药后可显著降低白细胞介素-1β(il-1β)表达(p<0.001),罗伊氏乳杆菌可显著下调病灶侧肿瘤坏死因子-α(tnf-α)的表达(p<0.01),罗伊氏乳杆菌干预后可显著下调病灶脑侧白细胞介素-6(il-6)的表达(p<0.0001)。本发明系统地考察罗伊氏乳杆菌对脑卒中的治疗作用的可行性与可能性,促进罗伊氏乳杆菌的开发,为肠道菌群对治疗中风的潜在干预作用提供新的证据。
附图说明
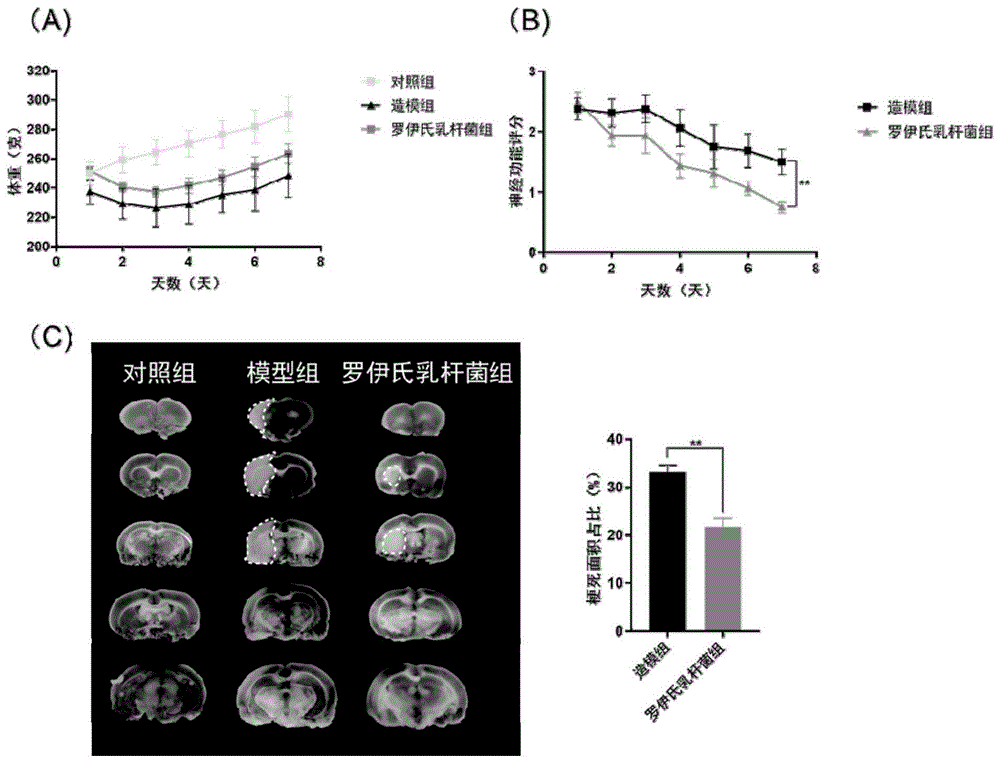
图1是罗伊氏乳杆菌对造模大鼠神经功能和脑梗死情况的改善;
图2是罗伊氏乳杆菌对造模大鼠病灶脑侧炎症因子表达的影响。
具体实施方式
下面结合附图和实施例,对本发明进行进一步的说明。
实施例1罗伊氏乳杆菌治疗脑卒中的药效研究
步骤一:大鼠局灶性脑缺血-再灌注模型的建立
(1)麻醉腹腔注射水合氯醛麻醉(每100gsd大鼠0.33ml)。
(2)器具准备把经消毒过的器械和绵签等整齐地放置于经消毒过的医用托盘上。
(3)固定把大鼠仰卧并固定于手术台上。
(4)消毒剪去大鼠右颈前部的毛。碘酒消毒两遍,75%酒精消毒两遍。
(5)作颈部旁切口使切口整齐,用剪刀沿标记线剪开皮肤。
(6)寻找并分离相应血管切开皮肤和皮下组织,钝性分离二腹肌肌腹和胸锁乳突肌,寻找到颈动脉鞘。在离颈动脉约0.8cm处结扎颈总动脉的近心端后向上分离右侧颈外动脉和颈内动脉。结扎颈外动脉,在颈内动脉的起始端放置一打好结的备用丝线,勿收紧线结。在手术显微镜下沿颈内动脉向下分离翼腭动脉。在插入阻塞线时,用小动脉夹暂时夹闭翼腭动脉。
(7)栓塞右侧大脑中动脉用一把眼科剪轻垫于右侧颈总动脉末端的后方,用另一把眼科剪在颈离动脉分叉处0.20mm处剪一“v”形切口。注意血管应在自然状态下,以保证血管的自然长度。此时一只手用一把眼科剪的前部轻垫于“v”形切口的后方,另一只手用眼科镊夹持线栓,插入已制备好的线栓头端,缓慢进入,在快至翼腭动脉时,用小动脉夹暂时夹闭翼腭动脉,以防止阻塞线误入翼腭动脉。继续插入线栓至计算的长度。插入完成后即开始计算缺血时间。插入后应马上适度收紧颈内动脉上的活结丝线,并打成死结,以固定线栓,防止线栓脱出。固定线栓时结不能打得过紧,防止再灌注时无法解开。以线栓不能脱出又比较便于再灌注时的拔线为准。
(8)术后处理由于术后动物尚未清醒,需要特别注意麻醉中大鼠的护理。把大鼠从手术台上取下后放入垫有双层干燥的棉布鼠笼中,再用干燥手术铺巾盖于鼠上,置于26℃的空调屋内。
(9)再灌注120min后,轻轻松开活结丝线,用眼科镊缓慢将线栓拔出0.5cm左右,再灌注过程中大鼠可能因为疼痛而出现挣扎,应该提前做好预防工作。再灌注完成后将残留线栓剪去并用细丝线固定。
(10)术口缝合清理颈部血块,逐层关闭,用1号丝线缝合皮肤,剪去多余阻塞线,使其在皮肤外保留约1.5cm。对整齐皮肤,用医用酒精消毒2次。将术后大鼠放回鼠笼并补充食物和水。
步骤二:罗伊氏乳杆菌冻干粉(菌种编号cicc6123,中国工业微生物菌种保藏管理中心)的活化及培养
(1)在超净台内用浸过75%酒精的脱脂棉擦净封装菌种冻干粉的安瓿瓶。
(2)用酒精灯火焰将安瓿瓶加热灭菌。
(3)在安瓿瓶上部1/3处用酒精灯火焰加热10-15秒,随后趁热用滴管滴加无菌水2-3滴,重复这一过程直至安瓿瓶身出现明显裂痕。轻轻敲打裂痕处,将安瓿瓶上部取下。
(4)用无菌枪头,吸取0.5ml无菌rcm培养基,滴入安瓿瓶内,轻轻吹打使冻干菌体溶解呈悬浮状。
(5)吸取约0.2ml菌体悬浮液,移植于指定的琼脂斜面培养基上,剩余液体按10%的接种量接种在液体培养基中。
(6)37℃厌氧培养,新传代的菌株需要2-3代才可完全恢复活力。
步骤三:罗伊氏乳杆菌的传代
(1)接种后约24小时,待液体培养基中罗伊氏乳杆菌覆盖满底部并有0.5cm左右厚度时便应传代。
(2)用酒精灯火焰对试管管口进行加热灭菌。
(3)用无菌枪头将液体培养基吹打均匀,吸取约150ul,按5%接种量接种至3ml的液体培养基中。
(4)向培养基中补加4ul多粘菌素b。
(5)再次用酒精灯火焰对试管管口进行加热灭菌后,轻轻塞上瓶塞(留有空隙供气体通过),迅速放入厌氧培养箱中培养。
步骤四:罗伊氏乳杆菌的定植
(1)取生长至对数生长期的罗伊氏乳杆菌,100倍稀释后根据od600nm的吸光度计算活菌数
(2)将菌液8000g离心,收集沉淀。
(3)根据测定出的细菌数,用新鲜rcm培养基将罗伊氏乳杆菌稀释至1*109cfu/ml,并至于4℃冷藏保存。
(4)按照每只大鼠每日1*109cfu灌胃给药。
步骤五:给药方案
sd大鼠适应性饲养一周后,禁食12h后,进行mcao手术。(1)对照组:造模后,灌胃生理盐水1周;(2)模型组:造模后,灌胃生理盐水1周;(3)罗伊氏乳杆菌治疗组:造模后,1*109cfu菌液灌胃给药1周。
步骤六:罗伊氏乳杆菌对大鼠神经功能和脑梗死情况的改善
造模后,每天记录体重并进行神经功能学评分。待评分的大鼠从鼠笼中取出,放在实验台上适应2-3分钟,观察其自主活动的情况。评分由三人同时进行,0分表示大鼠没有任何神经损伤症状;1分(轻微神经损伤)症状为大鼠不能够完全伸展左前足;2分(中度神经损伤)症状为大鼠自发行走时向左侧打转;3分(严重神经损伤)症状为大鼠自发行走时会向左侧倾倒。4分(极严重神经损伤)症状为大鼠不能够自发行走,且有部分的意识丧失。评分过程中保持环境安静和温度恒定。
术后第8天将大鼠处死,直接取脑,于-20度冰箱中速冻20分钟左右切片,切成5片,每隔2mm切一片。第一刀在脑前极与视交叉连线中点处;第二刀在视交叉部位;第三刀在漏斗柄部位;第四刀在漏斗柄与后叶尾极之间。将切片置于含1%ttc的0.2m磷酸缓冲液(ph7.4)中。避光放入37℃温孵箱15~30min,不时翻动脑片,使均匀接触到染色液。染色后白色部分为梗死部分。用adobephotoshop7.0软件对于获得的照片进行基本的图像处理。用image-j软件精确计算脑梗死面积百分率计算:(vi/vs)*100%。
结果见图1,其中,(a)实验进程中大鼠体重变化;(b)神经功能评分;(c)ttc染色及梗死面积统计。结果表明:造模后大鼠体重明显下降,神经功能发生损伤,罗伊氏乳杆菌干预后可改善大鼠生理状态和神经功能。mcao造模后出现明显的脑部梗死,罗伊氏乳杆菌干预后脑梗死面积明显减小(p<0.01),梗死症状减轻。
步骤七:罗伊氏乳杆菌对造模大鼠病灶脑侧炎症因子表达的影响
结果如图2所示,mcao模型大鼠病灶脑侧的tnf-α(p<0.05)、il-1β(p<0.05)和il-6(p<0.001)的炎症因子水平表达显著上调。罗伊氏乳杆菌干预后,显著下调了由造模引起的tnf-α(p<0.01),il-1β(p<0.001)和il-6(p<0.0001)的表达升高。
- 还没有人留言评论。精彩留言会获得点赞!