通过使用VLP复制子投递II类MHC抗原的癌症免疫疗法的制作方法
通过使用vlp复制子投递ii类mhc抗原的癌症免疫疗法
本技术是申请日为2014年12月16日,申请号为201480074163.2,发明名称为“通过使用vlp复制子投递ii类mhc抗原的癌症免疫疗法”的发明专利申请的分案申请。对相关申请的交叉引用本技术要求35 u.s.c.
§
119(e)下2013年12月16日提交的美国临时专利申请no.61/916,394的权益,其内容通过提述完整并入本文。
发明领域
本文描述的发明涉及使用复制缺陷性病毒样颗粒将表达ii类主要组织相容性抗原的核酸投递和转录给哺乳动物。发明背景癌症治疗,特别是化疗中的主要挑战是缺少对靶癌细胞的特异性,因为小分子被系统性施用并影响具有高有丝分裂指数的所有细胞,从而导致有害副作用。基于抗体的治疗展现对靶细胞的改进的特异性,但导致低功效。单克隆抗体(mab)构成试剂或药物的最大类别之一。目前mab的全球市场超过$360亿(ledford,2020,nature 468:18
‑
19)。基于抗体的癌症疗法的当前策略仅限于少数细胞外蛋白或受体(baker,2005,nature biotech,23:1065
‑
72;cohen,等2009,mabs,1:56
‑
66),其可接近且在癌细胞的外膜上表达。由于它们是可接近的,可以生成针对其的抗体。例子包括利妥昔单抗(rituximab)(或),治疗淋巴瘤的一种抗cd20单克隆抗体(mab),曲妥珠单抗(trastuzumab)治疗一些乳腺癌的一种抗her2mab,和西妥昔单抗(cetuximab)治疗头颈癌和结直肠癌的一种抗fgf受体mab(adams,2005,nature biotech,23:1147
‑
57)。它们被证实是用于识别和摧毁癌细胞的有效药剂。然而,没有癌细胞表面上的新的可接近的癌症标志物,这限制了可以产生的未来的ab储库(repertoire)。
1.对于开发胞内癌症抗原的较大的未被利用的来源以用于癌症治疗存在未满足的需求。这类胞内癌症治疗靶物的例子包括:ras突变体、磷酸酶、激酶转录因子、α胎蛋白(afp)、ca15
‑
3、ca27
‑
29、ca19
‑
9、ca
‑
125、降钙素、钙视网膜蛋白、癌胚抗原、嗜铬粒蛋白、细胞角蛋白、结蛋白、上皮膜蛋白(ema)、因子viii、cd31、fl1、神经胶质纤维酸性蛋白(gfap)、巨囊性病(gross cystic disease)流体蛋白(gcdfp
‑
15)、hmb
‑
45、人绒毛膜促性腺激素(hcg)、抑制素、角蛋白、淋巴细胞标志物、mart
‑
1(melan
‑
a)、myo d1、肌特异性肌动蛋白(msa)、神经丝、神经元特异性烯醇化酶(nse)、胎盘碱性磷酸酶(plap)、前列腺特异性抗原、ptprc(cd45)、s100蛋白、平滑肌肌动蛋白(sma)、突触素(synaptophysin)、甲状腺球蛋白、甲状腺转录因子
‑
1、肿瘤m2
‑
pk、波形蛋白、分化簇10(cd10)、cd13、cd15、cd20、cd25、cd28、cd30、cd34、cd99、和cd117。胞内癌症抗原是抗体难以接近的,因此使用针对这些抗原的抗体来治疗癌症患者更加困难,因为由于抗体的较大尺寸,它们可能未到达胞内位置。
2.一个办法是使那些癌症抗原出来并在肿瘤细胞表面上展示以将它们转化成诱导的抗原提呈细胞(iapc)和生成针对该肿瘤细胞的癌症疫苗,由此教导肿瘤细胞激活细胞体系(machinery)来制备针对其的抗体。已知肿瘤细胞合成多种是潜在免疫原的蛋白,且从这
些蛋白处理的肽将激活患者中的抗肿瘤应答。转染的肿瘤细胞将呈现那些抗原至t(cd4+)辅助细胞和激活溶细胞性t淋巴细胞(cd8+细胞),并生成效应器和免疫记忆t细胞,有效生成癌症疫苗,这可能是提供保护免于转移(癌症死亡的主要原因)所必要的。该办法用于癌症治疗的吸引力是不需要对癌症抗原的在先了解。因此,它可能对导致任何类型癌症的蛋白或抗原都适用。癌症疫苗是癌症治疗和预防的有前景的工具,因为其用于诱导肿瘤特异性应答连同对健康细胞的最小毒性的潜力。
3.发现小鼠(自体)系统中的小鼠hla/cd80延长存活(armstrong,等,1997,proc natl acad sci,94:6886
‑
91;humphreys,等,2004,cell mol lmmunol,1:180
‑
85)。该系统要求分离肿瘤细胞、增殖肿瘤细胞、用含有这些基因的重组逆转录病毒修饰细胞(离体),并将这些细胞重新植入小鼠以研究免疫治疗。该过程是麻烦的、过长的,且在离体步骤中容易被污染。此外,报道的结果基于遗传和同基因的(syngeneic)、免疫上相同的系统。逆转录病毒的使用创造了逆转录病毒在可以有潜在危险的位置处整合到宿主基因组中的机会。
4.需要开发一种产生没有离体规程的缺点,且不需要使用可能损害宿主的逆转录病毒的基因疗法的手段/工具(means)。发明概述描述了用于癌症的可诱导免疫治疗的新方法。该免疫治疗针对在患者的肿瘤细胞内共表达ii类主要组织相容性(mhc)抗原以加强对肿瘤抗原的免疫应答。转染的细胞将充当抗原提呈细胞。发现了在转染的肿瘤细胞中表达的mhc抗原通过充当抗原提呈分子诱导针对肿瘤抗原的免疫反应。针对肿瘤细胞的免疫应答随后将通过在宿主抗原提呈细胞上提呈的肿瘤抗原的存在而得到详细阐述。还描述了可施用给动物的病毒样颗粒(vlp),其含有编码mhc ii类抗原连同肿瘤抗原的rna,其诱导动物的宿主细胞表达这些抗原。vlp介导的rna投递系统之前在wo 2013148302中描述(其通过提述完整并入本文),且在其中显示为在哺乳动物细胞中有效表达蛋白。
5.描述了预防或治疗哺乳动物受试者中疾病的方法,包括对有此需要的受试者施用有效剂量的包含vlp的药物组合物,所述vlp包含:a.包含重组多核苷酸的α病毒复制子,其中所述多核苷酸包含编码人ii类主要组织相容性抗原的两个亚基的序列,b.逆转录病毒gag蛋白,和c.促融合包膜蛋白,其中所述vlp不含有α病毒结构蛋白基因。重组多肽还可以包含编码共刺激信号蛋白的序列。所述共刺激信号蛋白优选选自下组:cd28、cd80、cd86、和ctla
‑
4。所述共刺激信号蛋白更优选包括cd80。
6.本文描述的方法可以针对预防或治疗患有肿瘤的患者中的疾病。患者可以是癌症患者,优选癌症患者是选自下组的癌症患者:具有源自乳腺、宫颈、前列腺、卵巢、肾癌、肺、胃、胰腺、成胶质细胞瘤和结直肠的实体瘤的癌症患者,最优选是乳腺癌患者。重组多核苷酸因而可以进一步包含编码肿瘤特异性抗原的序列,优选选自下组的多肽:afp、ca15
‑
3、ca27
‑
29、ca19
‑
9、ca
‑
125、降钙素、钙视网膜蛋白、癌胚抗原、嗜铬粒蛋白、细胞角蛋白、结蛋白、ema、因子viii、fl1、gfap、gcdfp
‑
15、hmb
‑
45、hcg、抑制素、角蛋白、淋巴细胞标志物、mart
‑
1(melan
‑
a)、myo d1、msa、神经丝、nse、plap、前列腺特异性抗原、s100蛋白、sma、突触
素、甲状腺球蛋白、甲状腺转录因子
‑
1、肿瘤m2
‑
pk、波形蛋白、cd10、cd13、cd15、cd20、cd25、cd30、cd31、cd34、cd45(ptprc)、cd99、cd117、及其片段。
7.本文描述的方法可针对预防或治疗感染性疾病。重组多肽因而可进一步包含传染原的序列。所述传染原可以是感染性病毒。
8.本文描述的方法的vlp可以包含源自辛德毕斯病毒或委内瑞拉马脑炎病毒的α病毒复制子。vlp的促融合包膜蛋白可以包含糖蛋白或其片段或衍生物。促融合包膜蛋白可以特异性结合肿瘤细胞。vlp因而可以能够结合真核细胞。所述真核细胞可以是人细胞。结合可以特异于靶细胞。
9.本文所述方法可以胃肠外施用药物组合物。药物组合物可以通过静脉内注射施用。药物组合物可以通过在肿瘤内注射施用。
10.在本文所述方法中,所述药物组合物可以与化疗药物组合施用。化疗药物可以选自由以下构成的药物类别:紫杉烷(紫杉醇(paclitaxel)或多西他赛)、蒽环类抗生素(多柔比星或表柔比星)、环磷酰胺、卡培他滨、他莫昔芬、来曲唑、卡铂、吉西他滨、顺铂、厄洛替尼(erlotinib)、伊立替康(irinotecan)、氟尿嘧啶和奥沙利铂。药物组合物可以与放射疗法组合施用。本技术涉及以下各项:1.病毒样颗粒(vlp),包含:a.包含重组多核苷酸的α病毒复制子,其中所述多核苷酸包含编码人ii类主要组织相容性抗原的两个亚基的序列和编码特异于患病细胞的抗原的序列;b.逆转录病毒gag蛋白,和c.促融合包膜蛋白,其中所述vlp不含有α病毒结构蛋白基因。2.项1的vlp,其中所述α病毒复制子包含辛德毕斯病毒或委内瑞拉马脑炎病毒的核酸序列。3.项1或2中任一项的vlp,其中所述vlp不包含或不表达逆转录病毒pol基因。4.项1
‑
3中任一项的vlp,包含第一和第二多核苷酸,其中所述α病毒复制子由所述第一多核苷酸编码且所述逆转录病毒gag蛋白由所述第二多核苷酸编码,且其中所述第一和第二多核苷酸不是共价连接的且不是操作性连接的。5.项1
‑
4中任一项的vlp,其中所述促融合包膜蛋白是糖蛋白、或其片段或衍生物。6.项1
‑
5中任一项的vlp,其中所述特异于患病细胞的抗原是肿瘤特异性抗原。7.项6的vlp,其中所述肿瘤特异性抗原选自下组:α胎蛋白(afp)、ca15
‑
3、ca27
‑
29、ca19
‑
9、ca
‑
125、降钙素、钙视网膜蛋白、癌胚抗原、cd34、cd99、cd117、嗜铬粒蛋白、细胞角蛋白、结蛋白、上皮膜蛋白(ema)、因子viii、cd31fl1、神经胶质纤维酸性蛋白(gfap)、巨囊性病(gross cystic disease)流体蛋白(gcdfp
‑
15)、hmb
‑
45、人绒毛膜促性腺激素(hcg)、抑制素、角蛋白、淋巴细胞标志物、mart
‑
1(melan
‑
a)、myo d1、肌特异性肌动蛋白(msa)、神经丝、神经元特异性烯醇化酶(nse)、胎盘碱性磷酸酶(plap)、前列腺特异性抗原、ptprc(cd45)、s100蛋白、平滑肌肌动蛋白(sma)、突触素(synaptophysin)、甲状腺球蛋白、甲状腺转录因子
‑
1、肿瘤m2
‑
pk、波形蛋白、cd80、cd28、cd30、cd13、cd15、cd20、cd25、和cd10。8.项1
‑
7中任一项的vlp,其中所述肿瘤特异性抗原和所述人ii类主要组织相容性
抗原两者均由所述α病毒复制子编码。9.项1
‑
8中任一项的vlp,其中所述vlp能结合真核细胞。10.项9的vlp,其中所述真核细胞是人细胞。11.项10的vlp,其中所述结合是特异于靶细胞的。12.项1
‑
11中任一项的vlp,其中所述促融合包膜蛋白特异性结合肿瘤细胞。13.项1
‑
5中任一项的vlp,其中所述特异于患病细胞的抗原由传染原的基因表达。14.项13的vlp,其中所述传染原是感染性病毒。15.在真核细胞中表达至少一种重组多核苷酸的方法,包括使细胞与项1
‑
14中任一项的vlp接触。16.将重组多核苷酸投递给受试者的方法,包括对所述受试者施用项1
‑
14中任一项的vlp。17.包含项1
‑
14中任一项的vlp的药物组合物。18.项17的药物组合物,其中所述组合物适用于胃肠外施用。19.预防或治疗哺乳动物受试者中的疾病的方法,包括对有此需要的受试者施用有效剂量的项17的药物组合物。20.项19的方法,其中所述哺乳动物受试者患有肿瘤。21.项20的方法,其中由所述vlp编码的所述ii类主要组织相容性抗原(ii类mhc抗原)不同于该哺乳动物受试者的ii类mhc抗原。22.项19
‑
20中任一项的方法,其中所述药物组合物诱导肿瘤特异性免疫。23.项19
‑
22中任一项的方法,其中所述哺乳动物受试者是选自下组的癌症患者:具有源自乳腺、宫颈、前列腺、卵巢、肾癌、肺、胃、胰腺、成胶质细胞瘤和结直肠的实体瘤的癌症患者。24.项20
‑
22中任一项的方法,其中所述肿瘤特异性抗原包含选自下组的多肽:α胎蛋白(afp)、ca15
‑
3、ca27
‑
29、ca19
‑
9、ca
‑
125、降钙素、钙视网膜蛋白、癌胚抗原、嗜铬粒蛋白、细胞角蛋白、结蛋白、上皮膜蛋白(ema)、因子viii、fl1、神经胶质纤维酸性蛋白(gfap)、巨囊性病流体蛋白(gcdfp
‑
15)、hmb
‑
45、人绒毛膜促性腺激素(hcg)、抑制素、角蛋白、淋巴细胞标志物、mart
‑
1(melan
‑
a)、myo d1、肌特异性肌动蛋白(msa)、神经丝、神经元特异性烯醇化酶(nse)、胎盘碱性磷酸酶(plap)、前列腺特异性抗原、s100蛋白、平滑肌肌动蛋白(sma)、突触素、甲状腺球蛋白、甲状腺转录因子
‑
1、肿瘤m2
‑
pk、波形蛋白、分化簇10(cd10)、cd13、cd15、cd20、cd25、cd30、cd31、cd34、cd45(ptprc)、cd99、cd117、及其片段。25.项20
‑
24中任一项的方法,其中所述肿瘤特异性抗原和所述ii类主要组织相容性抗原由相同的宿主细胞共表达。26.项19的方法,其中所述疾病是感染性疾病。27.项26的方法,所述重组多肽还包含传染原的序列。28.项27的方法,其中所述药物组合物诱导免疫免于感染性疾病。29.项27的方法,其中所述传染原是感染性病毒。30.项19
‑
27中任一项的方法,其中所述vlp导致抗原提呈至所述哺乳动物受试者的免疫系统细胞。31.项19的方法,其中所述药物组合物与化疗药物一起在组合治疗中施用。
32.项31的方法,其中所述组合治疗还包括施用选自由以下组成的药物类别的化疗药物:紫杉烷(紫杉醇或多西他赛)、蒽环类抗生素(多柔比星或表柔比星)、环磷酰胺、卡培他滨、他莫昔芬、来曲唑、卡铂、吉西他滨、顺铂、厄洛替尼(erlotinib)、伊立替康(irinotecan)、氟尿嘧啶和奥沙利铂。33.项19的方法,其中所述药物组合物与放射疗法组合施用。34.vlp用于预防或治疗哺乳动物受试者中疾病的用途,包含治疗有效量的项17的药物组合物。附图简述图1图示了载体的例子。该载体的dna序列在所附序列表中提供(seq id no:1)。
11.图2显示产生和使用本文描述的vlp的基本概念。复制子质粒含有驱动复制子和感兴趣基因表达的cmv启动子。所述复制子含有元件nsp1,nsp2,nsp3和nsp4。感兴趣的基因含有编码两个ii类mhc抗原亚基和疾病特异性抗原的核酸。结构性载体含有在cmv启动子的控制下的来自rsv的gag。包膜载体含有在cmv启动子的控制下的vsv
‑
g蛋白。这些被转染到生产者宿主细胞中,其制造含有rna的vlp。vlp可用于感染靶细胞,其产生由感兴趣基因编码的蛋白。
12.图3显示实施例的具体构建体。这显示复制子质粒vlp
‑
vee,其含有编码hla
‑
dr1和cd80蛋白的核酸。
13.图4显示在4t1
‑
luc2(乳腺癌)细胞移植(grafting)后的动物存活。
14.图5显示在用4t1
‑
luc2细胞激发后的免疫动物存活。发明详述定义除非另外指示,当术语“一个/一种”在本公开中使用时,其指“至少一个/一种”或“一种或多种”。
15.术语“促融合(fusogenic)蛋白”如本文使用意指以下蛋白,其能诱导vlp的质膜衍生的包膜融合到接受体细胞的膜。
16.术语“表达”和“产生”在本文中同义使用,且指基因产物的生物合成。这些术语涵盖将基因转录成rna。这些术语还涵盖将rna翻译成一种或多种多肽,且还涵盖所有天然存在的转录后和翻译后修饰。抗体或其抗原结合片段的表达或产生可以在细胞的细胞质内,或者到胞外环境中如细胞培养物的生长培养基中。
[0017]“多核苷酸”与“核酸分子”、“核苷酸”或“核酸”同义,指任何多聚核糖核苷酸或多聚脱氧核糖核苷酸,其可以是未修饰的rna或dna或经修饰的rna或dna。“多核苷酸”包括但不限于单链和双链dna,作为单链和双链区混合物的dna,单链和双链rna,以及作为单链和双链区混合物的rna,包含dna和rna的杂合分子,所述dna和rna可以是单链或者更典型的是双链的,或者是单链和双链区的混合物。另外,“多核苷酸”指包含rna或dna或rna和dna两者的三链区。术语多核苷酸还包括含有一个或多个经修饰碱基的dna或rna,和具有经修饰骨架以用于稳定或其他原因的dna或rna。“修饰的”碱基包括,例如三苯甲基化(tritylate)的碱基和不寻常碱基如次黄苷。可对dna和rna进行多种修饰;如此,“多核苷酸”涵盖了如通常见于自然界的多核苷酸的化学、酶法或代谢修饰形式,以及病毒和细胞特征性的dna和rna的化学形式。“多核苷酸”还涵盖相对短的核酸链,常称为寡核苷酸。
[0018]“复制子”如本文使用的指具有促进其序列复制必需的遗传元件且同时也能进行翻译的多核苷酸。
[0019]“病毒样颗粒”(vlp)如本文使用的指类似于病毒颗粒的结构。在优选的实施方案中,vlp含有展现在颗粒表面上的至少一种促融合蛋白。依照本发明的病毒样颗粒缺少病毒基因组的复制组分的全部或部分。典型地,依照本发明的病毒样颗粒不携带编码该病毒样颗粒的蛋白的遗传信息。载体
[0020]
α病毒(alphavirus)属于病毒的披膜病毒科(togaviridae)的组iv。α病毒是具有单个正义链rna的基因组的小的,球形的包膜病毒。总基因组长度在11,000到12,000个核苷酸的范围内,且具有5’帽和3’聚a尾部。4个非结构蛋白基因(nsp基因)编码在基因组的5
′
的2/3中,而3个结构蛋白从与基因组的3
′
1/3线性对应的亚基因组mrna翻译。
[0021]
α病毒基因组中有两个开放阅读框(orf),非结构性的和结构性的。第一种包括nsp基因且编码病毒rna转录和复制必需的蛋白(nsp1
–
nsp4)。第二种编码3种结构蛋白:核心核壳体蛋白c,和联合成异二聚体的包膜蛋白p62和e1。病毒膜锚定的表面糖蛋白负责受体识别和经由膜融合进入靶细胞。
[0022]
辛德毕斯病毒(sin)和委内瑞拉马脑炎病毒(veev)是α病毒,其基因组包含11703个核苷酸的mrna正链。sin感染多种脊椎动物宿主。辛德毕斯病毒的基因组编码非结构性(ns,复制子)和结构性蛋白(壳体和ph依赖性促融合包膜),其在宿主细胞的细胞质中直接翻译。α病毒还包括aura病毒、babanki病毒、barmah forest病毒、bebaru病毒、cabassou病毒、chikungunya病毒、东方马脑炎病毒、everglades病毒、fort morgan病毒、getah病毒、highlands j病毒、kyzylagach病毒、mayaro病毒、me tri病毒、middelburg病毒、mosso das pedras病毒、mucambo病毒、ndumu病毒、o
′
nyong
‑
nyong病毒、pixuna病毒、rio negro病毒、ross river病毒、鲑鱼胰腺病(salmon pancreas disease)病毒、semliki forest病毒(sfv)、南象海豹(southern elephant seal)病毒、tonate病毒、trocara病毒、una病毒、西方马脑炎病毒、和whataroa病毒。
[0023]
用α病毒感染宿主细胞导致以凋亡告终的细胞毒性,这大多由于以下两种造成:α病毒基因组rna大量表达,从而在宿主细胞中触发了抗病毒状态,和α病毒非结构性蛋白(sin的nsp2或veev的nc)与细胞mrna合成或翻译关闭(shut
‑
off)的直接相互作用,其导致宿主细胞上的致细胞病变作用(cpe)。在非结构性蛋白之一nsp2(在位置726)中含有点突变的天然sin变体展现出感染细胞中的持续的和非致细胞病变性的生长,尽管从感染的细胞回收的病毒滴度实质性降低(frolov,等,1999,j virol,73:3845
‑
65)。
[0024]
基因治疗研究者对α病毒感兴趣。ross river病毒、sin、sfv和veev已全部用来开发用于基因投递的载体。假型化病毒(pseudotyped virus)可通过组合α病毒包膜糖蛋白和逆转录病毒壳体形成。经α病毒包膜糖蛋白假型化的逆转录病毒或慢病毒能将其携带的基因整合到潜在宿主细胞中。假型化的α病毒被α病毒包膜蛋白e2和e1识别和感染。病毒基因的稳定整合由这些载体的逆转录病毒性内部介导。
[0025]
由于其缺少靶向的特异性,在基因治疗领域使用α病毒存在限制。然而,经由在e2结构中的非保守环中引入可变抗体域,已经靶向特定的细胞群体。此外,使用全α病毒用于基因疗法的功效有限,既因为几种内部α病毒蛋白牵涉在感染时诱导凋亡,又因为α病毒壳
体仅介导mrna瞬时引入宿主细胞中。这些限制中没有一种扩展到逆转录病毒或慢病毒的α病毒包膜假型。描述了用于在靶细胞中转基因表达的各种基于α病毒的表达载体(xiong,等,1989,science,243:1188
‑
91;和bredenbeek,等,1993,j virol,67:6439
‑
46)。出于安全性考虑,这些表达系统通常包含两种质粒。一种质粒含有病毒复制子的编码序列(即非结构蛋白)和内部启动子以及转基因编码区,而第二种质粒编码病毒结构基因。这些质粒用于体外生成mrna,然后其被电穿孔到宿主细胞中以生成单轮(one
‑
round)感染病毒颗粒。这些病毒颗粒然后用于感染靶细胞以进行转基因表达。然而,这些颗粒产生了安全性忧虑,因为编码非结构性和结构性病毒元件的序列元件之间的重组可产生能复制的α病毒颗粒,其具有在体内介导显著的致细胞病变作用的能力。
[0026]
该问题的一个可能的解决办法是使用不相关的vlp来将α病毒复制子投递至哺乳动物细胞的细胞质,其中它们能自主复制和表达感兴趣的基因,没有任何核涉入。可以使用三种载体产生这些vlp。第一载体包含在哺乳动物启动子(例如cmv)的控制下的α病毒复制子的编码序列,逆转录病毒特异性rna包装信号,和感兴趣的基因或多核苷酸。所述基因可以表达具有治疗或研究应用的蛋白,或shrna或其他调节性核酸。第二载体包含逆转录病毒gag。第三载体将提供适宜的包膜糖蛋白用于感染靶细胞。
[0027]
在共转染到适宜的包装细胞系时,从第一载体中存在的细胞启动子转录的rna分子将包装到从第二载体产生的vlp中。这些vlp能基于vlp中存在的包膜糖蛋白将基于α病毒的复制子投递至靶细胞。一旦在细胞内,宿主翻译体系将翻译引入的α病毒rna和产生α病毒复制蛋白,其相应地将扩增rna和表达感兴趣的基因或多核苷酸。突变体复制子如上文描述的那种能极大地延长表达的持续时间,且对于宿主细胞具有极小影响。而且,编码用于α病毒结构元件的基因的dna将不存在于靶细胞中,从而极大地增强提出的系统的安全性。
[0028]
本文中描述了涉及vlp的组合物和用于制备和使用所描述的vlp的方法。描述的组合物包含vlp,以及用于产生所述vlp的载体和细胞。本文描述的相关方法涉及产生vlp的方法,使用vlp转导细胞的方法,和使用本文描述的vlp在靶细胞中产生感兴趣的蛋白或多核苷酸的方法。还描述了基于α病毒的复制子,其允许在靶细胞中表达蛋白或多核苷酸,且没有病毒感染的风险。
[0029]
本文中描述了用于产生携带基于α病毒的复制子的vlp的载体,所述复制子不编码α病毒结构蛋白。为了产生此类vlp,可以通过以下来产生几种组分:将编码这些组分的一种或多种载体转染或核转染(nucleofecting)到细胞系中用于体外生产。在一些实施方案中,这些组分由分别的载体编码以降低所得vlp将能复制的可能性。例如,可以使用多质粒系统,其中一种质粒编码vlp要包装的遗传材料如rna多核苷酸(编码辛德毕斯病毒或veev非结构蛋白);另一种编码vlp的结构蛋白如gag;且另一种质粒编码融合蛋白如vsv
‑
g以促进vlp对靶细胞膜的融合。
[0030]
编码要被宿主细胞包装的遗传材料的载体可采用多种形式,如可选择或可诱导的质粒,但一般具有一些共有的特征。例如,本文描述的编码基于rnaα病毒的复制子的载体可以包含启动子序列,逆转录病毒包装信号序列,翻译起始序列,非结构性α病毒蛋白,用于插入感兴趣的基因或多核苷酸的克隆位点,插入的感兴趣的基因或多核苷酸,3’非翻译区和多腺苷尾部区段。
[0031]
在一些实施方案中,描述的载体包含启动子元件,其允许载体的区段被宿主细胞
转录。在一些实施方案中,载体序列可转录成要包装到vlp中的rna。在所描述载体的大多数实施方案中,启动子序列将位于载体中包含的所有可翻译元件的上游(见例如,例示巨细胞病毒启动子“pcmv”的位置的图1)。在本文描述的一些实施方案中,启动子序列将源自病毒,如cmv或猿病毒40(sv40)。本领域技术人员公知大量的其他启动子序列,且基于提供的说明将其用于本文描述的载体将是显而易见的。
[0032]
在一些实施方案中,编码要被宿主细胞包装的遗传材料的所述载体可包括多核苷酸序列,其编码逆转录病毒包装信号序列(也称为psi(ψ)元件)以允许从载体转录的rna序列的一个或两个拷贝包装到在宿主细胞中形成的vlp颗粒中。大多数(如果不是所有)逆转录病毒具有此类性质的包装序列,如此这些序列及其整合到所述载体中对于本领域技术人员将是显而易见的。在一些实施方案中,本文描述的载体包括多核苷酸序列,其编码逆转录病毒包装序列,源自rous肉瘤病毒、moloney鼠白血病病毒、猿免疫缺陷病毒(siv)、hiv、人t
‑
嗜淋巴细胞病毒,等等。在一个具体的实施方案中,所述逆转录病毒包装序列源自rous肉瘤病毒。或者,所述逆转录病毒包装序列源自鼠白血病病毒。
[0033]
编码本文描述的要被宿主细胞包装的遗传材料的载体的另一个方面是翻译起始序列,其允许由载体编码的rna序列在宿主细胞中翻译。在一些实施方案中,所描述的翻译起始序列可以能允许基于α病毒的非结构性蛋白的表达,所述非结构性蛋白在所述vlp携带的rna序列投递到宿主细胞时能复制它。在一些实施方案中,所描述的翻译起始序列可以能允许感兴趣基因的表达。在一些实施方案中,所述翻译起始序列可以允许感兴趣的基因被宿主细胞翻译复合物翻译。在一些实施方案中,本文描述的翻译起始序列可以源自α病毒,如辛德毕斯病毒或veev。在其他实施方案中,翻译起始序列可以源自其他基因,如已知具有能通过哺乳动物翻译复合物启动rna序列翻译的翻译起始序列的病毒基因。或者,翻译起始序列可以源自其他基因,如插入所述α病毒复制子中的感兴趣基因的天然翻译起始序列。在一些实施方案中,本文描述的翻译起始序列在包装的rna分子中可以位于超过一个位置,如此可以由所述载体编码一次或多次。例如,可以期望从包装rna分子编码的感兴趣基因分别翻译所述辛德毕斯或veev非结构性蛋白。在这类情况中,编码非结构性蛋白的多核苷酸和编码感兴趣蛋白的多核苷酸两者将在载体和包装的rna中具有位于其位置5’的分别的翻译起始序列。基于该说明,本领域技术人员将理解可将能促进rna在哺乳动物细胞中翻译的多种翻译起始序列纳入本文描述的所述vlp包装的rna中。
[0034]
编码要被宿主细胞包装的遗传材料的载体还可以包含编码非结构性α病毒蛋白的多核苷酸,如来自sin或veev的非结构性蛋白。例如,在一些实施方案中,所述载体可包含编码一种或多种辛德毕斯病毒非结构性蛋白的多核苷酸。在一些实施方案中,所述载体可包含编码一种或多种veev非结构性蛋白的多核苷酸。在一些实施方案中,所述载体可包含编码sin或veev非结构性蛋白nsp1的多核苷酸。在一些实施方案中,所述载体可包含编码辛德毕斯病毒或veev非结构性蛋白nsp2的多核苷酸。在一些实施方案中,所述载体可包含编码sin或veev非结构性蛋白nsp3的多核苷酸。在一些实施方案中,所述载体可包含编码辛德毕斯病毒或veev非结构性蛋白nsp4的多核苷酸。在一些实施方案中,所述载体可包含编码sin或veev非结构性蛋白nsp1,nsp2,nsp3和nsp4的多核苷酸。在一些实施方案中,所述载体的编码α病毒非结构性蛋白的多核苷酸将源自α病毒基因组的相应基因组序列,如辛德毕斯病毒或veev的。在一些实施方案中,编码α病毒非结构性蛋白的多核苷酸没有编码α病毒结构蛋
白的任何多核苷酸,不管结构蛋白是来自与存在的非结构性蛋白序列相同还是不同的α病毒。
[0035]
用于整合要被宿主细胞包装的遗传材料的本文所述载体还可以含有感兴趣的多核苷酸,其可以在通过携带载体编码的遗传材料的vlp转导的宿主细胞中表达。在一些实施方案中,所述载体可以编码要包装到vlp中的rna多核苷酸序列,其然后可通过vlp介导的细胞转导投递至宿主细胞。一旦已将rna多核苷酸序列投递至靶细胞,那么该rna编码的感兴趣的多核苷酸可以提供感兴趣的蛋白的表达。因此,本文所述载体设计为编码用于包装到vlp中的rna,其一旦在靶细胞内部就能表达感兴趣的基因。因此,在一些实施方案中,所述载体将包含感兴趣的多核苷酸序列。在所述载体的一些实施方案中,感兴趣的多核苷酸序列可以编码感兴趣的蛋白。例如,感兴趣的多核苷酸序列在一些实施方案中可以编码绿色荧光蛋白(gfp)并充当靶细胞的病毒转导的可检测标志物。在另一个实施方案中,感兴趣的多核苷酸序列可以编码靶细胞内源性的蛋白质的功能型式。在另一个实施方案中,感兴趣的多核苷酸序列可以编码对于目标受试者内源性的蛋白质的功能型式。在另一个实施方案中,感兴趣的多核苷酸序列可以编码对于靶细胞而言外来的蛋白。在另一个实施方案中,感兴趣的多核苷酸序列可以编码对于目标受试者而言外来的蛋白。在一些实施方案中,感兴趣的多核苷酸序列可以编码能够在靶细胞上具有治疗效果的蛋白。在一些实施方案中,感兴趣的多核苷酸序列可以编码能够在目标受试者上具有治疗效果的蛋白。在备选的实施方案中,感兴趣的多核苷酸序列可以充当干扰rna分子并功能为调节宿主细胞内的内源性基因表达。例如,在一些实施方案中,感兴趣的多核苷酸序列可以包含以下序列,其提供rna发夹环的形成以起始rna干扰。另外,感兴趣的多核苷酸可以是rna的正义或负义链,其可通过由包装的rna分子编码的α病毒非结构性蛋白形成的rna依赖性rna聚合酶复合物转录。由于该rna依赖性rna聚合酶能在正义和负义方向上转录rna,因此可将干扰rna序列如mirna或shrna插入包装的rna复制子中且可设计为在任一方向编码干扰多核苷酸。本领域技术人员将领会所述转导系统的这一方面的治疗特征,因为它可以允许选择的蛋白在受试者中的表达。根据所述载体的这一方面,还可以将具有一个或多个限制内切核酸酶位点的克隆位点纳入载体中以促进感兴趣的多核苷酸序列的插入。
[0036]
可用于产生本文描述的vlp的另一种载体是编码病毒结构蛋白的载体。一种此类蛋白是逆转录病毒组特异性抗原(gag)蛋白。gag蛋白是逆转录病毒的核心结构蛋白,且在一些情况中当在真核细胞中表达时能形成包膜的病毒核心。此特性使得gag蛋白尤其可用于生成vlp,因为它们能形成颗粒的基本结构方面并允许与逆转录病毒包装信号序列联合的rna的包装。因此,本文描述了包含编码逆转录病毒gag蛋白的多核苷酸的载体。在一些实施方案中,所述载体包含编码逆转录病毒gag蛋白的多核苷酸和允许gag基因序列通过宿主细胞rna聚合酶转录成mrna的启动子多核苷酸序列。在一个实施方案中,所述启动子多核苷酸序列源自病毒,如sv40或cmv。在一些实施方案中,载体将进一步包含编码感兴趣蛋白的多核苷酸。有关领域的技术人员将理解可以使用来自任何逆转录病毒的gag蛋白的多核苷酸序列来生产本文描述的载体和vlp。在一些实施方案中,编码gag蛋白的多核苷酸序列可以源自rous肉瘤病毒。在一些实施方案中,编码gag蛋白的多核苷酸序列可以源自鼠白血病病毒。在一些实施方案中,编码gag蛋白的多核苷酸序列可以源自siv。在一些实施方案中,编码gag蛋白的多核苷酸序列可以源自人t
‑
嗜淋巴细胞病毒。
[0037]
可用于产生本文描述的vlp的另一种载体是编码介导vlp包膜和宿主细胞之间的
融合的蛋白的载体。适用于该目的的一类蛋白是病毒融合蛋白,其通过允许包膜的病毒将其膜与宿主细胞的膜融合来促进细胞的病毒感染。许多病毒融合蛋白还具有已知或怀疑的细胞受体蛋白,其允许靶向选定的细胞类型,或在更普遍存在的受体(如流感病毒的唾液酸)的情况中,可以期望更一般化的靶向。在一些情况中,病毒融合蛋白连同病毒附接蛋白、细胞受体的配体、细胞配体的受体、或辅助(accessory)蛋白一起作用,因而此种蛋白也可以由所述载体编码,除了由编码病毒融合蛋白的载体外,或者还由编码病毒融合蛋白的载体编码。或者,在一些实施方案中,来自一种病毒的病毒融合蛋白可以由所述载体编码,连同另一种病毒的病毒附接蛋白、细胞受体的配体、细胞配体的受体或辅助蛋白以促进或指导vlp靶向至期望的细胞类型。在一些实施方案中,所述病毒融合蛋白、病毒附接蛋白、细胞受体的配体、细胞配体的受体或辅助蛋白将是i型膜蛋白,其将允许蛋白的胞外域在提呈于细胞表面上时向细胞外取向。这还将允许vlp从包装细胞出芽(budding)后融合蛋白正确地取向。这类蛋白在细胞中的表达通常将导致细胞表面被该蛋白包被,从而vlp从细胞膜任何部分的出芽都将提供在其表面上有一些量的所述蛋白(一种或多种)的vlp。在一些实施方案中,所述载体包含编码病毒融合蛋白的多核苷酸和允许该融合蛋白基因序列通过宿主细胞rna聚合酶翻译成mrna的启动子多核苷酸序列。在一个实施方案中,所述启动子多核苷酸序列源自病毒,如sv40或cmv。在一些实施方案中,所述载体包含编码病毒附接蛋白的多核苷酸和允许附接蛋白基因序列通过宿主细胞rna聚合酶翻译成mrna的启动子多核苷酸序列。在一个实施方案中,所述启动子多核苷酸序列源自病毒,如sv40或cmv。在一些实施方案中,本文所述的载体包含编码水泡性口炎病毒(vesicular stomatitis)g蛋白的多核苷酸。在一些实施方案中,本文所述的载体包含编码流感血凝素蛋白的多核苷酸。在一些实施方案中,本文所述的载体包含编码流感神经氨酸酶蛋白的多核苷酸。在一些实施方案中,本文所述的载体包含编码呼吸道合胞病毒融合蛋白的多核苷酸。在一些实施方案中,本文所述的载体包含编码轮状病毒vp7蛋白的多核苷酸。基于对有关病毒的期望的向性或细胞靶物,其他此类融合蛋白对于本领域技术人员将是明显的。表达所述载体的细胞
[0038]
本文中提供了包含所述载体以产生vlp的细胞。这些细胞可用于产生本文所述的vlp,其通过转录或表达载体的多核苷酸。例如,用具有编码α病毒rna构建体(具有感兴趣的基因或多核苷酸)和包装信号的多核苷酸序列的载体、编码逆转录病毒gag蛋白的载体、和编码病毒融合蛋白的载体转染的哺乳动物细胞能产生在其表面上具有表达的病毒融合蛋白的vlp,其中所编码的α病毒rna构建体的一个或两个拷贝位于vlp的内部。此外,由于这些载体中没有一个编码α病毒结构蛋白,因此创建感染病毒的可能性相比于的确包含α病毒结构蛋白的系统实质性降低。
[0039]
所述细胞可以是任何真核细胞,其能转录且在必要时(如在gag和融合蛋白的情况中)翻译所述载体的多核苷酸。细胞在许多实施方案中可能将是哺乳动物细胞。例如,可以使用啮齿动物细胞,如鼠、仓鼠(cho或bhk
‑
21)或大鼠细胞来表达所述载体;犬类细胞,如madin darby犬肾细胞可用于表达所述载体;灵长类细胞如vero细胞可用于表达所述载体;和人细胞如hek293t细胞(人肾)、hep
‑
2细胞(人气道)、caco
‑
2(肠)、hela(上皮)和其他这类本领域已知的细胞系可用于表达所述载体。在一些实施方案中,可以使用本领域已知的标准的转染和选择方法来转染和选择所述细胞以稳定地包含一种或多种所述载体。
[0040]
在一些实施方案中,本文描述的细胞系将含有包含编码α病毒复制子的多核苷酸序列的载体(其中所述α病毒复制子编码感兴趣的蛋白),包含编码gag蛋白的多核苷酸序列的载体,和包含编码异源促融合包膜蛋白的多核苷酸序列的载体,其中载体或细胞均不含有编码α病毒结构蛋白的基因。在一些实施方案中,α病毒复制子可以源自辛德毕斯病毒或veev。在一些实施方案中,α病毒复制子可以具有编码辛德毕斯病毒或veev非结构性蛋白nsp1、nsp2、nsp3、nsp4,和逆转录病毒包装信号的多核苷酸序列。在一些实施方案中,所述逆转录病毒包装信号可以源自rous肉瘤病毒或鼠白血病病毒。在一些实施方案中,编码gag蛋白的多核苷酸序列源自rous肉瘤病毒。在一些实施方案中,编码异源促融合包膜蛋白的多核苷酸序列编码vsv
‑
g。病毒样颗粒
[0041]
使用所述载体和细胞产生的vlp也在本文描述。本文描述的vlp将具有四个一般特征:它们将包含编码α病毒复制子和任选地感兴趣蛋白的一种或两种rna分子;它们将具有包含逆转录病毒gag蛋白(或在一些实施方案中为gag融合蛋白)的病毒核心;它们将具有表面蛋白以促进与细胞的融合,且它们将不含有编码α病毒结构蛋白的多核苷酸。
[0042]
本文描述的vlp将可用于转导细胞以在其中表达感兴趣的蛋白。因此,所述vlp可以纳入能编码感兴趣蛋白的一种或两种基于α病毒的rna多核苷酸。为了促进rna序列的翻译,所述包装的rna的一些实施方案可以包含如本文描述的翻译启动序列。在一些实施方案中,纳入vlp的rna序列将包含逆转录病毒包装序列,其将促进rna纳入到形成的vlp中。在一些实施方案中,所述逆转录病毒包装序列源自rous肉瘤病毒、moloney鼠白血病病毒、siv、hiv、人t
‑
嗜淋巴细胞病毒,等等。在一个具体的实施方案中,所述逆转录病毒包装序列源自rous肉瘤病毒。或者,所述逆转录病毒包装序列可以源自鼠白血病病毒。另外,包括在vlp中的rna序列可以能编码非结构性α病毒蛋白。例如,在一些实施方案中,包装的rna可以编码一种或多种辛德毕斯病毒或veev非结构性蛋白。在一些实施方案中,包装的rna可以编码辛德毕斯病毒或veev非结构性蛋白nsp1。在一些实施方案中,包装的rna可以编码辛德毕斯病毒或veev非结构性蛋白nsp2。在一些实施方案中,包装的rna可以编码辛德毕斯病毒或veev非结构性蛋白nsp3。在一些实施方案中,包装的rna可以编码辛德毕斯病毒或veev非结构性蛋白nsp4。在一些实施方案中,包装的rna可以编码辛德毕斯病毒或veev非结构性蛋白nsp1,nsp2,nsp3,和nsp4。包装的rna还可以包含感兴趣蛋白的多核苷酸序列。例如,感兴趣的多核苷酸序列在一些实施方案中可以编码gfp并充当靶细胞的病毒转导的可检测标志物。在另一个实施方案中,感兴趣的多核苷酸序列可以编码靶细胞内源性的蛋白质的功能型式。在另一个实施方案中,感兴趣的多核苷酸序列可以编码对于目标受试者内源性的蛋白质的功能型式。在另一个实施方案中,感兴趣的多核苷酸序列可以编码对于靶细胞而言外来的蛋白。在另一个实施方案中,感兴趣的多核苷酸序列可以编码对于目标受试者而言外来的蛋白。在一些实施方案中,感兴趣的多核苷酸序列可以编码能够在靶细胞上具有治疗效果的蛋白。在一些实施方案中,感兴趣的多核苷酸序列可以编码能够在目标受试者上具有治疗效果的蛋白。本领域技术人员将领会所描述的vlp的这一方面的治疗特征,因为其可允许选择的蛋白在细胞或受试者中的表达。
[0043]
本文描述的vlp还可以包含病毒gag蛋白以向颗粒提供病毒核心结构。gag蛋白是逆转录病毒的核心结构蛋白,且在一些情况中,当在真核细胞中表达时能形成包膜的病毒
核心。该特性使得gag蛋白尤其可用于生成vlp,因为它们能形成颗粒的基本结构方面并允许与逆转录病毒包装信号序列联合的rna的包装。有关领域的技术人员将理解可以使用来自任何逆转录病毒的gag蛋白来生产本文描述的载体和vlp。在一些实施方案中,gag蛋白可以源自rous肉瘤病毒。在一些实施方案中,gag蛋白可以源自鼠白血病病毒。在备选的实施方案中,gag蛋白可以源自siv、hiv、人t
‑
嗜淋巴细胞病毒或类似的逆转录病毒。
[0044]
本文描述的vlp的另一组分是介导vlp包膜和宿主细胞之间融合的蛋白。适用于该目的的一类蛋白是病毒融合蛋白,其通过允许包膜的病毒将其膜与宿主细胞的膜融合来促进细胞的病毒感染。许多病毒融合蛋白还具有已知或怀疑的细胞受体蛋白,其可以允许靶向选定的细胞类型,或在更遍在的受体(如流感病毒的唾液酸)的情况中,可以实现更一般化的靶向。在一些情况中,病毒融合蛋白可以连同病毒附接蛋白、细胞受体的配体、细胞配体的受体、或辅助蛋白一起作用,因而除了病毒融合蛋白外此种蛋白也可以存在于vlp表面上。或者,在一些实施方案中,所述vlp可以具有来自一种病毒的病毒融合蛋白和另一种病毒的病毒附接蛋白、细胞受体的配体、细胞配体的受体或辅助蛋白,从而促进或指导vlp靶向至期望的细胞类型。类似地,所述vlp可以产生为在vlp包膜中具有超过一种融合蛋白,因为这可以促进对多种选择的细胞类型的融合。在一些实施方案中,vlp表面蛋白将是i型膜蛋白,其将允许蛋白的胞外域在提呈于细胞表面上时向细胞外取向。这还将允许vlp从包装细胞出芽后融合蛋白正确地取向。这类蛋白在细胞中的表达通常将导致细胞表面被该蛋白包被,从而vlp从细胞膜任何部分的出芽都将提供在其表面上有一些量的融合蛋白的vlp。在一些实施方案中,本文所述的vlp包含vsv
‑
g蛋白以介导细胞融合。在一些实施方案中,本文所述的vlp包含流感血凝素蛋白以介导细胞融合。在一些实施方案中,本文所述的vlp包含流感神经氨酸酶蛋白以促进细胞融合。在一些实施方案中,本文所述的vlp包含呼吸道合胞病毒融合蛋白。在一些实施方案中,本文所述的vlp包含轮状病毒vp7蛋白。基于相关病毒的期望向性或细胞靶物,其他此类融合蛋白对于本领域技术人员将是明显的。
[0045]
本文所述的vlp可以包含α病毒复制子,逆转录病毒gag蛋白,和异源促融合包膜蛋白,其中所述α病毒复制子包含感兴趣的多核苷酸或编码感兴趣的蛋白;其中vlp不含有α病毒结构蛋白基因。在一些实施方案中,vlp的α病毒复制子源自辛德毕斯病毒或veev。例如,本文所述的vlp可以具有编码辛德毕斯病毒或veev非结构性蛋白nsp1、nsp2、nsp3、和nsp4的α病毒复制子。在一些实施方案中,与所述vlp中的包装rna关联的逆转录病毒包装信号源自rous肉瘤病毒或鼠白血病病毒。基于本说明书,本领域技术人员将容易地理解所述vlp可以经修饰以纳入可以促进vlp稳定性、rna包装或细胞进入的病毒的方面。这类修饰应理解为在本文提供的公开内容的范围内。一个实施方案由包含以下的vlp组成,所述vlp包含重组多核苷酸的α病毒复制子,其中所述多核苷酸包含编码ii类主要组织相容性抗原的两个亚基的序列;逆转录病毒gag蛋白,和促融合包膜蛋白,其中所述vlp不含有α病毒结构蛋白基因。vlp的重组多肽可进一步包含编码共刺激信号蛋白的序列。共刺激信号蛋白优选地选自下组:cd28、cd80、cd86、和ctla
‑
4。共刺激信号蛋白最优选包含cd80。产生所述vlp的方法
[0046]
本文所述的vlp可以以多种方式产生,如对于本领域技术人员来说基于所提供的公开内容明显的。这些不同方法的共性是在细胞中表达所述载体,所述细胞能表达必需的
蛋白(gag和融合蛋白)和产生基于α病毒的rna复制子。因此,产生本文描述的vlp的一种方法可包括用包含编码α病毒复制子的多核苷酸序列的载体;包含编码逆转录病毒gag蛋白的多核苷酸序列的载体;和包含编码异源促融合包膜蛋白的多核苷酸序列的载体共转化、转染或核转染真核细胞,其中所述α病毒复制子包含感兴趣的多核苷酸或编码感兴趣的蛋白;并在适合导致每种载体产生其编码产物的条件下培养共转化的细胞,由此产生病毒样颗粒。在一些实施方案中,编码α病毒复制子的多核苷酸序列可以源自辛德毕斯病毒或veev。在一些实施方案中,所述α病毒复制子可以具有编码辛德毕斯病毒或veev非结构性蛋白nsp1、nsp2、nsp3、nsp4,和逆转录病毒包装信号的多核苷酸序列。在一些实施方案中,所述逆转录病毒包装信号可以源自rous肉瘤病毒或鼠白血病病毒。在一些实施方案中,编码gag蛋白的多核苷酸序列源自rous肉瘤病毒。在一些实施方案中,编码异源促融合包膜蛋白的多核苷酸序列编码vsv
‑
g。组合物和施用方法
[0047]
本文中描述了包含至少一种所述vlp和药学可接受的载体的组合物。这类组合物可用于例如施用给需要外源蛋白表达或正常见于与受试者相同物种中的蛋白的增加的表达的受试者。组合物可以配制成本领域已知且合适的多种配制剂中的任一种,包括在本文中所描述和例示的那些。在一些实施方案中,所述组合物是水性制剂。可通过将vlp混合在水或适宜的生理缓冲液中,并任选按照期望添加适宜的着色剂、增味剂、防腐剂、稳定剂和增稠剂等来制备水性溶液。水性混悬剂也可以通过将vlp分散在具有粘性材料(如天然或合成胶(gum)、树脂、甲基纤维素、羧甲基纤维素钠、和其他公知的悬浮剂)的水或生理缓冲液中来制备。
[0048]
组合物可以配制为用于注射给受试者。对于注射,所述组合物可以配制在水性溶液如水或生理学相容缓冲液如汉克氏溶液(hanks’s solution)、林格氏溶液(ringer’s solution)或生理盐水缓冲液中。溶液可以含有一种或多种配制剂,如悬浮剂、稳定剂或分散剂。注射制剂还可以配制为固体形式制备物,其意图在使用不久前转化成适用于注射的液体形式制备物,例如在使用前通过用适合的媒介物,如无菌水、盐水溶液或醇构建。本文描述的方法可以胃肠外施用药物组合物。所述药物组合物可以通过静脉内注射施用。所述药物组合物可以通过注射到组织中,优选肿瘤或癌症中来施用。
[0049]
组合物可以配制为用于对受试者烟雾化投递。对于气溶胶投递,所述组合物可以配制在水性溶液如水或生理学相容缓冲液如汉克氏溶液、林格氏溶液或生理盐水缓冲液中。溶液可以含有一种或多种配制剂,如悬浮剂、稳定剂或分散剂。
[0050]
所述组合物可以配制成延迟释放媒介物或储存(depot)配制剂。这类长效作用制剂可以通过植入(例如皮下或肌内)或肌内注射施用。因此,例如所述组合物可以与适宜的聚合或疏水性材料(例如,作为可接受油中的乳剂)或离子交换树脂一起配制,或作为略溶性衍生物,例如略溶性盐来配制。脂质体和乳剂是适用作疏水药物的载体的投递媒介物的公知的例子。治疗方法
[0051]
本文描述的方法可以涉及预防或治疗患有肿瘤的患者中的疾病。患者可以是癌症患者,优选癌症患者是选自下组的癌症患者:具有源自乳腺、宫颈、前列腺、卵巢、肾癌、肺、胃、胰腺、成胶质细胞瘤和结直肠的实体瘤的癌症患者,最优选是乳腺癌患者。重组多核苷
酸因而可以进一步包含编码肿瘤特异性抗原的序列,优选选自下组的多肽:α胎蛋白(afp)、ca15
‑
3、ca27
‑
29、ca19
‑
9、ca
‑
125、降钙素、钙视网膜蛋白、癌胚抗原、嗜铬粒蛋白、细胞角蛋白、结蛋白、上皮膜蛋白(ema)、因子viii、fl1、神经胶质纤维酸性蛋白(gfap)、巨囊性病流体蛋白(gcdfp
‑
15)、hmb
‑
45、人绒毛膜促性腺激素(hcg)、抑制素、角蛋白、淋巴细胞标志物、mart
‑
1(melan
‑
a)、myo d1、肌特异性肌动蛋白(msa)、神经丝、神经元特异性烯醇化酶(nse)、胎盘碱性磷酸酶(plap)、前列腺特异性抗原、s100蛋白、平滑肌肌动蛋白(sma)、突触素、甲状腺球蛋白、甲状腺转录因子
‑
1、肿瘤m2
‑
pk、波形蛋白、分化簇10(cd10)、cd13、cd15、cd20、cd25、cd30、cd31、cd34、cd45(ptprc)、cd99、cd117、及其片段。
[0052]
本文所述方法可以胃肠外施用药物组合物。药物组合物可以通过静脉内注射施用。药物组合物可以通过注射在肿瘤内施用。
[0053]
在本文所述方法中,所述药物组合物可以与化疗药物组合施用。化疗药物可以选自由以下构成的药物类别:紫杉烷(紫杉醇或多西他赛)、蒽环类抗生素(多柔比星或表柔比星)、环磷酰胺、卡培他滨、他莫昔芬、来曲唑、卡铂、吉西他滨、顺铂、厄洛替尼、伊立替康、氟尿嘧啶和奥沙利铂。药物组合物可以与放射疗法组合施用。
[0054]
在本文所述方法中,所述药物组合物诱导肿瘤特异性cd8+溶细胞性t细胞。所述方法还针对包含vlp的药物组合物,该vlp包含诱导肿瘤特异性免疫的ii类mhc抗原。
[0055]
本文所述方法可以涉及预防或治疗感染性疾病。因此重组多肽可以进一步包含传染原的序列。所述传染原可以是感染病毒。
[0056]
提供下列实施例用于例示目的且意为增强而非限制前述公开内容。
实施例
实施例1
–
产生基于α病毒的基因表达系统
[0057]
设计α病毒基因表达系统以允许以较低的导致致细胞病变病毒感染的风险,将外源感兴趣基因(goi)或感兴趣蛋白(poi)经vlp介导的投递至靶细胞。使用三种载体设计表达系统,所述载体可在包装细胞系中表达以产生转导vlp。一种载体编码基于α病毒的表达构建体,另一种载体编码逆转录病毒gag蛋白以促进vlp形成,且第三载体编码融合蛋白以介导vlp对宿主细胞融合。另外,所述系统构建为在不需要存在α病毒结构蛋白的情况下工作。
[0058]
为了实现这一点,产生具有以下的基于α病毒的dna质粒:巨细胞病毒启动子(cmv);接着是相应逆转录病毒包装蛋白gag的逆转录病毒包装信号;接着是编码非结构性蛋白nsp1、nsp2、nsp3和nsp4的辛德毕斯或vee病毒基因;且最后是一种或多种亚基因组启动子(sgp;用于病毒编码的rna依赖性rna聚合酶的启动子,导致mrna的形成)以驱动感兴趣的基因(goi)表达,所述感兴趣的基因由重组多核苷酸组成且插入多克隆位点中;3’非翻译区(urt);和聚a尾部(图1)。
[0059]
构建另一种质粒来编码逆转录病毒gag蛋白,和第二种任选的感兴趣的蛋白(poi)。构建第三质粒来提供vsv
‑
g病毒融合蛋白的表达。
[0060]
一旦构建,测试所述质粒产生携带具有感兴趣基因的辛德毕斯病毒复制子的vlp的能力。对于这些实验,使用gfp作为感兴趣基因以协助基因的投递和胞内表达的检测。为了产生vlp,使用标准的核转染规程根据制造商用法说明(lonza)用amaxa系统将上述三种质粒中的每种转染到幼仓鼠肾(bhk
‑
21)细胞中。
[0061]
简言之,将3x106的bhk
‑
21细胞重悬于100μl核转染溶液l(amaxa)中并转移至含有以下的管中:4.5μg编码gag的质粒,3μg编码vsv
‑
g糖蛋白的质粒,和100纳克编码辛德毕斯α病毒复制子的质粒或对于vee复制子为2.5微克(总体积10μl)。将细胞和质粒的混合物转移至核转染小杯(cuvette)并使用amaxa核转染仪ii装置使用对bhk
‑
21的设置进行核转染。将核转染的细胞重悬于500μl完成培养基中并转移至含有培养基溶液的组织培养板中,在37℃温育72
‑
96小时或在32℃温育72小时。此时间后,通过以下来澄清由vlp和壳体化的α病毒复制子组成的上清液:在4℃以3000rpm/10min离心,通过0.45um滤器过滤并在室温暴露于10单位dnase i(turbo
tm
‑
dnase:ambion)30min。将处理过的vlp在4℃存储或在干冰上冷冻并转移至
‑
80℃。作为阴性对照(融合缺陷的vlp),还将bhk
‑
21细胞仅用pcmv
‑
sin rep
‑
poi
‑
2或veev
‑
rep
‑
poi和pgag
‑
poi
‑
1质粒而没有编码vsv
‑
g的penvelope质粒进行核转染。在转染后,将细胞在组织培养基中在允许vlps的质粒驱动生成的正常生长条件下温育48
–
72小时。一旦完成转染细胞的温育,就收集组织培养上清液,其应当含有任何产生的vlp。然后,将收集的细胞上清液添加至培养的bhk
‑
21细胞以确定所述细胞是否用gfp成功转导。当暴露于未转染的bhk
‑
21细胞时,从用所有三种质粒转染的bhk
‑
21细胞收集的细胞上清液产生强gfp表达。相反地,对于与从仅用pcmv
‑
sin rep
‑
poi
‑
2和pgag
‑
poi
‑
1质粒转染的bhk
‑
21细胞收集的细胞上清液温育的未转染的bhk
‑
21细胞,未观察到gfp表达。还使用人胚胎肾(hek293t)细胞进行类似的实验以证实构建的vlp能转导人细胞。此外,构建的vlp还可以存储于4℃达至少30天,而没有损失转导细胞的能力。
[0062]
还进行了实验以评估基于veev的α病毒复制子在细胞中表达蛋白的能力。对于这些研究,将bhk
‑
21细胞用具有插入veev复制子的gaussia萤光素酶基因的vlp转导。在转导后,监测细胞上清液中萤光素酶蛋白的表达。相对于没有外源基因或具有编码gfp的基因的对照veev复制子,在用具有gaussia萤光素酶基因的veev复制子转导的细胞的上清液中检测到高量萤光素酶。另外,萤光素酶蛋白的表达在转导后快速增加。在将功能性cre重组酶(红细胞)投递到工程化为在不存在cre重组酶的情况下表达gfp的细胞的背景中也观察到类似的结果。
[0063]
将细胞用编码gfp的基于辛德毕斯的vlp或编码gfp的基于veev的vlp并行转导。两种基于α病毒的vlp均导致强gfp表达,而观察到用基于veev的vlp转导的细胞具有更高的表达水平。实施例2
–
在用vee vlp转导的靶细胞中多种蛋白的表达
[0064]
使用vlp的rna投递的基本概念显示于图2。在该实验中,使用乳腺癌模型。开发了复制子的双启动子载体用于表达hla
‑
dr1和cd80(图3)。使用编码这两种抗原的vlp来感染4t1
‑
luc2乳腺癌细胞。使用抗
‑
hla
‑
dr和cd80抗体,结果显示两种蛋白确实均在该细胞中表达。hla
‑
dr1和cd80在用具有图2的vlp
‑
vee复制子的vlp转染的4t1
‑
luc2细胞中表达。表达hla
‑
dr1的细胞通过用fitc标记的抗hla
‑
dr抗体鉴定。表达cd80的细胞通过用pe标记的抗cd80抗体鉴定。
[0065]
为了评估α病毒复制子是否能在同一细胞中表达两种单独的蛋白,使用具有在一种亚基因组启动子控制下的hla
‑
dr1和在另一种亚基因组启动子控制下的cd80的vee复制子实施实验。在产生具有所述vee复制子的vlp后,转导细胞并检查两种蛋白的表达。如图4中显示的,转导的细胞能表达两种蛋白(免疫标记的hla
‑
dr1以绿色显示(fitc)和cd80以红
色显示(藻红蛋白)。实施例3
–
在用vee vlp转导的靶细胞中多种蛋白的表达
[0066]
为了在小鼠动物系统中测试vlp,将4t1
‑
luc2细胞(高度攻击性和转移性的乳腺癌细胞)植入10只小鼠的乳房脂肪垫中。肿瘤在几天内就可见,且在一周内就变得明显和可触知的(5
‑
7mm)。将3只小鼠用表达惰性蛋白(gfp)的vlp肿瘤内注射,2只小鼠用表达人hla
‑
dr1/cd80(异基因)的vlp注射,和5只小鼠保持未注射作为对照。
[0067]
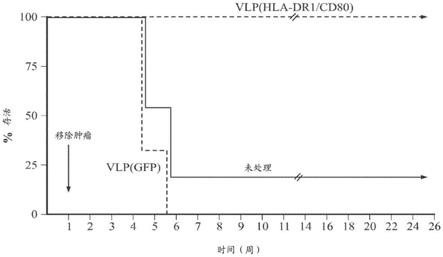
1周后,从所有小鼠手术移除肿瘤并在数周内追踪肿瘤的再生长和转移。结果(图5)显示5只未注射小鼠(未处理对照)中有4只由于癌症在肺、乳腺和肝中的再生长和转移在4
‑
6周内死亡。所有3只注射vlp/gfp(非特异性蛋白对照)的小鼠也由于癌症在肺、乳腺和肝中的再生长和转移在4
‑
6周内死亡。然而,2只用vlp/hla
‑
dr1/cd80处理的小鼠保持存活达超过25周,且没有肿瘤形成的迹象。
[0068]
为了显示小鼠确实形成针对肿瘤细胞的免疫,将从之前实验幸存下来的小鼠再次用4t1
‑
luc2细胞攻击(challenge)。还纳入了4只新的对照小鼠。在攻击实验中,将所有小鼠用10,000个4t1
‑
luc2细胞静脉内注射,并监测肿瘤生长和进展。如果小鼠形成了免疫,则幸存下来的小鼠将不形成肿瘤且不会发现转移。如果没有免疫,则小鼠将死于转移性癌症。4只对照动物在静脉内注射4t1
‑
luc2细胞的2周内死于转移性癌症,而用治疗性vlp处理的小鼠在攻击超过4周后幸存下来(图5)。这表明用hla/cd80处理的动物已获得了对肿瘤细胞的免疫力。
[0069]
上文描述的多个特征和方法可以彼此独立地使用,或以多种方式组合使用。所有可能的组合和子组合意图落入本公开的范围内。另外,在一些执行方式中可以省去某些方法或过程块。本文描述的方法和过程也不限于任何具体的顺序,且与其相关的块或状态可以以适宜的其他顺序实施。例如,所描述的块或状态可以以不同于具体描述的次序进行,或者可将多个块或状态组合在单个块或状态中。示例块或状态可以连续、并行或以一些其他方式实施。可将块或状态从所公开的示例实施方案中添加或移除。本文描述的示例系统和组分可以不同于描述的方式配置。例如,与所公开的示例实施方案相比,可以添加、移除要素或将其重排。
[0070]
除非另外具体说明,或者在使用的上下文中另外理解,本文中使用的条件语言如“能”、“可能”、“可以”、“例如”等等,一般意图传达的意思是,某些实施方案包括而其他实施方案不包括某些特征、要素和/或步骤。因此,这类条件用语一般不意图指示特征、要素和/或步骤是在任何方式中对于一个或多个实施方案而言必需的,或一个或多个实施方案必要地包括逻辑来决定(有或没有作者输入或提示)是否包括这些特征、要素和/或步骤或者其要在任何具体实施方案中实施。术语“包含”、“包括”、“具有”等是同义的且以开放式方式包涵性使用,且不排除另外的要素、特征、行为、操作等等。还有,术语“或”以其包涵性意义使用(而不是以其排除性意义),因此在例如连接一组要素使用时,术语“或”意为列表中的一个、一些或所有要素。
[0071]
虽然已描述了某些示例实施方案,但这些实施方案仅通过举例呈现,且不意图限制本文公开的本发明的范围。因此,前述说明书中没有一处意图按时任何具体的特征、性质、步骤、模块或块是必要的或必不可少的。事实上,本文中描述的新方法和系统可以体现为多种其他形式;此外,可以在本文所述方法和系统的形式中进行多种省略、取代和变化,而不背离本文公开的发明的精神。所附权利要求及其等同体意图涵盖这类形式或修改,如
会落入本文公开的本发明的范围和精神内的。表1:seq id no:1
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1