一种大黄素对感染嗜水气单胞菌的团头鲂生理指标的影响研究的制作方法
al.,1993),导致团头鲂疾病大规模爆发,造成鱼体较高的死亡率。前期试验证明,大黄素可作为一种免疫增强剂促进团头鲂的生长、非特异性免疫及抗嗜水气单胞菌能力等,但大黄素对感染嗜水气单胞菌的团头鲂抗菌能力的影响却鲜有研究。
6.鉴于此,本发明申请探讨不同添加量的大黄素对团头鲂抗嗜水气单胞菌感染的初步研究,明确大黄素的添加量与对团头鲂抗感染能力之间的关系,揭示团头鲂各组织气单胞菌属总菌数及各免疫指标和抗氧化能力随大黄素添加量及采样时间的变化规律,阐明大黄素在团头鲂体内的作用原理,同时从鱼体生理指标及肝脏相关抗氧化基因表达上,探讨大黄素对感染嗜水气单胞菌的团头鲂生理代谢及肝脏修复的影响,以期为生产实践中预防性药物添加剂的使用提供理论依据和技术支持。
技术实现要素:
7.本发明的目的就在于为了解决上述问题而提供一种大黄素对感染嗜水气单胞菌的团头鲂生理指标的影响研究。
8.本发明通过以下技术方案来实现上述目的,一种大黄素对感染嗜水气单胞菌的团头鲂生理指标的影响研究,包括腹腔注射嗜水气单胞菌后大黄素对团头鲂各组织中气单胞菌属总菌数的影响研究、腹腔注射嗜水气单胞菌后大黄素对团头鲂免疫指标的影响研究、腹腔注射嗜水气单胞菌后大黄素对团头鲂肝脏组织结构的影响研究、腹腔注射嗜水气单胞菌后大黄素对团头鲂抗氧化指标的影响研究以及腹腔注射嗜水气单胞菌后大黄素对团头鲂cu/zn
‑
sod、cat、gpx、 tnf
‑
α及il
‑
1βmrna相对表达量的影响研究,具体包括以下步骤:
9.a试验设计
10.a
‑
1嗜水气单胞菌菌液制备及活体试验设计
11.无菌条件下,取
‑
80℃保存的嗜水气单胞菌菌种划线接种于lb固体平板培养基上,28℃恒温培养箱中培养20h后,挑取单菌落接种于5mllb液体培养基中, 180rpm/min、28℃恒温摇床过夜培养,用无菌lb液体培养基将菌液按10倍系列浓度稀释,选择1
×
106cfu/ml的菌悬液进行活体试验;
12.对团头鲂分别进行腹腔注射梯度为1
×
106、1
×
107、1
×
108、1
×
109和 1
×
10
10
cfu/ml的嗜水气单胞菌,经过7天的观察来确定半致死浓度lc
50
和致病但不死亡的细菌浓度,结果显示lc
50
为5
×
106cfu/ml,使团头鲂致病但不死亡的细菌浓度为1
×
106cfu/ml;
13.a
‑
2养殖试验设计
14.本研究采用单因子试验设计,基础饲料中分别添加0、30、100及150mg/kg 大黄素以此制备4种等氮、等能饲料,饲料以鱼粉、豆粕、菜粕和棉粕为蛋白源,以豆油为脂肪源,以米糠和次粉为糖源,选择体质健康、规格一致、初体重为50.4
±
2.35g的团头鲂随机分成5组,每组3个重复,每个重复25尾鱼;
15.a
‑
3人工感染致病与抗感染试验设计
16.试验分为5组,每组3个平行,每个平行25尾鱼,第一组为阴性对照组,按每100g鱼重腹腔注射生理盐水1.0ml的比例为鱼体注射,饲喂无添加大黄素饲料即基础饲料;第二组为阳性对照,按相同比例腹腔注射1
×
106cfu/ml的菌悬液,注射菌液12h后,团头鲂出现明显的活力弱、不进食等病症,向鱼体饲喂无添加大黄素饲料即基础饲料;第三组为30mg/kg大黄素组,按相同比例腹腔注射1
×
106cfu/ml的菌悬液,养殖模式的处理同第二组,向鱼体
饲喂添加30mg/ kg大黄素饲料;第四组为100mg/kg大黄素组,按相同比例腹腔注射1
×
106cfu/ ml的菌悬液,养殖模式的处理同第二组,饲喂添加100mg/kg大黄素饲料;第五组为150mg/kg大黄素组,按相同比例腹腔注射1
×
106cfu/ml的菌悬液,养殖模式的处理同第二组,饲喂添加150mg/kg大黄素饲料;
17.观察团头鲂并记录其活动、摄食及死亡情况,并在试验开始时,以及投喂饲料第1、4、7、14d,从每缸抽取3尾团头鲂进行采样并进行细菌计数及血浆中相关指标测定;
18.b养殖管理
19.养殖期间每天定时投喂4次,投喂时间分别为08:30、11:00、13:30和16:00,每次投喂持续30min以上,达饱食状态,每天吸污一次以确保水质,饲养期间温度为26
±
1℃,ph为7.2~7.8,溶解氧>6mg/l,氨氮<0.05mg/l,硫化氢 <0.01mg/l;
20.c采样与处理
21.采样前禁食24小时,每缸随机取3尾鱼,用浓度为100mg/l的ms
‑
222作快速深度麻醉,尾静脉采血1"1.2ml;将血样收集在抗凝管中,一部分用于呼吸爆发测定及血细胞计数,另一部分以4℃、2000
×
g离心10min制备血浆,
–
80℃冻存备用;同时迅速分离肝脏、肾脏及肠道,并称重,肠道用2.5%的戊二醛固定;另外,每条鱼采集肝脏,保存于液氮后存储在
‑
80℃冰箱以便进一步分析;
22.d测定的指标与方法
23.d
‑
1团头鲂血液及各组织气单胞菌属细菌计数
24.在无菌条件下,取团头鲂血液、肾脏及肝脏组织,肾脏及肝脏组织常温下解冻并称重,按照1:9的比例加入无菌生理盐水,并用10ml的灭菌后的玻璃匀浆器将其均匀匀浆,将血液稀释液及匀浆后的肝脏和肾脏的菌悬液作为原液,将血液、肝脏及肾脏的菌悬液作为原液,采用10倍稀释法将样品分别稀释10
‑1、 10
‑2、10
‑3和10
‑4共4个梯度,分别取原液及各稀释度样品0.1ml涂布于rs选择性培养基平板上,平板均置于恒温培养箱中过夜培养20h,随后计数;
25.d
‑
2白细胞计数及呼吸爆发活力
26.白细胞(wbc)计数在全自动血细胞分析仪上测定,呼吸爆发活力采用氯化硝基四氮唑蓝(nbt)的方法进行测定;
27.d
‑
3血浆指标测定
28.包括sod活性、mda含量、tnf
‑
α(肿瘤坏死因子
‑
α)和il
‑
1(白细胞介素
‑ꢀ
1)含量的测定,其中sod活力的测定根据(granelli et al.,1995)报道,由黄嘌呤氧化产生的活性氧阴离子的清除率来计算,mda含量的测定根据 (drape et al.,1993)报道,使用硫代巴比妥酸比色法测定,tnf
‑
α和il
‑
1的含量是采用双抗体夹心法来测定;
29.d
‑
4补体替代途径(ach
50
)活力
30.ach
50
的测定方法根据yano等(1988)和matsuyama等(1988)的描述进行修改:
31.取等量的阿氏液和绵羊血混合后保存于4℃,并将阿氏液和绵羊血混合液在400
×
g下离心10min,将离心后的沉淀即绵羊血红细胞使用egta
‑
mg
‑
gelatin veronol buffer洗涤两次,在400
×
g下离心10min,并去上清后用生理盐水调整细胞浓度在2.3
×
109cfu/ml;%
32.将800μl使用egta
‑
mg
‑
gvb以10倍稀释法连续稀释成不同浓度的血浆放置于测定
ep管中,加入400μl的绵羊血红细胞悬液后孵育60min,对照组使用完全溶血的绵羊血红细胞,即800μl蒸馏水和400μl的绵羊血红细胞混合液,空白组为800μlegta
‑
mg
‑
gvb和400μl绵羊血红细胞混合液,在400
×
g下离心 10min,y值(百分溶血率)由405nm处上清的光密度计算,结果由做y/(1
‑
y) 和x(血浆量)的对数图得出,ach
50
活力(u/ml)由图中50%溶血所需的血浆量的倒数决定;
33.d
‑
5肝脏组织切片制作
34.养殖试验结束后,每个网箱中随机取3尾鱼麻醉,在冰盘上解剖取出肝脏,放入预先配制好的波恩氏固定液中进行组织固定,然后按照操作规范对固定好的肝脏组织进行水洗、脱水、透明、浸蜡、包埋和切片,蜡片制作完成后,将其附贴于用蛋白甘油处理过的载玻片上进行he染色,然后用中性树胶封片,封片结束后,将组织切片置于光学显微镜下观察;
35.d
‑
6血液生理指标测定
36.血糖含量(glu)用葡萄糖氧化酶
‑
过氧化物酶终点比色法,谷丙转氨酶 (alt)、谷草转氨酶(ast)、总蛋白含量(tp)、碱性磷酸酶(akp)、甘油三酯(tg)采用比色法,在全自动生化分析仪上测定;三碘甲腺原氨酸 (t3)、甲状腺素(t4)、皮质醇(cor)采用化学发光免疫竞争法(ria) 进行测定;
37.d
‑
7肝脏铜锌超氧化物歧化酶(cu/zn
‑
sod)、过氧化氢酶(cat)、谷胱甘肽过氧化物酶(gpx)、肿瘤坏死因子
‑
α(tnf
‑
α)及白细胞介素
‑
1β(il
‑ꢀ
1β)mrna测定
38.d
‑7‑
1引物设计及合成
39.根据团头鲂cu/zn
‑
sod全长序列、cat全长序列、gpx全长序列、tnf
‑
α全长序列、il
‑
1β全长序列、持家基因β
‑
actin(genebank accession no. ay170122.2)基因全长序列,利用premier 5.0引物设计软件设计特异性引物,具体如下:
[0040][0041]
d
‑7‑
2总rna提取
[0042]
取液氮中保存的团头鲂肝脏样品50~100mg,放入含有1mlrnaiso plus的离心管中,之后按照rnaiso plus试剂盒中说明书操作,提取总rna,试样品od
260
/ od
280
保持在1.8
‑
2.0;
[0043]
d
‑7‑
3 cdna制备
[0044]
按照primescript
tm rt reagent kit with gdna eraser试剂盒说明方法除去总 rna中的dna,并以50ng/μl的终浓度逆转录合成cdna,并
‑
20℃保存备用,取多个样品等量cdna混合,10倍梯度稀释共5个浓度,用以制作标准曲线;
[0045]
d
‑7‑
4实时荧光定量pcr反应
[0046]
cu/zn
‑
sod、cat及gpx mrna相对量采用primix ex taqtm ii (tlirnaseh plus)kit试剂盒,在abi prism 7500real
‑
time pcr system仪器进行检测和分析,real time pcr反应体系为20μl,qrt
‑
pcr反应程序:第一阶段(50℃2min,95℃3min),第二阶段(95℃15s,60℃1min,40次循环),第三阶段溶解曲线分析(95℃15s,60℃1min,95℃30s,60℃ 15s);
[0047]
d
‑7‑
5数据分析
[0048]
数据分析根据(唐永凯和贾永义,2008)报道,cu/zn
‑
sod、cat及gpx mrna水平计算以团头鲂β
‑
actin为内参,对得到的各样品ct值进行均一化处理,应用各自的标准曲线方法确定其相对水平;
[0049]
e数据处理
[0050]
试验数据用spss 17.0软件进行单因素方差分析,数据显著差异时,采用 duncan检验法进行多重比较,差异显著时p<0.05&试验结果以平均值
±
标准误 (mean
±
se)表示。
[0051]
优选地,所述嗜水气单胞菌菌种(wj2011bj44)由本实验室分离鉴定得到,
‑
80℃保存于15%的甘油中,所述试验设计中采用的大黄素纯度>99%,由西安飞达生物技术有限公司提供,所述lb固体平板培养基中各组分比例为酵母提取物:蛋白胨:氯化钠为1:2:1。
[0052]
优选地,所述养殖试验所用的团头鲂由中国水产科学研究院淡水渔业研究中心南泉渔场提供,养殖试验在室内循环养殖系统中进行,所用的循环水养殖桶规格为φ820
×
700mm,养殖试验开始前一周用沉性颗粒饲料驯化团头鲂,驯化用沉性颗粒饲料购自通威饲料公司。
[0053]
优选地,所述白细胞(wbc)计数中所用的全自动血细胞分析仪型号为迈瑞bc
‑
5300vet,所述白细胞(wbc)计数中所用试剂由深圳迈瑞生物医疗电子股份有限公司提供。
[0054]
优选地,所述呼吸爆发活力根据secombes等(1990)、song等(1994)和 ai等(2007)的描述进行修改,取100μl采样时抽取的抗凝新鲜血液,并向其中加入100μl0.2%nbt,37℃下孵育30min,取15μl反应液,加入300μln,n
‑ꢀ
二甲基甲酰胺(dmf),充分混匀,在2000r/min、4℃条件下离心5min,取 200μl上清液于540nm下读取吸光值,以200μldmf为空白对照,呼吸爆发活性表示为od
540nm
。
[0055]
优选地,所述egta
‑
mg
‑
gelatin veronol buffer、nbt均购自sigma中国公司。
[0056]
优选地,所述sod活力和mda含量测定中使用的试剂盒均购自南京建成生物工程研究所;所述tnf
‑
α和il
‑
1含量测定中使用的试剂盒分别为tnf
‑
αelisa检测试剂盒和il
‑
1 elisa检测试剂盒,检测试剂盒均由ibl(德国)公司提供,试验检测波长为450nm。
[0057]
优选地,所述肝脏组织切片制作过程中使用的波恩氏固定液配制比例为: 1.22%的饱和苦味酸75ml,40%福尔马林溶液25ml,冰醋酸5ml;所用切片机型号为leica rm
‑
2255,德国;所用的光学显微镜型号为nikon ds
‑
fi1。
[0058]
优选地,所述glu、alt、ast、tp、akp、甘油三酯(tg)测定中所用试剂盒购自复旦张江生物医疗股份有限公司,测定过程中使用的全自动生化分析仪型号为迈瑞bs
‑
400;三碘甲腺原氨酸(t3)、甲状腺素(t4)、cor测定过程中采用的试剂盒购自深圳新产业生物医学工程有限公司。
[0059]
优选地,所述肝脏cu/zn
‑
sod、cat、gpx、tnf
‑
α及il
‑
1βmrna测定中所需的团头鲂cu/zn
‑
sod、cat、gpx、tnf
‑
α及il
‑
1β全长序列从中国水产科学研究院淡水渔业研究中心鱼类病害与营养饲料研究室提供的团头鲂基因组中筛选所得,所有引物均由上海捷瑞生物工程有限公司合成,测定过程中使用的 rnaiso plus试剂盒、primescript
tm rt reagent kit with gdna eraser试剂盒以及primix ex taqtm ii(tlirnaseh plus)kit试剂盒均购自大连takara公司。
[0060]
本发明的有益效果是:
[0061]
(1)本发明研究结果显示,日粮中添加100mg/kg大黄素可通过提高机体吞噬功能,促进细胞因子的分泌等,从而杀伤体内致病菌,提高团头鲂抗嗜水气单胞菌感染能力,进而恢复机体免疫功能;
[0062]
(2)本发明研究结果显示,日粮中添加100mg/kg大黄素可通过影响机体血液ast和alt活力、皮质醇、t3和t4等激素水平以及血糖含量等来影响机体生理代谢,从而使受感染团
头鲂机体生理反应尽快恢复至正常水平;
[0063]
(3)本发明研究结果显示,日粮中添加100mg/kg大黄素可对受损肝脏进行修复,同时通过影响肝脏相关抗氧化基因表达量来维持机体氧化与抗氧化动态平衡。
附图说明
[0064]
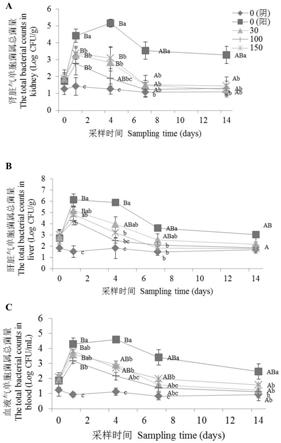
图1a为本发明被嗜水气单胞菌感染的团头鲂肾脏组织中气单胞菌属总菌数受大黄素添加量及投喂时间影响图。
[0065]
图1b为本发明被嗜水气单胞菌感染的团头鲂血液中气单胞菌属总菌数受大黄素添加量及投喂时间影响图。
[0066]
图1c为本发明被嗜水气单胞菌感染的团头鲂肝脏组织中气单胞菌属总菌数受大黄素添加量及投喂时间影响图图。
[0067]
图2a为本发明被嗜水气单胞菌感染的团头鲂呼吸爆发活力受大黄素添加量及投喂时间影响图。
[0068]
图2b为本发明被嗜水气单胞菌感染的团头鲂tnf
‑
α含量受大黄素添加量及投喂时间影响图。
[0069]
图2c为本发明被嗜水气单胞菌感染的团头鲂il
‑
1β含量受大黄素添加量及投喂时间影响图。
[0070]
图3a为本发明被嗜水气单胞菌感染的团头鲂白细胞数受投喂饲料中大黄素添加量及投喂时间影响图。
[0071]
图3b为本发明被嗜水气单胞菌感染的团头鲂补体替代途径活力ach
50
受投喂饲料中大黄素添加量及投喂时间影响图。
[0072]
图4a为本发明被嗜水气单胞菌感染的团头鲂血浆sod活力受投喂饲料中大黄素添加量及投喂时间影响图。
[0073]
图4b为本发明被嗜水气单胞菌感染的团头鲂血浆mda含量受投喂饲料中大黄素添加量及投喂时间影响图。
[0074]
图5为本发明被嗜水气单胞菌感染的团头鲂在试验开始1天时大黄素含量对肝脏组织的影响图。
[0075]
图6为本发明被嗜水气单胞菌感染的团头鲂在试验第7天时大黄素含量对肝脏组织的影响图。
[0076]
图7a为本发明被嗜水气单胞菌感染的团头鲂血浆alt含量受投喂饲料中大黄素添加量及投喂时间影响图。
[0077]
图7b为本发明被嗜水气单胞菌感染的团头鲂血浆ast含量受投喂饲料中大黄素添加量及投喂时间影响图。
[0078]
图7c为本发明被嗜水气单胞菌感染的团头鲂血浆tp含量受投喂饲料中大黄素添加量及投喂时间影响图。
[0079]
图8a为本发明被嗜水气单胞菌感染的团头鲂血浆cor含量受投喂饲料中大黄素添加量及投喂时间影响图。
[0080]
图8b为本发明被嗜水气单胞菌感染的团头鲂血浆t3含量受投喂饲料中大黄素添加量及投喂时间影响图。
[0081]
图8c为本发明被嗜水气单胞菌感染的团头鲂血浆t4含量受投喂饲料中大黄素添加量及投喂时间影响图。
[0082]
图9a为本发明被嗜水气单胞菌感染的团头鲂血浆akp活力含量受投喂饲料中大黄素添加量及投喂时间影响图。
[0083]
图9b为本发明被嗜水气单胞菌感染的团头鲂血浆glu含量受投喂饲料中大黄素添加量及投喂时间影响图。
[0084]
图9c为本发明被嗜水气单胞菌感染的团头鲂血浆tg含量受投喂饲料中大黄素添加量及投喂时间影响图。
[0085]
图10a为本发明被嗜水气单胞菌感染的团头鲂肝脏gpxmrna表达量受投喂饲料中大黄素添加量及投喂时间影响图。
[0086]
图10b为本发明被嗜水气单胞菌感染的团头鲂肝脏cu/zn
‑
sodmrna表达量受投喂饲料中大黄素添加量及投喂时间影响图。
[0087]
图10c为本发明被嗜水气单胞菌感染的团头鲂肝脏catmrna表达量受投喂饲料中大黄素添加量及投喂时间影响图
[0088]
图11a为本发明被嗜水气单胞菌感染的团头鲂肝脏tnf
‑
αmrna相对表达量受投喂饲料中大黄素添加量及投喂时间影响图。
[0089]
图11b为本发明被嗜水气单胞菌感染的团头鲂肝脏il
‑
1βmrna相对表达量受投喂饲料中大黄素添加量及投喂时间影响图。
具体实施方式
[0090]
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0091]
本试验数据用spss 17.0软件进行单因素方差分析,数据显著差异时,采用 duncan检验法进行多重比较,差异显著时p<0.05&试验结果以平均值
±
标准误 (mean
±
se)表示。
[0092]
一种大黄素对感染嗜水气单胞菌的团头鲂生理指标的影响研究,包括腹腔注射嗜水气单胞菌后大黄素对团头鲂各组织中气单胞菌属总菌数的影响研究、腹腔注射嗜水气单胞菌后大黄素对团头鲂免疫指标的影响研究、腹腔注射嗜水气单胞菌后大黄素对团头鲂肝脏组织结构的影响研究、腹腔注射嗜水气单胞菌后大黄素对团头鲂抗氧化指标的影响研究以及腹腔注射嗜水气单胞菌后大黄素对团头鲂cu/zn
‑
sod、cat、gpx、tnf
‑
α及il
‑
1βmrna相对表达量的影响研究,具体包括以下步骤:
[0093]
a试验设计
[0094]
a
‑
1嗜水气单胞菌菌液制备及活体试验设计
[0095]
无菌条件下,取
‑
80℃保存的嗜水气单胞菌菌种划线接种于lb固体平板培养基上,28℃恒温培养箱中培养20h后,挑取单菌落接种于5mllb液体培养基中, 180rpm/min、28℃恒温摇床过夜培养,用无菌lb液体培养基将菌液按10倍系列浓度稀释,选择1
×
106cfu/ml的菌悬液进行活体试验,其中lb培养基配方详见表1;
[0096]
对团头鲂分别进行腹腔注射梯度为1
×
106、1
×
107、1
×
108、1
×
109和 1
×
10
10
cfu/ml的嗜水气单胞菌,经过7天的观察来确定半致死浓度lc
50
和致病但不死亡的细菌浓度,结果显示lc
50
为5
×
106cfu/ml,使团头鲂致病但不死亡的细菌浓度为1
×
106cfu/ml;
[0097]
表1 lb培养基成分
[0098][0099]
注:*成分溶于1000ml蒸馏水中,固体培养基包含20%琼脂,培养基的ph值为7.5
±
0.1。
[0100]
分装后120℃高压灭菌20min。
[0101]
上述嗜水气单胞菌菌种(wj2011bj44)由本实验室分离鉴定得到,
‑
80℃保存于15%的甘油中。
[0102]
a
‑
2养殖试验设计
[0103]
本研究采用单因子试验设计,基础饲料中分别添加0、30、100及150mg/kg 大黄素以此制备4种等氮、等能饲料,饲料以鱼粉、豆粕、菜粕和棉粕为蛋白源,以豆油为脂肪源,以米糠和次粉为糖源,选择体质健康、规格一致、初体重为50.4
±
2.35g的团头鲂随机分成5组,每组3个重复,每个重复25尾鱼;
[0104]
上述试验设计中采用的大黄素纯度>99%,由西安飞达生物技术有限公司提供;基础饲料的配方和营养水平如表2所示。
[0105]
上述养殖试验所用的团头鲂由中国水产科学研究院淡水渔业研究中心南泉渔场提供,养殖试验在室内循环养殖系统中进行,所用的循环水养殖桶规格为φ820
×
700mm,养殖试验开始前一周用沉性颗粒饲料驯化团头鲂,驯化用沉性颗粒饲料购自通威饲料公司。
[0106]
表2基础饲料配方与营养水平
[0107]
[0108][0109]
注:a、维生素预混物(iu or mg/kg饲料):维生素a,900000iu;维生素d,200000iu;维生素e,4500mg;维生素 k3,220mg;维生素b1,320mg;维生素b2,1090mg;维生素b5,2000mg;维生素b6,500mg;维生素b12,1.6mg; 维生素c,5000mg;泛酸,1000mg;叶酸,165mg;胆碱,60000mg;
[0110]
b、矿物质预混物(g/kg饲料):cuso4·
5h2o,2.0g;feso4·
7h2o,25g;znso4·
7h2o,22g;mnso4·
4h2o,7g; na2seo3,0.04g;ki,0.026g;cocl2·
6h2o,0.1g;
[0111]
c、总能按蛋白质16.7ki/g、脂肪37.7kj/g、碳水化合物16.7kj/g计算,其他指标为实测值。
[0112]
a
‑
3人工感染致病与抗感染试验设计
[0113]
试验分为5组,每组3个平行,每个平行25尾鱼,第一组为阴性对照组,按每100g鱼重腹腔注射生理盐水1.0ml的比例为鱼体注射,饲喂无添加大黄素饲料即基础饲料;第二组为阳性对照,按相同比例腹腔注射1
×
106cfu/ml的菌悬液,注射菌液12h后,团头鲂出现明显的活力弱、不进食等病症,向鱼体饲喂无添加大黄素饲料即基础饲料;第三组为30mg/kg大黄素组,按相同比例腹腔注射1
×
106cfu/ml的菌悬液,养殖模式的处理同第二组,向鱼体饲喂添加30mg/ kg大黄素饲料;第四组为100mg/kg大黄素组,按相同比例腹腔注射1
×
106cfu/ ml的菌悬液,养殖模式的处理同第二组,饲喂添加100mg/kg大黄素饲料;第五组为150mg/kg大黄素组,按相同比例腹腔注射1
×
106cfu/ml的菌悬液,养殖模式的处理同第二组,饲喂添加150mg/kg大黄素饲料;
[0114]
观察团头鲂并记录其活动、摄食及死亡情况,并在试验开始时,以及投喂饲料第1、4、7、14d,从每缸抽取3尾团头鲂进行采样并进行细菌计数及血浆中相关指标测定;
[0115]
b养殖管理
[0116]
养殖期间每天定时投喂4次,投喂时间分别为08:30、11:00、13:30和16:00,每次投喂持续30min以上,达饱食状态,每天吸污一次以确保水质,饲养期间温度为26
±
1℃,ph为7.2~7.8,溶解氧>6mg/l,氨氮<0.05mg/l,硫化氢 <0.01mg/l;
[0117]
c采样与处理
[0118]
采样前禁食24小时,每缸随机取3尾鱼,用浓度为100mg/l的ms
‑
222作快速深度麻醉,尾静脉采血1"1.2ml;将血样收集在抗凝管中,一部分用于呼吸爆发测定及血细胞计数,另一部分以4℃、2000
×
g离心10min制备血浆,
–
80℃冻存备用;同时迅速分离肝脏、肾脏及肠道,并称重,肠道用2.5%的戊二醛固定;另外,每条鱼采集肝脏,保存于液氮后存储在
‑
80℃冰箱以便进一步分析。
[0119]
实施例1腹腔注射嗜水气单胞菌后大黄素对团头鲂各组织中气单胞菌属总菌数的影响研究
[0120]
1.1团头鲂血液及各组织气单胞菌属细菌计数
[0121]
在无菌条件下,取团头鲂血液、肾脏及肝脏组织,肾脏及肝脏组织常温下解冻并称重,按照1:9的比例加入无菌生理盐水,并用10ml的灭菌后的玻璃匀浆器将其均匀匀浆,将血液稀释液及匀浆后的肝脏和肾脏的菌悬液作为原液,将血液、肝脏及肾脏的菌悬液作为原液,采用10倍稀释法将样品分别稀释10
‑1、 10
‑2、10
‑3和10
‑4共4个梯度,分别取原液及各稀释度样品0.1ml涂布于rs选择性培养基平板上,平板均置于恒温培养箱中过夜培养20h,随后计数,rs选择性培养基配制方法见表3。
[0122]
表3 rs选择性培养基成分表
[0123][0124]
注:*rs培养基包含12.5g/l琼脂,成分均溶于1000ml蒸馏水中。培养基的ph值为7.0
±
0.1。分装后120℃高压灭菌20 min。
[0125]
1.2结果分析
[0126]
如图1a所示,被嗜水气单胞菌感染的团头鲂肾脏组织中气单胞菌属总菌数受大黄素添加量显著影响。结果显示,受嗜水气单胞菌感染的团头鲂在投喂饲料前肾脏气单胞菌属总菌数无显著差异,阴性对照组(未感染组)在团头鲂肾脏内气单胞菌属总菌数较稳定且数量较少。投喂1d时,与阴性对照组相比其它组的肾脏气单胞菌属总菌数均显著升高(p<0.05),且阳性对照组的肾脏气单胞菌属总菌数显著高于30、100及150mg/kg大黄素组(p<0.05);投喂4d时, 100mg/kg大黄素组与阴性对照组之间鱼体肾脏气单胞菌属总菌数差异不显著,但30及150mg/kg大黄素组的肾脏气单胞菌属总菌数显著高于阴性对照且显著低于阳性对照组(p<0.05);投喂7d时,各组鱼体肾脏内气单胞菌属总菌数均呈现下降趋势,30、100、150mg/kg大黄素组气单胞菌属总菌数显著低于阳性对照组(p<0.05),且与阴性对照组之间无显著差异;自投喂7d后各组肾脏气单胞菌属总菌数基本稳定。
[0127]
如图1b所示,阴性对照组的血液气单胞菌属总菌数变化较稳定且数量较少,阳性对照组团头鲂血液气单胞菌属总菌数变化较大,投喂饲料1d时数量达到104数量级以上,投喂4d时,数量达到105数量级且开始出现下降趋势;30、100、150mg/kg大黄素组团头鲂血液气单胞菌属总菌数均呈先升高后降低的趋势,投喂1d后数量达到最高,随后便出现下降趋势。投喂1d时,阴性对照组的血液气单胞菌属总菌数显著低于其它四组(p<0.05),且100mg/kg大黄素组的气单胞菌属总菌数显著低于阳性对照组(p<0.05);投喂4d时,阳性对照组的血液气单胞菌属总菌数显著高于其它四组(p<0.05),与阴性对照组相比, 30、150mg/kg大黄素组的气单胞菌属细菌量显著较高,而100mg/kg组与之无显著差异。自投喂7d后,各组鱼体血液气单胞菌属总菌数变化均基本稳定。
[0128]
如图1c所示,阴性对照组(未感染组)团头鲂肝脏气单胞菌属总菌数变化较稳定且数量较少,而其它四组均呈先上升后下降趋势;在团头鲂感染嗜水气单胞菌初期但未投喂饲料时,阴性对照组的肝脏气单胞菌属总菌数低于但不显著低于其它四组(p>0.05);投喂饲料1d时,其它四组肝脏气单胞菌属总菌数较阴性对照组显著升高(p<0.05),100mg/kg大黄素组气单胞菌属总菌数显著低于阳性对照组(p<0.05),其他各组之间差异不显著;投喂4d时,与阳性对照组相比,100及150mg/kg大黄素组的肝脏气单胞菌属总菌数显著降低 (p<0.05),30mg/kg大黄素组的气单胞菌属总菌数低于但不显著低于阳性对照组(p>0.05);投喂7d时,100、150mg/kg大黄素组的肝脏气单胞菌属总菌数仍显著低于阳性对照组(p<0.05);自投喂7d后,各组肝脏气单胞菌属总菌数基本趋于稳定,到投喂14d时,各组之间差异已不显著。
[0129]
综上所述,建议在团头鲂嗜水气单胞菌病症多发季节,采用投喂添加100 mg/kg大黄素的饲料来达到抗嗜水气单胞菌感染效果。
[0130]
实施例2腹腔注射嗜水气单胞菌后大黄素对团头鲂免疫指标的影响研究
[0131]
2.1.1白细胞计数及呼吸爆发活力测定
[0132]
取50μl采样时抽取的抗凝新鲜血液用于白细胞(wbc)计数,白细胞计数在全自动血细胞分析仪(迈瑞bc
‑
5300vet)上测定,所用试剂由深圳迈瑞生物医疗电子股份有限公司提供。
[0133]
呼吸爆发活力根据secombes等(1990)、song等(1994)和ai等(2007) 的描述进行修改,采用nbt的方法进行测定,取100μl采样时抽取的抗凝新鲜血液,并向其中加入100μ
l0.2%nbt(nitroblue tetrazolium,sigma),37℃下孵育30min,取15μl反应液,加入300μln,n
‑
二甲基甲酰胺(dmf),充分混匀,在2000r/min,4℃条件下离心5min,取200μl上清液于540nm下读取吸光值,以200μldmf为空白对照,呼吸爆发活性表示为od
540nm
。
[0134]
2.1.2血浆tnf
‑
α和il
‑
1含量测定
[0135]
tnf
‑
α(肿瘤坏死因子
‑
α)和il
‑
1(白细胞介素
‑
1)的含量是采用双抗体夹心法来测定,所用试剂盒分别为tnf
‑
αelisa检测试剂盒和il
‑
1 elisa检测试剂盒,均由ibl(德国)公司提供,试验检测波长为450nm。
[0136]
2.1.3补体替代途径(ach
50
)活力测定
[0137]
ach
50
的测定方法根据yano等(1988)和matsuyama等(1988)的描述进行修改:
[0138]
ach
50
的测定方法根据yano等(1988)和matsuyama等(1988)的描述进行修改:
[0139]
取等量的阿氏液和绵羊血混合后保存于4℃,并将阿氏液和绵羊血混合液在 400
×
g下离心10min,将离心后的沉淀即绵羊血红细胞使用egta
‑
mg
‑
gelatin veronol buffer洗涤两次,在400
×
g下离心10min,并去上清后用生理盐水调整细胞浓度在2.3
×
109cfu/ml;%
[0140]
将800μl使用egta
‑
mg
‑
gvb以10倍稀释法连续稀释成不同浓度的血浆放置于测定ep管中,加入400μl的绵羊血红细胞悬液后孵育60min,对照组使用完全溶血的绵羊血红细胞,即800μl蒸馏水和400μl的绵羊血红细胞混合液,空白组为800μlegta
‑
mg
‑
gvb和400μl绵羊血红细胞混合液,在400
×
g下离心 10min,y值(百分溶血率)由405nm处上清的光密度计算,结果由做y/(1
‑
y) 和x(血浆量)的对数图得出,ach
50
活力(u/ml)由图中50%溶血所需的血浆量的倒数决定;
[0141]
2.2结果分析
[0142]
如图2a所示,阴性对照组团头鲂呼吸爆发活力的变化较稳定,而其它四组的呼吸爆发活力均受投喂饲料及投喂时间的影响,呈先上升后下降的趋势。试验开始时,阴性对照组的呼吸爆发活力显著低于其它四组(p<0.05);投喂饲料1d时,阴性对照组的呼吸爆发活力仍显著低于其它四组(p<0.05),而30、 100、150mg/kg大黄素组的呼吸爆发活力显著高于阳性对照组(p<0.05);投喂4d时,阳性对照组、30、100、150mg/kg大黄素组四组的呼吸爆发活力较投喂1d时均降低,且阴性对照组呼吸爆发活力仍显著低于其它四组(p<0.05),此外,100mg/kg大黄素组的呼吸爆发活力显著低于阳性对照组及30、100mg/kg 大黄素组(p<0.05);投喂7d时,较投喂4d时各试验组均呈现下降趋势;投喂 14d时,100mg/kg大黄素组的呼吸爆发活力显著低于30mg/kg组及阳性对照组 (p<0.05),而其它各组之间无显著差异。
[0143]
如图2b所示,在14天的试验周期内,被嗜水气单胞菌感染的团头鲂血浆 tnf
‑
α含量受大黄素添加量显著影响,呈先上升后下降的变化趋势。试验开始时,阳性对照组团头鲂的tnf
‑
α含量100、150mg/kg大黄素组及阳性对照组的 tnf
‑
α含量显著高于阴性对照组(p<0.05),100mg/kg组的tnf
‑
α含量显著高于阳性对照组(p<0.05);投喂4d时,各试验组的tnf
‑
α含量均比投喂1d时显著降低,30、150大黄素组及阳性对照组tnf
‑
α含量仍显著高于阴性对照组 (p<0.05),而100mg/kg组与阴性对照组相比无显著差异;投喂7d时,阳性对照组的tnf
‑
α含量仍显著高于阴性对照组,但各组之间无显著差异;自投喂7d 始tnf
‑
α含量趋于稳定。
[0144]
如图2c所示,在14天的试验周期内,各组血浆il
‑
1β含量的变化趋势与tnf
‑ꢀ
α含量
基本相同。试验开始时,阴性对照组的il
‑
1β含量显著低于其它四组 (p<0.05);投喂饲料1d时,除阴性对照组外各试验组的il
‑
1β含量均比试验开始时显著增高(p<0.05),且各试验组含量均高于阴性对照组;与前一次采样相比,投喂4d时的各试验组il
‑
1β含量显著降低(p<0.05),与此同时,阳性对照组的il
‑
1β含量仍高于阴性对照组,其他各组无显著差异;投喂7d时,阳性对照组il
‑
1β含量仍显著高于阴性对照组,其它各组之间无显著差异。此后,il
‑ꢀ
1β含量变化趋向稳定基本不变。
[0145]
如图3a所示,被嗜水气单胞菌感染的团头鲂白细胞数受投喂饲料中大黄素添加量及投喂时间显著影响,呈先上升后下降的趋势。试验开始时,与阴性对照组相比,其它四组的团头鲂白细胞数显著较高(p<0.05);投喂饲料1d时,各试验组被感染的团头鲂白细胞数均比试验开始时有所升高,但100mg/kg大黄素组的白细胞数显著高于阳性对照组(p<0.05),其余各组无显著差异;投喂 4d时,各试验组团头鲂的白细胞数较上次采样有所降低,但阳性对照组白细胞数仍显著高于阴性对照组(p<0.05);投喂7d时及以后,100mg/kg组的白细胞数降低至阴性对照组组水平且显著低于阳性对照组(p<0.05),其他各组无显著差异。
[0146]
如图3b所示,阴性对照组的团头鲂补体替代途径活力ach
50
不受投喂饲料及投喂时间影响,变化基本稳定。但被嗜水气单胞菌感染的团头鲂补体替代途径活力ach
50
受投喂饲料中大黄素添加量及投喂时间显著影响。试验开始时,阳性对照组及30、100、150mg/kg大黄素组的ach
50
活力显著低于阴性对照组 (p<0.05),但四组之间无显著差异;投喂饲料1d时,各试验组ach
50
活力较试验开始时有所降低,其中阳性对照组ach
50
活力显著低于阴性对照组 (p<0.05),其它各组之间无显著差异;投喂4d时,30、100、150mg/kg大黄素均可使受感染的团头鲂ach
50
活力有所上升,然阳性对照组中其活力仍显著低于阴性对照组及100mg/kg大黄素组(p<0.05);投喂7d时,30、100、150mg/ kg组团头鲂ach
50
活力与阴性对照组无显著差异,然阳性对照组仍显著低于30、 100mg/kg大黄素组(p<0.05);自投喂7d后,除阳性对照组外各组ach
50
活力均保持稳定状态,到投喂14d时,各组之间ach
50
活力差异均不显著。
[0147]
上述结果表明,在一定程度上添加100mg/kg大黄素比添加30、150mg/kg能更快的降低机体炎症,有利于提高团头鲂抗嗜水气单胞菌感染能力;此外,在上述实施例中,团头鲂ach
50
活力与白细胞数、tnf
‑
α含量等呈相反趋势,说明大黄素激活了团头鲂体内杀菌免疫应答机制,如呼吸爆发活力及一些体液或细胞免疫因子,从而使机体启动免疫防御系统,使机体最终达到正常状态。
[0148]
实施例3腹腔注射嗜水气单胞菌后大黄素对团头鲂抗氧化指标的影响研究
[0149]
3.1血浆sod活性和mda含量
[0150]
sod活力的测定根据(granelli et al.,1995)报道,由黄嘌呤氧化产生的活性氧阴离子的清除率来计算;mda含量的测定根据(drape et al.,1993)报道,使用硫代巴比妥酸比色法测定,sod活性和mda含量测定所用试剂盒均购自于南京建成生物工程研究所。
[0151]
3.2结果分析
[0152]
在14天的试验周期内,阴性对照组、阳性对照组、30、100、及150mg/kg 大黄素组的团头鲂血浆sod活力如图4a所示。结果显示,在试验开始以及投喂饲料的1、7、14d时,与阴性对照组相比,各试验组团头鲂血浆中sod活力无显著差异(p>0.05),而投喂4d时,阳性对照
组的团头鲂血浆sod活力显著低于其他各组(p<0.05)。
[0153]
如图4b所示,阴性对照组团头鲂血浆mda含量变化稳定且数量较低,而其它试验组的mda含量受投喂饲料及投喂时间的显著影响。在试验开始及投喂饲料1d时,各组mda含量无显著变化且差异不显著;投喂4d时,30、100及 150mg/kg大黄素组的团头鲂血浆mda含量较前一次采样有所升高,但与阴性对照组相比仍无显著差异(p>0.05),阳性对照组mda含量显著低于阴性对照组;投喂7d时,30、100、150mg/kg组mda含量时较投喂4d显著降低且与阴性对照组无显著差异,然阳性对照组中其含量仍显著高于阴性对照组 (p<0.05);投喂14d时,阳性对照组mda含量显著高于阴性对照组及100mg/ kg组,其它各组之间无显著差异。
[0154]
上述结果表明,当机体遭受病原菌感染时,大黄素诱导产生的ros用于充分杀灭外源细菌及微生物,维持机体氧化与抗氧化系统动态平衡保护机体不受脂质过氧化损害,因而,并未引起相关抗氧化酶活力的增加。
[0155]
实施例4腹腔注射嗜水气单胞菌后大黄素对团头鲂肝脏组织结构的影响研究
[0156]
4.1肝脏组织切片制作
[0157]
养殖试验结束后,每个网箱中随机取3尾鱼麻醉,在冰盘上解剖取出肝脏,放入预先配制好的波恩氏固定液中进行组织固定。然后按照操作规范对固定好的肝脏组织进行水洗、脱水、透明、浸蜡、包埋和切片。蜡片制作完成后,将其附贴于用蛋白甘油处理过的载玻片上进行he染色,然后用中性树胶封片。封片结束后,将组织切片置于光学显微镜下观察。
[0158]
上述波恩氏固定液配制比例为:1.22%的饱和苦味酸75ml,40%福尔马林溶液2ml,冰醋酸5ml。
[0159]
上述切片过程中所用切片机型号为leica rm
‑
2255,德国;光学显微镜型号为nikon ds
‑
fi1。
[0160]
4.2结果分析
[0161]
腹腔注射嗜水气单胞菌后大黄素对团头鲂肝脏组织结构的影响如图5及图6 所示。投喂饲料1d时,样品切片在油镜(
×
1000)下观察,结果显示,0(阳性对照组)、30、100及150mg/kg组的肝细胞出现严重空泡现象及细胞膨大现象,大部分肝细胞的细胞核出现偏移,其中,0mg/kg(阳性对照组)组的细胞膨大及空泡化现象最为严重。而0mg/kg(阴性对照组)组的肝细胞形状较为正常,没有表现出细胞膨大现象,也无明显的脂肪空泡;细胞核大小适中,分布于细胞中间。投喂7d时,五组中仅0mg/kg(阳性对照组)组的肝脏细胞出现空泡化现象,部分肝细胞的细胞核出现偏移,但与投喂1d时相比,肝细胞的空泡化及膨大现象减轻;此外,其它各组肝细胞形状较为正常,没有表现出细胞膨大现象,也无明显的脂肪空泡,细胞核大小适中,分布于细胞中间。
[0162]
实施例5腹腔注射嗜水气单胞菌后大黄素对团头鲂生理反应影响研究
[0163]
5.1血液生理指标测定
[0164]
血糖含量(glu)用葡萄糖氧化酶
‑
过氧化物酶终点比色法,谷丙转氨酶 (alt)、谷草转氨酶(ast)、总蛋白含量(tp)、碱性磷酸酶(akp)、甘油三酯(tg)采用比色法,所用试剂盒购自复旦张江生物医疗股份有限公司,在迈瑞bs
‑
400全自动生化分析仪上测定。
[0165]
三碘甲腺原氨酸(t3)、甲状腺素(t4)、皮质醇(cor)采用化学发光免疫竞争法(ria)进行测定,试剂盒购自深圳新产业生物医学工程有限公司。
[0166]
5.2结果分析
[0167]
5.2.1腹腔注射嗜水气单胞菌后大黄素对团头鲂血浆alt、ast活力及tp 含量的影响研究
[0168]
如图7a所示,被嗜水气单胞菌感染的团头鲂血浆alt活力受大黄素添加量及投喂时间影响显著。结果显示,阴性对照组的alt活力在整个试验期内持稳定趋势不受投喂时间的影响,其它四组alt活力均呈先上升后下降的趋势。试验开始时,各组之间的alt活力无显著差异,然而投喂饲料1d时,阳性对照组的血浆alt活力显著高于阴性对照组(p<0.05),30、100及150mg/kg大黄素组高于但不显著高于阴性对照组(p>0.05);投喂4d时,与前一次采样相比各试验组的alt活力均有所下降,然各组之间差异与投喂1d时基本相同;投喂7d后,各试验组的alt活力趋向稳定基本与阴性对照组无显著差异。
[0169]
如图7b所示,阴性对照组的ast活力的变化比较稳定且相对较低,而其它四组的ast活力均受投喂饲料及投喂时间的影响,呈先上升后下降的趋势。此外,试验开始时,各组之间的ast活力无显著差异(p>0.05);投喂饲料1d 时,阳性对照组及30、100、150mg/kg大黄素组的ast活力显著高于阴性对照组 (p<0.05),但四组之间差异不显著;此后,除阴性对照组外其他四组的ast 呈现下降趋势,投喂4d时,100mg/kg组的ast活力与阴性对照组相比无显著差异,但阳性对照组及30、150mg/kg组仍显著高于阴性对照组;投喂7d时,30、 100、150mg/kg组与阴性对照组之间的ast活力差异不显著(p>0.05),但阳性对照组仍显著高于阴性对照组及100mg/kg组(p<0.05);此后,各组ast活力的变化基本不变趋向稳定。
[0170]
如图7c所示,除阴性对照组外其他四组的血浆tp含量均受投喂饲料及投喂时间的影响。试验开始时,阳性对照组及30、100、150mg/kg组的tp含量迅速上升显著高于阴性对照组(p<0.05),但四组之间无显著差异;投喂饲料1d 时,各试验组的tp含量仍有所上升,且阳性对照组及30、100、150mg/kg组的 tp含量仍显著高于阴性对照组(p<0.05),此后,tp含量呈下降趋势;投喂4d 时,阳性对照组的tp含量显著下降且与阴性对照组无显著差异,30mg/kg组仍显著高于阴性对照组及阳性对照组(p<0.05),但100、150mg/kg大黄素组与阴性对照组及阳性对照组均无显著差异(p>0.05);投喂饲料7d时,阳性对照组的tp含量在各组织中最低,且显著低于30、100、150mg/kg组;而当投喂饲料14d时,阳性对照组的tp含量最低且显著低于其他四组。
[0171]
5.2.2腹腔注射嗜水气单胞菌后大黄素对团头鲂血浆cor、t3和t4的影响研究
[0172]
如图8a所示,嗜水气单胞菌可导致团头鲂血浆cor含量有显著变化,而阴性对照组的cor变化较稳定且含量较低。试验开始时,受感染的鱼体血浆cor迅速上升且显著高于阴性对照组(p<0.05);投喂饲料1d时,阳性对照组的cor水平仍呈上升趋势且显著高于阴性对照组(p<0.05),但添加大黄素组(30、 100、150mg/kg组)的cor含量无显著变化且与阴性对照组无显著差异 (p>0.05);投喂4d时,阳性对照组的cor水平仍显著高于阴性对照组 (p<0.05),然30、100、150mg/kg组的cor与阴性对照组差异不显著 (p>0.05);投喂7、14d,阳性对照组的cor水平仍最高且显著高于其他各组 (p<0.05)。
[0173]
如图8b所示,受嗜水气单胞菌感染的团头鲂t3含量受大黄素显著影响。试验开始时,嗜水气单胞菌导致团头鲂t3含量迅速上升且显著高于阴性对照组 (p<0.05);投喂饲料1d时,各试验组t3含量均有所上升,然与阴性对照组相比,阳性对照组的t3含量显著升高(p<0.05),但30、100、150mg/kg组与之无显著差异;此后,各试验组t3含量开始降低,投喂4d时,阳性对照组的t3含量仍显著高于阴性对照组(p<0.05),其它各组无显著差异;投喂7d时,阳
性对照组的t3含量显著高于100mg/kg组(p<0.05),其它各组之间无显著差异 (p>0.05),此后,各组t3含量趋向稳定直至差异不显著。
[0174]
如图8c所示,腹腔注射后大黄素对团头鲂血浆t4含量有显著影响。其中,试验开始时,各试验组的血浆t4含量无显著差异且含量较低;投喂饲料1d时,阳性对照组及30、100、150mg/kg组的t4含量迅速上升且显著高于阴性对照组 (p<0.05);投喂4d时,与前一次采样相比,除阴性对照组外各试验组的t4含量有所下降,然阳性对照组仍显著高于阴性对照组(p<0.05),其他各组无显著差异(p>0.05);投喂7d时,30、100、150mg/kg组t4含量均下降至与阴性对照组无显著差异(p>0.05),但显著低于阳性对照组(p<0.05)。
[0175]
5.2.3腹腔注射嗜水气单胞菌后大黄素对团头鲂血浆akp、glu和tg的影响研究
[0176]
腹腔感染嗜水气单胞菌后大黄素对团头鲂血浆akp活力的影响如图9a所示。结果显示,嗜水气单胞菌可导致团头鲂血浆akp活力呈现先上升后下降趋势。试验开始时,各组akp活力差异不显著(p>0.05);投喂饲料1d时,各组akp活力均有所上升,但差异不显著(p>0.05);投喂4d时,各试验组akp活力有所下降,然各组差异均不显著;投喂7及14d时,各组akp活力基本稳定,阳性对照组其活力显著低于100mg/kg组(p<0.05),其它各组无显著差异 (p>0.05)。
[0177]
腹腔感染嗜水气单胞菌后大黄素对团头鲂血浆glu含量的影响如图9b所示。结果显示,试验开始时,各组之间glu含量无显著差异且含量较低;投喂饲料 1d时,阳性对照组及30、100、150mg/kg组的血糖含量有所上升且显著高于阴性对照组(p<0.05);投喂4d时,与前一次采样相比,各组血糖含量无显著变化(p>0.05);投喂7d时,30、100、150mg/kg大黄素组血糖含量出现降低,且100、150mg/kg组显著低于阳性对照组(p<0.05);投喂14d时,各组之间血糖含量无显著差异(p>0.05)。
[0178]
腹腔感染嗜水气单胞菌后大黄素对团头鲂血浆tg含量的影响如图9c所示。结果显示,阴性对照组的tg含量变化较稳定且含量较低,而其它四组的tg含量均受大黄素的影响,呈先下降后升高趋势。其中,试验开始时嗜水气单胞菌并未导致tg含量有显著的变化(p>0.05);投喂饲料1d时,阳性对照组及30、100、150mg/kg组的血浆tg含量均显著低于阴性对照组(p<0.05);然而在投喂4d时,此四组的tg含量出现恢复,但阳性对照组仍显著低于阴性对照组及 100mg/kg组(p<0.05),与其它两组无显著差异(p>0.05);投喂7、14d时,各试验组tg含量趋向稳定,且均与正常状态差异不显著。
[0179]
上述结果表明,日粮中添加大黄素能够修复受损肝脏,提高感染嗜水气单胞菌的团头鲂tp含量,促进机体的生理代谢,使机体免疫力提高;嗜水气单胞菌的感染会导致团头鲂cor含量升高,然通过饲喂大黄素可抑制团头鲂cor含量的升高,在一定程度上保护了机体的免疫机能,其中以添加100mg/kg大黄素为最佳;嗜水气单胞菌可导致团头鲂血浆t3、t4显著升高,使机体在一定程度上患甲状腺功能亢进症,而饲喂大黄素可尽快的缓解机体甲状腺亢进;嗜水气单胞菌感染可导致团头鲂akp活力迅速升高,然而在随后投喂的饲料中添加30、 100、150mg/kg大黄素可在一定程度上降低akp活力;感染后期,阳性对照组的 akp活力低于阴性对照组。
[0180]
实施例6腹腔注射嗜水气单胞菌后大黄素对团头鲂肝脏铜锌超氧化物歧化酶(cu/zn
‑
sod)、过氧化氢酶(cat)、谷胱甘肽过氧化物酶(gpx)、肿瘤坏死因子
‑
α(tnf
‑
α)及白细胞介素
‑
1β(il
‑
1β)mrna相对表达量的影响研究
[0181]
6.1肝脏cu/zn
‑
sod、cat、gpx、tnf
‑
α及il
‑
1βmrna测定
[0182]
6.1.1引物设计及合成
[0183]
根据团头鲂cu/zn
‑
sod全长序列、cat全长序列、gpx全长序列、tnf
‑
α全长序列、il
‑
1β全长序列、持家基因β
‑
actin(genebank accession no. ay170122.2)基因全长序列,利用premier 5.0引物设计软件设计特异性引物,具体如下:
[0184]
表2 cu/zn
‑
sod、cat、gpx、tnf
‑
α及il
‑
1β基因荧光定量pcr引物
[0185][0186][0187]
6.1.2总rna提取
[0188]
取液氮中保存的团头鲂肝脏样品50~100mg,放入含有1mlrnaiso plus的离心管中,之后按照rnaiso plus试剂盒中说明书操作,提取总rna,试样品od
260
/ od
280
保持在1.8
‑
2.0;
[0189]
6.1.3cdna制备
[0190]
按照primescript
tm rt reagent kit with gdna eraser试剂盒说明方法除去总 rna中的dna,并以50ng/μl的终浓度逆转录合成cdna,并
‑
20℃保存备用,取多个样品等量cdna混合,10倍梯度稀释共5个浓度,用以制作标准曲线;
[0191]
6.1.4实时荧光定量pcr反应
[0192]
cu/zn
‑
sod、cat及gpx mrna相对量采用primix ex taqtm ii (tlirnaseh plus)kit试剂盒,在abi prism 7500real
‑
time pcr system仪器进行检测和分析,real time pcr反应体系为20μl,qrt
‑
pcr反应程序:第一阶段(50℃2min,95℃3min),第二阶段(95℃15s,60℃1min,40次循环),第三阶段溶解曲线分析(95℃15s,60℃1min,95℃30s,60℃ 15s);
[0193]
6.1.5数据分析
[0194]
数据分析根据(唐永凯和贾永义,2008)报道,cu/zn
‑
sod、cat及gpx mrna水平计算以团头鲂β
‑
actin为内参,对得到的各样品ct值进行均一化处理,应用各自的标准曲线方法
确定其相对水平。
[0195]
上述实施例中,所述肝脏cu/zn
‑
sod、cat、gpx、tnf
‑
α及il
‑
1βmrna测定中所需的团头鲂cu/zn
‑
sod、cat、gpx、tnf
‑
α及il
‑
1β全长序列从中国水产科学研究院淡水渔业研究中心鱼类病害与营养饲料研究室提供的团头鲂基因组中筛选所得,所有引物均由上海捷瑞生物工程有限公司合成,测定过程中使用的 rnaiso plus试剂盒、primescript
tm rt reagent kit with gdna eraser试剂盒以及primix ex taqtm ii(tlirnaseh plus)kit试剂盒均购自大连takara公司。
[0196]
6.2结果分析
[0197]
腹腔感染嗜水气单胞菌后大黄素对团头鲂肝脏gpxmrna表达量的影响如图 10a所示。结果显示,嗜水气单胞菌可导致团头鲂肝脏gpxmrna表达量有显著变化。其中,试验开始时,嗜水气单胞菌并未导致鱼体gpxmrna表达量有显著变化(p>0.05);投喂饲料1d时,阳性对照组及30、100、150mg/kg组的gpxmrna 表达量出现降低,且阳性对照组及30、100mg/kg组显著低于阴性对照组 (p<0.05);投喂4d时,各试验组的gpxmrna表达量有所回升,但阳性对照组中其表达量仍显著低于阴性对照组(p<0.05),其它各组之间无显著差异 (p>0.05);此后,gpxmrna表达量趋向稳定且各组之间无显著差异。
[0198]
腹腔感染嗜水气单胞菌后大黄素对团头鲂肝脏cu/zn
‑
sodmrna表达量的影响如图10b所示。结果显示,大黄素对已感染嗜水气单胞菌的团头鲂肝脏的cu/ zn
‑
sodmrna表达量有显著影响。与gpxmrna表达量变化趋势相类似,试验开始时,cu/zn
‑
sodmrna表达量无显著变化(p>0.05);投喂饲料1d时,阳性对照组及30、100、150mg/kg组的cu/zn
‑
sodmrna表达量出现降低,且此四组均显著低于阴性对照组(p<0.05);自投喂4d开始,各组的cu/zn
‑
sodmrna表达量恢复至正常水平,且差异不显著(p>0.05)。
[0199]
腹腔感染嗜水气单胞菌后大黄素对团头鲂肝脏catmrna表达量的影响如图 10c所示。结果显示,嗜水气单胞菌与投喂大黄素剂量和投喂时间均可成为影响团头鲂肝脏catmrna表达量的影响因素。试验开始时,嗜水气单胞菌并未对鱼体catmrna表达量造成显著影响(p>0.05);随后各试验组catmrna表达量出现下降,投喂饲料1d时,阳性对照组及30、100、150mg/kg组的catmrna表达量显著低于阴性对照组(p<0.05),且四组之间无显著差异(p>0.05);投喂4d时,30mg/kg组的catmrna表达量显著低于阴性对照组(p<0.05),其它各组无显著差异(p>0.05);投喂7、14d时,各组catmrna表达量基本稳定无显著差异(p>0.05)。
[0200]
腹腔感染嗜水气单胞菌后大黄素对团头鲂肝脏tnf
‑
α和il
‑
1βmrna相对表达量的影响如图11a和11b所示。结果显示,饲喂大黄素对已感染的团头鲂肝脏 tnf
‑
α和il
‑
1βmrna相对表达量无显著影响。
[0201]
上述结果表明,日粮中添加大黄素饲喂受感染团头鲂可在一定程度上修复肝脏损伤,恢复肝脏抗氧化能力。
[0202]
综上所述,日粮中添加100mg/kg大黄素可通过提高机体吞噬功能,促进细胞因子的分泌等,从而杀伤体内致病菌,提高团头鲂抗嗜水气单胞菌感染能力,进而恢复机体免疫功能;日粮中添加100mg/kg大黄素可通过影响机体血液 ast和alt活力、皮质醇、t3和t4等激素水平以及血糖含量等来影响机体生理代谢,从而使受感染团头鲂机体生理反应尽快恢复至正常水平;日粮中添加 100mg/kg大黄素可对受损肝脏进行修复,同时通过影响肝脏相关抗氧化基因表达量来维持机体氧化与抗氧化动态平衡。
[0203]
对于本领域技术人员而言,显然本发明不限于上述示范性实施例的细节,而且在不背离本发明的精神或基本特征的情况下,能够以其他的具体形式实现本发明。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在本发明内。不应将权利要求中的任何附图标记视为限制所涉及的权利要求。
[0204]
此外,应当理解,虽然本说明书按照实施方式加以描述,但并非每个实施方式仅包含一个独立的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施例中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1