车前子提取物在制备治疗心肌肥大症药物中的用途
1.本发明是涉及车前子提取物在制备治疗心肌肥大症药物中的用途,属于中药材应用技术领域。
背景技术:
2.心肌肥大(cardiac hypertrophy)是心脏对长期负荷过重及神经内分泌的过度激活的一种适应性应答反应。病理学整体表现为:心脏体积增大、重量增加、室壁向心性肥大和心室腔容积减小;细胞的表型变化以心肌细胞体积增加、蛋白质含量增多及细胞间质增生为主要特征,是一种慢性代偿性反应,是慢性心力衰竭的发展前期和重要前兆。
3.慢性心力衰竭(简称心衰)是心血管疾病的终末期表现,临床上是以同时出现肺循环和(或)体循环静脉淤血为特征而引发的一系列复杂的临床症候群,具有较高致残率和病死率。目前世界范围内已有2300万心衰患者,其中我国约有400万,约占全球心衰患者的17.4%,而且随着人口老龄化的增加,心衰的发病率呈上升趋势,预计至2030年,全球患病率还将增加46%,给社会造成巨大的经济负担。
4.目前临床用于治疗心肌肥大的药物按作用机制主要包括钙通道拮抗剂,β受体阻断剂和利尿剂等。虽然用于治疗心肌肥大疾病的药物种类众多,但是由于现代西药靶点单一、不良反应多等因素限制了其对心肌肥大症的治疗效果。
5.车前子(semen plantaginis),为车前科车前属植物车前plantago asiatica l.或平车前p.depressa willd.的干燥成熟种子,最早记载于《神农本草经》,是《中国药典》(2015年版)收载的常用中药,具有清热、利尿通淋、渗湿止渴、止泻、明目、祛痰的功效,常用于热淋湿痛、水肿胀满、暑湿泄泻、目赤肿痛和痰热咳嗽等症状,在中医临床广泛应用。但目前未见车前子提取物是否具有防治心肌肥大症作用的相关报道。
技术实现要素:
6.针对现有技术存在的上述问题,本发明的目的是提供车前子提取物在制备治疗心肌肥大症药物中的用途,为防治心肌肥大症提供一种新的药物途径。
7.本发明所述的车前子提取物中含有京尼平苷酸、车前素a、麦角甾苷和异麦角甾苷四种成分,且所述四种成分的质量含量依次为1~31%、0.1~22%、1~30%和0.03~5%。
8.一种优选方案,本发明上述的车前子提取物,是由体积分数为60~90%的乙醇水溶液对车前子进行回流提取1~6次得到,每次提取按1克车前子用6~15毫升所述的乙醇水溶液。
9.一种优选方案,本发明所述的车前子提取物中,京尼平苷酸的质量含量为9~25%,车前素a的质量含量为7~20%,麦角甾苷的质量含量为9~25%,异麦角甾苷的质量含量为1~5%。
10.进一步优选方案,本发明上述的车前子提取物,是由体积分数为65~80%的乙醇水溶液对车前子进行回流提取1~3次得到,每次提取按1克车前子用9~13毫升所述的乙醇
水溶液。
11.进一步优选方案,本发明所述的车前子提取物中,京尼平苷酸的质量含量为19~22%,车前素a的质量含量为15~18%,麦角甾苷的质量含量为17~23%,异麦角甾苷的质量含量为2~4%。
12.进一步优选方案,本发明上述的车前子提取物,是由体积分数为70%的乙醇水溶液对车前子进行回流提取2次得到,每次提取按1克车前子用12毫升所述的乙醇水溶液。
13.本发明所述的车前子可为车前科植物车前和/或平车前的干燥成熟种子,以车前科植物车前的干燥成熟种子较优。
14.本发明所述的心肌肥大症包括原发性扩张性心肌病、肥大型心肌病、慢性心力衰竭症、高血压性心肌病中的任意一种或几种。
15.本发明所述药物可采用任何可药用的剂型,包括但不限于:片剂、糖衣片剂、薄膜衣片剂、肠溶衣片剂、胶囊剂、硬胶囊剂、软胶囊剂、口服液、口含剂、颗粒剂、冲剂、丸剂、散剂、膏剂、丹剂、混悬剂、粉剂、溶液剂、注射剂、栓剂、软膏剂、硬膏剂、霜剂、喷雾剂、滴剂、贴剂;优选口服剂型,如:胶囊剂、片剂、口服液、颗粒剂、丸剂、散剂、丹剂、膏剂等;所述的口服剂型可含有常用的赋形剂,诸如粘合剂、填充剂、稀释剂、压片剂、润滑剂、崩解剂、着色剂、调味剂和湿润剂,必要时可对片剂进行包衣;适宜的填充剂包括纤维素、甘露糖醇、乳糖和其它类似的填充剂;适宜的崩解剂包括淀粉、聚乙烯吡咯烷酮和淀粉衍生物,例如羟基乙酸淀粉钠;适宜的润滑剂包括,例如硬脂酸镁。适宜的药物可接受的湿润剂包括十二烷基硫酸钠。
16.与现有技术相比,本发明具有如下显著性有益效果:
17.本发明利用异丙肾上腺诱导的心肌肥大的实验动物模型进行体内药效实验,研究结果表明:本发明所述的车前子提取物可以显著改善异丙肾上腺诱导的心肌肥大小鼠心功能,能明显抑制心肌形态变大和胚胎基因的高表达,可望作为临床心肌肥大症的防治或辅助治疗药物。
附图说明
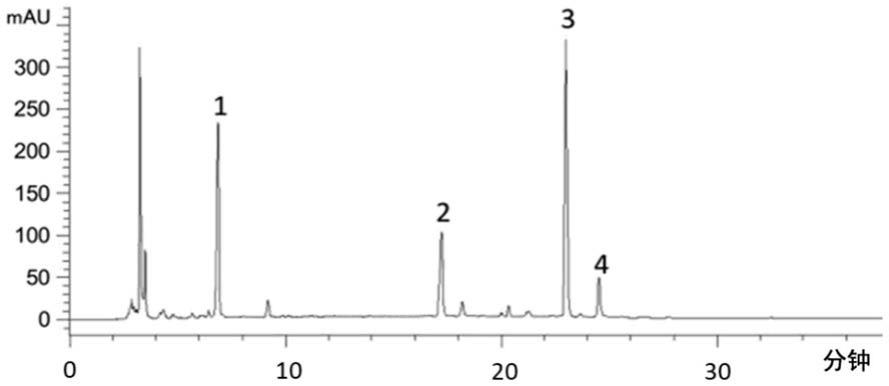
18.图1a为本发明实施例得到的车前子提取物1的hplc色谱图,图中:1峰为京尼平苷酸,2峰为车前素a,3峰为麦角甾苷,4峰为异麦角甾苷;
19.图1b为车前子提取物1与平车前子提取物的薄层色谱对照图,图中:s1为京尼平苷酸,s2为麦角甾苷,1
‑
6为平车前子提取物的平行样品,7
‑
11为车前子提取物1的平行样品;
20.图1c为车前子提取物1与平车前子提取物的液质联用分析总离子流对照图:图中:a为车前子提取物1,b为平车前子提取物,1峰为caffeoyl
‑
hexose(咖啡酰基六碳糖),2峰为京尼平苷酸,3峰为plantagoside(野黄芩素
‑7‑
葡萄糖甙),4峰为麦角甾苷,5峰为车前素a,6峰为异麦角甾苷,7峰为pentahydroxyflavanone(五羟基黄酮);
21.图2a至图2e从不同角度显示了采用不同剂量的车前子提取物1对异丙肾上腺素诱导的心肌肥大小鼠心功能的改善效果,图中:###表示相对对照组,p<0.001;*表示相对异丙肾上腺素组,p<0.05;**表示相对异丙肾上腺素组,p<0.01;***表示相对异丙肾上腺素组,p<0.001;
22.图3a至图3c从不同角度显示了采用不同剂量的车前子提取物1对异丙肾上腺素诱
导的心肌肥大小鼠心肌形态改变的抑制效果,图中:###表示相对对照组,p<0.001;*表示相对异丙肾上腺素组,p<0.05;***表示相对异丙肾上腺素组,p<0.001;
23.图3d至图3f从不同角度显示了采用不同剂量的车前子提取物1对异丙肾上腺素诱导的心肌肥大小鼠的心肌肥大基因表达的抑制效果,图中:###表示相对对照组,p<0.001;***表示相对异丙肾上腺素组,p<0.001;
24.图4a至图4c从不同角度显示了车前子提取物2对异丙肾上腺素诱导的心肌肥大小鼠心肌形态改变的抑制效果,图中:###表示相对对照组,p<0.001;*表示相对异丙肾上腺素组,p<0.05;***表示相对异丙肾上腺素组,p<0.001;
25.图5a至图5c从不同角度显示了车前子提取物3对异丙肾上腺素诱导的心肌肥大小鼠心肌形态改变的抑制效果,图中:###表示相对对照组,p<0.001;*表示相对异丙肾上腺素组,p<0.05;***表示相对异丙肾上腺素组,p<0.001;
26.图6a至图6c从不同角度显示了车前子提取物4对异丙肾上腺素诱导的心肌肥大小鼠心肌形态改变的抑制效果,图中:###表示相对对照组,p<0.001;*表示相对异丙肾上腺素组,p<0.05;***表示相对异丙肾上腺素组,p<0.001;
27.图7a和图7b从不同角度显示了车前子提取物与平车前子提取物对异丙肾上腺素诱导的心肌肥大小鼠心肌形态改变的抑制效果的差异,图中:###表示相对对照组,p<0.001;*表示相对异丙肾上腺素组,p<0.05;***表示相对异丙肾上腺素组,p<0.001。
具体实施方式
28.下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。
29.实施例
30.一、本发明所述的车前子提取物的制备
31.1)先用体积分数为70%的乙醇水溶液对车前子进行回流提取2次,每次提取按1克车前子用12毫升所述的乙醇水溶液,然后对收集的提取液进行过滤、浓缩成浸膏,即得车前子提取物1;
32.2)先用体积分数为60%的乙醇水溶液对车前子进行回流提取1次,每次提取按1克车前子用6毫升所述的乙醇水溶液,然后对收集的提取液进行过滤、浓缩成浸膏,即得车前子提取物2;
33.3)先用体积分数为80%的乙醇水溶液对车前子进行回流提取1次,每次提取按1克车前子用9毫升所述的乙醇水溶液,然后对收集的提取液进行过滤、浓缩成浸膏,即得车前子提取物3;
34.4)先用体积分数为90%的乙醇水溶液对车前子进行回流提取3次,每次提取按1克车前子用15毫升所述的乙醇水溶液,然后对收集的提取液进行过滤、浓缩成浸膏,即得车前子提取物4;
35.5)先用体积分数为70%的乙醇水溶液对平车前子进行回流提取2次,每次提取按1克车前子用12毫升所述的乙醇水溶液,然后对收集的提取液进行过滤、浓缩成浸膏,即得平车前子提取物。
36.二、本发明所述的车前子提取物的分析表征
37.色谱条件:仪器与设备为agilent 1100高效液相色谱仪,色谱柱为waters x
‑
bridge c18(4.6*250mm,5μm),柱温为25℃,流速为1.0ml/min,进样量为2μl,以0.033mol/l磷酸二氢钾水溶液和乙腈为流动相进行洗脱,检测波长为270nm;
38.供试品溶液及对照品溶液的制备:分别取车前子提取物1
‑
4各5mg,精密称定,置100ml具塞锥形瓶中,精密加入甲醇50ml,超声至完全溶解,6000g离心10min,取上清液用0.22μm滤膜滤过,作为供试品溶液;取京尼平苷酸、麦角甾苷、异麦角甾苷和车前素a对照品适量,精密称定,置量瓶中,加甲醇溶解即得对照品溶液;
39.精密吸取对照品溶液与供试品溶液各2μl,注入高效液相色谱仪,测定样品中京尼平苷酸、车前素a、麦角甾苷、异麦角甾苷各成分的含量。
40.图1a为实施例得到的车前子提取物1的hplc色谱图,图中:1峰为京尼平苷酸,2峰为车前素a,3峰为麦角甾苷,4峰为异麦角甾苷;另外,经hplc色谱图分析,实施例得到的车前子提取物1
‑
4中均含有京尼平苷酸、车前素a、麦角甾苷和异麦角甾苷四种成分,且其中的四种成分的质量含量分别如下:
41.车前子提取物1中,京尼平苷酸的质量含量为20.6
±
1.3%,车前素a的质量含量为16.6
±
0.7%,麦角甾苷的质量含量为19.9
±
2.6%,异麦角甾苷的质量含量为3.4
±
0.5%;
42.车前子提取物2中,京尼平苷酸的质量含量为3.3
±
1.2%,车前素a的质量含量为2.2
±
1.3%,麦角甾苷的质量含量为2.6
±
1.2%,异麦角甾苷的质量含量为1.0
±
0.8%;
43.车前子提取物3中,京尼平苷酸的质量含量为11.9
±
2.1%,车前素a的质量含量为9.6
±
2.6%,麦角甾苷的质量含量为11.4
±
2.2%,异麦角甾苷的质量含量为3.6
±
1.0%;
44.车前子提取物4中,京尼平苷酸的质量含量为27.3
±
3.3%,车前素a的质量含量为19.6
±
2.4%,麦角甾苷的质量含量为25.5
±
3.6%,异麦角甾苷的质量含量为4.4
±
0.5%。
45.图1b为车前子提取物1与平车前子提取物的薄层色谱对照图,薄层色谱分析操作如下:
46.取车前子提取物1与平车前子提取物样品各5份,分别取粗粉1g,加入甲醇10ml,超声处理30min,滤过,滤液蒸干,残渣加甲醇2ml使溶解,作为供试品溶液;
47.取京尼平苷酸、麦角甾苷对照品适量,加甲醇溶解制成对照品溶液;
48.取制备好的京尼平苷酸和麦角甾苷对照品溶液、平车前子提取物和车前子提取物1供试品溶液各5μl,分别点在同一块硅胶gf254薄层板上,展开剂为乙酸乙酯
‑
甲醇
‑
甲酸
‑
水(18:2:1.5:1),展开,取出,晾干,喷以0.5%香草醛硫酸溶液,在105℃加热至斑点显色清晰;然后观察供试品与对照品相应位置的斑点,具体如图1b所示,图中:s1为京尼平苷酸,s2为麦角甾苷,1
‑
6为平车前子提取物的平行样品,7
‑
11为车前子提取物1的平行样品;
49.图1c为车前子提取物1与平车前子提取物的液质联用分析总离子流对照图:图中:a为车前子提取物1,b为平车前子提取物,1峰为caffeoyl
‑
hexose(咖啡酰基六碳糖),2峰为京尼平苷酸,3峰为plantagoside(野黄芩素
‑7‑
葡萄糖甙),4峰为麦角甾苷,5峰为车前素a,6峰为异麦角甾苷,7峰为pentahydroxyflavanone(五羟基黄酮);
50.结合图1b和图1c的对比结果可见:
51.采用相同提取工艺,由车前科车前属植物车前plantago asiatica l.的干燥成熟种子所提取得到的车前子提取物1与由平车前p.depressa willd.的干燥成熟种子所提取
得到的平车前子提取物中,均含有1至6峰,但其中所含的京尼平苷酸、车前素a、麦角甾苷和异麦角甾苷四种成分的组成含量具有明显差异,且平车前子提取物中还含有一定量的pentahydroxyflavanone(五羟基黄酮,对应图1c中的7峰)特有成分,而在车前子提取物1中未检测到此成分,两者的具体差异如下表所示:
[0052] 车前子提取物1平车前子提取物京尼平苷酸20.6
±
1.3%2.6
±
1.3%车前素a16.6
±
0.7%0.2
±
0.1%麦角甾苷19.9
±
2.6%18.2
±
2.1%异麦角甾苷3.4
±
0.5%0.04
±
0.01%pentahydroxyflavanone无有
[0053]
由上表所示对比结果发现:即使采用完全相同的提取工艺,选用均属于车前科车前属植物的车前和平车前的干燥成熟种子进行提取,却使提取得到的车前子提取物的组成含量产生了意料之外的显著差异。
[0054]
三、在异丙肾上腺素诱导的实验性心肌肥大模型上评价本发明所述的车前子提取物对小鼠心肌形态的药效作用
[0055]
1、实验性心肌肥大模型的建立
[0056]
对10周20
‑
25g的c57bl/6雄性小鼠,皮下注射异丙肾上腺素(iso,30mg/kg),连续注射14天,构建小鼠心肌肥大模型;
[0057]
心肌肥大指征通过心脏超声指标,左室心肌细胞形态以及胚胎基因心房利钠肽(anp)、b型钠尿肽(bnp)、e肌球蛋白重链(β
‑
mhc)的异常表达进行评价。
[0058]
2、动物给药及体重测量
[0059]
分别采用车前提取物1(给药剂量为20、40、80mg/kg),车前提取物2
‑
4(给药剂量分别为40mg/kg)及阳性对照药普萘洛尔(给药剂量为20mg/kg)在诱导后1天至14天灌胃给药,模型组动物给予生理盐水,在诱导后每天称量动物体重一次。
[0060]
3、小鼠心脏超声
[0061]
用0.5~1%异氟烷吸入麻醉小鼠后,采用vevo2100彩色多普勒超声心动图仪,30mhz探头,m
‑
mode探查小鼠心尖部和骨左缘3、4肋间两个部位,调节图像,记录射血分数(ef,%)、缩短分数(fs,%)、每搏输出量(sv),心排出量(co),均测量五个心动周期取平均值。
[0062]
4、he染色
[0063]
心室组织置于4%多聚甲醛中固定,石蜡包埋切片,二甲苯脱蜡,苏木素伊红染色,中性树脂封片,光学显微镜下观察及拍照分析。
[0064]
5、rt
‑
pcr
[0065]
小鼠心室组织于
‑
80℃保存,取出研磨制作组织匀浆后,用trizol裂解,提取mrna,测定浓度,反转录为cdna进行pcr反应,检测心肌细胞肥大相关基因表达,以gapdh作为内参基因。
[0066]
6、比较车前子提取物1与平车前子提取物的药效差异
[0067]
分别将车前子提取物1(给药剂量为40mg/kg)和平车前子提取物(给药剂量为40mg/kg)在异丙肾上腺素诱导实验性心肌肥大模型上评价小鼠心肌形态药效作用。
[0068]
7、结论分析
[0069]
图2a至图2e从不同角度显示了采用不同剂量的车前子提取物1对异丙肾上腺素诱导的心肌肥大小鼠心功能的改善效果,图中:###表示相对对照组,p<0.001;*表示相对异丙肾上腺素组,p<0.05;**表示相对异丙肾上腺素组,p<0.01;***表示相对异丙肾上腺素组,p<0.001;结合图2a至图2e可见:
[0070]
iso模型组的左心室收缩末期和舒张末期内径,相比正常对照组都有明显的缩小;
[0071]
iso皮下给药同时给予车前子提取物1治疗组,心功能损伤得到明显改善,特别是对于肥大所造成的射血分数、缩短分数和心输出量、每搏输出量和心排出量具有明显的恢复作用;
[0072]
说明本发明所述的车前子提取物1能显著改善iso诱导的心肌肥大小鼠心功能。
[0073]
图3a至图3c从不同角度显示了采用不同剂量的车前子提取物1对异丙肾上腺素诱导的心肌肥大小鼠心肌形态改变的抑制效果,图中:###表示相对对照组,p<0.001;*表示相对异丙肾上腺素组,p<0.05;***表示相对异丙肾上腺素组,p<0.001;结合图3a至图3c可见:
[0074]
左心室后壁厚度和室间隔厚度,相比正常对照组明显增厚,治疗组有改善作用;
[0075]
细胞的横截面积是判断心肌是否发生肥大的重要指标,心肌肥大会使心肌细胞膨胀变大,image j对心肌细胞截面积分析显示iso组小鼠心肌细胞变大,由实验统计分析结果可以看出,iso组的平均心肌细胞面积相比对照组增大,显示模型制作方法均能实现致大鼠心肌肥大且iso组表现出更明显的心肌细胞肥大表征,经车前子提取物治疗的心肌细胞,其细胞横截面积都比相对应的模型组有显著性减小,结果提示车前子提取物对iso引起的心肌细胞变大有明显的治疗作用。与此同时,模型组的小鼠心脏体重比显著增加,但经车前子提取物处理后,实验小鼠的心脏体重比增大得到显著抑制,说明,车前子提取物1能显著抑制iso诱导的心肌肥大小鼠心肌形态改变。
[0076]
图3d至图3f从不同角度显示了采用不同剂量的车前子提取物1对异丙肾上腺素诱导的心肌肥大小鼠的心肌肥大基因表达的抑制效果,图中:###表示相对对照组,p<0.001;***表示相对异丙肾上腺素组,p<0.001;由图3d至图3f所示可见:
[0077]
模型组基因表达明显高于正常对照组,anp,bnp和β
‑
mhc mrna的表达均明显上升;给予车前子提取物治疗后,各组均可有效降低anp、bnp、β
‑
mhc的表达,说明本发明所述的车前子提取物能够有效抑制iso诱发小鼠心肌细胞胚胎基因上调。
[0078]
图4a至图4c从不同角度显示了车前子提取物2对异丙肾上腺素诱导的心肌肥大小鼠心肌形态改变的抑制效果,图中:###表示相对对照组,p<0.001;*表示相对异丙肾上腺素组,p<0.05;***表示相对异丙肾上腺素组,p<0.001;由图4a至图4c所示可见:
[0079]
经过车前子提取物2给药组的细胞横截面积比相对应的模型组有显著性减小,与此同时,模型组的小鼠心脏体重比显著增加,但经车前子提取物2处理后,实验小鼠的心脏体重比增大得到显著抑制,说明本实施例所述的车前子提取物2对异丙肾上腺素诱导的心肌肥大小鼠心肌形态改变具有显著抑制效果,能够明显改善iso诱导的心肌肥大,对iso引起的心肌细胞变大有明显的治疗作用。
[0080]
图5a至图5c从不同角度显示了车前子提取物3对异丙肾上腺素诱导的心肌肥大小鼠心肌形态改变的抑制效果,图中:###表示相对对照组,p<0.001;*表示相对异丙肾上腺素组,p<0.05;***表示相对异丙肾上腺素组,p<0.001;由图5a至图5c所示可见:
[0081]
经过车前子提取物3给药组的细胞横截面积比相对应的模型组有显著性减小,与此同时,模型组的小鼠心脏体重比显著增加,但经车前子提取物3处理后,实验小鼠的心脏体重比增大得到显著抑制,说明本实施例所述的车前子提取物3对异丙肾上腺素诱导的心肌肥大小鼠心肌形态改变具有显著抑制效果,能够明显改善iso诱导的心肌肥大,对iso引起的心肌细胞变大有明显的治疗作用。
[0082]
图6a至图6c从不同角度显示了车前子提取物4对异丙肾上腺素诱导的心肌肥大小鼠心肌形态改变的抑制效果,图中:###表示相对对照组,p<0.001;*表示相对异丙肾上腺素组,p<0.05;***表示相对异丙肾上腺素组,p<0.001;由图6a至图6c所示可见:
[0083]
经过车前子提取物4给药组的细胞横截面积比相对应的模型组有显著性减小,与此同时,模型组的小鼠心脏体重比显著增加,但经车前子提取物4处理后,实验小鼠的心脏体重比增大得到显著抑制,说明本实施例所述的车前子提取物4对异丙肾上腺素诱导的心肌肥大小鼠心肌形态改变具有显著抑制效果,能够明显改善iso诱导的心肌肥大,对iso引起的心肌细胞变大有明显的治疗作用。
[0084]
图7a和图7b从不同角度显示了车前子提取物与平车前子提取物对异丙肾上腺素诱导的心肌肥大小鼠心肌形态改变的抑制效果的差异,图中:###表示相对对照组,p<0.001;*表示相对异丙肾上腺素组,p<0.05;***表示相对异丙肾上腺素组,p<0.001;由图7a和图7b所示可见:车前子提取物1和平车前子提取物均对异丙肾上腺素诱导的心肌肥大小鼠心肌形态改变具有改善效果,但车前子提取物1的药效优于平车前子提取物。
[0085]
最后有必要在此说明的是:以上实施例只用于对本发明的技术方案作进一步详细地说明,不能理解为对本发明保护范围的限制,本领域的技术人员根据本发明的上述内容作出的一些非本质的改进和调整均属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1