TNFSF15蛋白作为巨噬细胞免疫增强剂的用途及其活化方法
tnfsf15蛋白作为巨噬细胞免疫增强剂的用途及其活化方法
技术领域
1.本发明涉及医药技术领域,特别是涉及一种tnfsf15蛋白作为巨噬细胞免疫增强剂的用途及其活化方法。
背景技术:
2.肿瘤是人类共同面临的重大疾病,随着环境污染和生活压力的增加,肿瘤发病率更是逐年提升。治疗肿瘤的方式主要有针对局部肿瘤的手术切除和放射线杀伤,以及利用化学药物杀伤肿瘤细胞的方法,这些方法均有无法根除疾病、易复发、副作用大的缺点。随着现代免疫学的发展,人们认识到免疫功能的稳定在肿瘤发生、发展、转移、逆转、消退中占有重要地位。肿瘤是一个复杂的体系,除了自身的肿瘤细胞,其微环境还包含许多常驻细胞类型,如脂肪细胞、成纤维细胞、巨噬细胞、嗜中性粒细胞和肥大细胞。其中巨噬细胞在肿瘤发生、发展、转移中常常起着至关重要的作用。巨噬细胞是机体固有免疫系统中重要的细胞组分,具有高度异质性。根据激活方式不同,本质上将巨噬细胞分为具有促炎、杀伤作用的经典激活巨噬细胞(classically activated macrophages,m1型)和具有抑炎、修复功能的替代激活巨噬细胞(alternative activated macrophages,m2型)。病理学研究显示,许多疾病的发生与巨噬细胞极性有关,如关节炎、动态粥样硬化、肥胖等由于病灶部位有大量m1巨噬细胞,其分泌的促炎因子,加重机体损伤;另外,巨噬细胞m2极性过强,也会引发哮喘、纤维化、寄生虫感染及肿瘤等疾病,因此维持巨噬细胞m1和m2极性的平衡对机体健康至关重要。大多数肿瘤内的巨噬细胞呈现m2型,促进肿瘤的生长,因此敲除肿瘤内的巨噬细胞是很多研究者尝试的方法。研究表明通过巨噬细胞特异性受体csf1r单克隆抗体或小型酪氨酸激酶抑制剂阻断csf1r信号传导,继而消除肿瘤的tam,可以抑制肿瘤的生长。此外,阻断ccr2受体,阻止肿瘤对巨噬细胞的招募,从而减少肿瘤内tam,也能达到抑制肿瘤生长的目的。但这种方法无法准确区分肿瘤中的所有巨噬细胞和其他区域巨噬细胞,简单粗暴的消除会引起副作用和长期毒性;另外将巨噬细胞消除后,肿瘤内的免疫系统缺少一项重要环节,不能激活体内其他免疫细胞。因此将tam转变为具有抗肿瘤功能的m1巨噬细胞被认为是一种更好的潜在治疗方法。
3.肿瘤坏死因子超家族成员15(tumor necrosis factor superfamily
‑
15,tnfsf15,又称tl1a),是一种主要由成熟血管内皮细胞分泌的血管生长抑制因子。研究发现它不仅是一种血管负调控因子,能够抑制肿瘤内血管新生和肿瘤生长;还可作为一种免疫激活剂,促进t细胞活化和树突状细胞成熟。目前,尚未有关于tnfsf15和巨噬细胞之间关系的报道。
技术实现要素:
4.本发明的目的是提供一种tnfsf15蛋白作为巨噬细胞免疫增强剂的用途及其活化方法,以解决上述现有技术存在的问题,该蛋白能增强巨噬细胞m1极性,使其具有杀伤作用,为肿瘤治疗提供治疗方案。
5.为实现上述目的,本发明提供了如下方案:
6.本发明提供一种tnfsf15蛋白作为巨噬细胞免疫增强剂在制备治疗肿瘤药物中的用途。
7.进一步地,在该用途中,将治疗有效量的tnfsf15蛋白与药学上可接受的载体和/或赋形剂混合制成组合物。
8.进一步地,所述巨噬细胞被活化为m1型。
9.在该用途中,tnfsf15蛋白增加肿瘤中巨噬细胞比例,尤其是抗原呈递蛋白(mhc2和cd86)阳性的m1巨噬细胞,且抑制肿瘤的生长。当肿瘤中的巨噬细胞,尤其是m1巨噬细胞被巨噬细胞清除剂消除后,tnfsf15蛋白的抑制肿瘤生长作用被削弱。
10.具体地,构建tnfsf15过表达质粒,慢病毒感染llc细胞,筛选出过表达tnfsf15的细胞株,与对照细胞,以每只小鼠5
×
105llc细胞量接种在c57bl/6肩部,两周后,观察到tnfsf15蛋白抑制了肿瘤生长,且增加肿瘤中巨噬细胞,尤其是m1巨噬细胞的浸润,当这些巨噬细胞被巨噬细胞清除剂(clodronate liposomes,cl)清除后,tnfsf15的抑制肿瘤生长作用减弱。
11.本发明还提供一种巨噬细胞在体外活化为m1型巨噬细胞的方法,所述方法包括巨噬细胞在包括tnfsf15蛋白的极化培养基中进行培养的步骤。
12.进一步地,所述tnfsf15蛋白在极化培养基中的浓度不高于10μg/ml。
13.进一步地,所述巨噬细胞为小鼠巨噬细胞,包括小鼠m
‑
csf或gm
‑
csf诱导的骨髓来源巨噬细胞、小鼠腹腔巨噬细胞和/或巨噬细胞系raw264.7。
14.进一步地,所述方法具体包括如下步骤:将巨噬细胞于孵箱中培养12小时,培养条件为37℃,5%co2,吸弃培养基,加入新鲜含有tnfsf15的极化培养基,培养24h,巨噬细胞向m1型活化。
15.具体地,该方法包括如下步骤:
16.取出小鼠骨髓细胞用(rpmi 1640+15%fbs+50ng/ml m
‑
csf/gm
‑
csf因子)培养基重悬,调整细胞浓度为2
×
106/ml,每孔2ml,加入孔板(如6孔板)中,于孵箱中(37℃,5%co2)培养7天。待骨髓细胞诱导成为巨噬细胞的比例达到85%以上,吸弃培养基,加入新鲜含有tnfsf15的极化培养基(rpmi 1640+10%fbs+3μg/ml tnfsf15蛋白),培养24h。
17.将小鼠巨噬细胞系raw264.7细胞用(rpmi 1640+10%fbs)培养基重悬,调整细胞浓度为2
×
105/ml,每孔1ml,加入孔板(如12孔板)中,于孵箱中(37℃,5%co2)培养12小时后,吸弃培养基,加入新鲜含有tnfsf15的极化培养基(rpmi 1640+10%fbs+3μg/ml tnfsf15蛋白),培养24h。
18.从小鼠腹腔中取出腹腔细胞,用(rpmi 1640+10%fbs)培养基重悬,调整细胞浓度为2
×
106/ml,每孔2ml,加入孔板(如6孔板)中,于孵箱中(37℃,5%co2)培养6小时后,吸弃培养基,用psb清洗两次以冲洗掉未贴壁的细胞,加入新鲜含有tnfsf15的极化培养基(rpmi 1640+10%fbs+3μg/ml tnfsf15蛋白),培养24h。
19.本发明还提供一种用于体外活化巨噬细胞的极化培养基,所述极化培养基中包括tnfsf15蛋白。
20.进一步地,所述极化培养基中tnfsf15蛋白的浓度不高于10μg/ml。
21.进一步地,所述极化培养基的组成为:rpmi 1640+10%fbs+3μg/ml tnfsf15蛋白。
22.本发明公开了以下技术效果:
23.(1)本发明tnfsf15蛋白通过增强肿瘤微环境中巨噬细胞m1极性,达到肿瘤治疗的目的,可以广泛地应用于肿瘤治疗中。
24.(2)与化疗方式相比,tnfsf15作为生物蛋白,具有毒性小,安全性更高的特点。
25.(3)本发明tnfsf15能够有效增强不同来源巨噬细胞m1极性,可应用在m2极性过强的相关疾病,如哮喘、纤维化、寄生虫感染、细菌感染。
26.(4)本发明tnfsf15纯化方法简单大量,经济成本较低廉,可与其他治疗方式联合治疗,具有很广的应用前景。
附图说明
27.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
28.图1为tnfsf15蛋白处理骨髓来源巨噬细胞后,其极性变化情况。
29.图2为tnfsf15蛋白处理腹腔巨噬细胞后,其极性变化情况。
30.图3为tnfsf15蛋白处理巨噬细胞系raw264.7细胞后,其极性变化情况。
31.图4为tnfsf15蛋白处理巨噬细胞系raw264.7细胞后,其吞噬大肠杆菌的变化情况,其中,a为巨噬细胞raw264.7处理组和未处理组图示大肠杆菌的荧光照片,b为对a图巨噬细胞吞噬大肠杆菌平均荧光强度的统计分析。
32.图5为tnfsf15蛋白处理巨噬细胞系raw264.7细胞后,其杀伤肿瘤细胞情况,其中,a为tnfsf15蛋白处理巨噬细胞系raw264.7细胞后,其吞llc肿瘤细胞的变化情况,b为tnfsf15蛋白处理巨噬细胞系raw264.7细胞后,其上清对llc肿瘤细胞引起的细胞凋亡的变化情况。
33.图6为tnfsf15蛋白上调m1巨噬细胞的比例抑制肿瘤生长,其中,a为tnfsf15蛋白对llc移植瘤的影响;b为tnfsf15蛋白对肿瘤内m1巨噬细胞的影响;c为tnfsf15蛋白对肿瘤内m2巨噬细胞的影响;d为tnfsf15蛋白对肿瘤内m1/m2巨噬细胞比例的影响。
34.图7为清除巨噬细胞消除tnfsf15蛋白对肿瘤内巨噬细胞和肿瘤生长的影响,其中,a为tnfsf15蛋白及巨噬细胞清除剂clodronate对llc移植瘤内mhc ii
+
的m1巨噬细胞的影响,b为tnfsf15蛋白及巨噬细胞清除剂clodronate对llc移植瘤内cd86
+
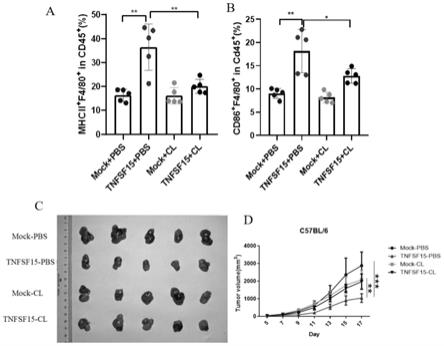
的m1巨噬细胞的影响,c为tnfsf15蛋白及巨噬细胞清除剂clodronate不同处理组的llc移植瘤图片,d为tnfsf15蛋白及巨噬细胞清除剂clodronate不同处理组的llc移植瘤肿瘤体积的变化情况。
具体实施方式
35.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
36.应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中
间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
37.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
38.在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见得的。本发明说明书和实施例仅是示例性的。
39.关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
40.实施例1tnfsf15蛋白对巨噬细胞活化的影响
41.1)骨髓来源巨噬细胞的获得
42.(1)、准备:将洁净的手术器械(至少两把小剪刀、小镊子)、纱布(8层,共需20块左右),尼龙膜(70μm孔径,10小块),置于饭盒中,高压灭菌,120℃,20min;
43.(2)、取出骨髓细胞:处死5周雄鼠,取出后腿骨,一只腿可以取出三截相连的骨头,用纱布剔除干净周围的组织,剪掉骨头两端的关节,用1ml注射器吸取pbs冲出骨髓细胞。冲出的骨髓细胞聚集在一起,呈现红色片状,用1ml注射器和移液枪吹打,使之分散为单细胞悬液;
44.(3)、将收集的骨髓细胞用70μm尼龙网过滤,400g,4℃离心5min,弃上清;
45.(4)、裂解红细胞:加2ml红细胞裂解液,重悬,置于冰上,3min后加入10ml含有2%fbs的pbs溶液,混匀;
46.(5)、400g,4℃离心5min,弃上清,加10ml 2%fbs的pbs溶液,混匀;
47.(6)、计数:吸取10μl上述细胞悬液,稀释一定倍数,用细胞计数板在显微镜下计数。10ml细胞总数=四大格细胞总数/4
×
104×
倍数
×
10ml;
48.(7)、4℃,400g离心5min,弃上清,用(rpmi 1640+15%fbs+50ng/ml m
‑
csf或gm
‑
csf因子)培养基重悬,调整细胞浓度为2
×
106/ml,每孔2ml,加入孔板(如6孔板)中,于孵箱中(37℃,5%co2)培养7天;
49.(8)、在培养3d、5d用(rpmi 1640+15%fbs+50ng/ml m
‑
csf或gm
‑
csf因子)培养基进行半量换液,待到7d收取细胞,以f4/80为marker,进行流式检测,f4/80
+
比例达到80%以上,即认为获取到骨髓来源巨噬细胞。
50.2)腹腔巨噬细胞获得
51.(1)、在分离巨噬细胞前5天,给小鼠以每只1ml的量腹腔注射无菌的4%巯基醋酸盐培养基,聚集巨噬细胞;
52.(2)、分离巨噬细胞当天,断颈初试小鼠,置于解剖板上,腹腔注射预冷的不含血清的rpmi
‑
1640培养基5ml,轻柔按摩小鼠腹部5min,之后静置5min;
53.(3)、在无菌条件下剖开小鼠腹部,用5ml注射器抽取腹腔液(黄色时巨噬细胞多);
54.(4)、将腹腔液过200目筛子,用预冷的培养皿收集滤液,之后将培养皿中的细胞悬
液收集至15ml预冷的离心管中;
55.(5)、4℃,1200rpm离心5min;
56.(6)、弃上清,尽量倒干净,加2ml红细胞裂解液,重悬,置于冰上,3min后加入10ml含有2%fbs的pbs溶液,混匀;
57.(7)、4℃,1200rpm离心5min,可进行下一步染色流式分析;若继续培养巨噬细胞,延续下面步骤;
58.(8)、弃上清,将沉淀用含10%fbs的rpmi
‑
1640培养基重悬,调整细胞浓度至2
×
106/ml,以每孔4
×
106细胞铺于六孔板中,37℃,5%co2培养;
59.(9)、6h后,弃上清,用不含fbs的rpmi
‑
1640洗2遍;
60.(10)、用含10%fbs的rpmi
‑
1640培养基,在37℃5%co2培养箱中继续培养。
61.3)raw264.7细胞的准备
62.将小鼠巨噬细胞系raw264.7细胞用(rpmi 1640+10%fbs)培养基重悬,调整细胞浓度为2
×
105/ml,每孔1ml,加入孔板(如12孔板)中,于孵箱中(37℃,5%co2)培养。
63.4)m1巨噬细胞的诱导
64.将巨噬细胞培养基替换成含有tnfsf15蛋白的诱导培养基(rpmi 1640+10%fbs+3μg/ml tnfsf15蛋白),培养24h。
65.5)结果分析:
66.由图1可知,与对照组相比,tnfsf15蛋白活化骨髓来源巨噬细胞为m1型;由图2可知,tnfsf15蛋白活化腹腔巨噬细胞为m1型;由图3可知,tnfsf15蛋白活化巨噬细胞系raw264.7细胞为m1型。由此可知,tnfsf15蛋白能够活化巨噬细胞为m1型。
67.实施例4tnfsf15蛋白对巨噬细胞吞噬细菌的影响
68.1)raw264.7细胞的处理
69.raw264.7铺于底部放有爬片圆片的二十四孔板中,12h后,加入buffer和tnfsf15处理24h;
70.2)吞噬操作
71.(1)、取一定量的荧光颗粒溶解在无菌无血清培养基中,使颗粒的终浓度为107/ml,超声处理30min,注意避光和无菌;
72.(2)、吸弃细胞上清液,用pbs清洗一遍,于每孔中加入300μl溶解有荧光颗粒的无血清培养基;
73.(3)、37℃孵育10min,30min,60min;
74.(4)、孵育完成,用预冷的pbs清洗两遍;
75.(5)、每孔加入300μl 4%的多聚甲醛,室温固定20min;
76.(6)、吸弃4%多聚甲醛,pbst清洗两遍;
77.(7)、加入300μl含有0.1%triton
‑
100和5%bsa的pbs,室温放置15min;
78.(8)、吸弃,pbst清洗两遍;
79.(9)、每孔加入200μl biotin
‑
f4/80抗体稀释液(1:100);37℃孵育60min;
80.(10)、吸弃一抗,加入pbst放置5min,吸弃,重复3次;
81.(11)、每孔加入200μl pe
‑
streptavidin(1:150))抗体稀释液,室温避光孵育60min;
82.(12)、吸弃二抗,加入pbst放置5min,吸弃,重复3次;
83.(13)、每孔加入200μl dapi稀释液(1:1000),室温避光10min;
84.(14)、吸弃,pbst清洗一遍;
85.(15)、用镊子将爬片圆片取出,封片;
86.(16)、使用激光扫描共聚焦显微镜拍摄,保存图片;
87.(17)、吞噬指数(pi)=被吞噬荧光颗粒总数/巨噬细胞总数,由于吞噬的荧光颗粒无法清晰计数,常用荧光强度来代替。
88.3)结果分析:
89.由图4可知,tnfsf15蛋白显著增加了raw264.7细胞对大肠杆菌的吞噬,因此tnfsf15蛋白能够增强巨噬细胞的吞噬能力。
90.实施例5tnfsf15蛋白对巨噬细胞杀伤肿瘤细胞的影响
91.1)tnfsf15蛋白对巨噬细胞吞噬肿瘤细胞的影响
92.(1)、raw264.7细胞铺于六孔板12h后,加入buffer和tnfsf15处理24h;
93.(2)、待llc,4t1密度达90%以上时,弃去细胞培养基,按照1:4000将calcein溶解在无血清培养基中(终浓度:1mm),加到llc和4t1中,37℃孵育30min;
94.(3)、分别将raw264.7、llc、4t1消化下来,清洗,计数,按照巨噬细胞:肿瘤细胞=1:2的比例将control组raw264.7和tnfsf15组raw264.7分别与llc、4t1混合,重悬在无血清培养基中,铺于24孔超低黏附板中,37℃孵育2h;
95.(4)、将每孔的细胞重悬,转移到1.5ml ep管中,200g离心5min;
96.(5)、每管加入100μl biotin
‑
f4/80抗体稀释液(1:100),4℃孵育30min;
97.(6)、200g离心5min,弃去一抗,pbs清洗一遍;
98.(7)、每管加入100μl apc
‑
streptavidin(1:150))抗体稀释液,4℃孵育30min;
99.(8)、200g离心5min,加入细胞固定液重悬,过70μm筛网,流式上机检测。
100.(9)、吞噬百分比=吞噬肿瘤细胞的巨噬细胞/总巨噬细胞
×
100%。
101.2)tnfsf15蛋白对巨噬细胞促进肿瘤细胞凋亡的影响
102.获取raw264.7上清液
103.将raw264.7调整密度为5
×
105/孔铺于六孔板中,12h后孔中加入对应buffer和tnfsf15刺激,24h后吸集细胞上清液在离心管中,500g离心10min,去除沉淀,将上清液转移到新的离心管中,储存于
‑
20℃备用;
104.处理llc肿瘤细胞
105.(1)、先用marker笔在未使用的6孔板底部,均匀地画三条横线和竖线,且间距保持一致;
106.(2)、以5
×
105/well密度将llc铺在六孔板中;
107.(3)、待细胞长满,用黄色枪头沿着标记在细胞上横平竖直划出痕迹;
108.(4)、吸弃培养基,用pbs清洗掉划起的细胞,在显微镜下拍摄,记录0时划痕宽度和细胞生长状态;
109.(5)、加入正常培养基或raw264.7条件培养基,培养24h后,再次拍摄,记录24h划痕宽度和细胞生长状态。
110.(6)、收取不同处理后的llc细胞的蛋白样,检测凋亡相关蛋白caspase3表达情况。
111.3)结果分析:
112.由图5可知,tnfsf15蛋白增加raw264.7细胞对llc肿瘤细胞的吞噬,而且llc细胞在tnfsf15处理后的raw264.7上清中,其caspase3被剪切激活,因此可知,tnfsf15蛋白能增强巨噬细胞的杀伤能力。
113.实施例6tnfsf15蛋白对肿瘤中巨噬细胞的影响
114.1)获得高表达tnfsf15细胞系或制备tnfsf15重组蛋白
115.(1)、构建plvx
‑
puro
‑
tnfsf15质粒;或制备tnfsf15重组蛋白已申请专利cn107541536a(此处是其新的药用作用)。
116.(2)、将plvx
‑
puro
‑
tnfsf15、pspax2和pmd.2g转染进293t细胞后,收集上清病毒液,转染llc细胞。并通过有限稀释法进一步筛选过表达tnfsf15细胞株;
117.2)tnfsf15过表达肿瘤模型的建立
118.(1)、将上述构建的过表达htnfsf15的llc与对照llc细胞系复苏培养,长至一定数量,消化下来,用pbs清洗两次,再以5
×
105/ml的密度重悬于无血清培养基中。
119.(2)、按照每只小鼠5
×
105/100μl的量,将细胞种植到c57bl/6j鼠皮下。每隔两天测量瘤子大小,记录老鼠体重,直至收取肿瘤。瘤子体积(mm3)=长
×
宽
×
宽/2。
120.3)分析肿瘤中巨噬细胞极性
121.(1)、从小鼠身上取下肿瘤组织,并用小剪刀剪碎,加入胰酶,在37℃水浴中消化30min,每隔10min摇晃一次。
122.(2)、消化完成用,用含有10%血清的培养基中和,离心;
123.(3)、用pbs清洗一次,接着在不锈钢70μm细胞筛网上用ep管盖轻轻研磨,可加pbs冲洗,使之分散为单个细胞。
124.(4)、离心,用pbs清洗一次,加入红细胞裂解液,冰上裂解5min,因为红细胞裂解液无色,此时溶液颜色的深浅可体现红细胞数量的多少;
125.(5)、用含有2%血清的pbs中和,用pbs清洗一次,过70μm尼龙膜,获得肿瘤单细胞悬液;
126.(6)、接下来将细胞转移到1.5ml ep管中,400g离心,5min,弃上清;
127.(7)、按照抗体说明,以1:100的比例将cd45、f4/80、cd86、mhcii抗体稀释在pbs中,离心后的细胞,加入100μl抗体稀释液,用移液枪轻柔吹打混匀,4℃避光孵育30min;
128.(8)、400g离心,5min,弃上清,加入1ml pbs洗涤;
129.(9)、400g离心,5min,弃上清,加入200μl pbs重悬,过70μm筛网后,转移到流式管中,即可上机检测分析。
130.由图6可知,tnfsf15在肿瘤组织中过表达抑制肿瘤生长,且增加m1巨噬细胞的比例,抑制m2巨噬细胞比例,因此可知,tnfsf15蛋白提升肿瘤中m1/m2巨噬细胞比例,改善肿瘤免疫微环境。
131.实施例7tnfsf15蛋白与肿瘤中巨噬细胞和肿瘤抑制的关系
132.1)建立巨噬细胞清除的tnfsf15过表达llc肿瘤模型
133.(1)、将上述构建的过表达htnfsf15的llc与对照llc细胞系复苏培养,长至一定数量,消化下来,用pbs清洗两次,再以5
×
105/ml的密度重悬于无血清培养基中。
134.(2)、按照每只小鼠5
×
105/100μl的量,将细胞种植到c57bl/6j鼠皮下,待到肿瘤
长至7d后,将llc
‑
tnfsf15和llc
‑
mock小鼠分别随机分成两组;
135.(3)、将巨噬细胞清除剂(clodronate liposomes,cl)和无菌pbs从冰箱取出,自然恢复至室温。上下颠倒混匀,按照组别给每只小鼠腹腔注射200μl;
136.(4)、每隔三天给药一次,每隔两天测量瘤子大小,记录老鼠体重,直至收取肿瘤。瘤子体积(mm3)=长
×
宽
×
宽/2)。
137.2)分析肿瘤中巨噬细胞极性
138.(1)、从小鼠身上取下肿瘤组织,并用小剪刀剪碎,加入胰酶,在37℃水浴中消化30min,每隔10min摇晃一次。
139.(2)、消化完成用,用含有10%血清的培养基中和,离心;
140.(3)、用pbs清洗一次,接着在不锈钢70μm细胞筛网上用ep管盖轻轻研磨,可加pbs冲洗,使之分散为单个细胞。
141.(4)、离心,用pbs清洗一次,加入红细胞裂解液,冰上裂解5min,因为红细胞裂解液无色,此时溶液颜色的深浅可体现红细胞数量的多少;
142.(5)、用含有2%血清的pbs中和,用pbs清洗一次,过70μm尼龙膜,获得肿瘤单细胞悬液;
143.(6)、接下来将细胞转移到1.5ml ep管中,400g离心,5min,弃上清;
144.(7)、按照抗体说明,以1:100的比例将cd45、f4/80、cd86、mhcii抗体稀释在pbs中,离心后的细胞,加入100μl抗体稀释液,用移液枪轻柔吹打混匀,4℃避光孵育30min;
145.(8)、400g离心,5min,弃上清,加入1ml pbs洗涤;
146.(9)、400g离心,5min,弃上清,加入200μl pbs重悬,过70μm筛网后,转移到流式管中,即可上机检测分析。
147.由图7可知,tnfsf15在肿瘤组织中过表达增加m1巨噬细胞的比例,且抑制肿瘤生长,而在巨噬细胞清除剂的使用下,m1巨噬细胞的比例降低后,tnfsf15的肿瘤抑制效果被削弱,因此可知,tnfsf15通过增强肿瘤中巨噬细胞免疫活性,抑制肿瘤生长。
148.以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1