CTRP13脂肪因子的新用途
ctrp13脂肪因子的新用途
技术领域
1.本发明属于医药领域,尤其涉及ctrp13脂肪因子的一些新用途。
背景技术:
2.人c1q肿瘤坏死因子相关蛋白13,英文名称为ctrp13,别名为complement c1q like 3;c1q and tumor necrosis factor
‑
related protein 13;complement component 1,q subcomponent
‑
like 3;complement c1q
‑
like protein 3;包含255个氨基酸,其分子量为26719da。
3.ncbi参考序列号:np_001010908.1,氨基酸序列如下:
4.mvlllvilipvlvssagtsahyemlgtcrmvcdpyggtkapstaatpdrglmqslptfiqgpkgeagrpgkagprgppgepgppgpmgppgekgepgrqglpgppgapglnaagaisaatystvpkiafyaglkrqhegyevlkfddvvtnlgnhydpttgkftcsipgiyfftyhvlmrggdgtsmwadlcknnqvrasaiaqdadqnydyasnsvvlhlepgdevyikldggkahggnnnkystfsgfiiyad。
5.近年来,补体c1q/tnf相关蛋白(c1q/tnf
‑
related proteins,ctrps)家族成员针对代谢紊乱性疾病的研究引起了极大的关注,其中包括代谢综合征和糖尿病。ctrp13脂肪因子(下称ctrp13)是ctrps家族成员中一种高度保守的新型脂肪因子,其参与对心血管及代谢相关疾病的调控作用。研究表明血糖水平影响ctrp13的表达,来自不同群体的多条证据已经证明,在包括脂肪肝、糖尿病在内的代谢性疾病中,血清ctrp13的表达水平明显降低。与这些研究一致,我们的前期研究也发现ctrp13能够明显抑制泡沫细胞形成,延迟动脉粥样硬化的发展。同时,我们也发现ctrp13能够减少肾衰血管钙化及高血压致腹主动脉瘤的发生率,因此我们推测ctrp13也可能在血管生物学,特别是血管重塑的发展调节中起着重要作用。目前尚不明确是否ctrp13可以作为血管损伤后再狭窄药物应用的潜能。
6.血管再狭窄是经介入手术(包括血管外科手术,心脏外科手术和血管成形术等)治疗后动脉管腔再次发生缩窄的现象,血管再狭窄通常在血运重建后3
‑
8个月进行测量,并且任意定义为与参考动脉相比,血管直径永久缩小大于50%。患者在冠状动脉介入治疗(pci)手术时,支架的植入会引起内皮细胞的损伤和剥脱,血管对损伤刺激发生反应,从而诱发炎症反应、血栓形成、纤维蛋白沉积、血小板聚集和白细胞募集等一系列反应,最后导致细胞外基质沉积和smcs增殖。一方面,支架植入极大地改善了临床结果。另一方面,它与会引起血管损伤反应,再加上慢性留置支架的作用,炎症级联反应是引发再狭窄的关键因素。
7.血管平滑肌细胞(vsmc)的表型可分为分化程度较高的收缩型和分化程度较低的分泌型,这两种表型代表了共存于血管壁内一系列不同表现型的两个极端类型,且表达不同的基因和蛋白。正常成人动脉血管的vsmc以收缩型为主,其主要功能是维持血管的弹性和收缩血管。收缩型vsmc增殖、迁移能力差或无,胞体呈梭形或带状,含大量肌丝和结构蛋白;而分泌型vsmc主要存在于胚胎中期血管和病理血管中,其主要功能是增殖、迁移入内膜以及合成细胞外基质蛋白。vsmc从收缩型向分泌型转换的过程称为vsmc的表型转换。研究表明丝裂原活化蛋白激酶(mapk)、pi
‑3‑
k、环一磷酸腺苷(camp)这三种信号传导途径参与
vsmc的表型转换,通过的受体包括vegfr、血小板源性生长因子受体(pdgfr)等。vsmc的异常增殖和迁移是高血压、肺动脉高压等血管疾病发生发展的共同病理特征,同时也是引起血管损伤后再狭窄的重要原因,而vsmc表型转化在vsmc增殖和迁移过程中发挥了重要作用。
8.目前有许多药物可以用于再狭窄的预防,包括抗血小板和抗凝药物、他汀类药物、血管紧张素转换酶抑制剂、维生素和一些抗增殖药等。但是越来越多的证据表明这些药物对再狭窄的预防作用不太显著。目前局部使用药物中临床效果较好且副作用低的主要是抗增殖药物类,例如西罗莫司及其衍生物(如依维莫司、唑他莫司等)和紫杉醇等,已经在药物涂层支架中广泛使用。吡格列酮、曲尼斯特、抗炎药如泼尼松、秋水仙碱等药物目前正在临床试验,有望在未来应用到临床治疗中。已有的研究表明ctrp13具有调节细胞信号分子及转录协调节活性,其在血管损伤后再狭窄中的作用尚无研究。
技术实现要素:
9.针对上述问题,本发明提供ctrp13一些新的用途以及一些疾病新的治疗药物,主要解决了现有ctrp13以及弥补一些血管疾病中研究空白。
10.为了解决上述问题,本发明采用如下技术方案:
11.ctrp13脂肪因子在制备pdgfrβ抑制剂中的应用。
12.ctrp13在制备pdgfrβ磷酸化抑制剂和/或pdgfr下游信号通路抑制剂中的应用。
13.pdgfrβ磷酸化和/或pdgfr下游信号通路的抑制剂,包括ctrp13。
14.pdgfrβ磷酸化和/或pdgfr下游信号通路抑制剂在制备平滑肌表型转换抑制药剂中的应用。
15.ctrp13在制备平滑肌表型转换抑制药剂中的应用。
16.平滑肌细胞或血管平滑肌细胞表型转换抑制药剂,至少包括下列之一:
17.a.ctrp13,
18.b.pdgfrβ磷酸化抑制剂,
19.c.pdgfr下游信号通路抑制剂。
20.ctrp13在制备防治血管疾病药物中的应用。
21.ctrp13在制备防治血管再狭窄药物中的应用。
22.防治血管疾病的药物,至少包括下列之一:
23.a.ctrp13,
24.b.pdgfrβ磷酸化抑制剂,
25.c.pdgfr下游信号通路抑制剂,
26.d.平滑肌表型转换抑制药剂。
27.一些方式中,所述血管疾病为血管再狭窄。
28.ctrp13在制备泡沫细胞抑制剂中的应用。
29.泡沫细胞抑制剂,包括ctrp13。
30.ctrp13在制备防治肾衰血管钙化和/或高血压致腹主动脉瘤疾病药物中的应用。
31.防治肾衰血管钙化和/或高血压致腹主动脉瘤疾病的药物,包括ctrp13。
32.本发明的有益效果是:
33.ctrp13对pdgfrβ有抑制作用,因此ctrp13可以抑制平滑肌表型转换,从而预防和/
或治疗血管损伤后再狭窄。此外,ctrp13并无通常心血管药物或其他平滑肌表型转换抑制剂的细胞毒作用,因此可以预期其安全性。其可以作为治疗平滑肌参与的相关疾病如血管再狭窄、肿瘤等疾病的药物而广泛应用。
附图说明
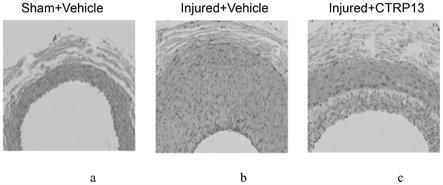
34.图1为a为假手术+载体处理组,b为结扎+载体处理组,c为结扎+ctrp13处理组处理后,利用油红
‑
苏木精(he)染色实验检测大鼠颈动脉球囊损伤后的血管形态;
35.图2为不同浓度的ctrp13和载体(dmso)利用edu实验检测vsmc细胞增殖情况;
36.图3为vsmc细胞给予pdgf
‑
bb处理后,分别给予ctrp13(100,200,300ng/ml)和载体(dmso)刺激,蛋白印迹实验检测细胞周期蛋白和抑癌蛋白的表达;
37.图4为vsmc细胞给予pdgf
‑
bb处理后,分别给予ctrp13(100,200,300ng/ml)和载体(dmso)刺激,不同浓度的ctrp13及载体利用蛋白印迹实验检测细胞凋亡有关蛋白的表达情况;
38.图5为vsmc细胞给予pdgf
‑
bb处理后,分别给予ctrp13(100,200,300ng/ml)和载体(dmso)刺激,不同浓度的ctrp13利用transwell实验检测细胞迁移情况;
39.图6为smc细胞给予pdgf
‑
bb处理后,分别给予ctrp13(100,200,300ng/ml)和载体(dmso)刺激,不同浓度的ctrp13利用划痕实验检测细胞增殖迁移情况;
40.图7为大鼠颈动脉球囊损伤后,分别于大鼠给予载体和10mg/kg
·
dctrp13处理,不同浓度的ctrp13利用免疫荧光实验检测收缩基因αsma表达情况;
41.图8为vsmc细胞给予pdgf
‑
bb处理后,分别给予ctrp13(100,200,300ng/ml)和载体(dmso)刺激,不同浓度的ctrp13利用蛋白印迹实验检测pdgfrβ磷酸化水平情况。
具体实施方式
42.下面对本发明做进一步说明:
43.ctrp13在制备pdgfrβ磷酸化抑制剂和/或pdgfr下游信号通路抑制剂中的应用。
44.pdgfrβ磷酸化和/或pdgfr下游信号通路的抑制剂,包括ctrp13脂肪因子。
45.pdgfrβ磷酸化和/或pdgfr下游信号通路抑制剂在制备平滑肌表型转换抑制药剂中的应用。
46.ctrp13脂肪因子在制备平滑肌表型转换抑制药剂中的应用。
47.平滑肌表型转换主要表现为平滑肌细胞表型转换。
48.平滑肌表型转换抑制药剂,至少包括下列之一:
49.a.ctrp13脂肪因子,
50.b.pdgfrβ磷酸化抑制剂,
51.c.pdgfr下游信号通路抑制剂。
52.ctrp13在制备防治血管疾病药物中的应用。
53.ctrp13在制备防治血管再狭窄药物中的应用。
54.防治血管疾病的药物,至少包括下列之一:
55.a.ctrp13脂肪因子,
56.b.pdgfrβ磷酸化抑制剂,
57.c.pdgfr下游信号通路抑制剂,
58.d.平滑肌表型转换抑制药剂。
59.所述血管疾病为血管再狭窄。血管损伤后再狭窄包括pci再狭窄、支架内再狭窄、旁路移植后再狭窄。
60.ctrp13脂肪因子在制备泡沫细胞抑制剂中的应用。
61.泡沫细胞抑制剂,包括ctrp13脂肪因子。
62.ctrp13脂肪因子在制备防治肾衰血管钙化和/或高血压致腹主动脉瘤疾病药物中的应用。
63.防治肾衰血管钙化和/或高血压致腹主动脉瘤疾病的药物,包括ctrp13脂肪因子。
64.以下实施例应用细胞实验研究该药物对vsmc表型转换的抑制作用。
65.本实施例测试使用的ctrp13脂肪因子购自aviscera bioscience公司,型号00333
‑
01
‑
100。分别采用下述步骤中的方法检测如下实验中血管损伤再狭窄及vsmc的表型转换情况。
66.应用edu细胞增殖实验检测vsmc细胞增殖情况,应用细胞划痕和transwell实验检测vsmc细胞迁移情况。检测方法参见huang d,wang y,wang l,zhang f,deng s,wang r,zhang y,huang k.poly(adp
‑
ribose)polymerase 1is indispensable for transforming growth factor
‑
βinduced smad3 activation in vascular smooth muscle cell.plos one.2011;6(10):e27123.具体过程如下:
67.edu细胞增殖实验:将大鼠来源的原代细胞(vsmc)接种于96孔板中,分别使用不同浓度(100,200,300ng/ml)的ctrp13和载体dmso处理细胞4h。48h后,以上四组处理用pdgf
‑
bb(30ng/ml)刺激48h(对照组为等体积的dsmo),edu的掺入分析按照制造商的说明进行,结果用olympus cellsens entry拍摄。
68.细胞划痕实验:将vsmc接种于6孔板中,培养至80%密度。细胞单层用1ml的移液管尖端划伤。细胞与不同浓度的ctrp13预孵育4h后,用pdgf
‑
bb(30ng/ml)刺激48h(对照组为等体积的dsmo),然后在含有体积浓度比为10%的胎牛血清的dmem中培养。使用olympus cellsens entry观察细胞,使用image j程序测量伤口闭合率。
69.transwell法测定细胞迁移:vsmc经过ctrp13预处理4h,播种到上气室,500l dmem和体积浓度比为10%的胎牛血清和pdgf
‑
bb(30ng/ml)放置到下气室中。24h后,下气室用质量浓度为4%的甲醛固定细胞20分钟,质量浓度为0.1%的结晶紫染色20分钟。使用olympus cellsens通道对迁移的细胞进行拍照。
70.实施例1
71.对sd大鼠行颈动脉球囊损伤或假手术损伤后,分别腹腔注射ctrp13(10mg/kg
·
d)和载体(dmso)。14天后,老鼠被安乐死,对受伤的血管进行血管切除手术。用质量浓度为4%的甲醛固定石蜡包埋后,将血管切段。图1分别为假手术+载体处理组、球囊+载体处理组、球囊+ctrp13处理组处理后,利用油红
‑
苏木精(he)染色实验检测大鼠颈动脉球囊损伤后的血管形态。结果如图1所示。其中图1从左至右分别为假手术+载体处理组、球囊+载体处理组、球囊+ctrp13处理组大鼠颈动脉平均厚度统计图。由图1可知,与假手术+载体处理组相比,大鼠行颈动脉球囊损伤后,颈动脉厚度增长,即血管损伤导致血管内皮细胞过度增殖;而ctrp13可抑制血管损伤导致的血管内皮细胞过度增殖。
72.实施例2
73.vsmc细胞给予pdgf
‑
bb(30ng/ml)处理后,分别给予不同浓度的ctrp13(100,200,300ng/ml)和载体dmso刺激。图2为不同浓度的ctrp13利用edu实验检测vsmc细胞增殖情况。第一列为载体处理组,第二列为pdgf
‑
bb和载体处理组,第三列为pdgf
‑
bb和100ng/ml的ctrp13处理组,第四列为pdgf
‑
bb和200ng/ml的ctrp13处理组,第五列为pdgf
‑
bb和300ng/ml的ctrp13处理组。由图2可知,pdgf
‑
bb处理vsmc细胞后,edu阳性的细胞增多,进一步用ctrp13处理后,edu阳性的细胞减少,且随着ctrp13浓度增大,edu阳性的细胞量减少。综上,pdgf
‑
bb处理vsmc细胞后,可促进vsmc细胞的增殖,而ctrp13可抑制pdgf
‑
bb引起的细胞增殖,且随着ctrp13的浓度增大,抑制作用增强。
74.实施例3
75.vsmc细胞给予pdgf
‑
bb(30ng/ml)处理后,分别给予不同浓度的ctrp13(100,200,300ng/ml)和载体dmso进行刺激,收集细胞,提取蛋白后,利用蛋白印迹实验检测细胞周期蛋白和抑癌蛋白的表达,结果如图3所示。vsmc细胞在不同处理下,细胞周期蛋白(pcna、cyclind1)和抑癌蛋白(p27、p21)的表达。由图3可知,给予pdgf
‑
bb处理后,vsmc细胞中细胞周期蛋白表达上升,抑癌蛋白表达下降;给予ctrp13刺激后,细胞周期蛋白表达下降,抑癌蛋白表达上升;而细胞凋亡有关的蛋白表达量无明显变化。
76.实施例4
77.vsmc细胞给予pdgf
‑
bb(30ng/ml)处理后,分别给予不同浓度的ctrp13(100,200,300ng/ml)和载体dmso进行刺激,收集细胞,提取蛋白后,利用蛋白印迹实验检测细胞凋亡蛋白的表达(caspase 3、剪切的caspase 3、bcl
‑
2、bax),结果如图4所示。由图4可知,不同浓度的ctrp13对细胞凋亡有关蛋白的表达无明显影响。
78.实施例5
79.vsmc细胞给予pdgf
‑
bb(30ng/ml)处理后,分别给予不同浓度的ctrp13(100,200,300ng/ml)和载体dmso进行刺激,利用transwell实验检测细胞迁移情况。结果如图5所示。由图5可知,pdgf
‑
bb促进细胞的迁移,而ctrp13抑制了细胞的迁移,且随着浓度的增加,抑制作用增强。
80.实施例6
81.vsmc细胞给予pdgf
‑
bb处理后(30ng/ml),分别给予不同浓度的ctrp13(100,200,300ng/ml)和载体dmso进行刺激,利用划痕实验检测细胞增殖迁移情况,结果如图6所示。由图6可知,pdgf
‑
bb促进细胞划痕的闭合率,而ctrp13抑制了该促进作用,且随着ctrp13浓度的增加,对细胞划痕的闭合的抑制作用增强。
82.实施例7
83.分别对大鼠颈动脉球囊损伤后,给予大鼠载体dmso和10mg/kg
·
d ctrp13处理,利用免疫荧光实验检测收缩基因αsma表达情况,组织切片用smα
‑
actin一抗(体积比为1:100)4oc孵育过夜,然后用fitc结合的荧光二抗37oc孵育2h。核酸用dapi 37oc染色15min。切片最终用olympus cellsens entry观察成像。观察颈动脉形态,结果如图7所示。图7中第一列为假手术加空载处理组,第二列为手术加空载处理组,第三列为手术加ctrp13处理组。由图7可知,大鼠行颈动脉球囊损伤后,颈动脉壁加厚,而颈动脉中收缩基因αsma的表达量下降;进一步用ctrp13处理后,颈动脉壁厚度下降,收缩基因αsma的表达量上升。血管损伤后,血
管壁增厚,收缩基因αsma的表达量下降。
84.实施例8
85.vsmc细胞给予pdgf
‑
bb处理后,分别给予不同浓度的ctrp13(100,200,300ng/ml)和载体dmso进行刺激,利用蛋白印迹实验检测pdgfrβ磷酸化水平情况后,结果如图8所示。由图8可知vsmc细胞给予pdgf
‑
bb处理后,pdgfrβ磷酸化水平上升;进一步使用ctrp13处理后,pdgfrβ磷酸化水平下降,且随着ctrp13浓度的增加,pdgfrβ磷酸化水平下降。因此,pdgf
‑
bb促进了pdgfrβ的磷酸化,而ctrp13抑制了pdgfrβ的磷酸化,且随着ctrp13浓度的增加,该抑制作用加强。
86.ctrp13能够直接抑制血管损伤后再狭窄及vsmc的表型转换。
87.本领域的技术人员可以明确,在不脱离本发明的总体精神以及构思的情形下,可以做出对于以上实施例的各种变型。其均落入本发明的保护范围之内。本发明的保护方案以本发明所附的权利要求书为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1