基于胆囊癌标志物的试剂盒及药物
1.本发明涉及a61p 35/00技术领域。
背景技术:
2.胆囊癌(gallbladder cancer,简称gbc)是胆道恶性肿瘤最常见的形式,占胆道恶性肿瘤的80%
‑
95%。在过去的几十年中,胆囊癌治疗策略未取得实质性进展,且因缺乏典型症状,早期诊断率仅有19.1%,多数患者明确诊断时已处于中晚期阶段。目前为止,手术切除仍然是胆囊癌患者的主要治疗方法,然而手术切除并不适合晚期患者。胆囊癌对放疗、化疗等治疗措施均不敏感,故整体预后极差,国外流行病学研究表明胆囊癌术后5年生存率仅5%。除此之外,术后易复发或者转移很大程度上决定了晚期胆囊癌的不良预后。据报道,胆囊癌的发生是由复杂的遗传因素及环境因素造成的,然而,胆囊癌进展的分子机制尚不清楚。因此,探究用于确诊胆囊癌的早期检测的生物标志物和有效治疗策略是至关重要的。
3.pim家族,包括pim1,pim2和pim3,,pim1在胆囊癌中的表达水平和功能作用尚不清楚,这需要更多的研究。
技术实现要素:
4.本发明旨在解决现有技术中存在的技术问题。
5.为了探究胆囊癌中pim1的表达水平,我们采用了组织芯片技术和免疫组织化学技术,探究胆囊癌组织及邻近的癌旁组织标本中pim1蛋白表达水平,并通过蛋白印迹技术在胆囊癌组织及胆囊癌细胞中对结果进行进一步验证。在蛋白水平探究pim1的表达结果显示,胆囊癌中pim1表达显著高于癌旁组织。
6.为进一步探究pim1的表达和胆囊癌临床特征及预后之间的关系,本发明人证实了pim1在tnm分期为iii—iv期的样本中表达水平显著高于i—ii期样本;本发明人还证实了pim1在肿瘤发生远处转移的样本中表达水平显著高于肿瘤未发生远处转移的样本,本发明证实pim1分子可以用于制备、预测、筛查人胆囊癌扩散、肿瘤临床分期的试剂盒。
7.本发明人还进行kaplan
‑
meier生存分析,结果显示pim1基因高表达组患者生存时间显著短于pim1基因低表达患者,患病期间pim1表达的增加与胆囊癌的临床预后存在着密切的相关性。pim1表达可以作为胆囊癌预后生存时间的参考判断指标及预后生存风险预测参考。
8.为了进一步探究pim1基因在胆囊癌发生发展中的作用,本发明人采用pim1干扰rna及pim1特异性抑制剂sgi
‑
1776,分别抑制pim1在胆囊癌细胞中的表达,分析对胆囊癌细胞增殖、迁移、侵袭及细胞凋亡的影响,本发明人证实抑制pim1表达,胆囊癌细胞增殖、迁移、侵袭能力显著降低,细胞凋亡显著增加,胆囊癌标志物pim1还可作为筛选制备诊断、缓解或治疗胆囊癌的药剂的分子靶标。
9.本发明还应用慢病毒敲除的pim1的gbc
‑
sd细胞接种至裸鼠皮下,证实了抑制pim1表达对胆囊癌细胞体内成瘤能力的影响,本发明人发现pim1敲除的实验组与不进行敲除的
对照组相比,肿瘤体积、荧光表达显著降低,本发明再次证明胆囊癌标志物pim1还可作为筛选制备诊断、缓解或治疗胆囊癌的药剂的分子靶标。第一方面,本发明公开了人pim1蛋白,作为胆囊癌诊断和/或预后判断标志物的用途。
10.第二方面,本发明公开了人pim1蛋白用于制备试剂盒的用途,所述试剂盒用于胆囊癌诊断和/或预后判断;对应地,本发明提供了试剂盒,该试剂盒包含抗人pim1蛋白的抗体,且用于胆囊癌诊断和/或预后判断;抗体可为单克隆或多克隆抗体。试剂盒可用于诊断、预测、检测或筛查人胆囊癌细胞扩散、胆囊癌临床分期或胆囊癌患者预后。
11.第三方面,本发明提供了pim1蛋白抑制剂在制备抗胆囊癌药物中的用途,所述抑制剂为sgi
‑
1776、其药学上可接受的盐,或pim1特异性干扰rna。进一步地,所述药物用于缓解或治疗胆囊癌,或者用于改善胆囊癌患者的预后。
12.需注意的是,前面第1
‑
3任一方面所述的胆囊癌tnm分期可为iii—iv期(优选)或i—ii期。
13.本发明表明pim1在临床实践中有非常重要的意义,有可能成为新一代的肿瘤生物诊断标志物和用于肿瘤治疗的分子靶标;尤其是开辟了以pim1为主的胆囊癌疾病全新靶标的研究,也为研制抗肿瘤新药开辟新的途径。
附图说明
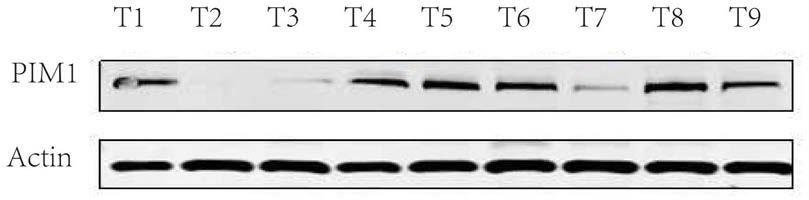
14.图1.1为蛋白印迹图,其中pim1对应表示胆囊癌组织中pim1蛋白的表达水平;
15.图1.2为蛋白印迹图,其中pim1对应表示四种胆囊癌细胞系pim1蛋白的表达水平。
16.图2.1表示通过组织芯片技术和免疫组织化学技术对胆囊癌及癌旁组织中pim1蛋白表达差异进行统计分析,我们发现:pim1在胆囊癌样本中表达水平显著高于癌旁样本;
17.图2.2a为pim1的表达水平与tnm分期的相关性分析,我们发现:pim1在tnm分期为iii
‑
iv的胆囊癌样本中表达水平显著高于i
‑
ii的胆囊癌样本;
18.图2.2b表示通过组织芯片技术和免疫组织化学技术对pim1的表达水平与胆囊癌远处转移情况的相关性进行统计分析,我们发现:pim1在合并转移的胆囊癌样本中表达水平显著高于未合并转移的胆囊癌样本;
19.图2.3为pim1表达水平与患者总体生存率间的相关性分析,kaplan
‑
meier生存分析结果显示pim1高表达组患者的总生存时间显著短于pim1低表达组的患者,即pim1高表达提示更差的临床预后。
20.图3.1a为实验3.1gbc
‑
sd胆囊癌细胞增殖对比图,图3.1b为实验3.1noz胆囊癌细胞增殖对比图;图3.2为实验3.2胆囊癌细胞迁移情况对比图;图3.3为实验3.3胆囊癌细胞侵袭情况对比图;各图中实验组为应用干扰rna抑制pim1的表达,对照组为未应用干扰rna的胆囊癌细胞,结果显示:pim1表达下调后,细胞增殖、迁移、侵袭能力显著减弱。
21.图4为pim1实验组和对照组裸鼠标准化光子通量变化曲线,该实验研究pim1下调后对裸鼠成瘤能力的影响,结果显示:pim1敲除的实验组,肿瘤体积显著低于对照组。
具体实施方式
22.下面通过几个典型实验解释本发明,本发明并不限于此。
23.一、western blot检测胆囊癌组织及细胞中pim1蛋白的表达
24.实验1.1:
25.将液氮保存的9例胆囊癌组织加入组织蛋白裂解液,用电动匀浆器在冰上进行充分研磨,置于冰上摇床反应1h,4℃10000r/min离心15min后取上清液。利用bca法酶标仪检测蛋白浓度,并将蛋白调整一致加入缓冲液100℃煮沸5min。分别将蛋白样品加至预制的12%聚丙烯酰胺凝胶泳道,在110v电压下电泳90min。蛋白电泳完成后电转移至硝酸纤维素膜,将膜置于含5%bsa的pbst液中封闭1h处理,在4℃环境中加入一抗孵育过夜,复温后荧光二抗孵育2h后使用发光图像分析仪分析抗体特异性条带的光密度,并用pim1蛋白/β
‑
actin的光密度比对相对蛋白质表达水平进行归一化分析。
26.结果发现:有6例胆囊癌组织检测到了明显的pim1的表达,如附图1.1所示。
27.实验1.2:
28.参照实验1.1,利用westernblot对胆囊癌细胞中pim1蛋白表达水平进行分析,胆囊癌细胞来自细胞系gbc
‑
sd、noz、ocgu1及sgc
‑
996,结果提示pim1在上述四个细胞系中均呈高表达,且在胆囊癌细胞gbc
‑
sd、noz中的表达,比sgc
‑
996、ocgu1细胞中更高,如附图1.2所示。
29.二、芯片实验
30.用免疫组化方法分析pim1蛋白在胆囊癌组织和癌旁组织中的表达
31.组织芯片:
①
构建胆囊癌肿瘤组织芯片,组织样本来源为郑州大学第一附属医院,其中包含胆囊癌组织52例、邻近的癌旁组织27例,临床信息包括性别、年龄、tnm分期、肿瘤大小、分级、随访信息等;芯片样本点的直径都为1.5mm,固定方式为福尔马林固定。
②
同时使用商业化组织芯片(上海芯超生物公司),包括79例胆囊癌组织、20例癌旁组织,临床信息包括性别、年龄、tnm分期、肿瘤大小、分级、随访信息等;芯片样本点的直径都为1.5mm,固定方式为福尔马林固定。
32.免疫组织化学主要操作步骤:
33.将组织芯片分别进行烤片、脱蜡、水化、修复抗原、封闭后,加入兔抗人pim1多克隆抗体(1:100稀释),4℃孵育过夜;滴加hrp标记的羊抗兔igg工作液,在37℃孵育60min,sabc试剂37℃孵育30分钟,然后用dab显色;苏木素复染;二甲苯透明,中性树胶封片。利用组织芯片扫描仪进行全景扫描,由2位资深病理医生分别独立评分,再通过讨论统一评分结果。根据染色程度划分五个等级,1分表示几乎无染色;2分表示弱染色;3分表示中度染色;4分表示强染色和5分极强染色。同时,将1分、2分和3分的定义为低表达,4分和5分视为高表达用于统计分析。
34.统计学处理:
35.作图软件采用graph pad prism5,图片整理采用adobe illustrator cs6,统计分析采用spss23.0。临床特征与pim1表达水平的差异采用卡方检验;探究胆囊癌独立危险因素采用单因素回归分析和多因素回归分析;pim1表达水平与胆囊癌患者总体生存时间的相关性采用kaplan
‑
meier生存分析。统计学分析结果p<0.05,认为差异具有统计学意义。
36.2.1:染色结果显示pim1亚细胞定位主要分布在细胞浆和细胞膜,阳性细胞呈现明显棕黄色或棕褐色颗粒,阴性细胞呈现为浅色颗粒或无色;pim1蛋白在胆囊癌组织中的表达水平高(阳性率为75.8%),而癌旁组织大部分中表现为低水平表达(阳性率为53.2%),两组间比较,差异具有统计学意义(p<0.05),如图2.1所示。
37.2.2pim1的表达水平与临床特征的关系
38.将随访患者的临床特征与pim1的表达水平进行卡方检验分析,结果显示,患者的年龄、性别及肿瘤大小与pim1的表达差异无统计学意义,肿瘤的tnm分期和远处转移与pim1表达差异有统计学意义。
39.2.2.1pim1的表达水平与tnm分期的相关性
40.tnm分期中ⅲ~ⅳ期的患者pim1表达水平明显高于ⅰ~ⅱ期的患者,差异具有统计学意义(p<0.05),利用graph pad prism5作图,见图2.2a。
41.图2.2a为pim1的表达水平与tnm分期的相关性分析。
42.2.2.2pim1的表达水平与发生远处转移的相关性
43.发生远处转移的患者pim1表达水平明显高于未发生远处转移的患者,差异具有统计学意义(p<0.05),见图2.2b。
44.2.3临床特征与患者总体生存率间的相关性
45.对随访资料完整的66例患者进行单因素回归分析,发现年龄、性别、肿瘤大小与患者的总体生存率无显著相关性(p>0.05),肿瘤的tnm分期、远处转移及pim1表达与患者的总体生存率存在显著相关性(p<0.05),为潜在危险因素;进一步多因素回归分析证实,高水平表达的pim1与患者的总体生存率存在显著相关性,是胆囊癌总体生存率的独立危险因素。
46.pim1表达水平与患者总体生存率间的相关性如图2.3所示:pim1高水平表达的患者总体生存率显著低于pim1低水平表达的患者,差异具有统计学意义(p<0.05)。
47.三、体外细胞实验
48.以来自胆囊癌gbc
‑
sd和noz两种细胞系的癌细胞为例,实验组用pim1特异性干扰rna抑制pim1在胆囊癌细胞中的表达,所用干扰rna的正义链序列自5
′
至3
′
为gauaugguguguggagauatt,反义链为uaucuccacacaccauauctt(去除tt后如序列1所示),对照组则对应为未经干扰rna处理的正常癌细胞,分析对胆囊癌细胞增殖、迁移及侵袭的影响;结果发现pim1表达下调后,细胞增殖、迁移、侵袭能力均显著减弱,具体描述如下:
49.实验3.1:cck
‑
8检测细胞增殖情况。
50.将处于对数生长期的转染筛选后细胞消化,细胞计数后调整细胞密度至适当浓度。以200ul/孔的体积将细胞悬液接种至96孔板中,37℃,5%co2培养箱中培养;在避光条件下,将cck8溶液以10ul/孔的体积加入上述96孔板,培养箱中孵育2h后,将酶联免疫检测仪上设置为450nm波长,检测各孔吸光度(a450)值。同时设置调零孔和对照孔,每组设定3个复孔。分别分析两组的均值及标准差,差异具有统计学意义(p<0.05)。
51.吸光度实验结果如图3.1a/3.1b所示。
52.实验3.2:细胞划痕检测细胞迁移情况。
53.细胞处理方法参见上述实验,将细胞悬液2ml/孔加至6孔板中,待每孔细胞汇合度达到80
‑
90%时,使用tip枪头在孔中划一直线,形成单层细胞间的划痕;然后用无菌pbs冲洗在划线过程中脱落的细胞,直至无脱落细胞存在。根据预先设计好的时间点,将6孔板置于显微镜下观察并拍照,测量细胞划痕间的迁移距离,实验重复三次。分别分析两组的均值及标准差,差异具有统计学意义(p<0.05)。结果如图3.2所示。
54.实验3.3:transwell实验检测细胞侵袭情况。
55.先将
‑
20℃保存的matrigel胶置于4℃冰箱过夜,再将matrigel胶按比例稀释于不
含血清的培养液中,然后均匀地铺满在transwell小室膜上,放置凝固;除去培养板里的残余培养基,每孔加入50ul含有10g/l bsa的无血清培养液,37℃孵育30min;将实验组及对照组细胞进行常规消化、离心后,用含有10g/l的bsa无血清培养液重悬细胞,调整细胞浓度;取200ul的细胞悬液接种到transwell小室的上室中,然后将transwell小室放入在24孔板孔内,24孔板下室加500ul含10%fbs的培养液;置于37℃、5%co2细胞培养箱中,常规培养36h;取出小室,用pbs冲洗,用湿润的棉签小心擦掉微孔膜内层的细胞,用95%乙醇固定,染色;显微镜下随机选取5个视野,计数穿过微孔膜下层的细胞数,取其平均值,每组3个小室,实验重复3次。分别分析两组的均值及标准差,差异具有统计学意义(p<0.05)。结果如图3.3所示。
56.实验组改用pim1蛋白抑制剂sgi
‑
1776抑制pim1表达,重复上述3个实验,结果亦发现:pim1表达下调后,细胞增殖、迁移、侵袭能力均显著减弱。
57.四、裸鼠成瘤实验:
58.对来自胆囊癌细胞系gbc
‑
sd的癌细胞,实验组用慢病毒敲除pim1,筛选后扩大培养,对照组则不进行慢病毒敲除,取各组对数生长期细胞制成细胞悬液,接种于裸鼠右侧腋窝皮下,建立裸鼠皮下移植瘤模型。定期(1周、2周、3周、4周、5周、6周)采用小动物活体成像仪测量并记录各组裸鼠的标准化的光子通量,用于间接反映裸鼠肿瘤大小,绘制曲线。
59.结果显示,pim1敲除组,肿瘤标准化光子通量显著低于对照组,实验的结果如图4所示。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1