一种多功能脂质体及其制备方法与流程
1.本发明涉及化妆品技术领域,尤其涉及一种含有三种不同分子量透明质酸多功能脂质体及其制备方法。
背景技术:
2.透明质酸(hyaluronicacid,ha)是一种天然的保湿因子,还是皮肤基底层结缔组织的重要支撑,皮肤内透明质酸的流失导致皱纹形成,呈现面部衰老迹象。ha具有防止皮肤皱纹形成和抗皮肤衰老功能。表皮中的ha可清除阳光中的紫外线照射所产生的活性氧自由基,保护皮肤免受其害,被称为高效的自由基“清道夫”。
3.在化妆品应用中,高、中、低三种不同分子量的透明质酸具有不同的生物活性和使用效果,只含有单一分子量透明质酸成分的护肤品作用有限,并不能发挥透明质酸的最佳护肤功效。现医美领域常用的皮肤注射透明质酸,因体内分解代谢快,需要反复注射且注射方式对于消费者的顺应性较差,微整形的方式也难以被广泛接受。目前,市场上还未出现以多种透明质酸为主要功能成分的脂质体产品。
4.人参皂苷是从人参中提取的天然成分,可强效减除肌肤黑色素、淡化及阻止黑色素的形成、显著增加肌肤锁水能力、软化皮肤角质化细胞、促进细胞新陈代谢、加速毛细血管的微循环、增强细胞之间的胶原带白的连接力,令肌肤净白,柔软,晶莹,充满弹性的功能。
5.酵母精华多做皮肤调理剂使用,该成分含有丰富的天然氨基酸中的各种营养成分,能够抑制酪氨酸酶活性,从而达到抑制黑色素、美白、长效保湿以及加速老化角质层细胞更新换代的作用。酵母精华还有一定的皮肤修复功能,并且具有良好的安全性和稳定性。
6.植物活性多肽不同于一般的加热醇提物(如黄酮),是常温下利用各种水解酶从植物(如核桃、向天果、糙米、藜麦、荞麦等)中提取的新型水溶性蛋白。活性多肽是皮肤天然修护过程中的重要分子,参与多个自然状态下皮肤修护的过程。如促进皮肤细胞的增殖、修复皮肤细胞、抗炎、促进血管生成、参与色素形成、参与蛋白质合成及调控。活性多肽因其安全性、高效性而广受医学研究者的关注。近年来皮肤防护研究者也将活性多肽引入化妆品的生产领域,用于提高产品解决抗肌肤老化、改善色素沉积、改善肌肤炎症,使得皮肤弹力增加、紧致、光滑等功效。大量科学研究表明,在水解某些蛋白质时,通过选择适当的蛋白酶,控制一定的水解度可以得到大量的生物活性多肽,并且具有许多独特的生理功能。例如,利用木瓜蛋白酶水解制备核桃粕,得到具有抗氧化活性的多肽,可能是潜在的天然、安全、高效的抗氧化剂。
7.红枸杞,为茄科植物枸杞的成熟果实。夏、秋果实成熟时采摘,除去果柄,置阴凉处晾至果皮起皱纹后,再暴晒至外皮干硬、果肉柔软即得。遇阴雨可用微火烘干。红枸杞有多种保健功效,是卫生部批准的药食两用食物。适量食用有益健康,具有清肝明目的效果。具有免疫调节、抗衰老、提高视力等功效。枸杞所含有的类胡萝卜素则具有非常重要的药用价值。胡萝卜素是枸杞色素的主要活性成分,具有抗氧化和作为维生素a的合成前体等重要的
生理功能。其枸杞子具有养肝,滋肾,润肺,补虚益精,清热明目的功效。枸杞多糖具有促进免疫、抗衰老、抗肿瘤、清除自由基、抗疲劳、抗辐射、保肝、生殖功能保护和改善等作用。
8.洋甘菊提取物有良好的护肤作用,能够很好地舒缓皮肤,防护辐射损伤,抵抗肌肤敏感,增强皮肤防护屏障,调节肌肤的水油平衡,加速痘痘的愈合,还能延缓肌肤衰老。洋甘菊提取物还具有广泛的药理作用,可以抗菌、抗病毒、抗过敏。其中富含的黄酮类化合物,使其还可以抗氧化抗炎症。因此洋甘菊提取物经常被加入面膜中,能够给肌肤深层补水,快速舒缓肌肤敏感,缓解红敏、瘙痒、晒伤等肌肤问题。
9.脂质体是微胶囊向纵深的发展,通常是指由磷脂构成的双层膜球形小泡,可以包埋亲水性、亲脂性或两亲性物质。脂质体主要壁材磷脂是生物膜的组成成分之一,生物相容性好,无免疫抑制作用,安全性高毒性小。纳米脂质体的粒径处于纳米级范围,其穿透生理组织屏障能力很强。脂质体用于化妆品中能够穿透皮肤,将控制活性成分缓慢释放出来被人体吸收,可持久地起到局部保养作用,促进活性成分在组织中的分布,提供其生物利用度,降低或不使用化学促透剂。
10.通过检索,发现以下公开专利:一种多功能透明质酸脂质体的制备方法及质检标准(cn 109394567 a),该专利提供一种补水保湿透明质酸脂质体的制备方法,该方法能够将补水保湿的透明质酸渗透到角质层,深入皮肤进行修复;一种透明质酸修饰的阳离子类脂质体、制备方法及其应用(cn108451908a),公开了一种透明质酸修饰的阳离子类脂质体、制备方法及其应用;一种含有透明质酸的醇脂质体的透皮给药系统及其制备方法与应用(cn106955277 a),公开了一种含有透明质酸的醇脂质体的透皮给药系统及其制备方法与应用。通过对比,本发明专利首次将三种不同分子量的透明质酸同时包载,协同增效,并利用纳米脂质体的高效透皮技术,实现透明质酸与多种活性成分的同时包载递送,真正实现多功能透明质酸化妆品的护肤效果,为一种无创的皮肤基底层补充透明质酸的方式,与上述专利公开文献存在本质不同。
技术实现要素:
11.本发明的目的是克服现有技术中的不足之处,提供一种包含三种不同分子量的透明质酸与多种天然提取活性成分组合的脂质体及其制备方法。发明以脂质体为透皮促渗载体,将透明质酸和新型天然提取活性成分组合(人参皂苷、酵母精华、多种植物活性多肽等)递送至皮肤基底层,协同发挥三种透明质酸和活性物质各自的功效。
12.通过实验发现,选择高分子量透明质酸、中等分子量透明质酸与低分子量透明质酸复配所制备的脂质体能够增强透明质酸脂质体的稳定性。
13.本发明中技术术语“高分子量透明质酸”是指透明质酸分子量在2000kda
‑
5000kda,能够在皮肤表层形成一层透气膜,在皮肤表面锁住水分,防止水分蒸发,长久保湿。但是穿透力差,通常难以被皮肤吸收。
14.本发明中技术术语“中等分子量透明质酸”是指透明质酸分子量在500kda
‑
1000kda之间。现有技术已知,中等分子量透明质酸在皮肤表层可形成透气膜,锁住水分,紧致皮肤。
15.本发明中技术术语“低分子量透明质酸”是指透明质酸分子量在10kda
‑
500kda之间。现有技术已知,低分子量透明质可渗透到皮肤的真皮层,在皮肤内部发挥作用,锁住水
分,促进皮肤代谢,使皮肤湿润光滑、细腻柔嫩、富有弹性。防止水分蒸发的能力很差。
16.本发明中技术术语“寡聚透明质酸”是指透明质酸分子量小于10kda,即小于50个单糖结构,聚合度小于25的透明质酸分子,可以深入真皮层内部,发挥全方位、持续保湿的作用,和普通透明质酸分子在皮肤表层发挥保湿作用不同,保湿持续时间长,效果好,长期使用,还具有抗衰老、去除皱纹的作用。
17.本发明解决其技术问题所采用的技术方案是:
18.一种多功能脂质体,利用卵磷脂和dspe
‑
peg
2000
制备脂质体,同时包载低分子量透明质酸、中等分子量透明质酸、高分子量透明质酸。
19.所述脂质体同时包载的组分还包括枸杞多糖、人参皂苷、洋甘菊提取物、酵母精华、植物活性多肽。
20.所述高分子量透明质酸的分子量为2000kda
‑
5000kda,所述中等分子量透明质酸的分子量为500kda
‑
1000kda,低分子量透明质酸分子量为10kda
‑
500kda。
21.所述脂质体其各成分重量比例为:卵磷脂1
‑
30份,dspe
‑
peg
20001‑
10份,低分子量透明质酸1
‑
10份,中等分子量透明质酸1
‑
10份,高分子量透明质酸1
‑
10份,枸杞多糖0.1
‑
10份,人参皂苷0.1
‑
10份,洋甘菊提取物0.1
‑
10份,酵母精华0.5
‑
20份,植物活性多肽0.1
‑
20份。
22.所述脂质体的制备方法如下:
23.按一定质量比例称取dspe
‑
peg
2000
、卵磷脂,加入适量的无水乙醇使其充分溶解,选择蒸发铺膜,成膜后加入溶解有低分子量透明质酸、中等分子量透明质酸、高分子量透明质酸,以及枸杞多糖、人参皂苷、洋甘菊提取物、酵母精华、植物活性多肽的水化液进行水化,然后进行超声得到所述透明质酸脂质体。
24.所述枸杞多糖的制备方法为:称取枸杞粉碎加入水,以水为提取溶剂,提取温度70
‑
100℃浸提3
‑
4小时,抽滤,收集水层,冻干后,即得枸杞多糖。
25.所述人参皂苷制备方法为:称取人参粉碎成粉,以纯净水为提取溶剂,料液质量比1∶ 2~10,70℃
‑
100℃加热回流1
‑
5小时,冷却,真空抽滤得滤液,将滤液于
‑
60℃~
‑
80℃预冻5
‑
15h 后放入冷冻干燥机冻成粉,即得人参皂苷。
26.所述洋甘菊提取物的制备方法如下:称取洋甘菊的茎和叶,粉碎,以纯净水为提取溶剂,茎和叶:水比为1:1.5~10,浸泡3
‑
10小时,70
‑
100℃浸提6
‑
10小时,真空抽滤得滤液,将滤液于
‑
60℃~
‑
80℃预冻5
‑
15h后放入冷冻干燥机冻成粉,即得洋甘菊提取物。
27.所述植物活性多肽的制备方法如下:取核桃10
‑
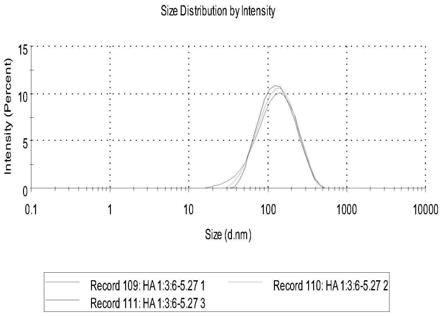
25重量份、核桃粕10
‑
15重量份、藜麦 10
‑
30重量份、荞麦10
‑
25重量份、糙米15
‑
30重量份,粉碎,加入水后调节ph值至7.5
‑
9.0,用碱溶酸沉法提取蛋白并冷冻干燥,经蛋白酶酶解,1000
‑
10000rpm离心3
‑
20分钟,上清液冷冻干燥获得植物活性多肽提取物。
28.所述酵母精华的制备方法如下:取酵母培养液,离心得酵母泥,清洗后加蒸馏水超声破壁,分离冻干得酵母精华。
29.上述一种包含三种不同分子量透明质酸的脂质体在制备化妆品中的应用,如眼霜、面霜、乳液、精华和面膜等。
30.与现有技术相比,本发明有益效果主要体现在:
31.目前,市场上还未出现以多种分子量的ha为主要功能成分的脂质体的产品,以脂
质体为透皮促渗载体,将ha和新型天然提取活性成分组合递送至皮肤基底层,协同发挥三种ha和活性物质各自的功效。脂质体渗透性强,渗漏率低,综合相容性高,稳定性好,且对于皮肤作用均匀柔和,增加皮肤内ha含量,进而达到护肤的目的;同时,保护和高效透皮递送天然提取活性成分,使其能够直接作用于基底细胞,更好地发挥皮肤状态改善效果。鉴于透明质酸在基底层还会代谢损耗,长期使用ha脂质体化妆品既可以快速补充皮肤ha,又有极佳的使用顺应性,且相对于注射成本更低,方式被更为广大的消费者认可。因此,以多种ha为主要功能成分的脂质体系列化妆品有着极为广阔的应用市场。
附图说明
32.图1为本发明中透明质酸分子量低分子量透明质酸:中等分子量透明质酸:高分子量透明质酸=1:3:6的脂质体三次测量的粒径分布图,每条曲线为测量一次的结果;
33.图2为本发明中透明质酸分子量低分子量透明质酸:中等分子量透明质酸:高分子量透明质酸=1:4:5的脂质体三次测量的粒径分布图,每条曲线为测量一次的结果;
34.图3为本发明中透明质酸分子量低分子量透明质酸:中等分子量透明质酸:高分子量透明质酸=2:3:5的脂质体三次测量的粒径分布图,每条曲线为测量一次的结果;
35.图4为本发明中透明质酸分子量低分子量透明质酸:中等分子量透明质酸:高分子量透明质酸=1:3:6的脂质体三次测量的zeta电势分布图,每条曲线为测量一次的结果;
36.图5为本发明中透明质酸分子量低分子量透明质酸:中等分子量透明质酸:高分子量透明质酸=1:4:5的脂质体三次测量的zeta电势分布图,每条曲线为测量一次的结果;
37.图6为本发明中透明质酸分子量低分子量透明质酸:中等分子量透明质酸:高分子量透明质酸=2:3:5的脂质体三次测量的zeta电势分布图,每条曲线为测量一次的结果;
38.图7为本发明中低分子量透明质酸脂质体透皮吸收时的透皮吸收率;
39.图8为本发明中中等分子量透明质酸脂质体透皮吸收时的透皮吸收率;
40.图9为本发明中高分子量透明质酸脂质体透皮吸收时的透皮吸收率;
具体实施方式
41.下面详细叙述本发明的实施例,需要说明的是,本实施例是叙述性的,不是限定性的,不能以此限定本发明的保护范围。
42.本发明中所使用的原料,如无特殊说明,均为常规的市售产品;本发明中所使用的方法,如无特殊说明,均为本领域的常规方法。
43.除非另有定义,本发明所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本发明中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本发明所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
44.实施例1
45.一种含有三种不同分子量透明质酸多功能脂质体及其制备方法,主要过程及步骤如下:
46.低分子量透明质酸、中等分子量透明质酸、高分子量透明质酸复配的脂质体:
47.称取卵磷脂20份和dspe
‑
peg
2000
5份,枸杞多糖1份,再加入适量的无水乙醇,振荡
溶解,水浴加热旋转蒸发铺膜,再加透明质酸溶液、枸杞多糖、酵母精华、植物活性多肽、洋甘菊提取物和人参皂苷提取物溶液74份(其中溶解有洋甘菊提取物2份,人参皂苷2份,酵母精华1份,植物活性多肽1份,低分子量透明质酸1份,中等分子量透明质酸3份,高分子量透明质酸6份),加入适量蒸馏水进行水化,超声过膜得透明质酸脂质体,其粒径测量见附图1,电位测量见附图4。
48.所述枸杞多糖的制备方法为:称取枸杞粉碎加入水,以水为提取溶剂,枸杞和水以合适的的体积比,提取温度80℃浸提3小时,抽滤,收集水层,冻干后,即得枸杞多糖。
49.所述人参皂苷制备方法为:称取人参粉碎成粉,以纯净水为提取溶剂,按料液质量比1∶ 10,90℃加热回流2小时,冷却,真空抽滤得滤液,将滤液于
‑
80℃预冻12h后放入冷冻干燥机冻成粉,即得人参皂苷。
50.所述洋甘菊提取物的制备方法如下:称取洋甘菊的茎和叶,粉碎,以纯净水为提取溶剂,茎和叶:水比为1:1.5,浸泡4小时,80℃浸提6小时,真空抽滤得滤液,将滤液于﹣80℃预冻12h后放入冷冻干燥机冻成粉,即得洋甘菊提取物。
51.所述活性多肽的制备方法如下:取核桃10重量份、核桃粕10重量份、藜麦10重量份、荞麦10重量份、糙米15重量份,粉碎,加入水后调节ph值至8.5,用碱溶酸沉法提取蛋白并冷冻干燥,经蛋白酶酶解,8000rpm离心5分钟,上清液冷冻干燥获得活性多肽提取物。
52.所述酵母精华的制备方法如下:取酵母培养液,离心得酵母泥,清洗后加蒸馏水超声破壁,分离冻干得酵母精华。
53.实施例2
54.一种含有三种不同分子量透明质酸多功能脂质体及其制备方法,主要过程及步骤如下:称取卵磷脂20份和dspe
‑
peg
2000
5份,枸杞多糖1份,再加入适量的无水乙醇,振荡溶解,水浴加热旋蒸铺膜,再加透明质酸溶液、枸杞多糖、酵母精华、植物活性多肽、洋甘菊提取物和人参皂苷提取物溶液74份(其中溶解有洋甘菊提取物2份,人参皂苷2份,酵母精华1 份,植物活性多肽1份,低分子量透明质酸1份,中等分子量透明质酸4份,高分子量透明质酸5份),加入适量蒸馏水进行水化,超声过膜得透明质酸脂质体,其粒径测量见附图2,电位测量见附图5。
55.所述枸杞多糖的制备方法为:称取枸杞粉碎加入水,以水为提取溶剂,枸杞和水以合适的的体积比,提取温度80℃浸提4小时,抽滤,收集水层,冻干后,即得枸杞多糖。
56.所述人参皂苷制备方法为:称取人参粉碎成粉,以纯净水为提取溶剂,按料液质量比1∶ 10,100℃加热回流2小时,冷却,真空抽滤得滤液,将滤液于
‑
80℃预冻10h后放入冷冻干燥机冻成粉,即得人参皂苷。
57.所述洋甘菊提取物的制备方法如下:称取洋甘菊的茎和叶,粉碎,以纯净水为提取溶剂,茎和叶:水比为1:3,浸泡4小时,80℃浸提7小时,真空抽滤得滤液,将滤液于﹣80℃预冻12h放入冷冻干燥机冻成粉,即得洋甘菊提取物。
58.所述活性多肽的制备方法如下:取核桃20重量份、核桃粕10重量份、藜麦10重量份、荞麦10重量份、糙米15重量份,粉碎,加入水后调节ph值至9,用碱溶酸沉法提取蛋白并冷冻干燥,经蛋白酶酶解,5000rpm离心5分钟,上清液冷冻干燥获得活性多肽提取物。
59.所述酵母精华的制备方法如下:取酵母培养液,离心得酵母泥,清洗后加蒸馏水超声破壁,分离冻干得酵母精华。
60.实施例3
61.一种含有三种不同分子量透明质酸多功能脂质体及其制备方法,主要过程及步骤如下:称取卵磷脂20份和dspe
‑
peg
2000
5份,枸杞多糖1份,再加入适量的无水乙醇,振荡溶解,水浴加热旋蒸铺膜,再加透明质酸溶液、枸杞多糖、酵母精华、植物活性多肽、洋甘菊提取物和人参皂苷提取物溶液74份(其中溶解有洋甘菊提取物2份,人参皂苷2份,酵母精华1 份,植物活性多肽1份,低分子量透明质酸2份,中等分子量透明质酸3份,高分子量透明质酸5份),加入适量蒸馏水进行水化,超声过膜得透明质酸脂质体,其粒径测量见附图3,电位测量见附图6。
62.所述枸杞多糖的制备方法为:称取枸杞粉碎加入水,以水为提取溶剂,枸杞和水以合适的的体积比,提取温度90℃浸提4小时,抽滤,收集水层,冻干后,即得枸杞多糖。
63.所述人参皂苷制备方法为:称取人参粉碎成粉,以纯净水为提取溶剂,按料液质量比1∶ 9,90℃加热回流2小时,冷却,真空抽滤得滤液,将滤液于
‑
80℃预冻12h后放入冷冻干燥机冻成粉,即得人参皂苷。
64.所述洋甘菊提取物的制备方法如下:称取洋甘菊的茎和叶,粉碎,以纯净水为提取溶剂,茎和叶:水比为1:4.5,浸泡8小时,100℃浸提10小时,真空抽滤得滤液,将滤液于﹣80℃预冻12h后放入冷冻干燥机冻成粉,即得洋甘菊提取物。
65.所述活性多肽的制备方法如下:取核桃25重量份、核桃粕15重量份、藜麦30重量份、荞麦25重量份、糙米30重量份,粉碎,加入水后调节ph值至9.0,用碱溶酸沉法提取蛋白并冷冻干燥,经蛋白酶酶解,10000rpm离心10分钟,上清液冷冻干燥获得活性多肽提取物。
66.所述酵母精华的制备方法如下:取酵母培养液,离心得酵母泥,清洗后加蒸馏水超声破壁,分离冻干得酵母精华。
67.实施例4
68.一种含有三种不同分子量透明质酸多功能脂质体及其制备方法,主要过程及步骤如下:称取卵磷脂20份和dspe
‑
peg
2000
5份,再加入适量的无水乙醇,振荡溶解,水浴加热旋蒸铺膜,再加透明质酸溶液、枸杞多糖、酵母精华、植物活性多肽、洋甘菊提取物和人参皂苷提取物溶液75份(其中溶解有洋甘菊提取物2份,人参皂苷2份,酵母精华1份,植物活性多肽1份,低分子量透明质酸1份,中等分子量透明质酸3份,高分子量透明质酸6份),加入适量蒸馏水进行水化,超声过膜得透明质酸脂质体。
69.所述人参皂苷制备方法为:称取人参粉碎成粉,以纯净水为提取溶剂,按料液质量比1∶ 9,90℃加热回流2小时,冷却,真空抽滤得滤液,将滤液于
‑
80℃预冻12h后放入冷冻干燥机冻成粉,即得人参皂苷。
70.所述洋甘菊提取物的制备方法如下:称取洋甘菊的茎和叶,粉碎,以纯净水为提取溶剂,茎和叶:水比为1:4.5,浸泡8小时,100℃浸提10小时,真空抽滤得滤液,将滤液于﹣80℃预冻12h后放入冷冻干燥机冻成粉,即得洋甘菊提取物。
71.所述活性多肽的制备方法如下:取核桃25重量份、核桃粕15重量份、藜麦30重量份、荞麦25重量份、糙米30重量份,粉碎,加入水后调节ph值至9.0,用碱溶酸沉法提取蛋白并冷冻干燥,经蛋白酶酶解,10000rpm离心10分钟,上清液冷冻干燥获得活性多肽提取物。
72.所述酵母精华的制备方法如下:取酵母培养液,离心得酵母泥,清洗后加蒸馏水超声破壁,分离冻干得酵母精华。
73.实施例5
74.一种含有三种不同分子量透明质酸多功能脂质体及其制备方法,主要过程及步骤如下:称取卵磷脂25份,枸杞多糖1份,再加入适量的无水乙醇,振荡溶解,水浴加热旋转蒸发铺膜,再加透明质酸溶液、枸杞多糖、酵母精华、植物活性多肽、洋甘菊提取物和人参皂苷提取物溶液74份(其中溶解有洋甘菊提取物2份,人参皂苷2份,酵母精华1份,植物活性多肽1份,低分子量透明质酸1份,中等分子量透明质酸3份,高分子量透明质酸6份),加入适量蒸馏水进行水化,超声过膜得透明质酸脂质体。
75.所述枸杞多糖的制备方法为:称取枸杞粉碎加入水,以水为提取溶剂,枸杞和水以合适的的体积比,提取温度80℃浸提3小时,抽滤,收集水层,冻干后,即得枸杞多糖。
76.所述人参皂苷制备方法为:称取人参粉碎成粉,以纯净水为提取溶剂,按料液质量比1∶ 10,90℃加热回流2小时,冷却,真空抽滤得滤液,将滤液于
‑
80℃预冻12h后放入冷冻干燥机冻成粉,即得人参皂苷。
77.所述洋甘菊提取物的制备方法如下:称取洋甘菊的茎和叶,粉碎,以纯净水为提取溶剂,茎和叶:水比为1:1.5,浸泡4小时,80℃浸提6小时,真空抽滤得滤液,将滤液于﹣80℃预冻12h后放入冷冻干燥机冻成粉,即得洋甘菊提取物。
78.所述活性多肽的制备方法如下:取核桃10重量份、核桃粕10重量份、藜麦10重量份、荞麦10重量份、糙米15重量份,粉碎,加入水后调节ph值至8.5,用碱溶酸沉法提取蛋白并冷冻干燥,经蛋白酶酶解,8000rpm离心5分钟,上清液冷冻干燥获得活性多肽提取物。
79.所述酵母精华的制备方法如下:取酵母培养液,离心得酵母泥,清洗后加蒸馏水超声破壁,分离冻干得酵母精华。
80.实施例6
81.一种含透明质酸脂质体眼霜的制备,步骤及过程如下:
82.取聚山梨酯802份溶于25份水中,加热使混合均匀;
83.取黄原胶0.5份,海藻酸钠0.2份,加入上述溶液中,搅拌使成混合均匀的凝胶基质,在 60℃条件下将实施例1制备的包载活性成分的透明质酸脂质体25份加入凝胶基质,搅拌至均匀后再加入维生素e 5份,继续搅拌至均匀,保温10min;
84.待温度降至35℃,按比例将苯氧乙醇0.2份、脱氢乙酸钠0.3份、烟酰胺0.3份,海藻糖 5份,甘油2份,丙二醇10份,茶多酚1份,去离子水补足至100份,搅拌至均匀,即得。
85.对比例1:与实施例1的区别仅在于将中等分子量透明质酸、高分子量透明质酸替换为等量的低分子量透明质酸。
86.对比例2:与实施例1的区别仅在于将低分子量透明质酸、高分子量透明质酸替换为等量的中等分子量透明质酸。
87.对比例3:与实施例1的区别仅在于将低分子量透明质酸、中等分子量透明质酸替换为等量的高分子量透明质酸。
88.对比例4:与实施例1的区别仅在于将低分子量透明质酸、中等分子量透明质酸、高分子量透明质酸替换为等量的寡聚透明质酸。
89.对比例5:维生素c水溶液
90.准确称取10mg纯维生素c,溶于10ml水,得到1mg/ml的vc水溶液,梯度稀释至 0.8mg/ml,0.6mg/ml,0.4mg/ml,0.2mg/ml。
91.试验例1
92.透明质酸脂质体稳定性比较
93.将实施例1对比例1
‑
4室温下放置,测定放置10天,20天,30天,60天后脂质体在介质(水)中的渗漏率。
94.渗漏率表示脂质体在贮存期间包封率的变化情况,是脂质体稳定性的主要指标。测定方法是一定条件下贮存脂质体,定时取样,测定脂质体包封药量或游离药物量,从而得到贮存后渗漏到介质的药量,与贮藏前包封的药物量比较,本发明以枸杞多糖的药量作为参考标准,具体计算公式如下:
[0095][0096]
枸杞多糖的定量测定方法为:pmp
‑
hplc;分析条件:色谱柱agilent eclipse xdb
‑
c18(4.6mm
×
250 mm,5μm),流动相:0.125mol
·
l
‑1磷酸缓冲液(ph 6.7)
‑
乙腈(1:5)。
[0097]
表1放置不同时间后不同分子量透明质酸复配的脂质体的渗漏率(%)
[0098][0099]
通过测定室温下放置不同时间后的不同分子量透明质酸组合的脂质体与不复配的透明质酸脂质体渗漏率进行比较,发现低、中、高分子量透明质酸复配的脂质体状态最佳,将低、中、高分子量透明质酸复配制备的脂质体能在增强护肤功效的同时可提高脂质体的稳定性,而寡聚透明质酸虽然分子量较小但其用脂质体包载时渗漏率较高,相容性较差,最终选用低、中、高分子量透明质酸复配制备的透明质酸脂质体进行接下来的实验评价。
[0100]
试验例2透明质酸脂质体粒径电位比较
[0101]
利用马尔文粒径分析仪对不同分子量比例的透明质酸脂质体进行粒径电位测量,结果见附图1
‑
附图6。
[0102]
表2不同分子量比例透明质酸脂质体的粒径电位
[0103]
[0104][0105]
试验例3
[0106]
不同分子量透明质酸脂质体处方稳定性比较(常温)
[0107]
通过测定室温下放置不同时间后的,处方中枸杞多糖、dspe
‑
peg
2000
对于稳定性的影响,就放置过程中脂质体宏观状态的改变作为评价指标,进行对比研究。结果表明枸杞多糖除了自身生物活性外,在物理化学作用中对于低、中、高分子量透明质酸具有一定“拉手”作用,通过缠绕包裹,可提高透明质酸在脂质体内水相的稳定性。而dspe
‑
peg
2000
也是脂质体膜的必需组分,通过peg2000长长的水化链增加脂质体纳米结构的内聚力,通过在脂质体外形成水化层来保护脂质体内容物,提高稳定性。
[0108]
表3不同分子量透明质酸脂质体处方稳定性比较(常温)
[0109][0110]
试验例4
[0111]
美白效果评价
[0112]
溶液配制:以常规配制方法制备ph 6.8的磷酸盐缓冲液50ml;称取适量酪氨酸加水溶解,制备2mmol/l的酪氨酸溶液,及浓度为500u/ml的酪氨酸酶溶液。
[0113]
酪氨酸酶活力测定
[0114]
取96孔板,每孔加入ph 6.8的磷酸盐缓冲液100μl,上述酪氨酸溶液50μl,按照实施例1的方法和对比例5的方法分别配制透明质酸与vc浓度为0.2/0.4/0.6/0.8/1mg/ml的待测样品。
[0115]
进行系列浓度稀释后,同浓度实验孔(n=3)分别加入10μl,进行比较。待混合均匀后,在冰浴中迅速加入酪氨酸酶溶液10μl,混匀,37℃孵育10min,于475nm处测定吸光度。
[0116]
酪氨酸酶抑制率(%)=[(a
‑
b)
‑
(c
‑
d)]/[a
‑
b]
×
100%
[0117]
a:未加透明质酸脂质体的加酶混合液所测的吸光度;
[0118]
b:未加透明质酸脂质体亦未加酶的混合液所测的吸光度;
[0119]
c:加透明质酸脂质体和酶的混合液所测的吸光度;
[0120]
d:加透明质酸脂质体而未加酶的混合液所测的吸光度。
[0121]
以上每个实验孔有3个复孔,即n=3。
[0122]
实验结果酪氨酸酶抑制率测定(n=3)
[0123]
表4低、中、高分子量透明质酸复配脂质体与vc溶液对酪氨酸酶活性抑制率
[0124][0125]
从表格数据可以看出,与vc对比,实施例1样品对酪氨酸酶活性的抑制不呈现浓度依赖。
[0126]
试验例5
[0127]
抗氧化效果评价
[0128]
溶液配制:称取4mg dpph自由基粉末至100ml容量瓶中,用无水乙醇溶解,定容,摇匀,得0.04mg/ml的dpph溶液。
[0129]
清除dpph自由基实验:取96孔板,滴加100μl dpph溶液,再分别加入100μl 对比例1或100μl实施例1,混合均匀,室温条件下避光反应20min,515nm测定紫外吸光度 (b)。
[0130]
实验组:按照实施例1的制备方法配制的透明质酸浓度为1/2/3/4/5mg/ml的样品;对照组:0.2
‑
1mg/ml的对比例5
[0131]
其中,a:空白吸光度;b:样品吸光度。
[0132]
以上实验设置平行实验孔3个,即n=3。
[0133]
表5透明质酸dpph自由基清除率测定实验结果(n=3)
[0134][0135]
表6维生素c dpph自由基清除率测定实验结果(n=3)
[0136][0137]
从表格数据可知,在1
‑
5mg/ml浓度范围内,透明质酸的抗氧化活性呈现浓度依赖,有一定的抗氧化作用。所以透明质酸脂质体更适宜添加到化妆品系列。
[0138]
试验例6
[0139]
明目效果评价
[0140]
用脂多糖刺激bv2小胶质细胞,通过mtt法检测细胞的存活率,来表征实施例对视神经细胞的保护效果。
[0141]
mtt法:检测原理为活细胞线粒体中的琥珀酸脱氢酶能使外源性mtt还原为水不溶性的蓝紫色结晶甲臜(formazan)并沉积在细胞中,而死细胞无此功能。二甲基亚砜(dmso) 能溶解细胞中的甲臜,用酶联免疫检测仪在492nm、630nm波长处测定其光吸收值,可间接反映活细胞数量。在一定细胞数范围内,mtt结晶形成的量与细胞数成正比。因bv2为半贴壁细胞,与一般贴壁细胞的mtt测定方法不同,采取以下方法进行:
[0142]
取96孔板,每孔加90μl细胞悬液,细胞密度为5
×
104个/ml,37℃,5%co2孵育24h;每孔加实施例710μl(1:10)预保护(n=6),1h后加终浓度为1μg/ml的脂多糖(lps) 溶液0.5μl;2h后加每孔20μl mtt溶液,继续培养4h;终止培养,加入盐酸异丙醇100μl 溶解甲瓒,孵育10min;在酶联免疫检测仪上492nm、630nm波长处测得各孔的光密度值(od 值);
[0143]
细胞存活率={(od值
‑
空白组od值[均值])/(dmso组od值
‑
空白组od}
×
100%
[0144]
实验结果:透明质酸脂质体对于1μg/ml脂多糖刺激bv2细胞的保护作用评价
[0145]
表7按照实施例1的方法制备的透明质酸浓度为0.1/0.2/0.3/0.4/0.5mg/ml的脂质体样品对于脂多糖刺激bv2细胞的保护作用结果
[0146][0147]
从上述数据中可以看出,在透明质酸脂质体浓度为0.2
‑
0.4mg/ml范围时,细胞存活率较高,与lps组对比,加药后可以有效保护细胞并且维持细胞增殖,此浓度下对细胞也
不产生毒性。
[0148]
试验例7
[0149]
体外透皮吸收
[0150]
离体皮肤制备:将老鼠处死剥离其腹部皮肤,去除皮下脂肪进行脱毛处理,配制一定量的硫化氢溶液将其鼠皮浸泡数分钟后,用镊子取出,小刀刮去皮肤上已经褪去的鼠毛。用生理盐水洗净,以滤纸吸干水分,再用磷酸盐缓冲液漂洗至洗液澄清,用滤纸吸干后,福尔马林
‑
4℃浸泡保存,备用。
[0151]
透皮吸收试验:采用tk
‑
6h1型透皮扩散试验仪,将上述处理好的鼠皮固定在扩散池的供给池与接受池之间,真皮层面向下,角质层面向上,排尽气泡。在供给池中加入3ml 含透明质酸脂质体,2ml生理盐水。接受池内加入5ml生理盐水,以300r/min的速度搅拌混匀,设定温度为(33
±
0.1)℃。分别于1、2、3、4、5、6h从接受池中取出200ul介质,同时向接受池中补加等量的接收液(生理盐水)。
[0152]
吸出的接收液经0.22μm微孔滤膜滤过后,采用ctab法进行透明质酸含量的测定。
[0153]
取上述接受液50ul加入50ul磷酸缓冲溶液于96孔板中,37℃孵育15min,再加入100ul ctab溶液,37℃孵育10min,于600nm酶标仪测其吸光度。
[0154]
透明质酸ctab法标准曲线绘制:取透明质酸标准品10mg于10ml超纯水中完全溶解,制得1mg/ml透明质酸标品水溶液,再将其进行逐级稀释制得0.5mg/ml、0.25mg/ml、 0.1mg/ml、0.01mg/ml、0.001mg/ml、0.1ug/ml,0.01ug/ml,0.001ug/ml标准品溶液。分别取上述各个浓度液体50ul,再分别加入50ul磷酸缓冲溶液于96孔板中,37℃孵育15min,再分别加入100ul ctab溶液,37℃孵育10min,于600nm酶标仪测其吸光度。记录数据,绘制标准曲线。
[0155]
透明质酸含量计算:将样品测定后的吸光度值带入至标准曲线线性方程中,即得其样品中透明质酸浓度
[0156]
表8对比例1
‑
3与相同浓度的低、中、高分子量的透明质酸溶液的透皮率实验结果
[0157][0158]
综合附图8,附图9,从表格数据得知,脂质体的透皮率大于同等浓度的溶液,可明显看出包载透明质酸的脂质体透皮效果更好,能更好的将大分子量的透明质酸递送到皮肤深处。本发明的低、中、高分子量透明质酸分子量同样经过了实验筛选,对于高分子量透明质酸,本发明选择透明质酸分子量在2000kda
‑
5000kda,通过透皮实验发现,即使利用脂质体包载,分子量大于6000kda的高分子量透明质酸皮肤穿透力依然较差。本发明中等分子量透明质酸选择透明质酸分子量在500kda
‑
1000kda之间,而包载分子量大于1000kda小于 2000kda的透明质酸酸时,虽然有一定的透皮率,但是会在一定程度上使水化效率降低。本
发明低分子量透明质酸选择10kda
‑
500kda之间,在该范围的低分子量透明质酸复配中、高分子量透明质酸的脂质体渗漏率较低同时透皮率较高。
[0159]
试验例8
[0160]
产品感官及效果测试
[0161]
以实施例5为实验组,眼霜对照组1与实施例5的区别在于将实施例5中的中等分子量的透明质酸用低分子量透明质酸进行等量替换;对照组2与实施例5的区别在于将实施例5 中的高分子量的透明质酸用中等分子量透明质酸进行等量替换。选择公司职工志愿者男性、女性各12人(共24人),随机平均分为3组(每组8人),每天清洁皮肤后将实验组和对照组涂于面部,30天后观察效果。根据皮肤状态变化分别对不同项目进行打分(0
‑
100分),结果如下表8所示。
[0162]
表9不同项目评分结果
[0163] 实施例5对照组一对照组二渗透性87.125
±
2.50284.375
±
5.20280.375
±
2.265保湿性88.250
±
2.81177.250
±
2.94786.125
±
1.732清爽性83.000
±
1.14182.500
±
2.71474.750
±
3.120消除黑眼圈85.625
±
3.43263.875
±
1.44684.250
±
4.633缓解视疲劳43.500
±
2.42623.875
±
6.23835.875
±
1.801
[0164]
综上以上结果发现,本发明制得的透明质酸脂质体纳米眼霜(实施例5)各项效果较优。
[0165]
尽管为说明目的公开了本发明的实施例,但是本领域的技术人员可以理解:在不脱离本发明及所附权利要求的精神和范围内,各种替换、变化和修改都是可能的,因此,本发明的范围不局限于实施例和附图所公开的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1