载小分子药聚合物囊泡在制备治疗急性淋系白血病药物中的应用
1.本发明属于聚合物纳米药物技术领域,具体涉及一种负载硫酸长春新碱的可逆交联可降解聚合物囊泡及其制备方法与在肿瘤靶向治疗中的应用,尤其在制备抗急性淋系白血病纳米药物中的应用。
背景技术:
2.现有技术采用elisa的方法来检测sb7
‑
h3在176位白血病病人脑脊液中的表达,依据国际公认的fab(french
‑
amer
‑
ican
‑
british)分类系统将急性白血病病人分型;sb7
‑
h3在急性淋系白血病与急性髓系白血病中的表达差异显著,在急性淋系白血病的亚型中,sb7
‑
h3的表达没有显著性差异,在急性髓系白血病的亚型中,sb7
‑
h3的表达在m3与m5和m4与m5之间存在显著性差异。硫酸长春新碱(vcr)是一种水溶性的强效药物,主要作用于微管蛋白,使有丝分裂停止于中期,但由于其存在严重的神经毒性,导致可用剂量较低。2012年批准上市的脂质体硫酸长春新碱(marqibo
®
)纳米药物虽然可以延长vcr的循环时间、降低毒副作用,但整体改善较为有限。因此,如何实现vcr的高效稳定包裹及肿瘤靶向递送至关重要。现有技术公开了一种硫酸长春新碱脂质体及其制备方法,该硫酸长春新碱脂质体由硫酸长春新碱以及使用鞘磷脂制备的纳米脂质体组成,其中所述硫酸长春新碱包裹在所述纳米脂质体中,使用鞘磷脂来制备纳米脂质体,并包裹硫酸长春新碱后制得硫酸长春新碱脂质体,其中鞘磷脂含有较多的酰胺键能够更好地抵抗化学和生物的降解,保护脂质体结构的稳定,提高肿瘤细胞的药物富集量,从而提高抗肿瘤效果。现有技术制备与表征硫酸长春新碱铁蛋白纳米粒(vincristine sulfate apoferritin nanoparticles, vcr
‑
apo
‑
nps),考察此载药铁蛋白纳米粒体内外跨越血脑屏障能力并研究其对脑胶质瘤体内外靶向性及抗肿瘤效应,采用ph梯度法制备硫酸长春新碱铁蛋白纳米粒,用高效液相测定硫酸长春新碱铁蛋白纳米粒的包封率,制备的硫酸长春新碱铁蛋白纳米粒粒径能达到设计的要求,形态圆整,包封率、载药量都比较好,稳定性良好,在酸性环境中有利于药物的释放。现有技术制备了白血病细胞特异性的穿膜肽修饰的载硫酸长春新碱的囊泡纳米药物cpp44
‑
ps
‑
vcr用于白血病的主动靶向治疗,通过ph梯度法vcr主动装载到囊泡内腔,粒径为90~100 nm。现有类脂质体结构的聚合物囊泡具有一个亲水内腔,可用于装载亲水性小分子药物,然而对vcr等亲水性药物的装载效率较低,且尚缺乏集体内循环稳定性、肿瘤特异靶向性、细胞内药物快速释放及生物相容性优异等多功能于一体的特性。
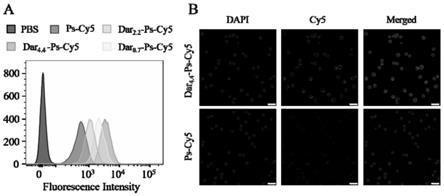
技术实现要素:
3.本发明的目的是公开两亲性嵌段聚合物、载药聚合物囊泡及其制备方法与在制备抗急性淋系白血病纳米药物中的应用,具体为一种负载硫酸长春新碱(vcr)的可逆交联可降解聚合物囊泡及其制备方法和应用。
4.为达到上述发明目的,本发明采用如下技术方案:
载小分子药聚合物囊泡在制备治疗急性淋系白血病药物中的应用。
5.两亲性嵌段聚合物在制备抗急性淋系白血病纳米药物中的应用,所述纳米药物的活性成分为小分子药物。
6.两亲性嵌段聚合物、官能团化两亲性嵌段聚合物和靶向分子在制备抗急性淋系白血病纳米药物中的应用,所述纳米药物的活性成分为小分子药物。
7.本发明载小分子药聚合物囊泡由小分子药物、两亲性嵌段聚合物制备;或者由小分子药物、两亲性嵌段聚合物、官能团化peg
‑
p(tmc
‑
dtc)、靶向单抗制备;所述两亲性嵌段聚合物的分子结构式如下一种:其中,z为5~15。
8.本发明中,所述两亲性嵌段聚合物中,peg的分子量为3000~8000 da;疏水链段的分子量为peg分子量的2.5~6倍;pdtc链段的分子量为疏水链段分子量的8%~30%。本发明的两亲性嵌段聚合物有亲水链段(n链段)、疏水链段(x+y链段)、kd
z
链段(z链段),疏水链段、kd
z
链段通过氨酯键连接;所述两亲性嵌段聚合物表示为peg
‑
p(tmc
‑
dtc)
‑
kd
z
、peg
‑
p(la
‑
dtc)
‑
kd
z
、peg
‑
p(cl
‑
dtc)
‑
kd
z
。
9.本发明中,所述小分子药物为硫酸长春新碱、阿霉素盐酸盐、表阿霉素盐酸盐、盐酸维拉帕米、盐酸伊立替康、瑞喹莫德,优选为硫酸长春新碱(vcr);所述靶向分子为靶向单抗,优选靶向单抗为靶向cd38单抗,如达雷木单抗(dar)、艾沙妥昔单抗(isa)或其它靶向cd38的单抗。
10.上述载药聚合物囊泡的制备方法为,以小分子药物、所述两亲性嵌段聚合物为原料,通过溶剂置换法制备载药聚合物囊泡;或者以小分子药物、所述两亲性嵌段聚合物、官能团化两亲性嵌段聚合物、靶向单抗为原料,通过溶剂置换法制备载药聚合物囊泡。优选的,将官能团化两亲性嵌段聚合物与所述两亲性嵌段聚合物组装交联并负载药物,然后与靶向cd38的单抗反应,制备载药聚合物囊泡。
11.本发明负载硫酸长春新碱(vcr)的可逆交联可降解聚合物囊泡,由两亲性嵌段聚合物组装并交联后得到,其具有不对称膜结构,外壳为聚乙二醇(peg),膜层为可逆交联的疏水聚碳酸酯,内壳为kd
z
,可以实现vcr的高效装载。本发明的载药囊泡为靶向或者非靶向
结构,本发明的靶向分子为单抗分子或单抗片段等,所述单抗分子如达雷木单抗(dar)、艾沙妥昔单抗(isa)或其它靶向cd38的单抗。
12.本发明采用两亲性嵌段聚合物先与官能团化两亲性嵌段聚合物,作为原料制备载药囊泡,然后再连接靶向cd38的单抗,得到cd38靶向载药囊泡。官能团来自peg引发剂,得到的聚合物peg端带有可反应性官能团,比如叠氮(n3),马来酰亚胺(mal)或n
‑
羟基琥珀酰亚胺(nhs),以两亲性嵌段聚合物peg
‑
p(tmc
‑
dtc)为例,官能团化两亲性嵌段聚合物可以为n3‑
peg
‑
p(tmc
‑
dtc)、mal
‑
peg
‑
p(tmc
‑
dtc)、nhs
‑
peg
‑
p(tmc
‑
dtc)。
13.本发明的载药囊泡由药物与囊泡组成,囊泡由聚合物交联得到,可以修饰也可以不修饰靶向分子;以两亲性嵌段聚合物peg
‑
p(tmc
‑
dtc)、硫酸长春新碱为例,本发明载药囊泡的制备方法可以如下:(1)将peg
‑
p(tmc
‑
dtc)的端羟基通过氯甲酸对硝基苯酯活化,再与kd
z
反应制得peg
‑
p(tmc
‑
dtc)
‑
kd
z
;(2)在peg
‑
p(tmc
‑
dtc)的peg端引入n3、mal或者nhs等官能团,得到官能化的peg
‑
p(tmc
‑
dtc);(3)以硫酸长春新碱、peg
‑
p(tmc
‑
dtc)
‑
kd
z
为原料,通过溶剂置换法制备负载vcr的可逆交联可降解聚合物囊泡;或者以硫酸长春新碱、peg
‑
p(tmc
‑
dtc)
‑
kd
z
和官能化的peg
‑
p(tmc
‑
dtc)为原料,通过溶剂置换法制备表面含有可反应性官能团的、负载vcr的、可逆交联、可降解聚合物囊泡,进而与单抗反应制备单抗导向的负载vcr的多功能囊泡。
14.本发明公开了上述负载vcr的可逆交联可降解聚合物囊泡及其制备方法,将peg
‑
p(tmc
‑
dtc)
‑
kd
z
聚合物的溶液注射入静置的vcr水溶液中,搅拌后透析,即得到负载vcr的可逆交联可降解聚合物囊泡(ps
‑
vcr);具体为将vcr溶于超纯水中并与hepes缓冲液(ph 6.8,10 mm)混合均匀,然后在静置下向其中注入peg
‑
p(tmc
‑
dtc)
‑
kd
z
聚合物的dmso溶液,搅拌3
‑
5分钟后用hepes(ph 7.4,10 mm)透析,即得到ps
‑
vcr。
15.本发明还公开了单抗导向、负载vcr的、可逆交联可降解聚合物囊泡及其制备方法:将peg
‑
p(tmc
‑
dtc)
‑
kd
z
的dmso溶液和官能化聚合物如n3‑
peg
‑
p(tmc
‑
dtc)的dmso溶液混合均匀后,再注入含有vcr的hepes溶液中,搅拌3
‑
5分钟后,透析即可得到表面含有n3的负载vcr的可逆交联聚合物囊泡;通过二苯并环辛炔修饰的单抗,如达雷木单抗(dar)、艾沙妥昔单抗(isa)或其它靶向cd38的单抗与叠氮官能化的载vcr囊泡(n3‑
ps
‑
vcr)发生张力触动的点击化学反应,可在温和条件下制备得到单抗导向的负载vcr囊泡(ab
‑
ps
‑
vcr)。采用同样的方法,通过巯基官能化的单抗分子与表面含有mal的载vcr囊泡发生迈克尔加成反应,或者单抗与nhs官能化的载vcr囊泡发生酰胺化反应也可简单制备得到ab
‑
ps
‑
vcr。
16.本发明的聚合物中,kd生物相容性好,结合peg链段与疏水链段,可以形成不对称膜结构囊泡,实现小分子药物(如vcr)的高效稳定包载;本发明通过静电作用力包载vcr,同时被双硫交联的囊泡膜与外界分隔,可避免在输送过程中泄漏及被细胞黏附而造成的损失和毒副作用,能够高效送至病灶部位,并在体内还原剂谷胱甘肽(gsh)的作用下,快速释放vcr,有效杀伤肿瘤细胞。
17.本发明中的聚合物囊泡为内膜带负电荷的还原敏感可逆交联、细胞内可解交联且生物可降解的聚合物囊泡;所述聚合物为peg
‑
p(tmc
‑
dtc)
‑
kd
z
,其中中间嵌段的tmc(la或者cl)与dtc呈无规排列;kd
z
的分子量为700
‑
2000 da ,远小于peg段的分子量,在自组装、
交联后得到内膜带有负电荷的可逆交联聚合物囊泡,囊泡的内壳为kd
z
用于复合小分子药物。囊泡膜为可逆交联的生物可降解且相容性好的ptmc,侧链的二硫戊烷结构类似人体天然的抗氧化剂硫辛酸,可自发形成还原敏感的可逆交联,不但可保证药物在血液中的稳定长循环,还可实现细胞内快速解交联,快速释放药物到靶细胞内。
18.与现有技术相比,本发明具有如下优点:1. 本发明设计了新的小分子亲水药物vcr载药囊泡及肿瘤靶向递送;囊泡膜为可逆交联的生物可降解且生物相容性好的ptmc,侧链的二硫戊烷可提供还原敏感的可逆交联,不但可保证药物在血液中的长循环,还可在细胞内快速解交联,释放药物到靶细胞内;外壳为peg同时具有单抗等靶向分子,可特异性结合癌细胞;囊泡的小尺寸以及肿瘤特异性靶向使得囊泡可高效输送vcr至肿瘤细胞内。
19.2. 本发明公开的载药囊泡体内外具有显著的抗肿瘤效果,聚合物生物相容性好,可形成不对称膜结构的囊泡,具有良好的药物包载效果。
20.3. 本发明的可降解聚合物囊泡载体避免了现有纳米载体粒径大、体内循环稳定性差、肿瘤细胞选择性低、细胞内vcr释放缓慢等缺陷。
21.4. 本发明的囊泡体系拥有许多独特的优点,包括尺寸小、制备简单可控、生物相容性优异、体内循环稳定性高、肿瘤细胞特异选择性强、细胞内药物释放速度快、肿瘤生长抑制效果显著等。因此,该囊泡体系有望成为简单且集多功能于一身的纳米平台,用于高效及特异性靶向递送vcr至急性淋系白血病细胞。
附图说明
22.图1为实施例一中n3‑
peg
‑
p(tmc
‑
dtc)的核磁谱图。
23.图2为实施例二中peg
‑
p(tmc
‑
dtc)
‑
npc的核磁谱图。
24.图3为实施例二中peg
‑
p(tmc
‑
dtc)
‑
kd5的核磁谱图。
25.图4为实施例五中dar与dar
‑
dbco的大分子质谱图。
26.图5为实施例六中dar
‑
ps
‑
vcr在高倍稀释及血清存在下的稳定性图。
27.图6为实施例六中dar
‑
ps
‑
vcr在非还原条件及10 mm gsh下的vcr释放行为。
28.图7为实施例七中(a)不同靶向密度的dar
‑
ps
‑
cy5在697细胞中的内吞情况以及(b)697细胞与dar
4.4
‑
ps
‑
cy5和ps
‑
cy5孵育4小时后的clsm图片(标尺:25 μm)。
29.图8为实施例七中(a)不同靶向密度的dar
‑
ps
‑
cy5在nalm
‑6‑
luc细胞中的内吞情况以及(b)nalm
‑6‑
luc细胞与dar
4.4
‑
ps
‑
cy5和ps
‑
cy5孵育4小时后的clsm图片(标尺:25 μm)。
30.图9为实施例七中不同靶向密度的dar
‑
ps
‑
cy5在ccrf
‑
cem细胞中的内吞情况。
31.图10为实施例八中不同靶向密度的dar
‑
ps
‑
vcr、ps
‑
vcr和游离vcr在697细胞中的毒性。
32.图11为实施例八中不同靶向密度的dar
‑
ps
‑
vcr和ps
‑
vcr在nalm
‑6‑
luc细胞中的毒性。
33.图12为实施例八中dar
‑
ps
‑
vcr和ps
‑
vcr在(a)mv4
‑
11细胞和(b)l929细胞中的毒性。
34.图13为实施例九中荷原位697 b系急性淋系白血病小鼠模型的构建。
35.图14为实施例十中荷原位697 b系急性淋系白血病在接受不同治疗后的体重变化以及kaplan
‑
meier生存曲线图。
36.图15为实施例十中流式监测荷原位697 b系急性淋系白血病小鼠在接受不同治疗后各脏器中697细胞的浸润情况。
37.图16为实施例十一中荷原位nalm
‑6‑
luc b系急性淋系白血病小鼠模型的构建。
38.图17为实施例十二中荷原位nalm
‑6‑
luc急性淋系白血病小鼠在接受不同治疗后的生物发光成像、肿瘤luc信号变化、体重变化以及生存曲线图。
具体实施方式
39.本发明负载vcr的可逆交联可降解聚合物囊泡,由两亲性三嵌段聚合物自组装的同时发生自交联得到;所述三嵌段聚合物的分子链包括依次连接的亲水链段、疏水链段以及kd分子;所述亲水链段为聚乙二醇(peg),分子量为3000
‑
8000 da;所述疏水链段为聚碳酸酯链段,分子量为亲水链段分子量的2.1
‑
5.7倍;kd多肽的分子量为peg亲水链段的15%
‑
50%。
40.本发明peg
‑
p(tmc
‑
dtc)
‑
kd
z
聚合物通过氯甲酸对硝基苯酯(p
‑
npc)活化peg
‑
p(tmc
‑
dtc)的末端羟基后,与kd
z
反应制得,合成路线如下:其中,在步骤(i)中,反应条件为无水二氯甲烷(dcm),吡啶,25
ꢀº
c,24小时;在步骤(ii)中,反应条件为无水二甲亚砜(dmso),kd
z
,三乙胺,30
ꢀº
c,48小时。
41.具体合成步骤如下:(1)在冰水浴中,向peg
‑
p(tmc
‑
dtc)的无水dcm溶液中加入吡啶,搅拌10分钟后向其中缓慢滴加p
‑
npc的dcm溶液。滴加完成后(约30分钟)继续在室温下反应24小时,然后抽滤除去吡啶盐,收集聚合物溶液旋蒸浓缩至~100 mg/ml,经冰乙醚沉淀、真空干燥,得到产物peg
‑
p(tmc
‑
dtc)
‑
npc;(2)在氮气保护下,称取kd
z
多肽置于双颈圆底烧瓶中并加入无水dmso使其完全溶解,在搅拌下加入三乙胺,然后向其中逐滴加入peg
‑
p(tmc
‑
dtc)
‑
npc的无水dmso溶液,30分钟滴加完成。在30
ꢀº
c下反应2天后,先用含有5%无水甲醇的dmso透析36小时(更换4~5次介质)以除去未反应的kd
z
和反应生成的对硝基苯酚,再用dcm透析6小时,然后收集聚合物溶
液并旋蒸浓缩至聚合物浓度约为50 mg/ml,在冰乙醚中沉淀后真空干燥,即得到白色棉絮状的聚合物peg
‑
p(tmc
‑
dtc)
‑
kd
z
。将tmc常规更换为la或者cl,得到peg
‑
p(la
‑
dtc)
‑
kd
z
、peg
‑
p(cl
‑
dtc)
‑
kd
z
。
42.本发明涉及的原料为现有市售原料,具体的制备方法以及测试方法为本领域常规技术;下面结合实施例和附图对本发明作进一步描述:实施例一 合成聚合物n3‑
peg
‑
p(tmc
‑
dtc)聚合物n3‑
peg
‑
p(tmc
‑
dtc)是以dpp为催化剂,n3‑
peg
‑
oh为大分子引发剂,引发tmc和dtc开环共聚合得到。首先,在手套箱氮气环境下称取n3‑
peg
‑
oh(m
n = 7.9 kg/mol,0.79 g,0.1 mmol),tmc(1.50 g,14.8 mmol)和dtc(0.20 g,1.0 mmol)于密闭反应器中,加入5.0 ml无水dcm溶解,然后加入dpp(0.25 g,1.2 mmol),并密封好反应器转移出手套箱,置于30
ꢀº
c下反应四天。反应结束后,用冰乙醚沉淀两次,真空干燥后得到白色絮状聚合物n3‑
peg
‑
p(tmc
‑
dtc),产率:85.4%。附图1中可以看到δ 3.38 和3.63 ppm处n3‑
peg的特征峰,δ 2.03和4.18 ppm处tmc的特征峰,以及δ 2.99和4.22 ppm处dtc的特征峰。通过δ 2.03和δ 2.99 ppm处的亚甲基氢积分面积与δ 3.63 ppm处peg亚甲基氢积分面积比值可计算得到n3‑
peg
‑
p(tmc
‑
dtc)聚合物的分子量为7.9
‑
(15.0
‑
2.0) kg/mol,gpc测得其分子量分布为1.1,用于以下实施例。
43.将n3‑
peg
‑
oh更换为分子量为5k的ch3o
‑
peg
‑
oh,其余不变,参照以上制备方法,得到peg
‑
p(tmc
‑
dtc)(5.0
‑
(15.0
‑
2.0) kg/mol)。
44.实施例二 合成聚合物peg
‑
p(tmc
‑
dtc)
‑
kd
z
聚合物peg
‑
p(tmc
‑
dtc)
‑
kd
z
的合成分为两步,即采用p
‑
npc活化peg
‑
p(tmc
‑
dtc)(5.0
‑
(15.0
‑
2.0) kg/mol)的末端羟基后,与kd
z
多肽分子反应得到。以peg
‑
p(tmc
‑
dtc)
‑
kd5的合成为例,具体操作如下,在氮气氛围下将peg
‑
p(tmc
‑
dtc)(1.0 g,45.5 μmol)溶解于10 ml无水dcm中,然后转移至冰水浴中并加入吡啶(18.0 mg,227.5 μmol),搅拌10分钟后向其中滴加p
‑
npc(48.4 mg,240.3 μmol)的dcm溶液(1.0 ml)。3 0分钟滴加完成后继续在室温下反应24小时,接着抽滤除去吡啶盐,收集聚合物溶液旋蒸浓缩至~100 mg/ml,经冰乙醚沉淀、真空干燥,得到产物peg
‑
p(tmc
‑
dtc)
‑
npc,产率:90.0%。随后,在氮气保护下,称取kd5(60.0 mg,83.4 μmol)溶解于4 ml无水dmso中并加入三乙胺(4.2 mg,41.7 μmol),然后在搅拌下向其中逐滴加入peg
‑
p(tmc
‑
dtc)
‑
npc的无水dmso溶液(9.0 ml),30分钟滴加完成。在30
ꢀº
c下反应2天后,用含有5%无水甲醇的dmso透析36小时(更换4~5次介质)以除去未反应的kd5和反应生成的对硝基苯酚,再用dcm透析6小时,然后收集聚合物溶液并旋蒸浓缩至聚合物浓度为50 mg/ml,在冰乙醚中沉淀并真空干燥,即得到白色棉絮状的聚合物peg
‑
p(tmc
‑
dtc)
‑
kd5,产率:91.0%。附图2和3是peg
‑
p(tmc
‑
dtc)
‑
npc和peg
‑
p(tmc
‑
dtc)
‑
kd5的核磁氢谱图。从附图2中可以看到p
‑
npc的特征峰(δ 7.41和δ 8.30 ppm)以及peg
‑
p(tmc
‑
dtc)的特征峰(δ 2.03、2.99、3.38、3.63、4.18和4.22 ppm),根据p
‑
npc特征峰的积分面积与δ 3.38 ppm处peg甲基氢峰面积比值计算得到npc的接枝率约为100%。附图3可以看到δ 7.41和δ 8.30 ppm处npc的特征峰消失,且在δ 4.54 ppm处出现了一个新的信号峰,即为kd5中次甲基的特征峰。通过比较δ 4.54 ppm处峰面积与δ 1.95 ppm处tmc亚甲基氢峰面积的比值计算得到kd5的取代度为~100%。此外,通过高效液相色谱(hplc)测得kd5的接枝率为100%,证明peg
‑
p(tmc
‑
dtc)
‑
kd5的成功合成,用于以下实施例。
45.实施例三 负载vcr的可逆交联生物可降解囊泡(ps
‑
vcr)的制备ps
‑
vcr通过溶剂置换法制备,其中vcr通过与kd
z
之间的静电相互作用进行包裹。将peg
‑
p(tmc
‑
dtc)
‑
kd
z
溶解于dmso中(40 mg/ml),取100
ꢀµ
l打入静置的含有vcr的900
ꢀµ
l hepes(ph 6.8,10 mm)中,在300 rpm下搅拌3分钟后,用hepes(ph 7.4,10 mm)透析8小时即得到ps
‑
vcr。其中vcr的理论载药量设定为4.8
‑
11.1 wt.%,研究发现所得ps
‑
vcr的粒径在26
‑
40 nm之间,粒径分布在0.05
‑
0.20(表1)。通过紫外可见光谱测定其在298 nm波长下的吸光值计算得到ps
‑
vcr的包封率高达97.2%。基于同样的方法,理论载药量4.8%下,peg
‑
p(la
‑
dtc)
‑
kd5、peg
‑
p(cl
‑
dtc)
‑
kd5制备的ps
‑
vcr的包封率分别为88.3%、83.9%;而采用peg
‑
p(tmc
‑
dtc)两嵌段聚合物制备的载药囊泡粒径在75 nm左右,且vcr的包封率较低,仅有14.1%。
46.实施例四 负载其它药物的可逆交联生物可降解囊泡(ps
‑
drug)的制备采用实施例三中类似的方法,研究了可逆交联可降解囊泡对其它药物如盐酸维拉帕米(ver)、盐酸伊立替康(cpt)、瑞喹莫德(r848)的包载。研究发现在包载不同药物后,所得ps
‑
drug的粒径在20
‑
40 nm之间,具体结果见表2。
47.实施例五 负载vcr的单抗导向聚合物囊泡(ab
‑
ps
‑
vcr)的制备ab
‑
ps
‑
vcr通过在叠氮官能化的聚合物囊泡vcr纳米药物(n3‑
ps
‑
vcr)表面后修饰二苯并环辛炔官能化的单抗(ab
‑
dbco)得到。n3‑
ps
‑
vcr由n3‑
peg
‑
p(tmc
‑
dtc)和peg
‑
p(tmc
‑
dtc)
‑
kd
z
共组装的同时包裹vcr而得到,其中n3‑
peg
‑
p(tmc
‑
dtc)的含量为1~10 wt.%。具体地,以含有2% n3‑
peg
‑
p(tmc
‑
dtc)的n3‑
ps
‑
vcr的制备为例,称取8.0 mg n3‑
peg
‑
p(tmc
‑
dtc)和392.0 mg peg
‑
p(tmc
‑
dtc)
‑
kd5(摩尔比2∶98)溶解于dmso中(聚合物总浓度为40 mg/ml),同时将4.0 ml vcr的水溶液(5 mg/ml)加入到90 ml hepes(ph 6.8,10 mm)中混合均匀,在静置下向其中注入10 ml聚合物溶液,搅拌5分钟后,置于37
ꢀº
c静置4小时。用hepes(ph 7.4,10 mm)透析(mwco:14 kda)8小时除去有机溶剂后,采用纳滤系统除去游离的vcr,得n3‑
ps
‑
vcr。动态光散射(dls)测得n3‑
ps
‑
vcr的粒径为36 nm,且分布较窄(pdi:0.11)。当vcr的理论载药量为4.8 wt.%时,包封率高达97.2%,载药量为4.6 wt.%。为了高效地键合单抗,随后采用切向流装置将n3‑
ps
‑
vcr由4 mg/ml浓缩到18.6 mg/ml,以方便储存并提高单抗的键合效率。浓缩后n3‑
ps
‑
vcr的粒径为42 nm,pdi为0.07。其在4
ꢀº
c储存180天期间粒径均保持在40 nm左右,pdi小于0.17,且vcr的泄漏量低于0.6%,说明n3‑
ps
‑
vcr具有优异的长期储存稳定性(表3)。
48.ab
‑
dbco通过小分子nhs
‑
oeg4‑
dbco与单抗上的氨基发生酰胺化反应制备得到,其中dbco的官能化度可通过改变ab与nhs
‑
oeg4‑
dbco的摩尔比进行调节。以dbco官能化达雷木单抗(dar
‑
dbco)的制备为例,用pb(ph 8.5,10 mm)将dar的pbs溶液(21.7 mg/ml)稀释到10 mg/ml,取200 μl在振荡下向其中加入3或5倍摩尔当量的nhs
‑
oeg4‑
dbco的dmso溶液(5 mg/ml),置于27
ꢀº
c,120 rpm摇床中反应过夜。反应结束后,用超滤管离心(mwco:10 kda,3000 rpm)除去未反应的nhs
‑
oeg4‑
dbco,并用pbs(ph 7.4,10 mm)洗涤超滤两次,得到dar
‑
dbco。当dar与nhs
‑
oeg4‑
dbco的摩尔比为1∶3和1∶5时,通过飞行时间质谱(maldi
‑
tof
‑
ms)测得每个dar上分别修饰了1.5和2.8个dbco(附图4),表示为dar
‑
dbco
1.5
和dar
‑
dbco
2.8
。为了最大程度地保持单抗的靶向性及生物学活性,后续均采用dar
‑
dbco
1.5
或者修饰有1.5
‑
2个dbco的其它单抗进行实验。
49.通过n3‑
ps
‑
vcr表面的n3与dar
‑
dbco之间发生张力触动的点击化学反应可简单制备得到dar
‑
ps
‑
vcr,dar的表面密度可通过改变投料比进行调节。设定dar
‑
dbco与n3的摩尔比分别为0.25∶1、0.5∶1和1∶1,即在107.5 μl n3‑
ps
‑
vcr(18.6 mg/ml)中分别加入10.4、20.9和41.8 μl的dar
‑
dbco溶液(5.6 mg/ml),然后在25
ꢀº
c、100 rpm摇床中反应过夜。采用超速离心(58 krpm,4
ꢀº
c、30分钟)除去未键合的dar
‑
dbco,并用hepes(ph 7.4,10 mm)洗涤两次,同时收集dar
‑
ps
‑
vcr和上清以测定dar的键合量。上清中未键合的dar
‑
dbco通过hplc测定,从而计算出每毫克聚合物囊泡表面dar的含量分别为28.6、56.4和112.2 μg,根据多角度激光光散射测得的聚合物囊泡的绝对分子量(1.15
×
107g/mol)和聚集数(523个)计算可知每个dar
‑
ps
‑
vcr表面分别键合有2.2、4.4和8.7个dar(表4)。随着dar密度的增加,dar
‑
ps
‑
vcr的粒径略有增加(43
‑
49 nm),粒径分布较窄(pdi:0.14
‑
0.21),接了单抗后,包封结果与本实施例n3‑
ps
‑
vcr一样。
50.其它单抗导向的负载vcr聚合物囊泡,如isa
‑
ps
‑
vcr和anti
‑
cd38
‑
ps
‑
vcr的制备方法均与dar
‑
ps
‑
vcr类似。其粒径在40
‑
60 nm之间,粒径分布较窄(pdi:0.10
‑
0.30),每个囊泡表面单抗的个数为1
‑
10个。
51.现有技术cn110229323a表7公开的载皂草素蛋白(sap)非靶向囊泡(kd5)经过超滤或超速离心(58 krpm,4
ꢀº
c、30分钟)后,dle由68.3%下降至23%,药物大量泄漏,说明其无法接靶向单抗。
52.实施例六 ab
‑
ps
‑
vcr靶向聚合物囊泡纳米药物的稳定性及体外药物释放采用每个囊泡表面含有4.4个dar的dar
4.4
‑
ps
‑
vcr为代表,研究ab
‑
ps
‑
vcr靶向囊泡纳米药物的稳定性及体外药物释放行为。dar
‑
ps
‑
vcr的稳定性分别采用磷酸缓冲溶液稀释50倍或者加入10%的胎牛血清,并通过动态光散射检测其粒径变化。附图5为dar
‑
ps
‑
vcr稳定性的粒径分布图。结果表明,dar
‑
ps
‑
vcr靶向囊泡纳米药物在稀释50倍以及加入10% fbs 24小时后均保持完好的粒径和粒径分布,具有良好的稳定性。
53.dar
‑
ps
‑
vcr的体外药物释放行为采用透析法研究,其中有2种释放介质,分别为hepes(ph 7.4,10 mm)和含有10 mm gsh的hepes溶液(氮气环境)。首先将0.5 ml dar
‑
ps
‑
vcr(0.5 mg/ml)装进释放袋(mwco:14 kda)中,然后置于20 ml相应的释放介质中,于37
ꢀº
c、100 rpm摇床中进行。在设定的时间点(0、1、2、4、6、8、10、12、24 h)取出5 ml透析液,并补加5 ml新鲜介质。透析液中vcr的含量通过hplc(流动相为甲醇:水(加入15%三乙胺,再用磷酸调节ph为7.0)= 70:30)测定。附图6为dar
‑
ps
‑
vcr靶向囊泡纳米药物的体外释放结果图。结果表明,dar
‑
ps
‑
vcr在10 mm gsh的还原条件下,12小时内vcr的释放量达到85%以上,而在非还原条件下,24小时内vcr的累积释放量只有22%左右。
54.实施例七 dar
‑
ps
‑
vcr靶向聚合物囊泡纳米药物的细胞内吞行为由于vcr本身无荧光,采用cy5标记聚合物囊泡,dar
‑
ps
‑
cy5的制备方法参考实施例五,ps
‑
cy5的制备方法参考实施例三;通过流式细胞仪和激光扫描共聚焦显微镜(clsm)研究不同dar密度的dar
‑
ps
‑
cy5在697和nalm
‑6‑
luc细胞中的摄取情况。流式实验中,首先将697或nalm
‑6‑
luc细胞悬液铺在6孔板中(5
×
105个/孔),置于培养箱孵育12小时后,每孔加入200 μl dar
‑
ps
‑
cy5和ps
‑
cy5(cy5孔内浓度为2.0 μg/ml),用pbs组作为对照。继续孵育4小时后,离心(800 rpm,5分钟)收集细胞,并用pbs清洗两次,最后用500 μl pbs分散并置于流式管中进行测定。测试结果显示,dar
‑
ps
‑
cy5在697细胞中的内吞量明显高于ps
‑
cy5,其中与dar
4.4
‑
ps
‑
cy5孵育的细胞具有最高的荧光强度,其荧光强度是ps
‑
cy5对照组的
5.7倍(附图7a),表明dar的引入可显著增强ps
‑
cy5的细胞摄取,且当每个囊泡表面键合4.4个dar时靶向性最佳。类似地,dar
‑
ps
‑
cy5在nalm
‑6‑
luc细胞中的内吞量也明显高于ps
‑
cy5,其中dar
4.4
‑
ps
‑
cy5的内吞量约是非靶向ps
‑
cy5的7.9倍(附图8a)。
55.随后采用clsm进一步研究了dar
4.4
‑
ps
‑
cy5和ps
‑
cy5在697和nalm
‑6‑
luc细胞中的内吞行为。具体实验步骤如下,将多聚赖氨酸(300 μl,0.1 mg/ml)预处理的小圆片置于24孔板中,并加入697或nalm
‑6‑
luc细胞悬液(3
×
105个/孔),于培养箱中培养24小时后,分别加入100 μl dar
4.4
‑
ps
‑
cy5和ps
‑
cy5(cy5孔内浓度为40 μg/ml)。继续孵育4小时后小心移去培养基,用pbs洗3次,接着用4%多聚甲醛溶液固定15分钟,用pbs洗3次,再用dapi染细胞核3分钟,用pbs清洗3次,最后采用甘油封片并用clsm(leica,tcs sp5)进行观察和拍摄。附图7b和8b分别为dar
4.4
‑
ps
‑
cy5和ps
‑
cy5在697和nalm
‑6‑
luc细胞中的摄取结果图。结果表明,当697或nalm
‑6‑
luc细胞与dar
4.4
‑
ps
‑
cy5孵育4小时后,细胞核周围呈现出明显的红色荧光,而与ps
‑
cy5孵育的细胞中荧光较为微弱,表明dar
‑
ps
‑
cy5具备优异的靶向性及高效快速的细胞内吞。
56.同时,不同dar密度的dar
‑
ps
‑
cy5在ccrf
‑
cem细胞中的摄取情况也通过流式细胞仪研究。首先将ccrf
‑
cem细胞悬液铺在6孔板中(5
×
105个/孔),置于培养箱孵育12小时后,每孔加入200 μl dar
‑
ps
‑
cy5和ps
‑
cy5(cy5孔内浓度为2.0 μg/ml),用pbs组作为对照。继续孵育4小时后,离心(800 rpm,5分钟)收集细胞,并用pbs清洗两次,最后用500 μl pbs分散并置于流式管中进行测定。测试结果显示,dar
‑
ps
‑
cy5在ccrf
‑
cem细胞中的内吞量明显高于ps
‑
cy5,其中与dar
4.4
‑
ps
‑
cy5孵育的细胞具有最高的荧光强度,其荧光强度是ps
‑
cy5对照组的4.1倍(附图9),表明dar的引入可显著增强ps
‑
cy5的细胞摄取,且当每个囊泡表面键合4.4个dar时靶向性最佳。
57.实施例八 dar
‑
ps
‑
vcr靶向聚合物囊泡纳米药物的细胞毒性实验dar
‑
ps
‑
vcr对b系急性淋系白血病(b
‑
all)697和nalm
‑6‑
luc细胞的体外抗肿瘤活性采用cck
‑
8试剂盒进行测定。先将697或nalm
‑6‑
luc细胞铺于96孔板中(18000个/孔),置于37
ꢀº
c、含5% co2的培养箱中培养12小时后,向每孔加入20 μl含有不同dar表面密度的dar
‑
ps
‑
vcr、ps
‑
vcr和游离vcr,孔内vcr的最终浓度分别为0.001、0.01、0.05、0.1、0.5、1、10和100 ng/ml。在37
ꢀº
c孵育48小时后,每孔加入10 μl cck
‑
8溶液继续孵育4小时,最后用酶标仪测试其在450 nm处的吸光度值。附图10为不同靶向密度的dar
‑
ps
‑
vcr囊泡纳米药物(z为5)对697细胞的细胞毒性结果图。结果表明,当每个囊泡表面键合4.4个dar时(dar
4.4
‑
ps
‑
vcr)细胞毒性最强,其半致死浓度(ic
50
)低至0.05 ng/ml,相比游离vcr(ic
50
:0.79 ng/ml)和非靶向对照组ps
‑
vcr (z为5,ic
50
:0.23 ng/ml)分别降低了16倍和5倍。类似地,dar
4.4
‑
ps
‑
vcr在nalm
‑6‑
luc细胞中的毒性约是非靶向对照组ps
‑
vcr的3.8倍之高,其ic
50
分别为0.28 和1.00 ng/ml(附图11)。
58.将mv4
‑
11细胞(12000个/孔)和l929成纤维细胞(3000个/孔)分别铺于96孔板中培养24小时,然后向每孔加入20 μl dar
4.4
‑
ps
‑
vcr(z为5)和ps
‑
vcr(z为5),孔内vcr的最终浓度为0.0001
‑
100 ng/ml。mv4
‑
11细胞在37
ꢀº
c孵育48小时后,每孔加入10 μl cck
‑
8溶液继续孵育4小时,并用酶标仪测试其在492 nm处的吸光度值。l929细胞在37
ꢀº
c孵育48小时后,向每孔中加入10 μl mtt的pbs溶液(5 mg/ml)孵育4小时,随后小心移除培养基并加入150 μl dmso溶解产生的甲瓒结晶,用酶标仪测试其在570 nm处的吸光度;结果显示,在mv4
‑
11
细胞中,ic
50
是697细胞中的27倍之高(附图12a)。更为有趣的是,对于l929正常细胞而言,即使在vcr浓度高达100 ng/ml时,dar
4.4
‑
ps
‑
vcr和ps
‑
vcr也没有表现出明显的毒性,细胞存活率均接近100%(附图12b)。这些结果综合表明dar
‑
ps
‑
vcr可选择性靶向并高效杀伤急性淋系白血病细胞,而对正常细胞毒性较小。
59.此外,采用同样的方法测试发现dar
‑
ps空囊泡和ps空囊泡以及游离dar对697和nalm
‑6‑
luc细胞均无明显的毒性。
60.以下实施例中dar
‑
ps
‑
vcr均是指dar
4.4
‑
ps
‑
vcr囊泡纳米药物(z为5),dar
‑
ps
‑
cy5均为dar
4.4
‑
ps
‑
cy5(z为5)。
61.实施例九 荷697原位b系急性淋系白血病小鼠模型的构建原位697 b
‑
all肿瘤模型的建立:所有动物实验及操作均获得苏州大学实验动物中心和苏州大学动物护理和使用委员会的批准。采用6
‑
8周龄、平均体重约为20 g的zod/scid雌性小鼠,在第0天采用1.5 gy的剂量辐照并通过腹腔注射0.2 mg(1 mg/ml)的anti
‑
cd122抗体对小鼠进行清髓,随后将697细胞(1
×
105个/只)通过尾静脉注射到小鼠体内 (附图13a)。在接种后第24天收集小鼠肝、脾、骨和外周血并标记anti
‑
human cd45
‑
apc抗体,通过流式检测697细胞在各脏器的浸润,结果如附图13b所示。其中荷原位697 b
‑
all小鼠的肝、脾、骨、外周血中均存在着明显的肿瘤浸润,cd45阳性697细胞的占比分别为96%,30%,48%和14%,证明原位697 b
‑
all模型的成功建立。
62.实施例十 dar
‑
ps
‑
vcr在荷697原位b系急性淋系白血病小鼠中的抗肿瘤效果为了研究dar
‑
ps
‑
vcr对荷697原位b系急性淋系白血病小鼠的抗肿瘤效果,在接种后第6天随机分组开始治疗实验。其给药方案为vcr剂量为0.25 mg/kg,4天给一针,共4针,组别为dar
‑
ps
‑
vcr,ps
‑
vcr和游离vcr,pbs组作为对照 (z = 6)。研究发现pbs组小鼠在接种后21天开始发病,表现为双腿瘫痪、体重下降并发生死亡,且肝、脾、骨髓和外周血中均存在明显的肿瘤浸润。附图14为各治疗组小鼠的体重变化及生存期。结果显示,所有治疗组小鼠在给药期间(6
‑
18天)体重稳定,且无体态异常,表明无明显的毒副作用 (附图14a)。在给药结束后,pbs、ps
‑
vcr和游离vcr治疗组小鼠迅速出现后肢瘫痪、体重下降、发病死亡的现象。而dar
‑
ps
‑
vcr治疗组小鼠在给药结束后仍持续保持体重稳定,生存期相比于上述三组均得到了显著延长(p < 0.001,附图14b)。此外,在接种后第21天时,dar
‑
ps
‑
vcr治疗组小鼠肝、脾、骨髓和外周血中的肿瘤细胞浸润均明显低于ps
‑
vcr和游离vcr组(附图15)。
63.实施例十一 荷nalm
‑6‑
luc原位b系急性淋系白血病小鼠模型的构建原位nalm
‑6‑
luc b
‑
all肿瘤模型的建立如附图16a所示:采用6
‑
8周龄、平均体重约为20 g的nod.cb17
‑
prkdc
scid
/il2rg
tm1
/bcgen(b
‑
ndg)雌性小鼠,在第0天将nalm
‑6‑
luc细胞(5
×
105个/只)通过尾静脉注射到小鼠体内。为监测nalm
‑6‑
luc原位异种移植模型的生长情况,在第5、10、15、23、27通过给荷瘤小鼠腹腔注射荧光素钾盐,成像监测小鼠体内生物发光信号强度。如附图16b和c所示,荷瘤小鼠的生物发光信号呈现快速增长的趋势,从第5天至23天时增加了5200多倍。且在接种后第10
‑
15天,后腿骨中即出现了明显的luc信号,在第15
‑
27天,肿瘤细胞在肝、脾、骨迅速浸润并增殖,小鼠体重明显下降并逐渐发生死亡,中位生存期为27天 (附图16c)。
64.实施例十二 dar
‑
ps
‑
vcr在荷nalm
‑6‑
luc原位b系急性淋系白血病小鼠中的抗肿瘤效果
为了研究dar
‑
ps
‑
vcr对荷nalm
‑6‑
luc原位b系急性淋系白血病小鼠的抗肿瘤效果,在接种后第5天随机分组开始治疗实验,并持续监测小鼠生物发光信号、体重、体态变化及生存期。其给药方案为vcr剂量为0.25 mg/kg,4天给一针,共4针,组别为dar
‑
ps
‑
vcr,ps
‑
vcr和游离vcr,pbs组作为对照 (z = 5)(附图17a)。附图17b
‑
e为各治疗组小鼠的生物发光成像,生物发光信号变化、生存期及体重变化。结果显示,相较游离vcr组及非靶向ps
‑
vcr组, dar
8.3
‑
ps
‑
vcr和dar
4.4
‑
ps
‑
vcr靶向药物治疗组小鼠体内的肿瘤luc信号得到了显著抑制(p < 0.001)(附图17c)。所有治疗组小鼠在给药期间(5
‑
17天)体重稳定,且无体态异常,表明无明显的毒副作用 (附图17d)。在给药结束后,pbs、ps
‑
vcr和游离vcr治疗组小鼠迅速出现后肢瘫痪、体重下降、发病死亡的现象。而dar
8.3
‑
ps
‑
vcr和dar
4.4
‑
ps
‑
vcr治疗组小鼠在给药结束后仍持续保持体重稳定,生存期相比于上述三组均得到了显著延长(p < 0.001和p <0.01)(附图17e)。
65.这些结果综合表明dar
‑
ps
‑
vcr可高效靶向递送vcr至肿瘤部位,从而高效抑制原位b系急性淋系白血病的生长。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1