一种阿霉素长循环脂质体靶向药物及其制备方法
1.本发明属于药剂学领域,具体涉及一种阿霉素长循环脂质体靶向药物及其制备方法。
背景技术:
2.癌症一直是全球死亡的主要死亡原因,2020年全球新发癌症统计,乳腺癌取代肺癌,成为了全球第一大癌,正在严重危害着人类的生命。临床化疗仍然是癌症的主要治疗方式。但由于抗癌药物可能的副作用,如非特异性毒性、溶解性差、血液循环时间短等,化疗效果仍然不理想。因此,药物缓控释纳米技术成为了研究热点,用于将所需的药物递送到肿瘤部位,实现减轻毒副作用和提高治疗效果的目标。
3.纳米粒由于其独特的性质和功能,包括小尺寸、功能化潜力、靶向能力和可控释放特性,在治疗肿瘤方法发挥着巨大的潜力。纳米粒进入体内后,其在体内的“活动”是复杂且难以控制的[1]。当纳米颗粒进入血液时,蛋白质会竞争性结合到纳米颗粒表面,纳米颗粒的命运则由被吸附的蛋白质层所主宰,形成纳米颗粒
‑
蛋白层(nanoparticle
‑
protein corona),即“蛋白冠”(“pc”)[2
‑
5]。当纳米颗粒进入机体后,机体组织和细胞真正识别的并不是纳米颗粒本身,而是其表面的蛋白冠,所以纳米颗粒的生物学作用实质上是由其表面的蛋白冠所决定的。其中,吸附调理素蛋白的纳米载体被免疫系统从血液中清除,如igg和补体蛋白,这些蛋白将纳米颗粒标记为异物,且这些蛋白屏蔽掉纳米粒本身的特性,显著影响了纳米粒在体内的分布和药物传递效率[6,7]。另一方面,蛋白的吸附也是有益的,吸附去调理素蛋白(如白蛋白,载脂蛋白)的纳米粒,与细胞膜的相互作用减少,降低其被吞噬细胞识别,从而延长其血液循环时间。并且吸附含有受体特异性蛋白质的纳米粒,可以促进纳米颗粒的特异性摄取,从而达到药物靶向递送的目的。所以特异性吸附去调理素蛋白而不与调理素蛋白结合成为了必要。考虑到防止蛋白冠形成的困难,利用其形成和基本特征可能将是一个有效地解决方式。
[0004]
白蛋白是一种很有前途的去调理素蛋白,可以延长药物的生物半衰期,不被吞噬细胞摄取,并通过sparc蛋白介导选择性地将其输送到肿瘤细胞[8
‑
13]。有研究者将纳米粒在体外与白蛋白进行孵育使白蛋白在纳米粒表面形成包衣,再将白蛋白包衣的纳米粒静脉注射到动物体内,结果显示白蛋白包衣能显著抑制调理素蛋白吸附、减少巨噬细胞吞噬、降低纳米粒的细胞毒性并延长其血液循环时间[14,15]。基于蛋白冠的形成和白蛋白对纳米颗粒的保护作用,本发明创新性地提出:将可特异的与白蛋白结合的功能分子偶联到脂质体表面,脂质体表面修饰的功能分子能与体内的内源性白蛋白发生特异性的结合进而改变蛋白冠的组分。由于脂质体表面有可以与白蛋白特异性结合的功能分子,使得白蛋白与脂质体的亲和力大为提高,最终,脂质体表面的蛋白冠将以白蛋白为主要成分。
[0005]
有研究者利用噬菌体展示技术筛选出了可以与白蛋白特异性结合的短肽(albumin
‑
binding domain,abd),该短肽含有46个氨基酸,序列为laeakvlanreldkygvsdfykrlinkaktvegvealklhilaalp
‑
cys。abd短肽与不同种属动物的血浆白蛋白都有着高亲和
力,与白蛋白结合的解离平衡常数都在μm水平以下。大多数关于abd介导的药物递送都是通过基因融合的方法,也有研究者合成abd肽用于递送小的疏水性抗癌药物,证明了abd是一种可以特异的结合白蛋白的功能分子,对白蛋白具有很高的亲和力[10,12,16]。因此,在发明中,我们选择abd肽作为结合白蛋白的功能分子,利用马来酰亚胺与abd肽上的巯基发生反应,将abd肽连接到脂质体上。连接abd肽的脂质体进入体内后,特异性与白蛋白结合,减少其他蛋白的吸附,延长血液循环时间;同时吸附白蛋白的脂质体与肿瘤细胞表面的白蛋白受体结合,提高药物靶向性。
[0006]
阿霉素(doxorubicin,dox)是一种广谱抗肿瘤药物,作为抗肿瘤药物,具有抗瘤谱广泛、疗效强等特点,常用于治疗血液系统癌、实体瘤和肉瘤,被称为是治疗实体瘤最有效的药物。
[0007]
参考文献:
[0008]
[1]c.h.yu,g.y.chen,m.y.xia,y.xie,y.q.chi,z.y.he,c.l.zhang,t.zhang,q.m.chen,q.peng,understanding the sheet size
‑
antibacterial activity relationship of graphene oxide and the nano
‑
bio interaction
‑
based physical mechanisms,colloids surf b biointerfaces 191(2020)111009.
[0009]
[2]c.corbo,r.molinaro,a.parodi,n.e.toledano furman,f.salvatore,e.tasciotti,the impact of nanoparticle protein corona on cytotoxicity,immunotoxicity and target drug delivery,nanomedicine(lond)11(1)(2016)81
‑
100.
[0010]
[3]s.tenzer,d.docter,j.kuharev,a.musyanovych,v.fetz,r.hecht,f.schlenk,d.fischer,k.kiouptsi,c.reinhardt,k.landfester,h.schild,m.maskos,s.k.knauer,r.h.stauber,rapid formation of plasma protein corona critically affects nanoparticle pathophysiology,nat nanotechnol 8(10)(2013)772
‑
81.
[0011]
[4]m.p.monopoli,c.aberg,a.salvati,k.a.dawson,biomolecular coronas provide the biological identity of nanosized materials,nat nanotechnol 7(12)(2012)779
‑
86.
[0012]
[5]a.l.barr
á
n
‑
berd
ó
n,d.pozzi,g.caracciolo,a.l.capriotti,g.caruso,c.cavaliere,a.riccioli,s.palchetti,a.lagan
à
,time evolution of nanoparticle
‑
protein corona in human plasma:relevance for targeted drug delivery,langmuir 29(21)(2013)6485
‑
94.
[0013]
[6]s.k.landfester,v.controlling the stealth effect of nanocarriers through understanding the protein corona,angew chem int ed engl 55(31)(2016)8806
‑
15.
[0014]
[7]h.gao,q.he,the interaction of nanoparticles with plasma proteins and the consequent influence on nanoparticles behavior,expert opin drug deliv 11(3)(2014)409
‑
20.
[0015]
[8]f.liu,j.mu,b.xing,recent advances on the development of pharmacotherapeutic agents on the basis of human serum albumin,curr pharm des 21(14)(2015)1866
‑
88.
[0016]
[9]q.peng,s.zhang,q.yang,t.zhang,x.q.wei,l.jiang,c.l.zhang,q.m.chen,
z.r.zhang,y.f.lin,preformed albumin corona,a protective coating for nanoparticles based drug delivery system,biomaterials 34(33)(2013)8521
‑
30.
[0017]
[10]y.zhang,z.guo,z.cao,w.zhou,y.zhang,q.chen,y.lu,x.chen,q.guo,c.li,d.liang,t.sun,c.jiang,endogenous albumin
‑
mediated delivery of redox
‑
responsive paclitaxel
‑
loaded micelles for targeted cancer therapy,biomaterials 183(2018)243
‑
257.
[0018]
[11]b.elsadek,f.kratz,impact of albumin on drug delivery
‑‑
new applications on the horizon,j control release 157(1)(2012)4
‑
28.
[0019]
[12]m.s.dennis,m.zhang,y.g.meng,m.kadkhodayan,d.kirchhofer,d.combs,l.a.damico,albumin binding as a general strategy for improving the pharmacokinetics of proteins,j biol chem 277(38)(2002)35035
‑
43.
[0020]
[13]m.i.koukourakis,a.giatromanolaki,r.a.brekken,e.sivridis,k.c.gatter,a.l.harris,e.h.sage,enhanced expression of sparc/osteonectin in the tumor
‑
associated stroma of non
‑
small cell lung cancer is correlated with markers of hypoxia/acidity and with poor prognosis of patients,cancer res 63(17)(2003)5376
‑
80.
[0021]
[14]s.chono,s.d.li,c.c.conwell,l.huang,an efficient and low immunostimulatory nanoparticle formulation for systemic sirna delivery to the tumor,j control release 131(1)(2008)64
‑
9.
[0022]
[15]d.sleep,albumin and its application in drug delivery,expert opin drug deliv 12(5)(2015)793
‑
812.
[0023]
[16]m.s.dennis,h.jin,d.dugger,r.yang,l.mcfarland,a.ogasawara,s.williams,m.j.cole,s.ross,r.schwall,imaging tumors with an albumin
‑
binding fab,a novel tumor
‑
targeting agent,cancer res 67(1)(2007)254
‑
61.
技术实现要素:
[0024]
本发明利用脂质体上的反应基团与abd肽上的巯基发生反应,将abd肽连接到脂质体上,目的是提供一种能特异性结合内源性白蛋白的阿霉素长效靶向制剂,实现阿霉素在肿瘤细胞上的特异性传递。
[0025]
上述目的是通过以下技术手段实现的:
[0026]
一种阿霉素长循环脂质体靶向药物,它由以下重量配比的原料制成:
[0027]
[0028]
所述反应性聚乙二醇磷脂上连接有能与巯基反应的基团;
[0029]
所述abd肽的氨基酸序列如seq id no:1所示。
[0030]
上述药物中,通过使用长循环脂质体材料,并通过脂质体上的反应基团在脂质体中引入能与内源性白蛋白特异结合的abd肽,实现了药物在进入体内后与内源性白蛋白的结合,减少与体内其他蛋白的吸附,从而提高药物在血液中的浓度,同时吸附内源性白蛋白的脂质体与肿瘤细胞表面的白蛋白受体特异结合,提高了药物在肿瘤细胞上的靶向性。该技术构思及其实现方式目前没有其它文献报导,具有很高的创新性和应用前景。
[0031]
进一步,申请人根据脂质体的包封率、粒径、反应性聚乙二醇磷脂结合率、药物在肿瘤模型小鼠的体内分布、血药浓度等进一步优化了原料配比,得到一种较佳的原料配方为:
[0032][0033]
根据本发明的一个具体实施例,其中一种最优的原料配方为:
[0034][0035][0036]
上述最佳原料配比制备的脂质体,其阿霉素包封率为(93.62
±
2.13)%,脂质体粒径为(100.9
±
9.8)nm、pdi为(0.236
±
0.07)、zeta电位为(
‑
15.8
±
1.5)mv,相比其它原料配比包封率处于更高水平,而且粒径更加均匀。同时,反应性聚乙二醇磷脂与脂质体的结合率达到97%,几乎每个反应基团上都结合有一个abd肽,相比其它原料配比也处于更高水平。
[0037]
通过向肿瘤模型小鼠体内注射不同abd肽含量的脂质体,并分析小鼠心、肝、脾、肺、肾、肿瘤组织中的荧光含量,结果发现该脂质体能实现在肿瘤中的蓄积,且蓄积量与abd肽含量存在量效关系;另外通过大鼠注射不同abd肽含量的脂质体,并于不同时间点测定眼静脉荧光浓度,发现连接abd肽的脂质体表现出更高的荧光浓度,且二者也存在量效关系。以上结果表明,该脂质体能更好地实现长效靶向性,abd肽在其中发挥关键作用。
[0038]
进一步优选地,所述卵磷脂为大豆卵磷脂。
[0039]
进一步优选地,所述聚乙二醇磷脂为二硬脂酰基磷脂酰乙醇胺
‑
聚乙二醇(dspe
‑
peg)。
[0040]
进一步优选地,所述反应性聚乙二醇磷脂上连接有能与巯基反应的马来酰亚胺。
当然,本发明的保护范围不限于此,理论上只要能与巯基反应的活性基团都能应用于本发明。
[0041]
本发明进一步提供一种制备所述阿霉素长循环脂质体靶向药物的方法,该方法包括以下步骤:
[0042]
(1)以卵磷脂、胆固醇、聚乙二醇磷脂、反应性聚乙二醇磷脂为脂质材料,使用薄膜超声分散法制备能够与巯基反应的长循环peg化脂质体;
[0043]
(2)将步骤(1)制备的脂质体用硫酸铵溶液水化后透析,透析液超声分散后加入阿霉素,孵育后得到载药脂质体;
[0044]
(3)将abd肽溶于缓冲液并加入到载药脂质体中,abd肽上的巯基通过与反应性聚乙二醇磷脂上的基团反应从而连接到载药脂质体上,即得阿霉素长循环脂质体靶向药物。
[0045]
其中,硫酸铵溶液的浓度、载药脂质体的孵育时间及其温度、abd肽与反应性聚乙二醇磷脂的反应时间、缓冲液ph等会对脂质体的粒径分布、包封率、abd肽结合率产生一定作用,申请人通过试验对这些制备条件进行优化,得出以下优选方案:
[0046]
所述硫酸铵溶液的浓度为100
‑
200mm。
[0047]
所述孵育的时间为10
‑
20min,温度为50
‑
60℃。
[0048]
所述abd肽与反应性聚乙二醇磷脂的反应时间是6
‑
8h。
[0049]
所述缓冲液为ph 7.4的hepes缓冲液。
[0050]
本发明的有益效果是:
[0051]
(1)本发明通过一种较新的方式实现了阿霉素在肿瘤细胞的靶向性。
[0052]
(2)abd肽与白蛋白的亲和力已被很多文献所报道,但主要应用于体外的结合,本发明首次将脂质体与abd肽结合将其应用于体内内源性白蛋白的结合并验证了其功能。
[0053]
(3)利用反应性聚乙二醇磷脂结合abd肽,同时实现了靶向性和长循环,而且易于操作、工艺简单、稳定可靠,重复性好。
[0054]
(4)本发明制备的脂质体还具有粒径分布均匀、药物包封率高、细胞毒性小、安全可靠等优点。
附图说明
[0055]
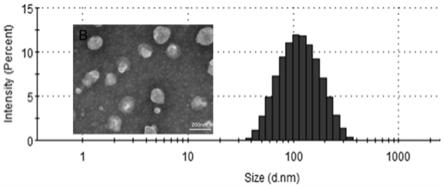
图1为实施例1制备的脂质体的粒径分布和透射电镜图。
[0056]
图2为不同abd肽含量的脂质体在荷瘤小鼠体内的分布。
[0057]
图3为不同abd肽含量的脂质体在大鼠体内的药代动力学曲线。
[0058]
图4为不同abd肽含量的脂质体吸附白蛋白的凝胶电泳图。
[0059]
图5为连接abd肽的脂质体对4t1细胞的毒性试验结果。
[0060]
图6为连接abd肽的脂质体4t1细胞上的激光共聚焦摄取图。
[0061]
图7为本发明制备的阿霉素长循环脂质体靶向药物形成蛋白冠后对4t1细胞的抑制作用。
具体实施方式
[0062]
下面结合具体实施例对本发明的技术方案作进一步说明,使本领域的技术人员可以更好的理解本发明并能予以实施。
[0063]
本实施例所用原料包括:
[0064]
盐酸阿霉素(dox.hcl,美仑生物技术有限公司);大豆卵磷脂,二硬脂酰基磷脂酰乙醇胺
‑
聚乙二醇2000(dspe
‑
peg2000),二硬脂酰基磷脂酰乙醇胺
‑
聚乙二醇2000
‑
马来酰亚胺(dspe
‑
peg2000
‑
mal)(均购自avt上海科技有限公司);胆固醇(cholesterol,美仑生物技术有限公司);abd肽由吉尔生化生物有限公司合成;其他试剂均为分析纯或更好。4t1细胞由四川大学提供。
[0065]
本实施例所用设备包括:
[0066]
research plus移液器(德国eppendorf公司),zen3600纳米粒度仪(英国马尔文仪器有限公司),synergy h1全功能酶标仪(美国biotek),cpa225b电子天平(赛多利斯天平有限公司),fl970荧光分光光度计(天美创科仪器有限公司),kmh1超声波清洗仪(宁波新芝生物科技股份有限公司),hh
‑
4数显恒温水浴锅(常州澳华仪器有限公司),re
‑
2000b旋转蒸发仪(上海亚荣生化仪器厂),jy92
‑
iin超声波细胞粉碎仪(宁波新芝超声设备有限公司),透析袋(8
‑
14kd)(上海炎怡生物技术有限公司),cha
‑
s恒温振荡器(常州澳华仪器有限公司),水平电泳槽(北京君意东方电泳设备有限公司),s1移液管电动移液器(赛默飞世尔科技有限公司),300kd超滤管(赛多利斯科学仪器有限公司)。
[0067]
实施例1
[0068]
一.原料处方
[0069]
种类功能用量占比大豆卵磷脂脂质体材料8.3mg37.5%胆固醇脂质体材料2.6mg11.8%dspe
‑
peg2000长循环脂质体材料2.8mg12.7%dspe
‑
peg2000
‑
mal用于连接肽段的脂质体材料1.2mg5.4%阿霉素活性成分1.2mg5.4%abd肽与体内白蛋白特异结合6.0mg27.2%
[0070]
二.制备工艺
[0071]
(1)制备peg化脂质体
[0072]
取处方量8.3mg大豆卵磷脂(s100)、2.6mg胆固醇(chol)、2.8mg二硬脂酰基磷脂酰乙醇胺
‑
聚乙二醇2000(dspe
‑
peg2000)、1.2mg二硬脂酰基磷脂酰乙醇胺
‑
聚乙二醇2000
‑
马来酰亚胺(dspe
‑
peg2000
‑
mal),将以上脂质材料溶于15ml的二氯甲烷溶剂中,在30℃条件下减压除去有机溶剂得到一层脂质薄膜。
[0073]
(2)制备载药脂质体
[0074]
用123mm硫酸铵溶液水化薄膜,然后在mw为8k
‑
14kda的透析袋中透析1.5h,每半小时换水一次,再用探头超声(功率260w,超声5min,超1s间停1s)对透析后的溶液进行分散,最后加入1.2mg阿霉素(dox)在55℃下孵育10min,即得载药脂质体(dox
–
lip)。
[0075]
(3)制备abd肽连接的载药脂质体
[0076]
将6mg的abd肽用少量hepes缓冲液(ph=7.4)溶解,与上述载药脂质体搅拌6h,即得连接abd肽的载阿霉素脂质体(dox
‑
abd
‑
lip)。
[0077]
实施例2
[0078]
一.原料处方
[0079][0080][0081]
二.制备工艺
[0082]
(1)制备peg化脂质体
[0083]
取处方量8.3mg大豆卵磷脂、2.6mg胆固醇、3.4mg dspe
‑
peg2000、0.6mg dspe
‑
peg2000
‑
mal,将以上脂质材料溶于15ml的二氯甲烷溶剂中,在30℃条件下减压除去有机溶剂得到一层脂质薄膜。
[0084]
(2)制备载药脂质体
[0085]
用123mm硫酸铵溶液水化薄膜,然后在mw为8k
‑
14kda的透析袋中透析1.5h,每半小时换水一次,再用探头超声对透析后的溶液进行分散,最后加入0.6mg阿霉素在55℃下孵育10min,即得载药脂质体(dox
–
lip)。
[0086]
(3)制备abd肽连接的载药脂质体
[0087]
将2.3mg的abd肽用少量hepes缓冲液(ph=7.4)溶解,与上述载药脂质体搅拌6h,即得连接abd肽的载阿霉素脂质体(dox
‑
abd
‑
lip)。
[0088]
实施例3
[0089]
一.原料处方
[0090]
种类功能用量占比大豆卵磷脂脂质体材料8.3mg45.6%胆固醇脂质体材料2.6mg14.3%dspe
‑
peg2000长循环脂质体材料3.8mg20.9%dspe
‑
peg2000
‑
mal用于连接肽段的脂质体材料0.2mg1.1%阿霉素活性成分1.8mg9.9%abd肽与体内白蛋白特异结合1.5mg8.2%
[0091]
二.制备工艺
[0092]
与实施例1或2相同。
[0093]
实施例4
[0094]
一.原料处方
[0095]
种类功能用量占比大豆卵磷脂脂质体材料8.3mg28.3%胆固醇脂质体材料2.6mg8.9%
dspe
‑
peg2000长循环脂质体材料1.6mg5.5%dspe
‑
peg2000
‑
mal用于连接肽段的脂质体材料2.4mg8.2%阿霉素活性成分2.4mg8.2%abd肽与体内白蛋白特异结合12mg41.0%
[0096]
二.制备工艺
[0097]
与实施例1或2相同。
[0098]
试验例
[0099]
试验1:包封率和粒径的测定
[0100]
取最终产物平均分成2份,一份脂质体通过超滤离心法分离脂质体和游离的阿霉素,收集游离部分,以乙醇稀释;另一份脂质体样品直接用乙醇溶液破乳并与超滤后的阿霉素稀释相同倍数。用荧光分光光度计测定脂质体中阿霉素含量来计算dox
‑
lip的包封率。包封率(%)=(1
‑
ca/cb)
×
100%其中,ca表示游离的阿霉素浓度,cb表示未分离的脂质体中阿霉素的浓度。
[0101]
利用zen3600系列纳米激光粒度仪测定纳米粒的粒径及pdi。取0.1ml的脂质体稀释至1ml,设置纳米粒度仪温度为25℃,平衡时间为2min,每个样品重复测定3次。
[0102]
结果见表1,其中实施例1的透射电镜和粒径分布如图1所示。
[0103]
表1实施例1
‑
4脂质体的粒径,pdi,包封率
[0104][0105]
试验2:马来酰亚胺功能化磷脂的结合量(dspe
‑
peg2000
‑
mal)的测定
[0106]
马来酰亚胺基团结合率通过间接ellman反应进行分析。试剂溶液是通过将5,5'
‑
二硫代双(2
‑
硝基苯甲酸)(dtnb)溶解在ph为8.0的0.1m磷酸钠反应缓冲液(含有1mm乙二胺四乙酸)中,配制成4mg/ml的储备液。脂质体与abd肽反应后游离巯基与马来酰亚胺反应形成稳定的硫醚键。通过ellman反应试验分析未反应的巯基的量。取50μl的dtnb(4mg/ml)用缓冲液稀释到2.5ml,将250μl样品加入其中,并在室温下孵育15分钟。dtnb试剂形成混合二硫化物和有色产物,其中含有未反应半胱氨酸的游离巯基。在412nm处用分光光度法监测反应。制作abd的标准曲线,将反应后的样品按上述方法测定游离巯基量。马来酰亚胺的结合率由未反应的半胱氨酸的量计算。
[0107][0108]
a为abd投入量,b为abd游离量,n为abd投入的摩尔量与马来酰亚胺功能化磷脂摩尔量的比值。
[0109]
表2实施例1
‑
4的马来酰亚胺功能化磷脂的结合率
[0110][0111]
试验3:体内分布实验
[0112]
荧光标记的abd
‑
lip制备:将did与脂质材料一起加入到有机试剂中,按实施例的方法制备不同含量abd肽且由荧光标记的abd
‑
lip。为了避免药物产生的荧光对试验结果造成干扰,制备脂质体时未加入阿霉素。
[0113]
荷瘤小鼠模型建立:将生长对数期的乳腺癌4t1细胞离心后用pbs重悬。将细胞悬浮液稀释至5
×
106个/ml,选取生长状况良好的balb/c小鼠用于动物模型的建立。接种时,每只小鼠接种100μl,注射小鼠右侧近腋下位置,尽量保证接种液无任何渗漏,且短时间完成以保证接种液细胞活力。接种后小鼠自由饮食饮水,约1周可以在接种位置看到肿瘤实体团块,模型建立成功。
[0114]
体内分布实验:取荷瘤小鼠12只,体重25g左右,随机分为4组,每组3只。小鼠按50μg/kg的剂量由尾静脉注射did标记的lip(不含abd肽的脂质体)、5%abd
‑
lip(abd肽含量5%的脂质体)、15%abd
‑
lip(abd肽含量15%的脂质体)、30%abd
‑
lip(abd肽含量30%的脂质体)。然后分别于给药后0.5、2、4、6、24h拍摄图片,24h时处死并取心、肝、脾、肺、肾、肿瘤生理盐水冲洗后,滤纸吸干水分拍照。
[0115]
如图2a所示,随着时间延长和abd肽含量增加,荧光强度也相应增强,说明脂质体在肿瘤部位蓄积增加。如图2b所示,解剖后的组织荧光分布图也表明脂质体在肿瘤组织中的荧光强度与abd肽存在量效关系。
[0116]
试验4:体内药代动力学实验
[0117]
将20只wistar雌性大鼠(体重220
±
20g)随机分为4组,每组5只。通过尾静脉分别注射200ul did标记的abd
‑
lip(abd肽含量分别为0、5%、15%、30%),于给药后5min、15min、30min、60min、2h、4h、8h、12h、24h、24h、48h各时间点由眼静脉取血,测定did的浓度。
[0118]
如图3所示,连接abd肽的脂质体表现出更高的血药浓度,二者存在量效关系。
[0119]
试验5:蛋白组分实验
[0120]
1.脂质
‑
蛋白冠复合物的制备
[0121]
将脂质体(脂质浓度为1mm)与大鼠血清(v/v=1/1)在37℃下孵育2h,并用15000r离心15min,用超纯水洗涤沉淀3次去除未结合的蛋白,得到的沉淀即为脂质
‑
蛋白冠复合物(lip
‑
pc)。
[0122]
2.变性凝胶电泳实验定性分析:
[0123]
将分离得到的脂质
‑
蛋白冠复合物用于95℃煮5min,sds
‑
page电泳后,考马斯亮蓝染色观察结果。
[0124]
如图4所示,随着abd肽含量的增加,白蛋白条带处的颜色逐渐加深,说明蛋白冠复合物吸附的白蛋白随着abd的含量增加而增加。
[0125]
3.蛋白组分定量分析
[0126]
为了确定abd肽连接的脂质体是否会特异性吸附血清中的白蛋白,在表征了脂质体表面形成的蛋白冠的凝胶电泳之后,我们评估了不含abd肽的脂质体(lip)及含有abd肽的脂质体(abd
‑
lip)在与血清孵育后产生的蛋白冠(pc)的蛋白成分。将分离得到的蛋白冠用lc
‑
ms/ms进行分析,质谱原始文件使用maxquant(1.6.2.10)检索目标蛋白数据库。所测数据见表3。结果显示,abd
‑
lip与血清形成的abd
‑
lip
‑
pc复合物主要成分是白蛋白,除此之外,相对于lip
‑
pc,abd
‑
lip
‑
pc吸附的调理素蛋白ig g及补体蛋白c3,c4均较低。
[0127]
表3前20种蛋白的丰富度表
[0128][0129][0130]
试验6:abd
‑
lip的体外细胞毒性实验
[0131]
1.mtt溶液的配制:
[0132]
称取适量mtt粉末溶于pbs缓冲液中,得浓度为5mg/ml的mtt溶液,于磁力搅拌器中搅拌30min溶解,过膜即得。所得溶液应在4℃条件下避光保存。
[0133]
2.细胞培养条件:
[0134]
小鼠乳腺癌细胞4t1于37℃,5%co2条件下培养。
[0135]
3.细胞毒性实验
[0136]
取生长状态良好的4t1细胞,用0.25%胰蛋白酶消化后,加入含有10%胎牛血清的完全培养基终止消化反应,并吹打均匀。每孔加入104个细胞,在培养箱中继续培养24h待细胞贴壁后,弃去培养基,换上含有不同浓度梯度lip及abd
‑
lip的新鲜培养基(脂质浓度梯度分别为0、50、75、100、200、300μg
·
ml
‑1),培养24,48,72h后,每孔加入20μl的5mg/ml mtt溶液继续孵育4h后,弃去原有培养基,每孔加入150μl的dmso溶液,与摇床上低速振荡10min后,然后在570nm处,用酶联免疫检测仪测定光密度值(a)。每组设置5个复孔,以不加药的培养基的细胞孔为对照计算细胞存活率,按公式(细胞存活率=a给药组/a对照组
×
100%)计算细胞存活率。
[0137]
如图5所示,连接abd肽的脂质体(abd
‑
lip)浓度为0
‑
300μg
·
ml
‑1时对4t1细胞均没有明显的毒性作用,表明所选用的abd肽对细胞毒性小,安全性高。
[0138]
试验7:4t1的细胞摄取实验
[0139]
1.香豆素
‑
6标记的abd
‑
lip的制备:
[0140]
用香豆素
‑
6(coumarin
‑
6)代替did,按照实施例的方法制备不含药物且由香豆素
‑
6标记的abd
‑
lip。
[0141]
2.香豆素
‑
6标记的abd
‑
lip的细胞摄取实验:
[0142]
取对数生长期4t1细胞,种1
×
105个4t1细胞铺在激光共聚焦专用玻底皿,贴壁后换无血无抗培养基饥饿,然后移去培养基,每皿加入提前与大鼠血清孵育2h的coumarin
‑
6标记的lip和abd
‑
lip(培养液中的coumarin
‑
6浓度为750ng/ml),2小时后,弃去培养基,用pbs洗涤2次,用4%多聚甲醛固定约10min后,继续用pbs洗涤2次后,加入dapi染液孵育5min后,加入两滴抗荧光衰减液,在激光共聚焦下观察细胞摄取药物情况。
[0143]
如图6所示,在4t1细胞上的激光共聚焦摄取图中可以看出,dapi标记的细胞核带蓝色荧光,香豆素
‑
6被摄取进胞质带绿色荧光,说明abd
‑
lip已进入胞质中,且相对于lip荧光更强,具有更高的靶向性。
[0144]
试验8:体外药效学实验
[0145]
取生长状态良好并处于对数生长期的4t1细胞,用胰蛋白酶溶液消化后,用含10%fbs的dmem培养液终止消化,并反复吹打制成单细胞悬液。在细胞计数仪计数后,将4t1细胞以104个/孔的密度接种于96孔板中,每孔加入200ml单细胞悬液,然后在co2培养箱中培养24h,待细胞完全贴壁后,移去培养基,加入100μl的无血无抗培养基饥饿。移走培养基,再加入提前与血清孵育2h的不同浓度的dox
‑
lip
‑
pc,dox
‑
abd
‑
lip
‑
pc无血清无抗培养基各100μl(相当于阿霉素的终浓度为0,1.25,2.5,5,10,25μg/ml)。于37℃分别孵育10h后,移去培养基,pbs洗1次,每孔换成200ml新鲜的完全培养基继续培养14h,每孔加入20ml的mtt(5mg/ml)试剂,再将培养板移入培养箱,4h之后,移出培养基,在570nm波长处测定吸光度。每组设置5个复孔,按公式(细胞存活率=a给药组/a对照组
×
100%)计算细胞存活率。
[0146]
如图7所示,dox
‑
abd
‑
lip
‑
pc对4t1细胞的抑制作用明显著高于dox
‑
lip
‑
pc(p<
0.01),该结果与前期摄取试验结果一致。
[0147]
本发明提供的技术方案,不受上述实施例的限制,凡是利用本发明的结构和方式,经过变换和代换所形成的技术方案,都在本发明的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1