一种低亚硝胺杂质含量的伐尼克兰药物组合物及其制备方法与应用与流程
1.本发明属于药物制剂领域,具体涉及一种低亚硝胺杂质含量的伐尼克兰药物组合物及其制备方法与应用。
背景技术:
2.伐尼克兰,是一种芳基稠合氮杂多环化合物,能够调节胆碱能,以酒石酸盐的形式出售,商品名为和能与神经元烟碱乙酰胆碱特异性受体位点结合,可用于以下疾病:
3.治疗炎性肠疾病(包括但不限于:溃疡性结肠炎、坏疽性脓皮病和克罗恩氏病(crohn’s disease))、过敏性肠综合症、痉挛性张力障碍、慢性疼痛、急性疼痛、腹泻(celiac sprue)、囊炎(pouchitis)、血管收缩、焦虑、恐慌症(panic disorder)、抑郁症、双相性精神障碍(bipolar disorder)、孤独症、睡眠障碍、时差反应(jet lag)、肌萎缩性侧索硬化(als)、认知机能障碍、药物/毒素-诱发的认知损伤(例如,起因于酒精、巴比妥类药物、维生素缺乏、消遣性药物(recreational drug)、铅、砷、汞)、疾病诱发的认知损伤(例如,起因于阿尔茨海默氏病(早老性痴呆)、血管性痴呆(vascular dementia)、帕金森氏病、多发性硬化症、aids、(大)脑炎、创伤、肾性脑病和肝性脑病、甲状腺机能减退、皮克氏病、科尔萨科夫氏综合症和前额(frontal)和皮层下痴呆(subcortical dementia))、高血压、食欲过盛、厌食症、肥胖症、心律失常、胃酸分泌过多、溃疡、嗜铬细胞瘤、进行性核上麻痹(progressive supramuscular palsy)、化学品依赖和成瘾(例如,对尼古丁(和/或烟草产品)、酒精、苯并二氮类、巴比妥类、类阿片或可卡因的依赖和成瘾)、头痛、偏头痛、中风、外伤性脑损伤(tbi)、强迫观念与行为性疾病(ocd)、精神病、亨廷顿氏舞蹈病、迟发性运动障碍、运动机能亢进、诵读困难、精神分裂症、多发性硬化性痴呆、年龄相关性认知衰退、癫痫症、包括小发作缺乏癫痫症(including petit mal absence epilepsy)、注意力缺陷机能亢进障碍(attention deficit hyperactivity disorder)(adhd)、图雷特氏综合症(tourette’s syndrome);特别是,对尼古丁的依赖、成瘾和脱瘾,包括在戒烟治疗中的应用(参见:cn 1509174a)。
4.伐尼克兰的制备方法,以及其消旋物的拆分方法,已被美国专利申请us 6,410,550和国际专利申请wo 01/62736所公开,它们的内容也可以通过引用的方式并入本文。
5.亚硝胺化合物,包括与胺结合的亚硝基(n(r1)(r2)-n=o)结构,是某些动物的基因毒性物质,有些已被国际癌症研究机构(iarc)列为可能或潜在的人类致癌物。
6.这些亚硝胺化合物,在人用药物注册技术要求国际协调会(international conference on harmonization,简称ich)指导文件m7(r1)中被称为“关注组群”化合物,评估和控制药品中的dna反应性(致突变)杂质以限制潜在的致癌风险(2018年3月)。ich指南建议,将包括亚硝胺化合物在内的任何已知致突变/致癌物控制在人类癌症风险可忽略的摄入量水平。
7.目前,美国食品和药物管理局(fda)已鉴定出七种亚硝胺杂质,这些杂质理论上可能存在于药品中,因为使用了可能导致亚硝胺形成的制备工艺和材料:n,n-二甲基亚硝胺(ndma)、n-亚硝基二乙胺(ndea)、n-亚硝基-n-甲基-4-氨基丁酸(nmba)、n亚硝基异丙基乙胺(nipea)、n-亚硝二异丙胺(ndipa)、n亚硝二丁胺(ndba)和n-亚硝基甲基苯胺(nmpa)。其中,有五种杂质(ndma、ndea、nmba、nipea和nmpa)实际上已在原料药或药品中检测到。
8.举例来说,fda试验的一些初步结果表明,某些雷尼替丁产品中的ndma含量已超过可接受的水平。近年来,fda还发现有的二甲双胍产品中含有ndma杂质,且在某些批次中检出ndma含量高于fda建议的可接受摄入量限值。
9.有鉴于此,特提出本发明,以便将伐尼克兰或其组合物中的亚硝胺杂质含量控制在能够满足安全性要求的较低水平。
技术实现要素:
10.针对现有技术存在的问题和/或不足,本发明的目的之一在于提供一种低亚硝胺杂质含量的伐尼克兰药物组合物及其制备方法与应用,其亚硝胺杂质含量低,具有较高的安全性。
11.本发明提供的技术方案如下:
12.本发明提供了一种药物组合物,其包括:氮杂多环化合物和药学上可接受的辅料;其中,所述药物组合物的亚硝胺杂质含量不大于10ppm,所述的亚硝胺杂质的结构如式p08所示;所述的氮杂多环化合物为伐尼克兰或其药学上可接受的盐;
[0013][0014]
进一步的,所述药物组合物的亚硝胺杂质含量不大于7.5ppm(例如7.4ppm、7.3ppm、7.2ppm、7.1ppm、7.0ppm、6.9ppm、6.8ppm、6.7ppm、6.6ppm、6.5ppm、6.4ppm、6.3ppm、6.2ppm、6.1ppm、6.0ppm、5.9ppm、5.8ppm、5.7ppm、5.6ppm、5.5ppm、5.4ppm、5.3ppm、5.2ppm、5.1ppm、5.0ppm、4.9ppm、4.8ppm、4.7ppm、4.6ppm、4.5ppm、4.4ppm、4.3ppm、4.2ppm、4.1ppm、4.0ppm、3.9ppm、3.8ppm、3.7ppm、3.6ppm、3.5ppm、3.4ppm、3.3ppm、3.2ppm、3.1ppm、3.0ppm、2.9ppm、2.8ppm、2.7ppm、2.6ppm、2.5ppm、2.4ppm、2.3ppm、2.2ppm、2.1ppm或2.0ppm等);例如:不大于7.4ppm、不大于7.3ppm、不大于7.2ppm、不大于7.1ppm、不大于7.0ppm、不大于6.9ppm、不大于6.8ppm、不大于6.7ppm、不大于6.6ppm、不大于6.5ppm、不大于6.4ppm、不大于6.3ppm、不大于6.2ppm、不大于6.1ppm、不大于6.0ppm、不大于5.9ppm、不大于5.8ppm、不大于5.7ppm、不大于5.6ppm、不大于5.5ppm、不大于5.4ppm、不大于5.3ppm、不大于5.2ppm、不大于5.1ppm、不大于5.0ppm、不大于4.9ppm、不大于4.8ppm、不大于4.7ppm、不大于4.6ppm、不大于4.5ppm、不大于4.4ppm、不大于4.3ppm、不大于4.2ppm、不大于4.1ppm、不大于4.0ppm、不大于3.9ppm、不大于3.8ppm、不大于3.7ppm、不大于3.6ppm、不大于3.5ppm、不大于3.4ppm、不大于3.3ppm、不大于3.2ppm、不大于3.1ppm、不大于3.0ppm、不大于2.9ppm、不大于2.8ppm、不大于2.7ppm、不大于2.6ppm、不大于2.5ppm、不大于2.4ppm、不大于2.3ppm、不大于2.2ppm、不大于2.1ppm或不大于2.0ppm等。
[0015]
进一步的,所述药物组合物的亚硝胺杂质含量大于0。
[0016]
进一步的,所述氮杂多环化合物中的亚硝胺杂质含量不大于7.5ppm(例如:7ppm、6.5ppm、6ppm、5.5ppm、5ppm、4.5ppm、4ppm、3.5ppm、3ppm、2.5ppm、2ppm、1.5ppm、1ppm、0.9ppm、0.8ppm、0.7ppm、0.6ppm、0.4ppm、0.3ppm或0.2ppm)、不大于7ppm、不大于6.5ppm、不大于6.0ppm、不大于5.5ppm、不大于5.0ppm、不大于4.5ppm、不大于4.0ppm、不大于3.5ppm、不大于3.0ppm、不大于2.5ppm、不大于2.0ppm、不大于1ppm、不大于0.9ppm、不大于0.8ppm、不大于0.7ppm、不大于0.6ppm、不大于0.5ppm或者更低。
[0017]
进一步的,所述药物组合物的单位剂型中包含0.01mg~10mg的有效成分;优选0.05mg~5mg的有效成分;更优选0.1mg~3mg的有效成分;最优选0.2mg~2mg的有效成分;例如:0.25mg、0.3mg、0.4mg、0.5mg、0.6mg、0.7mg、0.75mg、0.8mg、0.9mg、1mg、1.1mg,1.2mg、1.25mg、1.3mg、1.4mg、1.5mg或1.75mg的有效成分;再例如0.5mg或1mg的有效成分;以片剂为例,所述伐尼克兰片中包含0.01mg/片~10mg/片的有效成分;优选0.05mg/片~5mg/片的有效成分;更优选0.1mg/片~3mg/片的有效成分;最优选0.2mg/片~2mg/片的有效成分;例如:0.25mg/片、0.3mg/片、0.4mg/片、0.5mg/片、0.6mg/片、0.7mg/片、0.75mg/片、0.8mg/片、0.9mg/片、1mg/片、1.1mg/片,1.2mg/片、1.25mg/片、1.3mg/片、1.4mg/片、1.5mg/片或1.75mg/片;再例如为0.5mg/片或1mg/片的有效成分。
[0018]
进一步的,所述药物组合物的有效成分是伐尼克兰。
[0019]
进一步的,所述的伐尼克兰药学上可接受的盐为酒石酸伐尼克兰。
[0020]
进一步的,所述药物组合物是固体制剂;优选片剂或颗粒剂。
[0021]
进一步的,所述片剂为素片或包衣片。
[0022]
进一步的,所述药物组合物为素片或包衣片。
[0023]
进一步的,所述药物组合物是口服制剂。
[0024]
进一步的,所述的药学上可接受的辅料包含稀释剂,所述的稀释剂选自微晶纤维素、硅化微晶纤维素、磷酸氢钙(包含:无水物、水合物)、甘露醇、共聚维酮、羟丙基纤维素、羟丙基甲基纤维素、甲基纤维素、乙基纤维素、淀粉、麦芽糊精、琼脂和瓜尔胶中的一种或两种以上;优选的,所述的稀释剂包含微晶纤维素和/或无水磷酸氢钙;更优选的,所述的稀释剂包含微晶纤维素和无水磷酸氢钙。
[0025]
进一步的,所述磷酸氢钙为无水磷酸氢钙,例如富克林或a150。
[0026]
进一步的,所述微晶纤维素与所述无水磷酸氢钙的重量比为(1.8~2.2):1。
[0027]
进一步的,所述药物组合物中所述有效成分与所述稀释剂的重量比为1:(100~300);优选为1:(150~250);更优选为1:(185~195)。
[0028]
进一步的,所述药学上可接受的辅料包含崩解剂,所述的崩解剂选自交联羧甲基纤维素钠、羟基乙酸淀粉钠、交联维酮、玉米预糊化淀粉、羧甲基纤维素钠和羧甲基纤维素钙中的一种或两种以上;优选的,所述的崩解剂为交联羧甲基纤维素钠。
[0029]
进一步的,所述药物组合物中所述有效成分与所述崩解剂的重量比为1:(1~10);优选为1:(2~6);更优选为1:(3.5~4.5);例如为1:4。
[0030]
进一步的,所述药学上可接受的辅料包含助流剂,所述的助流剂选自胶态二氧化硅、气相二氧化硅、胶态硅石、玉米淀粉、滑石粉、硅酸钙、硅酸镁、磷酸三钙和硅水凝胶中的一种或两种以上;优选的,所述的助流剂为胶态二氧化硅。
[0031]
进一步的,所述药物组合物中所述有效成分与所述助流剂的重量比为1:(0.1~8);优选为1:(0.2~5);更优选为1:(0.5~2.5);最优选为1:(0.8~2)(包括但不限于1:0.8、1:1或1:2)。
[0032]
进一步的,所述药学上可接受的辅料包含润滑剂,所述的润滑剂选自硬脂酸盐、硬脂酸、滑石粉、矿物油、麦芽、苯甲酸甘油酯、氢化植物油、聚乙二醇、苯甲酸钠、乙酸钠、氯化钠、亮氨酸、月桂基硫酸镁和月桂基硫酸钠中的一种或两种以上;优选的,所述的润滑剂为硬脂酸盐;更优选的,所述的硬脂酸盐为硬脂酸镁。
[0033]
进一步的,所述药物组合物中所述有效成分与所述润滑剂的重量比为1:(0.1~8);优选为1:(0.2~5);更优选为1:(0.5~2.5);最优选为1:(1~2)(包括但不限于1:1、1:1.4或1:2等)。
[0034]
进一步的,所述的药物组合物满足以下条件中一种或两种及以上,优选同时满足以下全部条件:
[0035]
条件
①
:所述有效成分与微晶纤维素的重量比为1:(40~240);优选为1:(100~200)(例如1:110、1:125、1:135、1:140、1:150、1:160、1:170或1:180);更优选为1:(120~130)。
[0036]
条件
②
:所述有效成分与磷酸氢钙的重量比为1:(10~100)(例如:1:30、1:40、1:50、1:55、1:58、1:60、1:66或1:68等);优选为1:(20~80);更优选为1:(50~70);
[0037]
条件
③
:所述有效成分与交联羧甲基纤维素钠的重量比为1:(1~10);优选1:(2~6);更优选1:(3.5~4.5);最优选为1:4;
[0038]
条件
④
:所述有效成分与胶态二氧化硅的重量比为1:(0.1~8);优选1:(0.2~5);更优选1:(0.5~2.5);最优选为1:(0.8~2)(包括但不限于1:0.8、1:1或1:2等);
[0039]
条件
⑤
:所述有效成分与硬脂酸盐的重量比为1:(0.1~8);优选1:(0.2~5);更优选1:(0.5~2.5);最优选为1:(1~2)(包括但不限于1:1、1:1.4或1:2等);
[0040]
进一步的,所述药物组合物包括:
[0041]
伐尼克兰或其药学上可接受的盐0.2~5.5重量份;
[0042]
稀释剂20~600重量份;
[0043]
崩解剂0.5~15重量份;
[0044]
助流剂0.1~6重量份;
[0045]
润滑剂0.1~6重量份。
[0046]
进一步的,所述药物组合物由以下组分组成:
[0047]
伐尼克兰或其药学上可接受的盐0.2~5.5重量份;
[0048]
稀释剂20~600重量份;
[0049]
崩解剂0.5~15重量份;
[0050]
助流剂0.1~6重量份;
[0051]
润滑剂0.1~6重量份。
[0052]
进一步的,所述药物组合物中,所述的伐尼克兰或其药学上可接受的盐为酒石酸伐尼克兰,所述的稀释剂为微晶纤维素和磷酸氢钙,所述的崩解剂为交联羧甲基纤维素钠,所述的助流剂为胶态二氧化硅,所述的润滑剂为硬脂酸盐。
[0053]
进一步的,所述药物组合物包括:
[0054]
酒石酸伐尼克兰0.2~5.5质量份(包括但不限于:0.3质量份、0.4质量份、0.5质量份、1质量份、1.5质量份、2质量份、2.5质量份、3质量份、3.5质量份、4质量份或4.5质量份等);
[0055]
微晶纤维素15~400质量份;
[0056]
磷酸氢钙5~200质量份;
[0057]
交联羧甲基纤维素钠0.5~15质量份;
[0058]
胶态二氧化硅0.1~6质量份;
[0059]
硬脂酸盐0.1~6质量份;
[0060]
优选的,包括:
[0061]
酒石酸伐尼克兰0.8~1.8质量份;
[0062]
微晶纤维素60~130质量份;
[0063]
磷酸氢钙25~75质量份;
[0064]
交联羧甲基纤维素钠1~5质量份;
[0065]
胶态二氧化硅0.2~2.5质量份;
[0066]
硬脂酸盐0.2~2.5质量份。
[0067]
进一步的,所述的药物组合物为以下任一配方:
[0068]
(1)酒石酸伐尼克兰1.7
±
0.02质量份;
[0069]
微晶纤维素126
±
0.5质量份;
[0070]
磷酸氢钙60
±
0.5质量份;
[0071]
交联羧甲基纤维素钠4
±
0.02质量份;
[0072]
胶态二氧化硅2
±
0.02质量份;
[0073]
硬脂酸盐2
±
0.02质量份;
[0074]
(2)酒石酸伐尼克兰1.7
±
0.02质量份;
[0075]
微晶纤维素126
±
0.5质量份;
[0076]
磷酸氢钙64
±
0.5质量份;
[0077]
交联羧甲基纤维素钠4
±
0.02质量份;
[0078]
胶态二氧化硅2
±
0.02质量份;
[0079]
硬脂酸盐2
±
0.02质量份;
[0080]
(3)酒石酸伐尼克兰1.7
±
0.02质量份;
[0081]
微晶纤维素126
±
0.5质量份;
[0082]
磷酸氢钙66
±
0.5质量份;
[0083]
交联羧甲基纤维素钠4
±
0.02质量份;
[0084]
胶态二氧化硅1
±
0.02质量份;
[0085]
硬脂酸盐1
±
0.02质量份;
[0086]
(4)酒石酸伐尼克兰1.7
±
0.02质量份;
[0087]
微晶纤维素126
±
0.5质量份;
[0088]
磷酸氢钙65.8
±
0.5质量份;
[0089]
交联羧甲基纤维素钠4
±
0.02质量份;
[0090]
胶态二氧化硅0.8
±
0.02质量份;
[0091]
硬脂酸盐1.4
±
0.02质量份;
[0092]
(5)酒石酸伐尼克兰0.85
±
0.02质量份;
[0093]
微晶纤维素63
±
0.5质量份;
[0094]
磷酸氢钙30
±
0.5质量份;
[0095]
交联羧甲基纤维素钠2
±
0.02质量份;
[0096]
胶态二氧化硅1
±
0.02质量份;
[0097]
硬脂酸盐1
±
0.02质量份;
[0098]
(6)酒石酸伐尼克兰0.85
±
0.02质量份;
[0099]
微晶纤维素63
±
0.5质量份;
[0100]
磷酸氢钙32
±
0.5质量份;
[0101]
交联羧甲基纤维素钠2
±
0.02质量份;
[0102]
胶态二氧化硅1
±
0.02质量份;
[0103]
硬脂酸盐1
±
0.02质量份;
[0104]
(7)酒石酸伐尼克兰0.85
±
0.02质量份;
[0105]
微晶纤维素63
±
0.5质量份;
[0106]
磷酸氢钙33
±
0.5质量份;
[0107]
交联羧甲基纤维素钠2
±
0.02质量份;
[0108]
胶态二氧化硅0.5
±
0.01质量份;
[0109]
硬脂酸盐0.5
±
0.01质量份;
[0110]
(8)酒石酸伐尼克兰0.85
±
0.02质量份;
[0111]
微晶纤维素63
±
0.5质量份;
[0112]
磷酸氢钙32.9
±
0.5质量份;
[0113]
交联羧甲基纤维素钠2
±
0.02质量份;
[0114]
胶态二氧化硅0.4
±
0.01质量份;
[0115]
硬脂酸盐0.7
±
0.01质量份。
[0116]
进一步的,所述药物组合物还包含包衣剂。
[0117]
进一步的,所述的包衣剂包含固体聚合物。
[0118]
进一步的,所述的包衣剂为欧巴代包衣剂(包括但不限于:白、蓝、黄、红、绿或橙等的欧巴代包衣剂);优选white和/或blue,最优选white。
[0119]
进一步的,所述包衣剂用的溶剂为乙醇和/或纯化水;优选为纯化水。
[0120]
进一步的,所述包衣剂与所述药物组合物中除包衣剂以外的成分之和的重量比为(0.5~5):100、(1~4.5):100或(1.5~4):100;优选的,所述包衣剂相对于所述片剂的重量比为(1.5~2.5):100、(2.5~3.5):100或(3~4):100,例如2:100。
[0121]
本发明的目的之二在于提供一种片剂,其包括:氮杂多环化合物和药学上可接受的辅料;其中,所述片剂的亚硝胺杂质含量不大于10ppm,所述的亚硝胺杂质的结构如式p08所示;所述的氮杂多环化合物为伐尼克兰或其药学上可接受的盐;
[0122][0123]
进一步的,所述片剂的亚硝胺杂质的含量如前所述。
[0124]
进一步的,所述氮杂多环化合物中的亚硝胺杂质含量如前所述。
[0125]
进一步的,所述片剂的单位剂型中有效成分的含量如前所述。
[0126]
进一步的,所述片剂的有效成分是伐尼克兰。
[0127]
进一步的,所述片剂是口服制剂。
[0128]
进一步的,所述片剂为素片或包衣片。
[0129]
进一步的,所述伐尼克兰药学上可接受的盐为酒石酸伐尼克兰。
[0130]
进一步的,所述的药学上可接受的辅料的种类和含量如前所述。
[0131]
进一步的,所述片剂包括:
[0132]
伐尼克兰或其药学上可接受的盐0.2mg~5.5mg;
[0133]
稀释剂20mg~600mg;
[0134]
崩解剂0.5mg~15mg;
[0135]
助流剂0.1mg~6mg;
[0136]
润滑剂0.1mg~6mg。
[0137]
进一步的,所述片剂由以下组分组成:
[0138]
伐尼克兰或其药学上可接受的盐0.2mg~5.5mg;
[0139]
稀释剂20mg~600mg;
[0140]
崩解剂0.5mg~15mg;
[0141]
助流剂0.1mg~6mg;
[0142]
润滑剂0.1mg~6mg。
[0143]
进一步的,所述片剂中,所述的伐尼克兰或其药学上可接受的盐为酒石酸伐尼克兰,所述的稀释剂为微晶纤维素和磷酸氢钙,所述的崩解剂为交联羧甲基纤维素钠,所述的助流剂为胶态二氧化硅,所述的润滑剂为硬脂酸盐。
[0144]
进一步的,所述片剂包括:
[0145]
酒石酸伐尼克兰0.2mg~5.5mg(包括但不限于:0.3mg、0.4mg、0.5mg、1mg、1.5mg、2mg、2.5mg、3mg、3.5mg、4mg或4.5mg等);
[0146]
微晶纤维素15mg~400mg;
[0147]
磷酸氢钙5mg~200mg;
[0148]
交联羧甲基纤维素钠0.5mg~15mg;
[0149]
胶态二氧化硅0.1mg~6mg;
[0150]
硬脂酸盐0.1mg~6mg;
[0151]
优选的,包括:
[0152]
酒石酸伐尼克兰0.8mg~1.8mg;
[0153]
微晶纤维素60mg~130mg;
[0154]
磷酸氢钙25mg~75mg;
[0155]
交联羧甲基纤维素钠1mg~5mg;
[0156]
胶态二氧化硅0.2mg~2.5mg;
[0157]
硬脂酸盐0.2mg~2.5mg。
[0158]
进一步的,所述的片剂为以下任一配方:
[0159]
(1)酒石酸伐尼克兰1.7
±
0.02mg;
[0160]
微晶纤维素126
±
0.5mg;
[0161]
磷酸氢钙60
±
0.5mg;
[0162]
交联羧甲基纤维素钠4
±
0.02mg;
[0163]
胶态二氧化硅2
±
0.02mg;
[0164]
硬脂酸盐2
±
0.02mg;
[0165]
(2)酒石酸伐尼克兰1.7
±
0.02mg;
[0166]
微晶纤维素126
±
0.5mg;
[0167]
磷酸氢钙64
±
0.5mg;
[0168]
交联羧甲基纤维素钠4
±
0.02mg;
[0169]
胶态二氧化硅2
±
0.02mg;
[0170]
硬脂酸盐2
±
0.02mg;
[0171]
(3)酒石酸伐尼克兰1.7
±
0.02mg;
[0172]
微晶纤维素126
±
0.5mg;
[0173]
磷酸氢钙66
±
0.5mg;
[0174]
交联羧甲基纤维素钠4
±
0.02mg;
[0175]
胶态二氧化硅1
±
0.02mg;
[0176]
硬脂酸盐1
±
0.02mg;
[0177]
(4)酒石酸伐尼克兰1.7
±
0.02mg;
[0178]
微晶纤维素126
±
0.5mg;
[0179]
磷酸氢钙65.8
±
0.5mg;
[0180]
交联羧甲基纤维素钠4
±
0.02mg;
[0181]
胶态二氧化硅0.8
±
0.02mg;
[0182]
硬脂酸盐1.4
±
0.02mg;
[0183]
(5)酒石酸伐尼克兰0.85
±
0.02mg;
[0184]
微晶纤维素63
±
0.5mg;
[0185]
磷酸氢钙30
±
0.5mg;
[0186]
交联羧甲基纤维素钠2
±
0.02mg;
[0187]
胶态二氧化硅1
±
0.02mg;
[0188]
硬脂酸盐1
±
0.02mg;
[0189]
(6)酒石酸伐尼克兰0.85
±
0.02mg;
[0190]
微晶纤维素63
±
0.5mg;
[0191]
磷酸氢钙32
±
0.5mg;
[0192]
交联羧甲基纤维素钠2
±
0.02mg;
[0193]
胶态二氧化硅1
±
0.02mg;
[0194]
硬脂酸盐1
±
0.02mg;
[0195]
(7)酒石酸伐尼克兰0.85
±
0.02mg;
[0196]
微晶纤维素63
±
0.5mg;
[0197]
磷酸氢钙33
±
0.5mg;
[0198]
交联羧甲基纤维素钠2
±
0.02mg;
[0199]
胶态二氧化硅0.5
±
0.01mg;
[0200]
硬脂酸盐0.5
±
0.01mg;
[0201]
(8)酒石酸伐尼克兰0.85
±
0.02mg;
[0202]
微晶纤维素63
±
0.5mg;
[0203]
磷酸氢钙32.9
±
0.5mg;
[0204]
交联羧甲基纤维素钠2
±
0.02mg;
[0205]
胶态二氧化硅0.4
±
0.01mg;
[0206]
硬脂酸盐0.7
±
0.01mg。
[0207]
进一步的,所述片剂还包含包衣剂。
[0208]
进一步的,所述的包衣剂包含固体聚合物。
[0209]
进一步的,所述的包衣剂为欧巴代包衣剂(包括但不限于:白、蓝、黄、红、绿或橙等的欧巴代包衣剂);优选white和/或blue,最优选white。
[0210]
进一步的,所述包衣剂用的溶剂为乙醇和/或纯化水;优选为纯化水。
[0211]
进一步的,所述包衣剂与所述片剂中除包衣剂以外的成分之和的重量比为(0.5~5):100、(1~4.5):100或(1.5~4):100;优选的,所述包衣剂相对于所述片剂的重量比为(1.5~2.5):100、(2.5~3.5):100或(3~4):100,例如2:100。
[0212]
本发明的目的之三是,提供如前任一方案所述的药物组合物或片剂的制备方法,其包括以下步骤:将助流剂、稀释剂、伐尼克兰或其药学上可接受的盐、崩解剂及润滑剂混匀,压片,较佳地,所述压片前还包括制粒。
[0213]
进一步的,所述制备方法优选:助流剂、稀释剂和伐尼克兰或其药学上可接受的盐混匀后,再加入崩解剂、润滑剂,混匀,制粒和/或压片。
[0214]
进一步的,所述制备方法优选:助流剂、稀释剂的25%~75%(或30%~68%)和伐尼克兰或其药学上可接受的盐混匀后,再加入剩余的稀释剂以及崩解剂、润滑剂,混匀,制粒和/或压片,即得。
[0215]
进一步的,所述的制粒为干法制粒或湿法制粒。
[0216]
进一步的,所述的压片为直接压片法。
[0217]
进一步的,所述压片之后,还包括进行包衣的步骤,所述包衣所用的包衣剂的定义如前所述。
[0218]
此外,本发明的目的之四是,提供如前任一方案所述的药物组合物或如前任一方案所述的片剂在制备药物中的应用,所述药物用于治疗和/或预防下列疾病:炎症性肠病、溃疡性结肠炎、坏疽性脓皮病、克罗恩氏病、过敏性肠综合症、痉挛性肌张力障碍、慢性疼痛、急性疼痛、腹泻、囊炎、血管收缩、焦虑、恐狂症、抑郁症、双相性精神障碍、自闭症、睡眠障碍、时差反应、肌萎缩性侧索硬化症、认知功能障碍、由酒精、巴比妥类药物、维生素缺乏、娱乐性药物、铅、砷或汞引起的认知障碍、阿尔茨海默病、老年痴呆、血管性痴呆、帕金森病、
多发性硬化、艾滋病、脑炎、外伤、肝肾性脑病、甲状腺功能减退、皮克氏病、科尔萨科夫氏综合症、前额痴呆或皮层下痴呆引起的认知障碍、高血压、贪食症、厌食症、肥胖、心律失常、胃酸分泌过多、溃疡、嗜铬细胞瘤、进行性核上麻痹、尼古丁、烟草产品、酒精、苯二氮类、巴比妥类、阿片类或可卡因的化学品依赖和成瘾、头痛、偏头痛、中风、外伤性脑损伤、强迫症、精神病、亨廷顿氏舞蹈病、迟发性运动障碍、运动亢进、阅读障碍、精神分裂症、多发性梗塞性痴呆、年龄相关性认知衰退、癫痫(小发作缺乏癫痫症)、注意力缺陷多动障碍或者图雷特氏综合症。
[0219]
进一步的,所述药物用于治疗尼古丁的依赖、成瘾或脱瘾。
[0220]
进一步的,所述药物用于治疗烟草产品的依赖、成瘾或脱瘾。
[0221]
进一步的,所述药物为戒烟药物。
[0222]
本发明的目的之五是,一种治疗疾病的方法,包括:向患者施用上述任意一项所述的药物组合物或如前任一方案所述的片剂;其中,所述的疾病包括:炎症性肠病、溃疡性结肠炎、坏疽性脓皮病、克罗恩氏病、过敏性肠综合症、痉挛性肌张力障碍、慢性疼痛、急性疼痛、腹泻、囊炎、血管收缩、焦虑、恐狂症、抑郁症、双相性精神障碍、自闭症、睡眠障碍、时差反应、肌萎缩性侧索硬化症、认知功能障碍、由酒精、巴比妥类药物、维生素缺乏、娱乐性药物、铅、砷或汞引起的认知障碍、阿尔茨海默病、老年痴呆、血管性痴呆、帕金森病、多发性硬化、艾滋病、脑炎、外伤、肝肾性脑病、甲状腺功能减退、皮克氏病、科尔萨科夫氏综合症、前额痴呆或皮层下痴呆引起的认知障碍、高血压、贪食症、厌食症、肥胖、心律失常、胃酸分泌过多、溃疡、嗜铬细胞瘤、进行性核上麻痹、尼古丁、烟草产品、酒精、苯二氮类、巴比妥类、阿片类或可卡因的化学品依赖和成瘾、头痛、偏头痛、中风、外伤性脑损伤、强迫症、精神病、亨廷顿氏舞蹈病、迟发性运动障碍、运动亢进、阅读障碍、精神分裂症、多发性梗塞性痴呆、年龄相关性认知衰退、癫痫(小发作缺乏癫痫症)、注意力缺陷多动障碍、或者,图雷特氏综合症。
[0223]
进一步的,所述的疾病是对尼古丁的依赖、成瘾或脱瘾;
[0224]
或者,所述的疾病是对烟草产品的依赖、成瘾或脱瘾。
[0225]
本发明药物的施用方式没有特别限制,代表性的施用方式包括但并不限于:口服、肠胃外(静脉内、肌肉内或皮下)、和局部给药。
[0226]
用于口服给药的固体剂型包括胶囊剂、片剂、丸剂、散剂和颗粒剂等。在这些固体剂型中,活性化合物与至少一种常规惰性赋形剂(或载体)混合,或与下述成分混合:(a)填料或增容剂;(b)增粘剂,例如:羧甲基纤维素及其盐;(c)保湿剂;(d)崩解剂;(e)缓溶剂;(f)吸收加速剂;(g)润湿剂;(h)吸附剂;以及(i)润滑剂等。胶囊剂、片剂和丸剂中,剂型还可包含缓冲剂。
[0227]
固体剂型如片剂、糖丸、胶囊剂、丸剂和颗粒剂,可采用包衣和壳材制备,如肠衣和其它本领域公知的材料。它们可包含不透明剂,并且,这种剂型中活性化合物或化合物的释放可以延迟的方式在消化道内的某一部分中释放。必要时,活性化合物也可与上述赋形剂中的一种或两种以上形成微胶囊形式。
[0228]
用于口服给药的液体剂型包括:药学上可接受的乳液、溶液、悬浮液、糖浆或酊剂。除了活性化合物外,液体剂型可包含本领域中常规采用的惰性稀释剂,如水或其它溶剂,以及增溶剂和乳化剂等。
[0229]
本发明的积极进步效果在于:
[0230]
本发明的药物组合物和片剂,其亚硝胺基因毒性杂质含量低,安全性高,更有利于保障人们的用药安全。
[0231]
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
附图说明
[0232]
图1为高效液相色谱法检测化合物a说明硝胺杂质化合物p06的色谱图。
具体实施方式
[0233]
下面将结合具体实施例对本发明进行清楚、完整的描述,本领域技术人员将会理解,下面所述的实施例是本发明一部分实施例,而不是全部的实施例,仅用于说明本发明,而不应视为对本发明保护范围的限制。
[0234]
本发明中,未注明具体条件者,按照常规条件或制造商建议的条件进行,所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
[0235]
关于本发明中使用术语的定义,除非另有说明,本文中术语提供的初始定义适用于全文中的该术语;对于本文没有具体定义的术语,应当根据公开内容和/或上下文,给出本领域技术人员能够给予它们的含义。
[0236]
实施例1
[0237]
酒石酸伐尼克兰片(制剂1):
[0238]
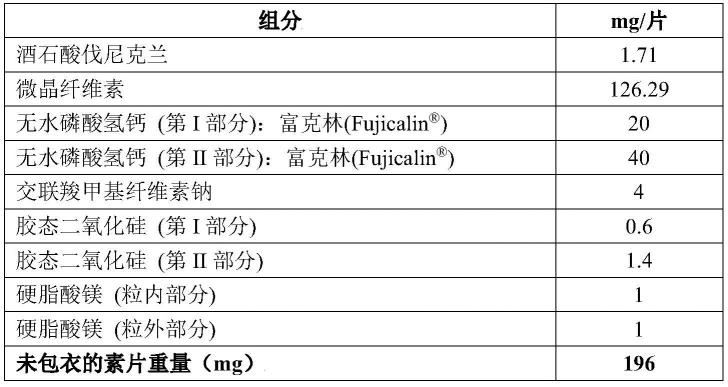
按照表1的配方,将胶态二氧化硅(colloidal silicon dioxide)第i部分和无水磷酸氢钙(anhydrous dibasic calcium phosphate)第i部分混合在一起,之后加入酒石酸伐尼克兰(varenicline tartrate)并混匀,再加入胶态二氧化硅第ii部分和无水磷酸氢钙第ii部分并混匀,然后加入微晶纤维素(microcrystalline cellulose)、交联羧甲基纤维素钠(croscarmellose sodium)和硬脂酸镁(magnesium stearate)粒内部分并混匀,干法制粒,并将颗粒和硬脂酸镁粒外部分混合在一起,压缩成片剂,然后使用欧巴代包衣粉进行包衣:乳白色和/或蓝色(white和/或blue,也可简称为:欧巴代白、欧巴代蓝等)。
[0239]
在上述制剂配方中,微晶纤维素和无水磷酸氢钙用作稀释剂,交联羧甲基纤维素钠用作崩解剂,胶态二氧化硅用作助流剂,硬脂酸镁用作润滑剂,乙醇和/或纯化水作为包衣溶剂。
[0240]
表1、制剂1(未包衣的素片)
[0241][0242]
其中,酒石酸伐尼克兰1.71mg/片可折算成伐尼克兰1mg/片,即:每片制剂中包含1mg有效成分(伐尼克兰),也可以表示为:1mg素片(或者1mg包衣片等);而0.5mg素片是在1mg素片的基础上各组分的量都减为一半。
[0243]
实施例2
[0244]
酒石酸伐尼克兰片(制剂2):
[0245]
按照表2的配方,将胶态二氧化硅(colloidal silicon dioxide)第i部分和无水磷酸氢钙(anhydrous dibasic calcium phosphate)第i部分混合在一起,之后加入酒石酸伐尼克兰(varenicline tartrate)并混匀,再加入胶态二氧化硅第ii部分和无水磷酸氢钙第ii部分并混匀,然后加入微晶纤维素(microcrystalline cellulose)、交联羧甲基纤维素钠(croscarmellose sodium)和硬脂酸镁(magnesium stearate)粒内部分并混匀,干法制粒,并将颗粒和硬脂酸镁粒外部分混合在一起,压缩成片剂,然后使用欧巴代包衣粉进行包衣:乳白色和/或蓝色(white和/或blue)。
[0246]
在上述制剂配方中,微晶纤维素和无水磷酸氢钙用作稀释剂,交联羧甲基纤维素钠用作崩解剂,胶态二氧化硅用作助流剂,硬脂酸镁用作润滑剂,纯化水作为包衣溶剂。
[0247]
表2、制剂2(未包衣的素片)
[0248][0249]
实施例3
[0250]
酒石酸伐尼克兰片(制剂3):
[0251]
按照表3的配方,将胶态二氧化硅(colloidal silicon dioxide)第i部分和微晶
纤维素(microcrystalline cellulose)第i部分混合在一起,之后加入酒石酸伐尼克兰(varenicline tartrate)并混匀,再加入胶态二氧化硅第ii部分和微晶纤维素第ii部分并混匀,然后加入无水磷酸氢钙(anhydrous dibasic calcium phosphate)、交联羧甲基纤维素钠(croscarmellose sodium)和硬脂酸镁(magnesium stearate)粒内部分并混匀,再与硬脂酸镁粒外部分混合在一起,压缩成片剂,然后使用欧巴代包衣粉进行包衣:乳白色和/或蓝色(white和/或blue)。
[0252]
在上述制剂配方中,微晶纤维素和无水磷酸氢钙用作稀释剂,交联羧甲基纤维素钠用作崩解剂,胶态二氧化硅用作助流剂,硬脂酸镁用作润滑剂,纯化水作为包衣溶剂。
[0253]
表3、制剂3(未包衣的素片)
[0254][0255]
实施例4
[0256]
酒石酸伐尼克兰片(制剂4):按照表4的配方,根据实施例3类似的工艺制备。
[0257]
表4、制剂4(未包衣的素片)
[0258][0259][0260]
实施例5
[0261]
酒石酸伐尼克兰片(制剂5):按照表5的配方,根据实施例3类似的工艺制备。
[0262]
表5、制剂5(未包衣的素片)
[0263][0264]
实施例6
[0265]
酒石酸伐尼克兰片(制剂6):按照表6的配方,根据实施例3类似的工艺制备(用干法制粒)。
[0266]
表6、制剂6(未包衣的素片)
[0267][0268]
实施例7
[0269]
利用uplc-ms/ms(设备类型:acquity i class&triple quad 5500+)检测酒石酸伐尼克兰原料药中的亚硝胺杂质p08,其结构式如下。利用hplc q-exactive-ms/ms(vanquish hplc q-exactive-ms/ms)检测酒石酸伐尼克兰片(素片或包衣片)中的亚硝胺杂质p08。
[0270][0271]
检测结果,见表7。
[0272]
表7、素片中亚硝胺杂质p08的检测结果
[0273][0274]
ppm:parts per million,定义为百万分之一,1ppm即为一百万分之一。
[0275]
实施例8
[0276]
包衣工艺优化:按照表8,对实施例2~6所得的素片进行包衣,得到酒石酸伐尼克兰包衣片。
[0277]
表8、酒石酸伐尼克兰包衣片
[0278][0279]
其中,#1w表示1mg素片(#1)用2%的white进行包衣,#2w表示1mg素片(#2)用2%的white进行包衣,其他类推。
[0280]
实施例9
[0281]
根据fda(food and drug administration,是指美国食品药品监督管理局)要求,需要对药物中的亚硝胺杂质进行检测,一般要求控制在≤7.5ppm。
[0282]
利用hplc q-exactive-ms/ms(vanquish hplc q-exactive-ms/ms)检测包衣片中的亚硝胺杂质p08。以美国畅沛(rld)和中国畅沛(rld)作为对照;其中,rld为reference listed drug的缩写,指的是参比制剂。检测结果见表9。
[0283]
表9、包衣片中亚硝胺杂质p08的检测结果
[0284][0285]
实施例10
[0286]
亚硝胺化合物p08的制备
[0287][0288]
向100ml三口瓶中,加入4.0g化合物m02(伐尼克兰)和45ml四氢呋喃(thf),搅拌溶清;加入8.2ml的nano2水溶液(浓度为0.4g/ml),加入2.9g醋酸,升温至52℃,tlc监控反应完毕,有固体析出,过滤,真空干燥,得到亚硝胺化合物p08,其纯度为98.87%(面积归一化法)。
[0289][0290]
亚硝胺化合物p08的1h-nmr、
13
c-nmr和ir图谱,分别见表10~12;m+h
+
=241.20;uv:在乙腈溶液中最大吸收波长为204.40nm。
[0291]
表10、亚硝胺化合物p08的1h-nmr图谱
[0292][0293]
表11、亚硝胺化合物p08的
13
c-nmr图谱
[0294][0295]
表12、亚硝胺化合物p08的ir图谱
[0296]
吸收波数(cm-1
)归属3048.8ar-h2961.4,2931.8饱和c-h伸缩振动1925.2苯环c=c伸缩振动1575.2n=o伸缩振动885.2苯环c-h弯曲振动
[0297]
实施例11
[0298]
我们创造性开发了超高效液相色谱三重四极杆质谱联用法(uplc-ms/ms),用于酒
石酸伐尼克兰原料药中亚硝胺杂质(化合物p08)的定性和/或定量检测,并进行和通过了方法学验证。
[0299]
uplc-ms/ms的色谱条件以及质谱条件,具体见表13。
[0300]
表13、uplc-ms/ms的色谱条件以及质谱条件
[0301][0302]
1、溶液配制
[0303]
稀释剂:纯化水
[0304]
对照品储备液:称取19.970mg亚硝胺化合物p08(纯度≥98%),置于10ml量瓶中,加入8ml乙腈,后加入稀释剂溶解并稀释至刻度,混匀。
[0305]
对照品母液:量取对照品储备液37.5μl于10ml量瓶中,稀释剂稀释至刻度,混匀。
[0306]
2、系统适用性
[0307]
系统适用性溶液(100%限度水平对照品溶液):量取对照品母液约100.0μl于10ml量瓶中,稀释剂稀释至刻度,混匀。
[0308]
连续进6针系统适用性溶液,计算6针系统适用性溶液中目标物峰面积的rsd,结果是4%,系统适用性良好。
[0309]
3、线性
[0310]
标准曲线溶液:分别量取对照品母液50.0μl、100.0μl、150.0μl、200.0μl置于4个
10ml量瓶中,稀释剂稀释至刻度,混匀,依次作为线性溶液l-3、l-4、l-5、l-6。量取l-3溶液800μ1至10ml量瓶中,稀释剂稀释至刻度,混匀,作为l-2。量取l-2溶液1000μ1至10ml量瓶中,稀释剂稀释至刻度,混匀,作为l-1。
[0311]
取标准曲线溶液分别进样分析,以目标物的浓度(x)为横坐标(单位:ng/ml),峰面积(y)为纵坐标,进行线性回归,计算得到线性方程和线性相关系数r;结果显示,线性方程:y=7370x-12900,线性相关系数r=0.999,线性良好,在0.2951ng/ml~147.6ng/ml(即:0.02951ppm~14.76ppm)的浓度范围内呈良好的线性。
[0312]
4、检测限(lod)
[0313]
lod溶液:量取l-1溶液5000μ1至10ml量瓶中,稀释剂稀释至刻度,混匀,作为lod溶液。
[0314]
取lod溶液连续进样2针,目标峰的s/n(信噪比)分别为11、8,满足不小于3的要求,方法灵敏;lod=0.01476ppm。
[0315]
5、定量限(loq)
[0316]
取定量限溶液(l-1溶液)连续进样6针,目标峰的s/n分别为23、24、17、12、24、14,满足不小于10的要求,方法灵敏;loq=0.02951ppm。
[0317]
6、准确度
[0318]
样品溶液:称取样品(例如:购买或合成的酒石酸伐尼克兰原料药)约100mg置于10ml量瓶中,加稀释剂稀释至刻度,混匀。平行制备2份。
[0319]
准确度溶液:称取样品约100mg置于10ml量瓶中,分别加入对照品母液50.0μl(50%限度水平)、100.0μl(100%限度水平)、150.0μl(150%限度水平),再用稀释剂稀释至刻度,混匀,即得。每个准确度水平平行配制3份。
[0320]
结果显示,在50%限度水平准确度溶液的回收率在95%~102%之间,rsd为4%;在100%限度水平准确度溶液的回收率在90%~103%之间,rsd为7%;在150%限度水平准确度溶液的回收率在98%~100%之间,rsd为1%,符合接受标准,准确度良好。
[0321]
7、重复性
[0322]
称取样品约100mg置于10ml量瓶中,加入对照品母液100.0μl,稀释剂稀释至刻度,混匀。平行配制6份。
[0323]
结果显示,6份重复性溶液中亚硝胺化合物p08含量的rsd为6%,符合接受标准,重复性良好。
[0324]
8、专属性
[0325]
取空白溶液(稀释剂)、100%限度水平对照品溶液、样品溶液(与“重复性”的样品溶液相同)、100%限度水平准确度溶液分别进样分析。
[0326]
结果显示,样品溶液、100%限度水平对照品溶液、100%限度水平准确度溶液的目标物保留时间均为3.47min,目标物的出峰位置处没有明显的干扰,满足分离度的要求,专属性良好。
[0327]
9、中间精密度
[0328]
中间精密度溶液:称取样品约100mg置于10ml量瓶中,加入对照品母液100.0μl,稀释剂稀释至刻度,混匀。平行配制6份。再加上“7、重复性”的6份溶液。
[0329]
计算6份中间精密度溶液和6份重复性溶液共计12份溶液的浓度rsd,为9%,满足
不大于15%的要求,符合接受标准,中间精密度良好。
[0330]
10、溶液稳定性
[0331]
取100%限度水平准确度溶液15℃放置,每隔一段时间进样分析,计算每个时间点与零点的浓度比值,21h内该比值在96%~113%之间。
[0332]
11、耐用性
[0333]
分别考察色谱柱温度变化
±
2℃、有机相初始比例
±
1%、流速变化
±
0.01ml/min时,100%限度水平准确度溶液中目标物的浓度值,每个条件下分别进样2针,计算同一参数波动中,6份溶液中目标物浓度值的rsd在4%~6%之间,方法耐用性良好。
[0334]
按照以下公式计算样品中的亚硝胺化合物p08含量,检测2次,取平均值:
[0335]
p08含量:c(ppm)=样品溶液中的p08浓度(ng/ml)/[m(mg)/v(ml)]
[0336]
m:样品质量,mg;
[0337]
v:样品稀释体积,ml。
[0338]
实施例12
[0339]
同时,我们还开发了hplc q-exactive-ms/ms(vanquish hplc q-exactive-ms/ms)方法,用于酒石酸伐尼克兰片剂中亚硝胺杂质p08的定性和/或定量检测,并进行和通过了方法学验证。
[0340]
hplc q-exactive-ms/ms的色谱条件以及质谱条件,具体见表14。
[0341]
表14、hplc q-exactive-ms/ms的色谱条件以及质谱条件
[0342][0343]
[0344]
1、溶液配制
[0345]
对照品储备液:称取7.5mg亚硝胺化合物p08置于100ml量瓶中,加入乙腈溶解,定容(定溶液1a)。取1.0ml定溶液1a置于100ml量瓶中,加入乙腈定容(定溶液1b)。取1.0ml定溶液1b置于20ml量瓶中,加入乙腈定容,得到对照品储备液。
[0346]
对照品溶液:取1.0ml对照品储备液置于10ml量瓶中,加入乙腈定容,即得对照品溶液。
[0347]
样品溶液:取10片酒石酸伐尼克兰片剂置于10ml量瓶中,加入3ml纯化水和3ml乙腈,超声30s,用乙腈稀释至刻度,混匀。
[0348]
样品加标溶液:取10片酒石酸伐尼克兰片剂置于10ml量瓶中,加入3ml纯化水和3ml乙腈,超声30s,再加入1.0ml对照品储备液,加入乙腈定容至刻度,混匀。
[0349]
安慰剂溶液:称取1g安慰剂(相当于去掉有效成分的片剂)置于10ml量瓶中,加入3ml纯化水和3ml乙腈,超声30s,用乙腈稀释至刻度,混匀。
[0350]
安慰剂加标溶液:称取1g安慰剂置于10ml量瓶中,加入3ml纯化水和3ml乙腈,超声30s,再加入1.0ml对照品储备液,加入乙腈定容稀释至刻度,混匀。
[0351]
空白:乙腈。
[0352]
2、专属性
[0353]
取空白、对照品溶液、样品溶液、安慰剂溶液、样品加标溶液、安慰剂加标溶液分别进样分析。
[0354]
结果显示,对照品溶液、样品溶液、加标溶液的目标物保留时间均约为7.80min,目标物的出峰位置处没有明显的干扰,满足分离度的要求,专属性良好。
[0355]
3、溶液稳定性
[0356]
取对照品溶液、样品溶液室温条件下放置,每隔一段时间进样分析:0、2、4、6、8、10、12小时,计算每个时间点与零点的峰面积比值(即:峰面积变化率)。
[0357]
结果显示,12小时内对照品溶液的亚硝胺化合物p08峰面积变化率<12%,12小时内样品溶液的亚硝胺化合物p08峰面积变化率<3.5%。
[0358]
4、系统适用性
[0359]
取对照品溶液进样分析5次,计算目标物峰面积的rsd,结果为1.41%,系统适用性良好。
[0360]
5、重复性
[0361]
平行配制6份样品溶液,分别进样分析。结果显示,6份样品溶液中杂质化合物p08含量的rsd为3.49%,符合接受标准,重复性良好。
[0362]
6、中间精密度
[0363]
由两位分析员在不同时间分别称取6份样品溶液,分别进样分析,并计算平均值和rsd。结果显示,rsd=5.93%。
[0364]
7、线性
[0365]
分别配制0.015ng/ml、0.38ng/ml、1.88ng/ml、3.77ng/ml、5.65ng/ml、18.83ng/ml、37.66ng/ml、753.2ng/ml的对照品溶液,进样分析;以目标物的浓度(x)为横坐标,峰面积(y)为纵坐标,进行线性回归,计算得到线性方程和线性相关系数r;
[0366]
结果显示,线性方程:y=462785x+1000000,线性相关系数r=0.9999,线性良好,
在0.015ng/ml~753.2ng/ml的浓度范围内呈良好的线性。
[0367]
8、准确度
[0368]
结果显示,样品加标溶液的回收率在85%~95%之间,rsd为2.03%,符合接受标准,准确度良好。
[0369]
9、检测限(lod)
[0370]
lod=13.2ppb,目标峰的平均s/n(信噪比)为75.94,满足大于3的要求,方法灵敏。
[0371]
10、定量限(loq)
[0372]
loq=17.6ppb,目标峰的平均s/n为103.35,满足大于10的要求,方法灵敏。
[0373]
11、耐用性
[0374]
考察色谱柱温度变化
±
2℃时,结果表明该方法的耐用性良好。
[0375]
按照以下公式计算计算样品中的亚硝胺杂质化合物p08含量:
[0376]
c(ppm)=样品溶液中的p08浓度(ng/ml)/样品溶液中的酒石酸伐尼克兰浓度(mg/ml)
[0377]
实施例13
[0378]
亚硝胺化合物p06的制备
[0379][0380]
向100ml三口瓶中,加入5g化合物m01和52ml四氢呋喃(thf),搅拌溶清;加入10ml的nano2水溶液(浓度为0.4g/ml),以及3g醋酸,升温至50℃反应,tlc或hplc监控反应完毕,浓缩,加入50ml二氯甲烷(dcm)和50ml饱和食盐水,搅拌溶清,静置,分液,取有机相,用饱和食盐水洗一次,无水硫酸钠干燥,过滤,浓缩至干,得到亚硝胺化合物p06,纯度为93.69%(面积归一化法)。
[0381][0382]
亚硝胺化合物p06的1h-nmr、
13
c-nmr和ir图谱,分别见表15~17;m+h
+
=279.10;uv:在乙腈溶液中最大吸收波长为223.80nm。
[0383]
表15、亚硝胺化合物p06的1h-nmr图谱
[0384][0385]
表16、亚硝胺化合物p06的
13
c-nmr图谱
[0386][0387]
表17、亚硝胺化合物p06的ir图谱
[0388][0389][0390]
实施例14
[0391]
亚硝胺化合物p07的制备
[0392][0393]
向100ml三口瓶中,加入4.0g化合物p06和50ml二氯甲烷(dcm),搅拌溶清;加入1.0g钯炭催化剂(pd/c),先用氮气置换后,然后再持续通氢气,升温至25~30℃,反应过夜,tlc监控反应完毕,过滤,浓缩至干,得到亚硝胺化合物p07,纯度为96.59%(面积归一化法)。
[0394][0395]
亚硝胺化合物p07的1h-nmr、
13
c-nmr和ir图谱,分别见表18~20;m+h
+
=219.20;uv:在乙腈:水=1:1溶液中最大吸收波长为212.00nm。
[0396]
表18、亚硝胺化合物p07的1h-nmr图谱
[0397][0398]
表19、亚硝胺化合物p07的
13
c-nmr图谱
[0399][0400][0401]
表20、亚硝胺化合物p07的ir图谱
[0402]
吸收波数(cm-1
)归属3432.6n-h伸缩振动
0.09mpa,40-50℃)至基本无馏分产生,得到含伐尼克兰的母液;
[0413][0414]
b、向步骤a所得含伐尼克兰的母液中,缓慢加入30kg无水乙醇和1.16kg(约7.73mol)l-(+)-酒石酸,控制反应温度在20-30℃,搅拌反应16h(包含无水乙醇和l-(+)-酒石酸的加入时间),然后停止反应,之后离心,干燥(70-75℃),得到2.08kg酒石酸伐尼克兰,为类白色固体。
[0415]
实施例16
[0416]
采用超高效液相色谱三重四极杆质谱联用法(uplc-ms/ms,详见表13),用于酒石酸伐尼克兰原料药中亚硝胺杂质(化合物p08)的定性和/或定量检测。
[0417]
经检测,实施例15制备的酒石酸伐尼克兰中亚硝胺杂质化合物p08的含量为114ppm(试验结果显示,该杂质的保留时间约在3.47min左右);这表明,如果不加以控制和处理,而按照常规的方法制备酒石酸伐尼克兰,所得产物中的亚硝胺杂质化合物p08含量通常在数百ppm级别,无法满足fda对亚硝胺杂质的限量要求。
[0418]
实施例17
[0419]
1、伐尼克兰中间体的制备
[0420]
①
、将3kg化合物a(经检测,化合物a中亚硝胺杂质化合物p06的含量为722ppm)和0.35kg钯炭(pd/c,pd 5%)催化剂,加入到36kg异丙醇和15kg纯化水的反应釜中,控制反应温度在25~35℃,通氢气并搅拌进行反应,hplc检测反应液中化合物a的剩余量≤0.5%停止反应,垫硅藻土过滤除去钯炭催化剂,得到含化合物b的反应液;
[0421]
②
、在惰性气体(氮气)保护下,向步骤
①
所得的反应液中,加入75g碳酸氢钠,然后缓慢加入乙二醛的水溶液(0.56kg乙二醛和6.5kg水)中,控制反应温度在20~30℃,搅拌反应,hplc检测反应液中化合物b的剩余量≤0.5%停止反应,减压蒸馏(真空度≤-0.09mpa,40~50℃)至基本无馏分产生,加入90kg纯化水,控制釜内温度在20~30℃,保温2h,之后离心,干燥(45~50℃),得到化合物c。
[0422]
2、酒石酸伐尼克兰的制备
[0423]
a、在惰性气体(氮气)保护下,向反应瓶中加入20kg纯化水、0.81kg氢氧化钠、8kg二氯甲烷和2kg化合物c(前一步骤制得),控制反应温度在20~35℃,hplc检测反应液中化合物c的剩余量≤0.5%停止反应,之后向反应釜内加入18.5kg二氯甲烷,搅拌,静置,分液,取有机相,水相用二氯甲烷(15kg
×
2)萃取,合并有机相,有机相中加入5kg无水硫酸钠干燥,过滤,对滤液减压蒸馏(真空度≤-0.09mpa,40~50℃)至基本无馏分产生,加入10kg无水乙醇,继续减压蒸馏(真空度≤-0.09mpa,40~50℃)至基本无馏分产生,得到含伐尼克兰的母液;
[0424]
b、向步骤a所得含伐尼克兰的母液中,缓慢加入30kg无水乙醇和1.16kg的l-(+)-酒石酸,控制反应温度在20~30℃,搅拌反应16h,然后停止反应,之后离心,干燥(70~75℃),得到酒石酸伐尼克兰;
[0425]
再按照每克酒石酸伐尼克兰的溶剂用量8ml,将制得的酒石酸伐尼克兰加入到打浆溶剂中,于30~40℃打浆1.5h,之后离心,干燥,即可;经检测,二氯甲烷打浆处理后的酒
酒石酸,控制反应温度在20~30℃,搅拌反应16h,然后停止反应,之后离心,干燥(70~75℃),得到酒石酸伐尼克兰;
[0438]
再按照每克酒石酸伐尼克兰的溶剂用量8ml,将制得的酒石酸伐尼克兰加入到打浆溶剂中,于30~40℃打浆1.5h,之后离心,干燥,即可;经检测,二氯甲烷打浆处理后的酒石酸伐尼克兰中,亚硝胺杂质化合物p08的含量为4.47ppm,亚硝胺杂质化合物p06和p07的含量为未检出(小于检测限)。
[0439]
实施例20
[0440]
酒石酸伐尼克兰的制备
[0441]
a、在惰性气体(氮气)保护下,向反应瓶中加入20kg纯化水、0.81kg氢氧化钠、8kg二氯甲烷和2kg化合物c(实施例18制得),控制反应温度在20~35℃,hplc检测反应液中化合物c的剩余量≤0.5%停止反应,之后向反应釜内加入18.5kg二氯甲烷,搅拌,静置,分液,取有机相,水相用二氯甲烷(15kg
×
2)萃取,合并有机相,有机相中加入5kg无水硫酸钠干燥,过滤,对滤液减压蒸馏(真空度≤-0.09mpa,40~50℃)至基本无馏分产生,加入10kg无水乙醇,继续减压蒸馏(真空度≤-0.09mpa,40~50℃)至基本无馏分产生,得到含伐尼克兰的母液;
[0442]
b、向步骤a所得含伐尼克兰的母液中,缓慢加入30kg无水乙醇和1.16kg的l-(+)-酒石酸,控制反应温度在20~30℃,搅拌反应16h,然后停止反应,之后离心,干燥(70~75℃),得到酒石酸伐尼克兰;
[0443]
再按照每克酒石酸伐尼克兰的溶剂用量8ml,将制得的酒石酸伐尼克兰加入到打浆溶剂中,于30~40℃打浆1.5h,之后离心,干燥,即可;经检测,异丙醇打浆处理后的酒石酸伐尼克兰中,亚硝胺杂质化合物p08的含量为2.89ppm,亚硝胺杂质化合物p06和p07的含量为未检出(小于检测限)。
[0444]
实施例21
[0445]
酒石酸伐尼克兰的制备
[0446]
a、在惰性气体(氮气)保护下,向反应瓶中加入20kg纯化水、0.81kg氢氧化钠、8kg二氯甲烷和2kg化合物c(实施例18制得),控制反应温度在20~35℃,hplc检测反应液中化合物c的剩余量≤0.5%停止反应,之后向反应釜内加入18.5kg二氯甲烷,搅拌,静置,分液,取有机相,水相用二氯甲烷(15kg
×
2)萃取,合并有机相,有机相中加入5kg无水硫酸钠干燥,过滤,对滤液减压蒸馏(真空度≤-0.09mpa,40~50℃)至基本无馏分产生,加入10kg无水乙醇,继续减压蒸馏(真空度≤-0.09mpa,40~50℃)至基本无馏分产生,得到含伐尼克兰的母液;
[0447]
b、向步骤a所得含伐尼克兰的母液中,缓慢加入30kg无水乙醇和1.16kg的l-(+)-酒石酸,控制反应温度在20~30℃,搅拌反应16h,然后停止反应,之后离心,干燥(70~75℃),得到酒石酸伐尼克兰;
[0448]
再按照每克酒石酸伐尼克兰的溶剂用量8ml,将制得的酒石酸伐尼克兰加入到打浆溶剂中,于30~40℃打浆1.5h,之后离心,干燥,即可;经检测,正庚烷打浆处理后的酒石酸伐尼克兰中,亚硝胺杂质化合物p08的含量为24.29ppm。
[0449]
实施例22
[0450]
酒石酸伐尼克兰的制备
[0451]
a、在惰性气体(氮气)保护下,向反应瓶中加入20kg纯化水、0.81kg氢氧化钠、8kg二氯甲烷和2kg化合物c(实施例18制得),控制反应温度在20~35℃,hplc检测反应液中化合物c的剩余量≤0.5%停止反应,之后向反应釜内加入18.5kg二氯甲烷,搅拌,静置,分液,取有机相,水相用二氯甲烷(15kg
×
2)萃取,合并有机相,有机相中加入5kg无水硫酸钠干燥,过滤,对滤液减压蒸馏(真空度≤-0.09mpa,40~50℃)至基本无馏分产生,加入10kg无水乙醇,继续减压蒸馏(真空度≤-0.09mpa,40~50℃)至基本无馏分产生,得到含伐尼克兰的母液;
[0452]
b、向步骤a所得含伐尼克兰的母液中,缓慢加入30kg无水乙醇和1.16kg的l-(+)-酒石酸,控制反应温度在20~30℃,搅拌反应16h,然后停止反应,之后离心,干燥(70~75℃),得到酒石酸伐尼克兰;
[0453]
再按照每克酒石酸伐尼克兰的溶剂用量8ml,将制得的酒石酸伐尼克兰加入到打浆溶剂中,于30~40℃打浆1.5h,之后离心,干燥,即可;经检测,乙醇打浆处理后的酒石酸伐尼克兰中,亚硝胺杂质化合物p08的含量为2.60ppm,亚硝胺杂质化合物p06和p07的含量为未检出(小于检测限)。
[0454]
实施例23~25
[0455]
通过进一步控制本发明起始原料中亚硝胺杂质化合物的含量(例如:将化合物a中亚硝胺杂质化合物p06的含量控制在≤250ppm、≤200ppm、≤150ppm、≤100ppm或更低的范围内),以及增加打浆处理的次数等,我们还制备得到了亚硝胺杂质化合物p08含量分别为0.511ppm、0.205ppm、0.118ppm的酒石酸伐尼克兰。
[0456]
若化合物a中亚硝胺杂质化合物p06的含量过高,可以通过以下打浆处理方法降低p06的含量,例如:将3.3kg化合物a(亚硝胺杂质化合物p06的含量为722ppm)加入到打浆溶剂(8.00kg正庚烷和2.70kg乙酸乙酯)中,于15~35℃打浆搅拌4~5h,之后离心,水洗滤饼,再离心,干燥,即可。经检测,打浆处理后化合物a中的亚硝胺杂质化合物p06含量为0.03%(315ppm)。这说明,通过一次上述打浆处理就能够将化合物a中亚硝胺杂质化合物p06的含量降低至少一半以上。
[0457]
打浆处理的工作原理是:利用打浆溶剂能够溶解目标化合物中的微量杂质使其留在液体中,而不溶的目标化合物仍为固体形式,再通过固液分离,进而降低目标化合物中的杂质含量。
[0458]
实施例26
[0459]
采用如表21所述条件的液相色谱-串联质谱法,用于本发明酒石酸伐尼克兰原料药中亚硝胺杂质化合物p07的定性和/或定量检测,并进行和通过了方法学验证。
[0460]
表21、检测亚硝胺杂质化合物p07的色谱条件以及质谱条件
[0461][0462]
1、溶液配制
[0463]
空白(稀释剂):水-乙腈(95:5)
[0464]
对照品储备液:称取25mg亚硝胺化合物p07(纯度≥95%),置于50ml容量瓶中,加入乙腈溶解,定容至刻度,混匀(定溶液i)。取1.0ml定溶液i,置于100ml容量瓶中,加入稀释剂定容至刻度,混匀,得到对照品储备液。
[0465]
对照品溶液:取0.45ml对照品储备液,置于100ml容量瓶中,加入稀释剂定容至刻度,混匀,即得。
[0466]
样品溶液:取酒石酸伐尼克兰原料药约100mg,置于10ml容量瓶中,加入稀释剂溶解并定容至刻度,混匀。
[0467]
2、系统适用性
[0468]
连续5针对照品溶液,亚硝胺杂质化合物p07峰面积的rsd≤15%,保留时间的rsd≤2.0%,与相邻峰能很好地分开,系统适用性良好。
[0469]
3、线性
[0470]
配制浓度分别为0.002688μg/ml、0.020157μg/ml、0.033594μg/ml、0.053751μg/ml、0.067189μg/ml、0.100783μg/ml(以亚硝胺化合物p07计)的对照品溶液;
[0471]
取上述不同浓度的对照品溶液分别进样分析,以目标物的浓度(x)为横坐标(单位:μg/ml),峰面积(y)为纵坐标,进行线性回归,计算得到线性方程和线性相关系数r;结果显示,线性方程:y=3000000x+2671.7,线性相关系数r=0.998,线性良好,在0.002688μg/
ml~0.100783μg/ml(即:0.2688ppm~10.0783ppm)的浓度范围内呈良好的线性。
[0472]
4、检测限(lod)
[0473]
lod=0.1344ppm,目标峰的s/n(信噪比)为14.8、13.1等,满足大于3的要求,方法灵敏。
[0474]
5、定量限(loq)
[0475]
loq=0.2688ppm,目标峰的s/n为20.5、24.9等,满足大于10的要求,方法灵敏。
[0476]
6、专属性
[0477]
结果显示,亚硝胺杂质化合物p07的保留时间为14.487min左右,相邻峰之间没有干扰,满足分离度的要求,专属性良好。
[0478]
此外,
[0479]
经验证,该检测方法的准确度、精密度、重复性、耐用性等也都符合方法学验证的规定和要求,能够很好地实现酒石酸伐尼克兰原料药中亚硝胺杂质化合物p07的定性和/或定量检测。
[0480]
实施例27
[0481]
采用如表22所述条件的液相色谱-串联质谱法,用于本发明酒石酸伐尼克兰原料药中亚硝胺杂质化合物p06的定性和/或定量检测,并进行和通过了方法学验证。
[0482]
表22、检测亚硝胺杂质化合物p06的色谱条件以及质谱条件
[0483][0484]
1、溶液配制
[0485]
空白(稀释剂):纯化水
[0486]
对照品储备液:称取25mg亚硝胺化合物p06(纯度≥92%),置于50ml容量瓶中,加入乙腈溶解,定容至刻度,混匀(定溶液ⅱ)。取1.0ml定溶液ⅱ,置于100ml容量瓶中,加入稀释剂定容至刻度,混匀,得到对照品储备液。
[0487]
对照品溶液:取4.5ml对照品储备液置于50ml容量瓶中,加入稀释剂定容至刻度,
混匀,即得。
[0488]
样品溶液:取酒石酸伐尼克兰原料药约1000mg,置于20ml顶空瓶中,准确量取5.0ml稀释剂溶解,混匀。
[0489]
2、系统适用性
[0490]
连续5针对照品溶液,亚硝胺杂质化合物p06峰面积的rsd≤15%,保留时间的rsd≤2.0%,与相邻峰能很好地分开,系统适用性良好。
[0491]
3、线性
[0492]
取不同浓度的对照品溶液分别进样分析,以目标物的浓度(x)为横坐标(单位:μg/ml),峰面积(y)为纵坐标,进行线性回归,计算得到线性方程和线性相关系数r;结果显示,线性相关系数r>0.99,线性关系良好。
[0493]
4、检测限(lod)
[0494]
lod=0.0145ppm,目标峰的s/n(信噪比)为5.8,满足大于3的要求,方法灵敏。
[0495]
5、定量限(loq)
[0496]
loq=0.0289ppm,目标峰的s/n为12.0,满足大于10的要求,方法灵敏。
[0497]
6、专属性
[0498]
结果显示,亚硝胺杂质化合物p06的保留时间为14.648min左右,相邻峰之间没有干扰,满足分离度的要求,专属性良好。
[0499]
此外,
[0500]
经验证,该检测方法的准确度、精密度、重复性、耐用性等也都符合方法学验证的规定和要求,能够很好地实现酒石酸伐尼克兰原料药中亚硝胺杂质化合物p06的定性和/或定量检测。
[0501]
实施例28
[0502]
为了更好地保证酒石酸伐尼克兰原料药或制剂中亚硝胺杂质化合物(包括:p06、p07、p08;其中,p08是由p06经中间产物p07转化而来;因此,p08是酒石酸伐尼克兰原料药或制剂中亚硝胺杂质的主要存在形式,p06是化合物a等原料中亚硝胺杂质的主要存在形式,p07是制备过程中的中间产物)的限量要求,需要对起始原料化合物a中的亚硝胺杂质化合物p06进行定性和/或定量检测,例如:采用高效液相色谱法,其色谱条件见表23。
[0503]
表23、检测化合物a中亚硝胺杂质化合物p06的色谱条件
[0504][0505]
[0506]
1、制作标准曲线
[0507]
空白(稀释剂):乙腈-水(60:40)
[0508]
对照品溶液:称取25mg亚硝胺化合物p06(纯度≥92%),置于25ml容量瓶中,加入稀释剂溶解并定容至刻度,混匀,得到对照品溶液。
[0509]
分别配制浓度为0.0001394mg/ml、0.0004645mg/ml、0.0007432mg/ml、0.000929mg/ml、0.001115mg/ml、0.001394mg/ml、0.001858mg/ml(以亚硝胺化合物p06计)的对照品溶液;
[0510]
取上述不同浓度的对照品溶液分别进样分析,以目标物的浓度(x)为横坐标(单位:mg/ml),峰面积(y)为纵坐标,进行线性回归,计算得到线性方程和线性相关系数r;结果显示,线性方程:y=228.94x+0.0025,线性相关系数r=0.999,线性良好,在该浓度范围内呈良好的线性。
[0511]
检测限:lod=0.004%(即40ppm),目标峰的s/n(信噪比)为6.4,满足大于3的要求,方法灵敏。
[0512]
定量限:loq=0.014%(即140ppm),目标峰的s/n为18.9,满足大于10的要求,方法灵敏。
[0513]
专属性:样品和对照品的混合溶液检测结果显示,亚硝胺杂质化合物p06的保留时间为4.592min左右(分离度r=13.18),化合物a的保留时间为7.587min左右(分离度r=6.82),杂质m01的保留时间为9.373min左右(分离度r=7.24),杂质m02的保留时间为12.45min左右(分离度r=5.25),各个峰之间没有干扰,满足分离度的要求,专属性良好。
[0514]
此外,
[0515]
经验证,该检测方法的准确度、精密度、重复性、耐用性等也都符合方法学验证的规定和要求,能够用于化合物a中亚硝胺杂质化合物p06的定性和/或定量检测。
[0516]
2、对样品进行检测
[0517]
样品溶液:取化合物a约25mg,置于25ml容量瓶中,加入稀释剂溶解并定容至刻度,混匀。
[0518]
样品溶液进样检测,得到其峰面积数据以及色谱图(见:图1)将该峰面积数据代入上述由对照品溶液得到的线性方程,计算得到检测样品溶液中亚硝胺杂质化合物p06的浓度数据。
[0519]
再按照以下公式,计算样品(化合物a)中的亚硝胺杂质化合物p06含量:
[0520]
p06含量:c(用%或ppm表示)=样品溶液中的p06浓度(mg/ml)/[m(mg)/v(ml)]
[0521]
m:样品质量,mg;
[0522]
v:样品稀释体积,ml。
[0523]
实施例29:
[0524]
检测亚硝胺杂质化合物p08是否具有基因毒性(能够致突变或致癌)。
[0525]
1材料和方法
[0526]
1.1实验菌株
[0527]
鼠伤寒沙门氏菌ta97a、ta98、ta100、ta102、ta1535,来源:美国molt ox公司,购自上海宝录生物科技有限公司。采用经鉴定符合要求的鼠伤寒沙门氏菌株进行试验。
[0528]
1.2代谢活化系统
[0529]
大鼠肝s9,来源:上海宝录生物科技有限公司。
[0530]
1.3受试物
[0531]
名称:亚硝胺杂质化合物p08,性状:白色粉末。
[0532]
1.4主要仪器与试剂
[0533]
x sr-204电子天平(瑞士梅特勒公司);高压蒸汽灭菌器(日本sanyo公司);隔水式恒温培养箱(上海一恒科技有限公司);stuart温控摇床培养箱(英国stuart公司);bhc-1300ii a2生物安全柜(苏净集团苏州安泰空气技术有限公司)。
[0534]
6-磷酸葡萄糖,来源:北京百灵威科技有限公司;辅酶ii,来源:国药集团化学试剂有限公司;营养肉汤,来源:北京陆桥技术股份有限公司;技术琼脂粉,来源:广东环凯微生物科技有限公司;灭菌注射用水,来源:辰欣药业股份有限公司;敌克松,来源:chemservice;甲磺酸甲酯,来源:北京百灵威科技有限公司;2-氨基芴,来源:上海晶纯试剂有限公司;1,8-二羟基蒽醌,来源:美国sigma-aldrich公司;环磷酰胺,来源:美国sigma-aldrich公司;叠氮化钠,来源:riedel-seelie。
[0535]
1.5试验方法(ames试验平板掺入法)
[0536]
实验采用平板掺入法。
[0537]
1.5.l剂量选择与受试物配制
[0538]
剂量设计:按每皿5mg、2.5mg、1.25mg、0.625mg、0.3125mg、0.15625mg进行试验。
[0539]
受试物配制:取本品用二甲基亚砜配成50mg/ml的溶液,用二甲基亚砜依次稀释成25mg/ml、12.5mg/ml、6.25mg/ml、3.125mg/ml、1.5625mg/ml。
[0540]
1.5.2试验方法。
[0541]
将冷冻保存的菌液ta97a、ta98、ta100、ta102、ta1535 0.1ml分别接种于10ml营养肉汤培养基,37℃振荡(100次/min)培养10h。将含0.5mmol/l组氨酸-0.5mmol/l生物素的顶层培养基2.0ml分装于试管中,0.103mpa灭菌20min,50℃水浴保温。然后每管依次加入受试物溶液0.1ml、s9混合液0.5ml(需代谢活化时)和菌液0.1ml,充分混匀,迅速倾入底层琼脂平板上,转动平板,使之分布均匀。水平放置待冷凝固化后,倒置于37℃培养箱里孵育48h,计数每皿回变菌落数。每个剂量均做三个平行板,同时设自发回变组、溶剂对照组和阳性对照组。
[0542]
1.6试验数据统计
[0543]
数据以均数
±
标准差表示,采用spss 19.0进行数据分析计算。
[0544]
1.7结果判定
[0545]
如果受试物的回变菌落数是溶剂对照回变菌落数的两倍或两倍以上,并呈剂量-反应关系,则该受试物判定为致突变阳性;受试物在任何一个剂量条件下,出现阳性反应并有可重复性,则该受试物判定为致突变阳性。如果受试物经上述试验菌株测定后,无论在加s9和未加s9条件下均为阴性,则该受试物为致突变阴性。
[0546]
2试验结果
[0547]
结果见表24。
[0548]
表24、ames试验结果
[0549][0550]
续表ames试验结果
[0551][0552]
ames试验结果可见,在不加s9的条件下,亚硝胺杂质化合物p08剂量为625μg/皿时,ta1535菌落数超过溶剂对照组的两倍。在加s9条件下,剂量为2500μg/皿时,ta98菌落数超过溶剂对照组的两倍,剂量为5000、2500、1250、625μg/皿时,ta1535菌落数超过溶剂对照组的两倍,并呈剂量-反应关系。这表明,在加与不加代谢活化系统的情况下,亚硝胺杂质化合物p08对鼠伤寒沙门氏菌为致突变阳性。
[0553]
实施例30
[0554]
参照现有的技术标准或技术规范(例如:中国农业行业标准ny/t 1156.4-2006农药室内生物测定试验准则杀菌剂第4部分:防治小麦白粉病试验盆栽法;中国农业行业标准ny/t 1156.5-2006农药室内生物测定试验准则杀菌剂第5部分:抑制水稻纹枯病菌试验蚕
豆叶片法;中国农业行业标准ny/t 1154.6-2006农药室内生物测定试验准则杀虫剂第6部分:杀虫活性试验浸虫法;ny/t1154.9-2008农药室内生物测定试验准则杀虫剂第9部分:喷雾法等),测定亚硝胺杂质化合物p08的杀菌或杀虫活性。
[0555]
当然,本发明还可以有其它多种实施方式,在不违背本发明精神及其实质的情况下,熟悉本领域的技术人员可以根据本发明作出各种相应的改变和/或变形,这些相应的改变和/或变形都应属于本发明所附的权利要求的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1