一种复合免疫增强剂及其制备方法和应用与流程
1.本发明属于医药领域,涉及一种免疫增强剂,尤其涉及一种复合免疫增强剂及其制备方法和应用。
背景技术:
2.免疫治疗已成为现代肿瘤学最引人注目的发展领域。基于肿瘤的免疫原性,研究者们在过去的二十多年里通过各种渠道利用免疫系统的特异性来治疗肿瘤。t细胞在抗癌免疫防御中扮演着重要角色,其激活与否受到共刺激受体(激活性受体)和免疫检查点(抑制性受体)的调节。阻断抑制性受体的抗体,如ctla
‑
4抗体、pd
‑
1/pd
‑
l1抗体等,在过去的25年中取得了突破性进展。
3.而针对共刺激受体(如ox40等)的激动性抗体始终未能在早期试验中达到很好的疗效。在genentech的ox40激动剂moxr0916的ib期试验中,与pdl1抑制剂atezolizumab结合使用,在51名接受治疗的患者中,只有2名(4%)有部分反应。genentech于2019年5月终止了ox40激动剂的临床试验。此外,其他公司如gsk的ox40激动剂进入临床试验已经四年了,它仍处于第一阶段。
4.ox40激动剂没有发挥应有的疗效可能原因在于没有对给药方式和药物组合进行优化。
技术实现要素:
5.本发明公开了一种用于肿瘤治疗的复合免疫增强剂,成分包括激动型抗ox40抗体和咪喹莫特,咪喹莫特可上调t细胞上ox40的表达,增强ox40抗体的疗效,解决ox40抗体临床应用的困局。
6.为实现上述目的,本发明提供一种用于肿瘤治疗的复合免疫增强剂,具有这样的特征:包括咪喹莫特混悬液和ox40溶液;咪喹莫特混悬液包括咪喹莫特;ox40溶液包括ox40激动型抗体。
7.进一步,本发明提供一种复合免疫增强剂,还可以具有这样的特征:还包括辅料,辅料为辛酸钠溶液。
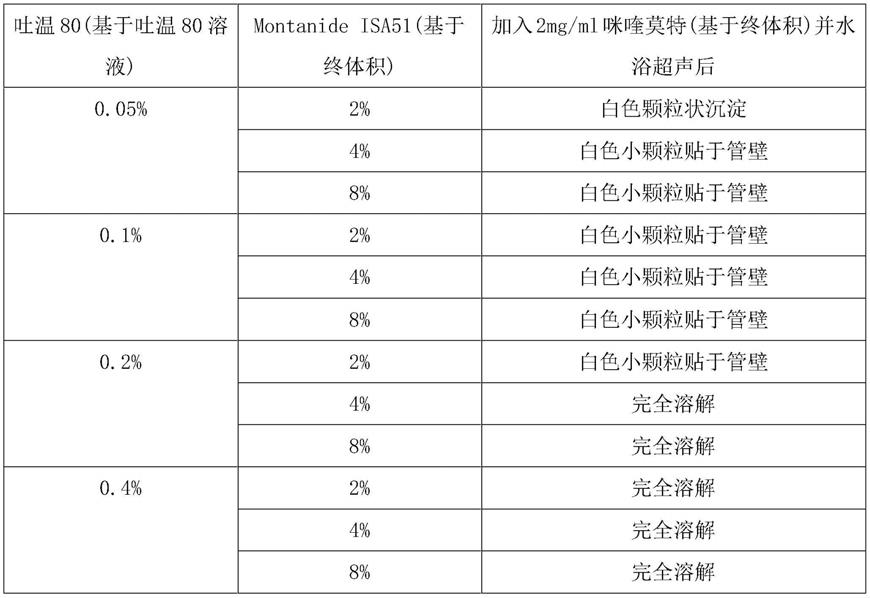
8.进一步,本发明提供一种复合免疫增强剂,还可以具有这样的特征:其中,所述咪喹莫特混悬液中还包括吐温80溶液和montanide isa51;吐温80溶液由吐温80溶于生理盐水和纯水配制而成。
9.进一步,本发明提供一种复合免疫增强剂,还可以具有这样的特征:其中,所述ox40溶液由ox40激动型抗体溶于生理盐水配制而成。
10.本发明还提供上述复合免疫增强剂的制备方法,具有这样的特征:包括以下步骤:
11.步骤一、咪喹莫特混悬液的制备:在生理盐水中加入纯水和吐温80,配制成吐温80溶液;在吐温80溶液加入montanide isa51,得到混合乳剂,在混合乳剂中加入咪喹莫特粉末,混匀后,水浴超声1h,得到咪喹莫特混悬液;
12.ox40溶液的制备:ox40激动型抗体溶于生理盐水,得到ox40溶液;
13.辛酸钠溶液的制备:辛酸钠溶于生理盐水,得到辛酸钠溶液;
14.步骤二、将咪喹莫特混悬液、ox40溶液和辛酸钠溶液混合,震荡均匀,得到复合免疫增强剂。
15.进一步,本发明提供一种复合免疫增强剂的制备方法,还可以具有这样的特征:其中,所述生理盐水的浓度为0.9m/v%;吐温80溶液中,生理盐水、纯水和吐温80的体积比为94.4∶5.4∶0.2;咪喹莫特混悬液中,吐温80溶液、montanide isa51的用量比为1ml∶40μl,混合乳剂和咪喹莫特的用量比为1ml∶2mg。
16.进一步,本发明提供一种复合免疫增强剂的制备方法,还可以具有这样的特征:其中,所述ox40溶液中,ox40激动型抗体和生理盐水的用量比为10mg∶1ml。
17.进一步,本发明提供一种复合免疫增强剂的制备方法,还可以具有这样的特征:其中,所述辛酸钠溶液中,辛酸钠和生理盐水的用量比为15mg∶1.5ml。
18.进一步,本发明提供一种复合免疫增强剂的制备方法,还可以具有这样的特征:其中,所述咪喹莫特混悬液、ox40溶液和辛酸钠溶液的体积比为1.5∶1∶1.5。
19.本发明还保护上述复合免疫增强剂在制备肿瘤治疗药物中的应用。
20.本发明的有益效果在于:本发明提供一种用于肿瘤治疗的复合免疫增强剂,包括咪喹莫特和ox40激动型抗体,咪喹莫特可上调cd4
+
t细胞上ox40的表达,进一步的动物实验表明二者联合可以发挥协同抗肿瘤作用。本复合免疫增强剂一方面可增强t细胞活力,另一方面可使肿瘤本身提供大量抗原,最大限度地减少免疫逃逸。
21.与其他常见原位疫苗策略如放射治疗、射频消融相比,本发明的复合免疫增强剂可采用瘤内注射方式,不依赖于特殊的医疗器械,可行性更强。与目前最受关注的新抗原疫苗相比,本发明的复合免疫增强剂在其实施过程相对简单,不需要二代测序、新抗原鉴定和多肽合成等繁琐的步骤,能为疾病处于快速进展期的患者节省宝贵的时间。水溶性差是咪喹莫特的临床应用障碍,尚未有注射剂型,目前仅以外用的咪喹莫特乳膏形式外用涂抹于皮肤表面,区别于常见的咪喹莫特乳膏,本发明采用咪喹莫特粉剂制备出稳定的可用于瘤内注射的液体制剂;同时采用一定剂量的吐温80和montanide isa51溶剂,使得咪喹莫特粉末可以实现良好的溶解,从而为其发挥相应疗效提供基础保障。
附图说明
22.图1是咪喹莫特上调ox40在肿瘤微环境中的表达;
23.图2a是单侧皮下荷瘤小鼠模型原位治疗实验流程图;
24.图2b是单侧皮下荷瘤小鼠模型原位治疗实验中各组小鼠的生长曲线图;
25.图2c是单侧皮下荷瘤小鼠模型原位治疗实验中各组小鼠的生存曲线图;
26.图3是侧皮下荷瘤小鼠模型治疗期间小鼠体重变化图;
27.图4a是腹部两侧各负荷一个肝癌病灶小鼠模型原位治疗实验流程图;
28.图4b是腹部两侧各负荷一个肝癌病灶小鼠模型原位治疗实验的生长曲线(治疗肿瘤病灶)图;
29.图4c是腹部两侧各负荷一个肝癌病灶小鼠模型原位治疗实验的生长曲线(未治疗肿瘤病灶)图;
30.图4d是腹部两侧各负荷一个肝癌病灶小鼠模型原位治疗实验的生存曲线图;
31.图5a是治疗一周后各组脾脏中央记忆t细胞和效应记忆t细胞的比例图;
32.图5b是ns组和imiquimod+ox40激动型抗体组小鼠脾细胞分别与cfse标记的h
22
肝癌细胞孵育,孵育后加入pi的肿瘤细胞中死细胞比例图;
33.图5c是治疗一周后各组肿瘤微环境中m2型巨噬细胞的比例和细胞因子il
‑
10的水平图;
34.图6a是瘤内注射复合免疫增效剂所引发的免疫应答实验流程图;
35.图6b是瘤内注射复合免疫增效剂所引发的免疫应答实验各小鼠的肿瘤生长曲线图。
具体实施方式
36.以下结合具体实施例对本发明作进一步说明。
37.本实施例提供一种用于肿瘤治疗的复合免疫增强剂,包括含有咪喹莫特的咪喹莫特混悬液、含有ox40激动型抗体的ox40溶液以及辅料辛酸钠溶液;其中,咪喹莫特混悬液中还包括吐温80溶液和montanide isa51,吐温80溶液由吐温80溶于生理盐水和纯水配制而成;ox40溶液由ox40激动型抗体溶于生理盐水配制而成,本实施例中ox40激动型抗体购于信达公司,货号ibi101。ox40激动型抗体具有t细胞共刺激功能。辛酸钠溶液具有促进试剂在肿瘤组织内扩散的作用。
38.复合免疫增强剂的制备方法包括以下步骤:
39.步骤一、咪喹莫特混悬液的制备:94.4ml生理盐水(0.9m/v%)中加入5.4ml纯水和0.2ml吐温80,配制成0.2%吐温80溶液;每1ml 0.2%吐温80溶液中加入40μl montanide isa51,每1ml混合乳剂中加入2mg咪喹莫特粉末,混匀后,水浴超声1h(frequency:80,power:100,时间:60min),得到咪喹莫特混悬液。
40.ox40溶液的制备:10mg ox40激动型抗体溶于1ml生理盐水,得到ox40溶液。
41.辛酸钠溶液的制备:15mg辛酸钠溶于1.5ml生理盐水,得到辛酸钠溶液。
42.步骤二、将1.5ml咪喹莫特混悬液、1ml ox40溶液和1.5ml辛酸钠溶液混合,震荡均匀,得到复合免疫增强剂。
43.复合免疫增强剂在制备肿瘤治疗药物中的应用:
44.咪喹莫特溶剂的选择:
45.咪喹莫特混悬液的制备
[0046][0047]
由上表可看出,在一定量的吐温80和montanide isa51溶剂中,咪喹莫特可以实现良好的溶解,从而为其发挥相应疗效提供基础保障。
[0048]
咪喹莫特和ox40激动型抗体在肿瘤治疗中的应用:
[0049]
测试了咪喹莫特和ox40激动型抗体的相关性。通过在线分析工具(http://gepia2.cancer
‑
pku.cn/#correlation)计算tlr7和ox40在肝细胞肝癌(lihc)中的相关性,结果如图1中a所示,表明ox40在肿瘤微环境中的表达与tlr7的表达呈正相关。建立单侧皮下荷瘤小鼠模型,瘤内注射生理盐水(左)或咪喹莫特(右)各一次,48h后切除肿瘤,流式细胞术检测cd
3+
cd
4+
t细胞亚群上ox40的表达,结果如图1中b所示,可见肿瘤内注射咪喹莫特后,肿瘤浸润的cd4
+
t细胞表面ox40有2倍的上调。因此,结果表明咪喹莫特能够上调ox40在肿瘤微环境中的表达。
[0050]
对单侧皮下荷瘤小鼠模型,复合免疫增强剂具有抑制肿瘤生长和延长小鼠生存期的作用。如图2a所示,原位疫苗治疗方案为:第0天在昆明鼠左下腹接种h
22
肝癌细胞2
×
106/只鼠,然后在第5天也就是当肿瘤最大直径达到0.5
‑
0.7cm时开始进行瘤内注射复合免疫增强剂治疗,隔天一次,共计三次。该复合免疫增强剂采用动物用配方,以人和动物间按体表面积折算等效剂量比计算,包括20μg咪喹莫特和4μg ox40激动型抗体(invivomab anti
‑
mouse ox40(cd134),bioxcell公司,货号be0031);其制备方法为:向咪喹莫特粉剂中加入dmso充分震荡混匀形成白色乳浊液(100mg/ml),向白色乳浊液中加入生理盐水稀释至0.4mg/ml,37℃恒温震荡1
‑
2小时,形成均匀稳定的小颗粒悬浊液,加入ox40激动型抗体(终浓度0.08mg/ml);使用1ml注射器将50μl该复合免疫增效剂注射进小鼠肿瘤组织内。
[0051]
各组小鼠的生长曲线如图2b所示,生长曲线代表各组的平均肿瘤体积。小鼠分组:生理盐水治疗组(ns)、咪喹莫特单药治疗组(imiquimod)、ox40抗体单药治疗组(ox40激动型抗体)、咪喹莫特和ox40抗体联合治疗组(imiquimod+ox40激动型抗体),每组十只小鼠。各组小鼠的生存曲线(n=10)如图2c所示。结果显示ns治疗组小鼠的肿瘤生长十分迅速,单
独使用咪喹莫特或ox40激动型抗体仅引起肿瘤生长的轻微延迟,但是两种免疫增效剂的联合注射使部分小鼠肿瘤完全消退,且生存期显著延长。
[0052]
瘤内注射复合免疫增效剂的安全性。在单侧皮下荷瘤小鼠模型治疗期间记录小鼠的体重,小鼠体重变化如图3所示,结果显示每组小鼠的平均体重具有相似的变化模式。
[0053]
对腹部两侧各负荷一个肝癌病灶的小鼠,一侧瘤内注射复合免疫增效剂后,注射肿瘤灶和远位肿瘤的生长均受到显著抑制。如图4a所示,原位疫苗治疗方案为:第0天在昆明鼠左下腹和右下腹分别接种h
22
肝癌细胞2
×
106/只鼠,然后在第5天也就是当肿瘤最大直径达到0.5
‑
0.7cm时开始对左下腹肿瘤进行瘤内注射复合免疫增强剂(20μg咪喹莫特和4μg ox40激动型抗体)治疗治疗,隔天一次,共计三次。各组小鼠的生长曲线如图4b和4c所示,生长曲线代表治疗肿瘤病灶(3b)和未治疗肿瘤病灶(3c)的平均体积。小鼠分组:生理盐水治疗组(ns)、咪喹莫特单药治疗组(imiquimod)、ox40抗体单药治疗组(ox40激动型抗体)、咪喹莫特和ox40抗体联合治疗组(imiquimod+ox40激动型抗体),每组六只小鼠。各组小鼠的生存曲线如图4d所示。结果显示ns治疗组小鼠的肿瘤在治疗部位和未治疗部位均显示进行性快速生长;单用咪喹莫特或ox40激动型抗体治疗的肿瘤生长趋势略有减慢;但是两种免疫增效剂的联合注射使得近一半小鼠的局部和远处肿瘤完全消退;与启动和增强免疫反应所需的时间一致,两种肿瘤的消退动力学不同,未经治疗的肿瘤消退速度比局部肿瘤慢几天;imiquimod+ox40激动型抗体组的存活时间明显长于任何其他组。
[0054]
瘤内注射复合免疫增效剂激活肿瘤免疫微环境。在完成最后一次治疗一周后,采用流式细胞术分析了脾脏中央记忆t细胞(tcm,cd3
+
cd8
+
cd62l
+
cd44
+
)和效应记忆t细胞(tem,cd3
+
cd8
+
cd62l
‑
cd44
+
)的比例,如图5a所示,显示与ns治疗组相比,imiquimod+ox40激动型抗体组中的中央记忆t细胞比例没有差异,而效应记忆t细胞比例增加了1倍,说明tem能够通过产生tnf
‑
α和ifn
‑
γ来诱导强烈的免疫保护作用。ns组和imiquimod+ox40激动型抗体组中的小鼠脾细胞分别与cfse标记的h
22
肝癌细胞按效应靶比(e:t)5:1、10:1和20:1孵育。孵育6h后加入pi,流式细胞仪分析肿瘤细胞中死细胞比例(cfse+pi+),结果如图5b所示,显示imiquimod+ox40激动型抗体组小鼠的脾细胞在效靶比为10:1时对h
22
肝癌细胞表现出更显著的杀伤能力。在完成最后一次治疗一周后,采用流式细胞术分析肿瘤微环境中m2型巨噬细胞(cd11b
+
f4/80
+
cd206
+
)的比例和细胞因子il
‑
10的水平,结果如图5c所示,显示咪喹莫特和ox40激动型抗体的联合瘤内注射引起m2型巨噬细胞的减少,及主要由其分泌的细胞因子il
‑
10水平的下降。
[0055]
瘤内注射本复合免疫增效剂所引发的免疫应答具有特异性。如图6a所示,治疗方案为:经过瘤内注射复合免疫增效剂后肿瘤完全消退的昆明鼠在第一次种瘤40天后再次皮下接种b16f10黑色素瘤细胞(2
×
105,左下腹)和h
22
肝癌细胞(2
×
106,右下腹)。每只小鼠的肿瘤生长曲线(5只小鼠)如图6b所示。结果显示原位疫苗接种治愈的小鼠对同种肿瘤(h
22
肝细胞癌,右下腹)有强大的免疫抵抗,肝癌病灶没有复发。而不同的肿瘤(b16f10黑色素瘤,左下腹)在小鼠皮下形成的比较大的肿瘤病灶。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1