一种稳定的干扰素微针制剂及其制备方法与应用与流程
1.本发明涉及医药领域,具体涉及一种稳定的干扰素微针制剂及其制备方法与应用。
背景技术:
2.干扰素是存在于人体内的一类天然的细胞因子,是先天性免疫应答的重要组成部分,具有抗病毒、抗肿瘤及免疫调节三大功能,人干扰素α已被广泛应用于肝炎、病毒性疾病及血液(或实体)肿瘤的临床治疗。干扰素α主要通过诱导细胞产生多种抗病毒蛋白,有效抑制病毒在细胞内的复制来发挥抗病毒功能,其在病毒性皮肤病治疗领域的适应症包括单纯疱疹、带状疱疹以及人乳头瘤病毒(hpv)引起的病毒性皮肤疣(扁平疣、寻常疣、尖锐湿疣等)等。目前临床采用的人干扰素α剂型主要有注射剂、凝胶剂和喷雾剂,但上述剂型存在用药途径不便、患者依从性差、药物透过率低以及生物药冷链运输和储藏条件带来的药物可及性差等问题,因此需要开发新的剂型实现干扰素的便捷给药及常温稳定保存。
3.微针给药技术是一种正在飞速发展的领域,该技术通过微米级高度的尖锐针尖对角质层形成微小的创口,向皮内或皮下进行药物递送或组织液提取。该技术由于越过了表皮屏障,可实现药物尤其是大分子蛋白的经皮给药;给药创口微小,高度低不刺激皮下神经,克服了传统注射的“针头恐惧”,增加了患者的依从性,是一种高效无痛的给药方式。经过多年学术研究,微针领域已经建立起了基本的评价方法,同时开展了许多临床试验。微针技术的发展有利于实现温度敏感型药物的脱冷链运输及储存,可大幅降低运输成本。
4.目前已有文章公开了可以稳定生物药品的微针处方。文章(j pharm sci.2015feb;104(2):740
‑
9.)中对流感疫苗的配方进行了系统的筛选。文章中选用三种同价同亚型的流感疫苗,制作辅料相同的微针,并在25℃干燥条件下进行6个月的稳定性试验。流感疫苗的微针稳定性结果表明,稳定剂海藻糖/蔗糖对h1n1疫苗 (a/brisbane/59/2007)有明显稳定作用,对b疫苗 (b/brisbane/60/2008)则无类似的稳定作用。由此可知,生物药品的稳定条件存在特异性,对特定药品可以起到稳定作用的微针成分不广泛适用于其他药品。
5.国内专利中,人干扰素α的制剂包含干粉吸入剂、注射液笔、冻干制剂、融合蛋白水溶液制剂等。在人干扰素α的干粉吸入剂的专利 (cn 102727467 a)、(cn 102727469 a)、(cn 102727468 a)、(cn102716469 a)、(cn 102716105 a)的实施例中,列举了不同配方在 40℃,75%rh条件下的加速稳定性,蛋白比活范围为70%~95%。在一种稳定的干扰素α多剂量笔注射液(cn 104888196 a)的专利中,注射液在冷藏条件下保存10天后的活性保持范围为第0天的 36%~92%。由此可以看出,相同药物的不同剂型稳定条件差异巨大。
6.因此,从生物药品的特异性,微针剂型的特殊性角度出发,有必要对干扰素进行定制化的微针剂型稳定性研究。对此,虽然 cn112055582a中也提到了一种用于递送干扰素的微针系统,但经该发明研究发现,该制剂实际上在室温(21℃)和冰箱温度(5℃)下储存时,干扰素的活性均无法得到有效保持。尽管公开数据中不同温度下储存1、3、6个月的β干扰素
抗病毒效力保持在与制备时间点相同的对数单位范围内,但实际上,经该发明验证,该制剂在21℃条件储存3个月的活性仅为初始值的54.04%,储存6个月的活性仅为初始值的50.18%。即使在对蛋白类药物更为友好的冷藏(5℃)条件下,该制剂储存1个月后的活性也仅为初始值的56.13%。根据2020版《中国药典》对于不同剂型干扰素制剂成品检定的要求,生物学活性均应为标识量的80%
‑
150%,因此公开文件中所述处方既不能满足冷藏(5℃) 条件,更无法实现常温储存条件下制剂的稳定性要求。
技术实现要素:
7.本发明的目的是提供一种稳定的干扰素微针制剂,以解决人干扰素运输成本高、给药不便、储存条件严格等问题。
8.为了实现上述目的,第一方面,本发明首先提供一种微针制剂,其中含有:
9.干扰素;以及
10.赋形剂,所述赋形剂中主要含有羧甲基纤维素钠、聚乙烯醇中的一种或其混合物。
11.本发明发现,当赋形剂的主要成分为羧甲基纤维素钠(cmc)、聚乙烯醇(pva)中的一种或其混合物时,有助于在保证微针的其他基本性能(如针型完整,具有穿刺性,且颜色透明等)的同时,大幅改善干扰素在微针制剂中的长期稳定性。
12.本领域人员在实际应用时能够理解所述的“主要含有”的具体实施方式,比如在赋形剂中含有50wt%以上、更优选为70wt%以上、进一步优选为90wt%以上的羧甲基纤维素钠和/或聚乙烯醇。
13.作为一种优选的实施方式,所述赋形剂为羧甲基纤维素钠、聚乙烯醇中的一种或其混合物。
14.作为优选,所述微针制剂中还含有:
15.稳定剂,所述稳定剂选自海藻糖、蔗糖、葡萄糖、葡聚糖、精氨酸、edta中的一种或多种,优选所述稳定剂选自海藻糖、蔗糖、edta 中的一种或多种,更优选所述稳定剂中至少含有海藻糖、蔗糖中的一种或其混合物。
16.当选用上述稳定剂时,可以进一步改善干扰素微针制剂的稳定性。
17.优选地,当所述稳定剂与所述赋形剂的质量比为1:3~1:2时,干扰素微针制剂的稳定性更优。
18.本发明中的所述干扰素为人干扰素及干扰素类似物中的一种或多种。
19.优选所述干扰素类似物与人干扰素的氨基酸序列的同源性不低于80%。
20.更优选地,当所述干扰素为干扰素α、干扰素α类似物(如干扰素α1b、干扰素α2b、干扰素α2a等)、干扰素β、干扰素γ、集成干扰素中的一种或多种时,采用本发明的微针制剂的效果更优。
21.在本发明的微针制剂中,干扰素的含量可以为5
‑
200μg;
22.进一步地,干扰素的含量可以为准确实现市售干扰素的规格,比如具体为10μg、15μg、20μg、30μg、50μg等。
23.第二方面,本发明还提供了所述的微针制剂的制备方法,其包括:
24.制备包含所述干扰素和所述赋形剂的水溶液;优选所述水溶液中还含有所述稳定剂;
25.而后将所述水溶液干燥,以得到微针制剂。
26.在具体实施时,本领域人员可根据需要,将所述水溶液倒入用于形成微针阵列的模具中,或者涂覆于一体式基座的针尖,然后干燥所述的溶液,以得到所需的微针制剂。
27.作为优选,控制所述水溶液的ph值小于7,优选为5.5~6.5,更优选为6.0
±
0.2。
28.本发明进一步发现,通过控制所述水溶液的ph值在上述范围,有助于改善干扰素微针制剂在制备时的稳定性,同时有利于大幅提升干扰素的长期稳定性。
29.作为优选方案,所述水溶液中还含有ph缓冲液,所述ph缓冲液为0.008m~0.02m的磷酸盐缓冲液、枸橼酸盐缓冲液、醋酸盐缓冲液或抗坏血酸盐缓冲液,其均可以在长期保存中较好的稳定干扰素的活性。
30.更优选的,当所述ph缓冲液为磷酸盐缓冲液或醋酸盐缓冲液,和/或,所述ph缓冲液的浓度为0.01
±
0.002m时,干扰素的长期稳定效果更优。
31.作为优选,在所述水溶液中,赋形剂的固含量为2.5~20wt%,稳定剂的固含量为3~15wt%。
32.本发明还提供经上述制备方法制得的微针制剂。
33.第三方面,本发明提供所述的微针制剂或所述的制备方法制得的微针制剂在制备经皮给药制剂中的应用。
34.进一步的,本发明还提供一种经皮给药制剂,其包含:
35.基底材料;以及
36.微针阵列,所述微针由所述基底材料上伸出,并且包含所述的微针制剂或所述的制备方法制得的微针制剂。
37.优选地,所述经皮给药制剂为一体式微针、分层微针或涂层微针。
38.作为一种优选的实施方案,当所述经皮给药制剂为分层微针时,所述分层微针的基底部分的赋形剂为pva,针尖部分的赋形剂为 cmc。
39.第四方面,本发明提供一种干扰素的透皮给药方法,其包括:利用所述的微针制剂或所述的制备方法制得的微针制剂或所述的经皮给药制剂,进行透皮给药。
40.基于上述技术方案,本发明的有益效果如下:
41.本发明的微针制剂可以使干扰素在常温常湿环境下长时间保持较高活性,并可广泛适用于不同的经皮给药制剂剂型,包含且不限于一体式微针、分层微针和针尖涂层微针等,其可以基本实现干扰素微针的常温运输和保存,极大地减少了该药物制剂的使用成本。
42.此外,根据体外试验结果,本发明的微针制剂溶解后抑制人乳头瘤病毒11型(hpv11)复制的作用与干扰素原液相当,即所述微针制剂的活性成分干扰素在制备成针的干燥过程中,活性能够得到有效保持,且能够发挥有效的抗hpv11病毒复制的作用。
附图说明
43.图1为一体式溶解微针结构示意图。
44.图2为一体式溶解微针一倍体视显微镜图。
45.图3为分层式溶解微针结构示意图。
46.图4为分层式溶解微针一倍体视显微镜图。
47.图5为针尖涂层微针结构示意图。
48.图6为针尖涂层微针体视显微镜图,其中,图a~c依次分别为针尖涂层微针在1倍体视显微镜、3倍体视显微镜、4倍体视显微镜下的图像。
49.图7为微针的铝箔泡罩包装。
50.图8为qpcr检测不同处理组hpv11的拷贝数结果;其中,a图为 dna含量的log2对数
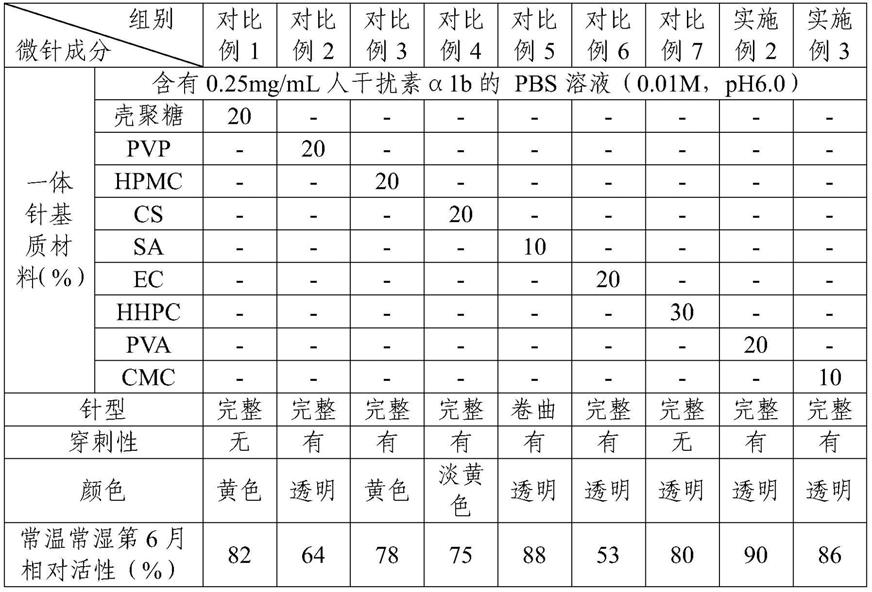
‑
ct值的标准曲线;b图为hpv11拷贝数的log10 对数
‑
ct值的标准曲线;c图为根据标准曲线计算的经不同剂型、不同浓度人干扰素α1b干预后hacat[hpv11]细胞中hpv11基因组的拷贝数变化。
具体实施方式
[0051]
以下实施例用于说明本发明,但不用来限制本发明的范围。
[0052]
实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购买得到的常规产品。
[0053]
实施例1人干扰素α1b的一体式溶解微针
[0054]
本实施例首先提供一种人干扰素α1b的一体式溶解微针,其制备方法如下:
[0055]
1、微针基质溶液配制:
[0056]
按照以下固含量比例配制微针基质溶液:20%cmc、5%海藻糖、5%蔗糖。称取cmc(羧甲基纤维素钠,粘度800cps,安徽山河药用辅料股份有限公司)0.2g,海藻糖0.05g,蔗糖0.05g,加入0.7ml pbs 溶液(0.01m,ph6.0)溶液,搅拌溶解后,0℃静置5min,离心除气泡,加入6mg/ml的人干扰素α1b原液0.042ml,涡旋震荡混匀后, 4℃离心除气泡,放置在4℃环境下静置待用。此时溶液中的干扰素α1b浓度为0.252mg/ml。
[0057]
2、微针成型
[0058]
移液枪移取上述制备的微针基质溶液40μl,滴加到微针模具单元上,pdms模具底部抽真空5min后,在超净台内吹风60min,使微针干燥,贴背衬胶纸脱模,即为图1~2所示的载干扰素的一体式微针,整片含药量约为10.08μg。
[0059]
3、检测微针的各参数
[0060]
1)微针完整性:通过体式显微镜观察整片微针的形态,观察是否能够完整脱模,针尖形态是否完整。
[0061]
2)检测微针的穿刺性:使用猪幼崽耳部皮肤,裁取适量面积,将微针针尖平整朝下,从微针背部进行20n的进针按压,持续按压 10s,按压完成后将微针从皮肤内取出,向施针部位皮肤滴加台盼蓝染色溶液,染色5min后将皮肤擦净,观察到整齐的着色针孔阵列即为具有穿刺性。
[0062]
3)针体颜色:同一日光灯光源下目视观察并记录。
[0063]
4)常温常湿第6个月相对活性实验:将微针贴片按照市售标准包装,如图7所示,放置于25℃/60%rh环境中保存6个月。使用细胞病变抑制法对第0天和第6个月的干扰素微针进行活性测定。
[0064]
结果针形完整,有穿刺性,颜色透明,常温常湿第6个月相对活性为85%。
[0065]
对比例1~7,实施例2~3:含有不同赋形剂的一体式溶解微针
[0066]
在对比例1
‑
7及实施例2~3中列举了发明人尝试过的赋形剂制得的一体式溶解微
针,对比例中赋形剂包括乙基纤维素(ec)、羟丙甲纤维素(hpmc)、壳聚糖、硫酸软骨素(cs)、聚乙烯吡咯烷酮(pvp)、海藻酸钠(sa)、羟丙基纤维素(hhpc),实施例中赋形剂包括聚乙烯醇(pva)和羧甲基纤维素钠(cmc),均按照实施例1的制作方法、按照表1中给出的物质重量百分比制备得到,并按照与实施例1 相同的方法对微针的完整性、穿刺性、针体颜色和生物分子的活性等各项参数进行了检测,结果见表1。
[0067]
从表1中可以看出,对比例1~7采用了不同的微针基质材料,其中以壳聚糖、hpmc和cs在成针时出现了发黄的现象,sa微针发生了卷曲,均不符合制剂的外观要求;当hhpc作为微针材料时,微针无穿刺性,不符合微针制剂的使用要求;当pvp和ec作为微针材料时,外观和穿刺性均能满足,但不能保持较高的干扰素活性。实施例2~3中以pva和cmc为基质材料的微针同时满足制剂外观、使用及干扰素活性要求。
[0068]
表1
[0069][0070]
实施例4~7、对比例8~12:含有不同稳定剂的一体式溶解微针
[0071]
按照实施例1的制作方法,按照表2中给出的物质重量百分比,制备实施例4~7、对比例8~12的微针并考察其微针完整性、穿刺性、针体颜色和生物分子的活性(见表2)。
[0072]
从表2中可以看出,实施例4~5、对比例8~12采用了类似的微针基质材料和单一组分稳定剂。含有葡庚糖酸钙和l
‑
甲硫氨酸的微针出现了不同程度的颜色变化,在外观上不符合标准;含有edta、精氨酸和葡聚糖的微针干扰素活性低于80%;含有海藻糖和蔗糖的微针具有良好外观、微针穿刺性和稳定性。实施例6、实施例7中使用了不同的微针基质材料和相同的稳定剂配方(海藻糖、蔗糖),各项测试结果良好且无明显差异,说明当微针的稳定剂中含有相同含量的海藻糖/蔗糖/二者组合时,对含有不同优选赋形剂的微针具有同等效果的稳定作用。
[0073]
表2
[0074][0075]
实施例8:人干扰素α1b的分层溶解微针
[0076]
本实施例提供一种人干扰素α1b的分层溶解微针,其制备方法如下:
[0077]
1、针尖溶液配制:
[0078]
实施例2、3中的活性结果表明,cmc和pva作为微针基质时可以起到稳定干扰素α1b的作用,故在制作分体针时将首选这两种材料作为针尖基质材料,在实际制作分层微针时,cmc的干燥速度比 pva快,更有利于稳定针尖的活性成分,故优选cmc作为针尖的基质材料。
[0079]
按照以下固含量比例配制微针针尖溶液:5%cmc、5%海藻糖、 5%蔗糖。称取cmc 0.05g,海藻糖0.05g,蔗糖0.05g,加入0.85ml pbs 溶液(0.01m,ph6.0)溶液,搅拌溶解后,0℃静置5min,离心除气泡,加入6mg/ml的人干扰素α1b原液0.084ml,涡旋震荡混匀后, 4℃离心除气泡,放置在4℃环境下静置待用。此时溶液中的干扰素α1b浓度为0.504mg/ml。
[0080]
2、基底溶液配制:
[0081]
pva可以配制更高的固含量,有助于起到支撑作用,增加微针的强度,提升穿刺性,故优选pva为基底材料。
[0082]
按照以下固含量比例配制微针基底溶液:20%pva、10%蔗糖。
[0083]
3、微针成型
[0084]
移液枪移取上述制备的微针针尖溶液20μl,滴加到微针模具单元上,pdms模具底部抽真空5min后,在超净台内吹风30min,使微针干燥,然后滴加微针基底溶液40μl,pdms模具底部抽真空 10min后,在超净台内吹风60min。贴背衬胶纸脱模,即为图3~4所示的载干扰素的分层溶解微针,整片含药量约为10.08μg。
[0085]
4、检测微针的各参数
[0086]
1)微针完整性:通过体式显微镜观察整片微针的形态,观察是否能够完整脱模,针尖形态是否完整。
[0087]
2)检测微针的穿刺性:使用猪幼崽耳部皮肤,裁取适量面积,将微针针尖平整朝
下,从微针背部进行20n的进针按压,持续摁压 10s,摁压完成后将微针从皮肤内取出,向施针部位皮肤滴加台盼蓝染色溶液,染色5min后将皮肤擦净,观察到整齐的着色针孔阵列即为具有穿刺性。
[0088]
3)针体颜色:同一日光灯光源下目视观察并记录。
[0089]
4)微针加速稳定性:将成型脱模后的一片微针封存于泡罩包装中,即为图7所示,在40℃/75%rh条件下放置3个月,进行高温高湿下的加速稳定性实验。实验期间第15天、1个月、2个月、3个月末分别取样一次,将成型脱模后的一片微针溶于相应无机盐溶液中,稀释成梯度浓度,参照实施例1中描述的细胞病变抑制法进行干扰素生物学活性测试。
[0090]
结果针形完整,有穿刺性,颜色透明,微针加速稳定性中,第 15天相对活性为93%,第1个月相对活性为91%,第2个月相对活性为89%,第3个月相对活性为85%。
[0091]
实施例9、对比例13~16:采用不同ph值的水溶液制得的分层溶解微针
[0092]
按照实施例8的制作方法和考察项目,按照表3中给出的物质重量百分比,制备对比例13~16的微针并考察其微针完整性、穿刺性、针体颜色和加速稳定性(见表3)。
[0093]
实施例9和对比例13~16采用了完全相同的针尖液、基底液材料,用不同ph的相同浓度的磷酸盐缓冲溶液做溶剂,制成的微针进行加速稳定性试验,从表3的稳定性结果分析,当缓冲体系在偏酸性环境下,均能保持干扰素α1b的活性,其中,当ph为6.0时高温稳定性最好,干扰素α1b的活性在40℃/75%rh的高温高湿条件下仍能保持在80%以上。
[0094]
表3
[0095]
[0096][0097]
实施例10~15:含有不同稳定剂的分层溶解微针
[0098]
按照实施例8的制作方法和考察项目,按照表4中给出的物质重量百分比,制备实施例10~15的微针并考察其微针完整性、穿刺性、针体颜色和加速稳定性(见表4)。
[0099]
根据实施例9、对比例13~16的稳定性结果,优选缓冲体系为 ph=6.0的0.01m磷酸盐缓冲体系进行针尖液和基底液的溶解。实施例10~15采用的针尖液主材料组分配比不变(cmc、海藻糖、蔗糖),加入不同含量的其余稳定剂(葡聚糖、精氨酸、edta),基底液的主材料(pva)及其比例保持不变选用不同的稳定剂(海藻糖、蔗糖),制成的微针进行加速稳定性试验,从表4的稳定性结果分析,固定缓冲体系和微针的成型辅料后,实施例之间的稳定性无明显差异,均对干扰素α1b有较好的稳定效果。
[0100]
表4
[0101][0102]
实施例16:人干扰素α1b的针尖涂层微针
[0103]
1、针尖溶液配制:
[0104]
按照以下固含量比例配制微针针尖溶液:20%pva、5%海藻糖、5%蔗糖。称取pva 0.2g,海藻糖0.05g,蔗糖0.05g,加入0.7ml pbs 溶液(0.01m,ph6.0)溶液,加热搅拌溶解后,0℃静置5min,离心除气泡,加入8mg/ml的人干扰素α1b原液3ml,涡旋震荡混匀后, 4℃离心除气泡,放置在4℃环境下静置待用。针尖液的最终成分为 5%pva、1.25%海藻糖、1.25%蔗糖、6mg/ml人干扰素α1b。
[0105]
2、一体式基座制备:
[0106]
取适量聚乳酸颗粒,放置于pdms微针模具上,模具下方抽真空并加热至200℃,聚乳酸颗粒融化变软后将其均匀铺平在模具的微针单元上,将模具联通聚乳酸一同冷却至室温,将聚乳酸微针脱模即得聚乳酸一体式基座。
[0107]
3、针尖液涂覆
[0108]
将针尖溶液平铺在200μm的载药池中,将聚乳酸一体式基座针尖朝下平整落入载
药池中再提起,即为完成了一次针尖载药过程,该过程可循环多次,直至达到目标载药量。该实施例中,载药循环次数为2次,载药量为10μg。将微针背部贴背衬胶纸,即为图5~6所示的载干扰素的针尖涂层微针。
[0109]
4、检测微针的各参数
[0110]
1)微针完整性:通过体式显微镜观察整片微针的形态,观察是否能够完整脱模,针尖形态是否完整。
[0111]
2)检测微针的穿刺性:使用猪幼崽耳部皮肤,裁取适量面积,将微针针尖平整朝下,从微针背部进行20n的进针按压,持续摁压 10s,摁压完成后将微针从皮肤内取出,向施针部位皮肤滴加台盼蓝染色溶液,染色5min后将皮肤擦净,观察到整齐的着色针孔阵列即为具有穿刺性。
[0112]
3)针体颜色:同一日光灯光源下目视观察并记录。
[0113]
4)微针长期稳定性:将成型脱模后的一片微针封存于泡罩包装中,即为图7所示,在25℃/60%rh的条件下放置9个月,进行常温常湿下的长期稳定性实验。实验期间第0月、3个月、6个月,9 个月分别取样一次,将一片涂层微针溶于相应无机盐溶液中,稀释成梯度浓度,参照实施例1中描述的细胞病变抑制法进行干扰素生物学活性测试。
[0114]
结果针形完整,有穿刺性,颜色透明,微针长期稳定性中,第0 月相对活性为94%,第3个月相对活性为90%,第6个月相对活性为88%,第9个月相对活性为85%。
[0115]
实施例17~18、对比例17~20:采用不同类型缓冲溶液制得的涂层微针
[0116]
按照实施例16的制作方法和考察项目,按照表5中给出的物质重量百分比,制备实施例17~18、对比例17~20的微针并考察其微针完整性、穿刺性、针体颜色和长期稳定性(见表5)。
[0117]
实施例17~18、对比例17~20采用了完全相同的针尖液材料,用相同ph的不同种类的缓冲溶液做溶剂,制成的微针进行长期稳定性试验,从表5的稳定性结果分析,当缓冲体系盐浓度为0.01m时,磷酸盐和醋酸盐缓冲体系的长期稳定性无显著性差异,都可以较好地稳定干扰素α1b的活性,其余对比例的配方稳定性稍弱。
[0118]
表5
[0119][0120][0121]
实施例19~24:含有不同稳定剂的涂层微针
[0122]
按照实施例16的制作方法和考察项目,按照表6中给出的物质重量百分比,制备实施例19~24的微针并考察其微针完整性、穿刺性、针体颜色和长期稳定性(见表6)。
[0123]
根据实施例19~24的长期稳定性结果,使用ph=6.0的不同的缓冲体系(0.01m磷酸盐缓冲体系、0.01m醋酸盐缓冲体系)进行针尖液的溶解。实施例采用的针尖液主材料分别为2.5%cmc和5%pva,加入不同含量的稳定剂(海藻糖、蔗糖、葡聚糖、精氨酸),制成的微针进行长期稳定性试验,从表6的稳定性结果分析,在存在海藻糖或蔗糖,基质材料为cmc或pva的情况下,实施例之间的长期稳定性无显著性差异,均对干扰素α1b有较好的稳定效果。
[0124]
表6
[0125][0126][0127]
实施例25~30:不同人干扰素的一体式微针
[0128]
按照实施例1的制作方法,按照表7中给出的物质重量百分比,制备实施例的微针并考察其微针完整性、穿刺性、针体颜色和长期稳定性(见表7)。
[0129]
从表7中可以看出,实施例25~30采用了相同的缓冲盐体系,赋形材料和稳定剂。相同处方材料、微针剂型和制作方法下,不同类型的干扰素制成微针后外观和穿刺性良好,干扰素活性在9个月内均不小于原活性的80%,说明筛选出的微针处方对不同类型干扰素均有长期活性稳定作用。其中实施例30中的新型集成干扰素(cn 1511849a,seq id no.4(mifn4)),是一种重组的、非自然存在的i型干扰素,与干扰素α与b具有86.7%的氨基酸序列同源性,与市售集成干扰素α具有98.2%的氨基酸序列同源性。
[0130]
表7
[0131][0132][0133]
实施例31:人干扰素α1b原液与溶解微针制剂抑制人乳头瘤病毒11 型(hpv11)复制的体外药效学比较
[0134]
取上述实施例1中的一体式溶解微针和实施例8中的分层溶解微针各1片,用浓度为10mm的磷酸盐缓冲液进行溶解,即得到微针制剂的干扰素工作液。取hacat[hpv11]细胞(cn111440772a)铺六孔板,每孔细胞数为5
×
105个,铺板2h待细胞贴壁后进行不同剂型 (原液与微针制剂)的人干扰素α1b干预,浓度梯度设置为0、 0.05μg/ml、0.5μg/ml。作用24h后,收集细胞提取基因组dna,qpcr 检测不同处理组hpv11的拷贝数。其中所述hacat[hpv11]细胞模型为环状hpv11全基因组感染的hacat细胞,可发生hpv11基因组的游离态扩增。
[0135]
结果(见图8)表明,在设定浓度范围内,hacat细胞dna量的log2对数与ct值间呈良好线性关系,r2为0.9972。待测样品上样量较佳地控制在20
‑
50ng时,ct值可落在上述标准曲线的线性范围内 (图8中a图)。在设定拷贝数范围内,hpv11拷贝数的log10对数与ct值之间线性良好,r2为0.9901(图8中b图)。图8中c图为根据标准曲线计算的经不同剂型、不同浓度人干扰素α1b干预后 hacat[hpv11]细胞中hpv11基因组的拷贝数变化。可见,人干扰素α
1b溶解微针制剂与原液体外抑制hpv11复制的能力相当。
[0136]
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1