一种氧化响应型纳米胶束及其制法与应用
1.本发明涉及分子医学纳米材料技术领域,特别涉及一种氧化响应型纳米胶束及其制法与应用。
背景技术:
2.随着纳米技术的进展,具有体积效应、表面效应、量子尺寸效应及宏观量子隧道效应的纳米粒子,已经广泛用于构建药物递送系统(dds)。由于肿瘤组织内的富血管及淋巴回流缺陷,肿瘤组织具有高通透滞留效应(erp),高分子纳米粒子能在肿瘤部分有效富集及延缓,小分子化疗药物自由通过正常组织肿瘤组织血管壁,纳米药物递送系统dds有利于实现高通透滞留效应erp,增加肿瘤组织的药物浓度,减少给药频率及全身毒副作用。光动力治疗pdt是一种通过近红外光照射激发光敏剂产生活性氧(ros),导致肿瘤坏死,由于其选择性高、毒副作用低已被广泛研究,但其不具备深部软组织穿透能力,限制了对深部肿瘤治疗的应用。声动力sdt作为一种新兴的治疗方法,是指在声敏剂下超声辐射后产生活性氧ros、空化效应及热效应,达到损伤组织和细胞的作用。超声作为一种机械波,有强大的深部组织穿透能力,弥补了光动力治疗pdt对深部肿瘤治疗的局限,并且仅对周围健康组织产生极小的损伤。
3.可控性刺激响应性药物递送系统dds硫缩酮键(thioketal,tk)是一种活性氧ros响应的化学键,能在活性氧ros刺激下断开,在目前活性氧ros响应相关的化学键中,硫缩酮键(thioketal,tk)在生物条件下具有稳定性,并且在活性氧ros刺激下能够高效裂解。通过硫缩酮键(thioketal,tk)偶联抗肿瘤药物,能在血液循环中维持纳米粒子结构稳定,减少药物泄漏,实现局部可控性药物释放。
技术实现要素:
4.本发明的目的在于,针对现有技术的上述不足,提供一种氧化响应型纳米胶束及其制法与应用,是由疏水性抗肿瘤药物阿霉素通过氧化响应的缩硫酮键与聚乙二醇单甲醚键合构建成的两亲性活性氧响应型纳米药物传递系统,纳米胶束在声动力作用下能产生大量的活性氧并刺激缩硫酮键断裂,使纳米胶束释放出抗肿瘤药物阿霉素作用于肿瘤组织,且减少对正常组织的伤害,实现了药物在肿瘤部位的有效富集及时空控制释放,具有有效的抗肿瘤作用。
5.本发明为达到上述目的所采用的技术方案是:
6.一种氧化响应型纳米胶束的制法,其包括如下步骤:
7.s1:将3
‑
巯基丙酸加入无水丙酮中在室温下搅拌反应一段时间,将产物结晶、冷冻、洗涤后,经冻干得到含缩硫酮键的二羧酸产物cooh
‑
tk
‑
cooh;
8.s2:将含缩硫酮键的二羧酸产物cooh
‑
tk
‑
cooh、二环己基碳二亚胺和4
‑
二甲氨基吡啶搅拌分散于有机溶剂中形成反应体系,将分散于有机溶剂中的聚乙二醇单甲醚逐滴加入反应体系中,之后依次在冰浴中、在室温下分别搅拌反应一段时间,再经过滤、沉降、抽滤
后,得到亲水性前体peg
‑
tk
‑
cooh;
9.s3:将亲水性前体peg
‑
tk
‑
cooh与疏水性药物分子采用缩合反应制备得到两亲性活性氧响应型共轭物;
10.s4:将两亲性活性氧响应型共轭物分散于有机溶剂中,经过透析得到氧化响应型纳米胶束。
11.作为具体实施方案的优选方案之一,所述的步骤s1中搅拌反应在干燥氯化氢气体中进行反应4
‑
6小时;冷冻温度为
‑
20
‑‑
60℃;洗涤采用正己烷、去离子水依次洗涤;所述的含缩硫酮键的二羧酸产物cooh
‑
tk
‑
cooh为白色粉末;
12.优选地,所述的3
‑
巯基丙酸与无水丙酮的重量比为5.2
‑
6.2g:5.8
‑
6.8g。
13.作为具体实施方案的优选方案之一,所述的步骤s2中分散搅拌在氮气氛围下进行;所述的有机溶剂为无水二氯甲烷;所述的冰浴中的时间为3
‑
5小时;所述的在室温下的时间为24
‑
36小时;所述的沉降采用乙醚沉降;所述的亲水性前体peg
‑
tk
‑
cooh为白色固体;
14.优选地,所述的含缩硫酮键的二羧酸产物cooh
‑
tk
‑
cooh、二环己基碳二亚胺、4
‑
二甲氨基吡啶、无水二氯甲烷的用量比为
15.252.1
‑
300mg:61.8
‑
100mg:61.1
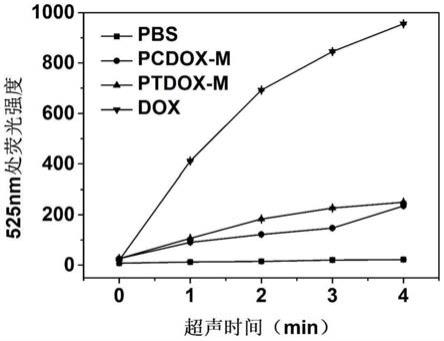
‑
100mg:10
‑
15ml;
16.优选地,所述的聚乙二醇单甲醚mpeg
2000
(mpeg
2000
即聚乙二醇单甲醚)与无水二氯甲烷的用量比为1
‑
2g:10
‑
20ml。
17.作为具体实施方案的优选方案之一,所述步骤s3中缩合反应步骤为:s11:将疏水性药物分子分散于有机溶剂中,加入无水三乙胺,避光搅拌一段时间,备用;
18.s12:将亲水性前体peg
‑
tk
‑
cooh、二环己基碳二亚胺,4
‑
二甲氨基吡啶分散于有机溶剂中,在氮气氛围下搅拌反应一段时间,经过滤去除沉淀,得到初产物;
19.s13:将步骤s11加入步骤s12初产物中,搅拌反应一段时间后,经沉降、抽滤得到两亲性活性氧响应型共轭物。
20.作为具体实施方案的优选方案之一,所述的步骤s3中疏水性药物分子为疏水性抗肿瘤药物分子,优选为阿霉素dox或盐酸阿霉素dox
·
hcl;
21.优选地,所述的两亲性活性氧响应型共轭物为红色固体。
22.作为具体实施方案的优选方案之一,所述的步骤s11和步骤s12中有机溶剂为无水二甲基甲酰胺;
23.优选地,步骤s11中疏水性药物分子、有机溶剂、无水三乙胺的用量比为60
‑
90mg:10
‑
15ml:15
‑
25ul;避光搅拌时间为12
‑
24小时;
24.优选地,步骤s12中亲水性前体peg
‑
tk
‑
cooh、二环己基碳二亚胺、4
‑
二甲氨基吡啶、有机溶剂的用量比为130.7
‑
150mg:20.6
‑
25mg:3.7
‑
5mg:10
‑
15ml;搅拌反应时间为4
‑
6小时;
25.优选地,步骤s13中搅拌反应时间为24
‑
36小时;沉降采用乙醚沉降。
26.作为具体实施方案的优选方案之一,所述的步骤s4中两亲性活性氧响应型共轭物与有机溶剂的用量比为20
‑
25mg:5
‑
10ml;
27.优选地,所述有机溶剂为无水二甲基甲酰胺;
28.优选地,所述透析在透析袋中透析时间为48
‑
72小时,透析袋的截留分子量为3500da,透析液为去离子水。
29.本发明还提供一种采用上述氧化响应型纳米胶束的制法制备得到的纳米胶束,该纳米胶束是由疏水性抗肿瘤药物阿霉素通过氧化响应的缩硫酮键与聚乙二醇单甲醚键合构建成的两亲性活性氧响应型纳米药物传递系统,该纳米胶束的粒径为32.12nm。
30.优选地,该纳米胶束为两亲性活性氧响应共轭物且一端为亲水片段分子结构、另一端为疏水性抗肿瘤药物分子结构,纳米胶束内活性氧响应基团为对羟基自由基、单线态氧或活性氧敏感的化合物之一,活性氧敏感的化合物为缩硫酮基团。
31.本发明还提供一种上述方法所得的氧化响应型纳米胶束的应用,该氧化响应型纳米胶束内的氧化相应基团缩硫酮键在氧化响应刺激下可发生断裂并释放药物,可负载抗肿瘤药物阿霉素用于癌症化疗或声动力治疗中。
32.与现有技术相比,本发明具有以下有益效果:
33.1、本发明的纳米胶束通过活性氧ros响应的硫缩酮键(thioketal,tk),将疏水的抗肿瘤药物dox与亲水peg片段相连,构建两亲性活性氧ros响应型纳米药物传递系统,得到两亲性的载药纳米粒子,而疏水的抗肿瘤药物阿霉素dox作为一种声敏剂,在声动力sdt作用下能产生大量的活性氧ros,在活性氧ros刺激下tk键断裂,释放出抗肿瘤药物阿霉素dox作用于肿瘤细胞的细胞核dna,实现了声动力sdt与化疗的联合治疗,实现了药物在肿瘤部位的有效富集及时空控制释放,不仅具有有效的抗肿瘤作用,而且大大减少了对周围健康组织的损害。
34.2、本发明的活性氧响应型纳米胶束,借助于肿瘤的高通透滞留效应erp作用,可有效的在特定肿瘤部位富集,延长在肿瘤部位的停留时间,肿瘤组织在外界超声辐射下,通过声动力产生大量的活性氧ros,不仅有直接损伤肿瘤细胞的作用,同时能够断开活性氧ros响应性基团硫缩酮键释放抗肿瘤药物,具有高度的时空控制释药效果。
附图说明
35.图1是peg
‑
tk
‑
dox的合成路线及核磁氢谱图;
36.图2是制备的纳米胶束的透射电子显微镜图;
37.图3是制备的纳米胶束的粒径分布图;
38.图4是制备的纳米胶束在超声条件下ros的产生效果;
39.图5是制备的纳米胶束在超声条件下药物释放图;
40.图6是不同组4t1细胞产生ros结果的共聚焦图;
41.图7是制备的纳米胶束在超声条件下对4t1细胞的毒性作用;
42.图8是制备的纳米胶束肿瘤相对生长曲线图;
43.图9是制备的纳米胶束荷瘤小鼠相对体重变化曲线。
具体实施方式:
44.为了使本发明的目的和技术方案及优点更加清楚明白,以下结合实施例作详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
45.实施例1:在本发明的具体实施方式中,本实施例提供的一种氧化响应型纳米胶束的制法,包括以下步骤:
46.1)将3
‑
巯基丙酸(5.2g,49.1mmol)加入无水丙酮(5.8g,98.2mmol)中,在干燥氯化
氢气体中反应,室温下搅拌反应4h后,将产物结晶放入
‑
20℃冷冻,冷冻后用正己烷和超纯水依次洗涤,之后经冻干得到含硫缩酮tk键的二羧酸白色粉末cooh
‑
tk
‑
cooh。
47.2)在氮气下,将cooh
‑
tk
‑
cooh(252.1mg,1mmol)及二环己基碳二亚胺(61.8mg,0.3mmol)、4
‑
二甲氨基吡啶(61.1mg,0.5mol)分散于的10ml无水二氯甲烷(dcm)中,得到反应体系;将聚乙二醇单甲醚mpeg
2000
(1g,0.5mmol)分散于10ml无水无水二氯甲烷(dcm)中,之后逐滴加入上述反应体系中,在冰浴中搅拌反应3h后再在室温下反应24h,经过滤除去沉淀、用乙醚沉降之后抽滤,得到白色固体(peg
‑
tk
‑
cooh)。
48.3)将盐酸阿霉素(60mg,0.1mmol)分散于5ml无水二甲基甲酰胺(dmf)中,加入15ul无水三乙胺,避光搅拌12h,得到反应体系;之后将二环己基碳二亚胺(20.6mg,0.1mmol)、4
‑
二甲氨基吡啶(3.7mg,0.03mmol)、peg
‑
tk
‑
cooh(130.7mg,0.06mmol)分散于10ml无水二甲基甲酰胺(dmf)中,在氮气下搅拌反应4
‑
6h后过滤除去白色沉淀,得到初产物。将上述反应体系加入初产物中,搅拌反应24h后,用乙醚沉降,抽滤得到两亲性活性氧响应型共轭物即红色固体(peg
‑
tk
‑
dox)。参见图1,利用核磁氢谱(1h nmr)对两亲性活性氧响应型共轭物进行鉴定,在1.59ppm出现硫缩酮tk特征峰,表明合成了具有硫缩酮键的两亲性活性氧ros响应型纳米药物传递系统peg
‑
tk
‑
dox。
49.4)将分别称取20mg两亲性活性氧响应型共轭物peg
‑
tk
‑
dox分散于5ml的无水二甲基甲酰胺(dmf)中,将溶液放入截留分子量为3500da的透析袋中,在去离子水中透析48h,每隔4h换一次水,得到氧化响应型纳米胶束ptdox
‑
m。
50.本实施例还提供采用上述氧化响应型纳米胶束的制法制备得到的纳米胶束,该纳米胶束是由疏水性抗肿瘤药物阿霉素通过氧化响应的缩硫酮键与聚乙二醇单甲醚键合构建成的两亲性活性氧响应型纳米药物传递系统,该纳米胶束的粒径为32.12nm。该纳米胶束为两亲性活性氧响应共轭物且一端为亲水片段分子结构、另一端为疏水性抗肿瘤药物分子结构,纳米胶束内活性氧响应基团为对羟基自由基、单线态氧或活性氧敏感的化合物之一,活性氧敏感的化合物为缩硫酮基团。
51.采用上述方法所得的氧化响应型纳米胶束内的氧化相应基团缩硫酮键在氧化响应刺激下可发生断裂并释放药物,可负载抗肿瘤药物阿霉素用于癌症化疗或声动力治疗中。
52.实施例2:本实施例提供的一种氧化响应型纳米胶束的制法及纳米胶束与应用,与实施例1基本相同,不同之处在于:
53.在步骤1)中,搅拌反应在干燥氯化氢气体中进行反应6小时;冷冻温度为
‑
60℃;3
‑
巯基丙酸与无水丙酮的重量比为6.2g:6.8g。
54.在步骤2)中,在冰浴中搅拌反应的时间为4小时;在室温下的反应时间为24小时;含缩硫酮键的二羧酸产物cooh
‑
tk
‑
cooh、二环己基碳二亚胺、4
‑
二甲氨基吡啶、无水二氯甲烷的用量比为260mg:68mg:66mg:1ml;聚乙二醇单甲醚mpeg
200
与无水二氯甲烷的用量比为1.2g:11ml。
55.在步骤3)中,疏水性药物分子(盐酸阿霉素)、有机溶剂、无水三乙胺的用量比为70mg:12ml:18ul;避光搅拌时间为14小时;亲水性前体peg
‑
tk
‑
cooh、二环己基碳二亚胺、4
‑
二甲氨基吡啶、有机溶剂的用量比为140mg:22mg:4mg:12ml;在氮气下搅拌反应6h后过滤除去白色沉淀,得到初产物。
56.在步骤4)中,两亲性活性氧响应型共轭物peg
‑
tk
‑
dox与有机溶剂的用量比为25mg:10ml;透析在透析袋中透析时间为72小时。
57.实施例3:本实施例提供的一种氧化响应型纳米胶束的制法及纳米胶束与应用,与实施例1基本相同,不同之处在于:
58.在步骤1)中,搅拌反应在干燥氯化氢气体中进行反应5小时;冷冻温度为
‑
50℃;3
‑
巯基丙酸与无水丙酮的重量比为5.8g:6.1g。
59.在步骤2)中,在冰浴中搅拌反应的时间为4小时;在室温下的反应时间为36小时;含缩硫酮键的二羧酸产物cooh
‑
tk
‑
cooh、二环己基碳二亚胺、4
‑
二甲氨基吡啶、无水二氯甲烷的用量比为295mg:90mg:70mg:14ml;聚乙二醇单甲醚mpeg
200
与无水二氯甲烷的用量比为1.5g:16ml。
60.在步骤3)中,疏水性药物分子(盐酸阿霉素)、有机溶剂、无水三乙胺的用量比为80mg:13ml:19ul;避光搅拌时间为12小时;亲水性前体peg
‑
tk
‑
cooh、二环己基碳二亚胺、4
‑
二甲氨基吡啶、有机溶剂的用量比为140mg:22mg:3.8mg:12ml;在氮气下搅拌反应4h后过滤除去白色沉淀,得到初产物。
61.在步骤4)中,两亲性活性氧响应型共轭物peg
‑
tk
‑
dox与有机溶剂的用量比为23mg:7ml;透析在透析袋中透析时间为70小时。
62.实施例4:本实施例提供的一种氧化响应型纳米胶束的制法及纳米胶束与应用,与实施例1基本相同,不同之处在于:
63.在步骤1)中,搅拌反应在干燥氯化氢气体中进行反应6小时;冷冻温度为
‑
40℃;3
‑
巯基丙酸与无水丙酮的重量比为5.5g:6g。
64.在步骤2)中,在冰浴中搅拌反应的时间为5小时;在室温下的反应时间为30小时;含缩硫酮键的二羧酸产物cooh
‑
tk
‑
cooh、二环己基碳二亚胺、4
‑
二甲氨基吡啶、无水二氯甲烷的用量比为300mg:100mg:80mg:13ml;聚乙二醇单甲醚mpeg2000与无水二氯甲烷的用量比为1.7g:18ml。
65.在步骤3)中,疏水性药物分子(盐酸阿霉素)、有机溶剂、无水三乙胺的用量比为85mg:15ml:25ul;避光搅拌时间为24小时;亲水性前体peg
‑
tk
‑
cooh、二环己基碳二亚胺、4
‑
二甲氨基吡啶、有机溶剂的用量比为150mg:25mg:4mg:14ml;在氮气下搅拌反应5h后过滤除去白色沉淀,得到初产物。
66.在步骤4)中,两亲性活性氧响应型共轭物peg
‑
tk
‑
dox与有机溶剂的用量比为23mg:8ml;透析在透析袋中透析时间为55小时。
67.实施例5:本实施例提供的一种氧化响应型纳米胶束的制法及纳米胶束与应用,与实施例1基本相同,不同之处在于:
68.在步骤1)中,搅拌反应在干燥氯化氢气体中进行反应4小时;冷冻温度为
‑
20℃;3
‑
巯基丙酸与无水丙酮的重量比为5.6g:6.1g。
69.在步骤2)中,在冰浴中搅拌反应的时间为4小时;在室温下的反应时间为28小时;含缩硫酮键的二羧酸产物cooh
‑
tk
‑
cooh、二环己基碳二亚胺、4
‑
二甲氨基吡啶、无水二氯甲烷的用量比为260mg:65mg:68mg:13ml;聚乙二醇单甲醚mpeg2000与无水二氯甲烷的用量比为1.2g:13ml。
70.在步骤3)中,疏水性药物分子(盐酸阿霉素)、有机溶剂、无水三乙胺的用量比为
70mg:11ml:17ul;避光搅拌时间为20小时;亲水性前体peg
‑
tk
‑
cooh、二环己基碳二亚胺、4
‑
二甲氨基吡啶、有机溶剂的用量比为145mg:23mg:5mg:15ml;在氮气下搅拌反应5h后过滤除去白色沉淀,得到初产物。
71.在步骤4)中,两亲性活性氧响应型共轭物peg
‑
tk
‑
dox与有机溶剂的用量比为20mg:5ml;透析在透析袋中透析时间为50小时。
72.对比实例1:合成不具备活性氧ros响应的载药纳米胶束pcdox
‑
m,该纳米胶束利用c
‑
c键将亲水peg片段与dox偶联。利用激光粒度仪及透射电子显微镜对纳米胶束的粒径和形貌进行表征,参见图2和图3所示,载药纳米胶束ptdox
‑
m及载药纳米胶束pcdox
‑
m胶束呈圆球形,分散均匀,水合粒径约30
‑
40nm,与tem结果相符合,证明这两种纳米胶束均合成成功并且在粒径、形态没有显著差异。
73.对比实例2:使用2',7'
‑
二氯荧光素二乙酸dcfh
‑
da荧光探针检测超声辐射后活性氧ros的产生,配置pcdox
‑
m、ptdox
‑
m及dox(dox的浓度为1ug/ml)的水溶液2880ul,在各溶液中加入120ul的预处理后2',7'
‑
二氯荧光素二乙酸dcfh,置于超声辐射不同时间(1hz,2w
·
cm
‑
2,100%占空比),放置2h后,使用荧光分度计测量超声不同时间特定波长的荧光强度(λex=488nm,λem=525nm),参见图4所示,磷酸盐缓冲溶液pbs在超声后525nm处的荧光强度不产生荧光强度的变化,但dox、ptdox
‑
m及pcdox
‑
m在525nm处的荧光强度随着超声时间的延长而增加,结果表明在超声辐射下dox作为声敏剂可以产生活性氧ros,即纳米胶束在超声条件下活性氧ros产生效果。
74.对比实例3:将2ml的ptdox
‑
m溶液加入截留分子量为3500da透析袋中,将透析袋两端扎紧,对透析袋中的ptdox
‑
m在超声(1hz,2w
·
cm
‑
2,100%占空比)下辐射不同时间,将透析袋放入装有10ml磷酸盐缓冲溶液pbs(ph=7.4)中的离心管中,在37℃恒温水浴中缓慢振荡,在预设时间点,取出3ml磷酸盐缓冲溶液pbs溶液,并加入3ml新鲜pbs溶液,用荧光光谱仪检测取出的3ml磷酸盐缓冲溶液pbs溶液中dox含量(λex=488nm,λem=590nm)。参见图5所示,ptdox
‑
m在未超声时,几乎没有活性氧dox的释放,随着超声时间的增加,活性氧dox的释放增加,超声5min后,48h的累积释药率达到了43%,但是超声辐射前后pcdox
‑
m并未检测到阿霉素dox的差异性释放。这说明由于超声产生的活性氧ros使ptdox
‑
m的tk键断裂后,ptdox
‑
mdox从胶束中释放的效果,即纳米胶束超声条件下释放阿霉素dox。
75.对比实例4:将4t1细胞以1
×
104的密度接种于共聚焦皿中,培养箱内培养12h后,分别加入pbs,dox,pcdox
‑
m,ptdox
‑
m(dox浓度为2ug/ml)培养8h,吸出培养基,用磷酸盐缓冲溶液pbs洗涤三遍除去未被细胞摄取的药物。将共聚焦皿置于超声波下辐射3min(1hz,2w
·
cm
‑
2,50%占空比),加入2',7'
‑
二氯荧光素二乙酸酯dcfh
‑
da后染色20min,多聚甲醛固定后,用hoechst33258染色15min,置于共聚焦显微镜下观察,2',7'
‑
二氯荧光素二乙酸酯dcfh
‑
da的激发波长为488nm,发射波长为525nm;hoechst 33258的激发波长为405nm,发射波长为447nm。参见图7所示,磷酸盐缓冲溶液pbs在超声条件下仅产生微弱的绿色荧光,而在ptdox
‑
m组超声辐射下,绿色荧光强度明显增加,结果证明在细胞水平,超声辐射下ptdox
‑
m能产生活性氧ros,即纳米胶束在细胞内产生活性氧ros。
76.对比实例5:将4t1细胞以5
×
103个/孔的细胞密度接种于96孔板内,置于37℃,5%co2的培养箱内培养12h,将不同浓度的dox,ptdox
‑
m及pcdox
‑
m与4t1细胞共培养24h后,用pbs洗去未吸收的材料,加入新的培养基后,培养箱内培养24h,加入噻唑兰mtt后共培养4h,
吸尽mtt后,再加入150ul的二甲亚砜dmso,充分振荡10min后,用酶标仪测量各孔在570nm处的吸光值。将4t1细胞以5
×
103个/孔的细胞密度接种于96孔板内,置于37℃,5%co2的培养箱内培养12h。将不同浓度的dox,pcdox
‑
m及ptdox
‑
m与4t1细胞共培养8h后,超声辐射3min(1hz,2w
·
cm
‑
2,50%占空比),再置于培养箱培养16h。后用磷酸盐缓冲溶液pbs洗去未吸收的材料,加入新的培养基,培养箱内培养24h,加入mtt后共培养4h,吸尽mtt后,再加入150ul的dmso,充分振荡10min后,用酶标仪测量各孔在570nm处的吸光值。参见图6所示,ptdox
‑
m在未超声时,细胞存活率在90%以上。在超声辐射后,dox最高浓度(2ug/ml)的细胞存活率仅为16.4%,但是仅超声辐射组的细胞存活率在90%以上。结果表明,超声并不对细胞产生毒性作用,然而ptdox
‑
m在超声前,对4t1细胞毒性作用低,具有一定的安全性,超声后,细胞毒性明显增强,这是由于超声产生的ros与tk断裂后释放的dox对细胞的双重损伤作用所致。
77.对比实例6:小鼠乳腺癌肿瘤模型构建后,待肿瘤体积约80
‑
100mm3时。将小鼠随机分为7组进行治疗:(1)pbs+us组;(2)free dox组;(3)free dox+us组;(4)ptdox
‑
m组;(5)ptdox
‑
m+us组。尾静脉注射药物(dox:6.5mg/kg),注射后4h进行超声处理(1hz,2w
·
cm
‑
2,50%占空比)5min。每隔3天进行给药及超声处理,共3次。治疗期间每隔2天用游标卡尺对肿瘤体积进行测量。治疗结束后对各组的小鼠的肿瘤相对体积及相对体重进行评价。参见图8和图9所示,相对于其他的对照组,ptdox
‑
m+us组的肿瘤抑制作用最强,肿瘤抑制率达到86.2%。但各组荷瘤小鼠相对体重没有差异。结果说明,ptdox
‑
m联合sdt治疗具有高效的抗肿瘤作用,并且具有较小的副作用。
78.根据上述说明书的揭示和教导,本发明所属领域的技术人员还可以对上述实施方式进行变更和修改。因此,本发明并不局限于上面揭示和描述的具体实施方式,对发明的一些修改和变更也应当落入本发明的权利要求的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1