脐血干细胞分泌物在促进子宫内膜细胞生长中的应用
1.本发明属于生物医药技术领域,尤其涉及脐血干细胞分泌物在促进子宫内膜细胞生长中的应用。
背景技术:
2.随着生活水平的不断提高,人口老龄化已经成为全世界国家所共同面临的问题,要想有效的减缓和解决人口老龄化问题,提高生育率是必然的选择。目前,我们国家已经开放了三胎政策,但是研究显示,我们国家每6对夫妻中就存在一对不孕不育的夫妻。因此,有效的解决不孕不育,将有效的提高生育率。
3.子宫是重要的生殖器官,其可分为3层,由内向外依次是内膜层、肌层和浆膜层。子宫内膜主要由子宫内膜上皮细胞、子宫内膜基质细胞,血管和腺体组成。研究显示,当子宫内膜的厚度越薄,着床率和妊娠率越低,女性流产的风险也越高。因此,有效的提高子宫内膜的厚度将有助于提高生育率。子宫内膜基质细胞是内的主要组成成分,其增殖在胚胎植入与妊娠建立中起着关键的作用。
技术实现要素:
4.本发明的目的在于提供脐血干细胞分泌物在促进子宫内膜细胞生长中的应用。
5.为了实现上述目的,本发明提供了脐血间充质干细胞的分泌物在制备子宫内膜细胞增殖促进剂中的应用,所述脐血间充质干细胞为转染ac100830.3
‑
sirna的脐血间充质干细胞。
6.优选地,所述ac100830.3的序列如seq id no.1所示,所述ac100830.3
‑
sirna的序列如seq id no.2和seq id no.3所示。
7.其次,本发明提供了脐血间充质干细胞的分泌物在制备子宫内膜细胞迁移促进剂中的应用,所述脐血间充质干细胞为转染ac100830.3
‑
sirna的脐血间充质干细胞。
8.优选地,所述ac100830.3的序列如seq id no.1所示,所述ac100830.3
‑
sirna的序列如seq id no.2和seq id no.3所示。
9.其次,本发明提供了ac100830.3
‑
sirna在促进脐血间充质干细胞的分泌物对子宫内膜细胞增殖促进作用中的应用,其特征在于,所述ac100830.3的序列如seq id no.1,所述ac100830.3
‑
sirna的序列如seq id no.2和seq id no.3所示。
10.优选地,所述应用包括ac100830.3
‑
sirna在促进脐血间充质干细胞的分泌物对子宫内膜细胞周期蛋白促进作用中的应用。
11.最后,本发明提供了ac100830.3
‑
sirna在促进脐血间充质干细胞的分泌物对子宫内膜细胞迁移促进作用中的应用,其特征在于,所述ac100830.3的序列如seq id no.1,所述ac100830.3
‑
sirna的序列如seq id no.2和seq id no.3所示。本发明的有益效果是:本发明提供了转染ac100830.3
‑
sirna的脐血间充质干细胞的分泌物在促进子宫
内膜细胞增殖和子宫内膜细胞迁移中的应用。从而可将转染ac100830.3
‑
sirna的脐血间充质干细胞的分泌物用于制备促进子宫内膜细胞增殖和迁移的药物,并为进一步制备治疗不孕不育的药物提供了基础。
附图说明
12.图1 ac100830.3
‑
sirna对于脐血间充质干细胞中ac100830.3的抑制效果,p <0.05,差异显著;图2转染ac100830.3
‑
sirna的脐血间充质干细胞的分泌物对于子宫内膜基质细胞的增殖的影响,p <0.05,差异显著;图3转染ac100830.3
‑
sirna的脐血间充质干细胞的分泌物对于子宫内膜基质细胞的细胞周期蛋白cyclin
‑
d1和cdk1的影响;图4转染ac100830.3
‑
sirna的脐血间充质干细胞的分泌物对于子宫内膜基质细胞的迁移的影响,p <0.05,差异显著。
具体实施方式
13.为能清楚说明本方案的技术特点,下面通过具体实施方式,对本方案进行阐述。
14.实施例1(1)在无菌环境下,将获得的子宫内膜样本放入到加入双抗的冰冷hank’s液中洗涤3次;(2)将组织置于冰上,使用眼科剪将组织剪碎为1mm
×
1mm
×
1mm大小的组织块;(3)将组织块转移至三角瓶中,加入适量的0.2%胶原蛋白酶,置于37℃孵育1h;(4)加入15u/ml dnasei继续消化30min,消化结束后,将得到的细胞悬液使用50目筛网进行过滤;(5)之后使用200目和400目筛网进行过滤,(6)子宫内膜基质细胞获取:收集滤液,900r/min离心5min,收集细胞,使用台酚蓝进行染色计数,按照2.5
×
105个/ml的密度进行接种,2h后,吸除培养基,加入新的培养基,得到子宫内膜基质细胞。
15.实施例2(1)采集健康剖宫产妇的脐血,使用1:1的pbs将其稀释混匀;(2)在离心管中倒入等体积的percoll液,混匀后,将离心管放置在离心机中,2000rpm/min离心20min;(3)离心结束之后,小心的吸取中间的絮状的白膜单核细胞层,使用pbs将细胞进行重悬;(4)再次将离心管放置在离心机中,1000rpm/min离心10min,收集离心管管底的细胞;(5)加入含10%的胎牛血清,0.1%青霉素和链霉素双抗的dmem/f12培养基重悬细胞;(6)再次使用dmem/f12培养基离心清洗细胞2次后,对细胞进行计数,并将细胞的密度调整为1
×
106/ml并将细胞接种于细胞培养皿中,加入培养基进行培养,即得脐血间充
质干细胞。
16.实施例3转基因改良脐血间充质干细胞(1)将脐血间充质干细胞接种于细胞培养板中,一组细胞转染nc
‑
sirna,另一组细胞接种ac100830.3
‑
sirna(ac100830.3基因的序列如seq id no.1所示),ac100830.3
‑
sirna的序列如下所示:正义链:uuucuugucuuuguauauc,seq id no.2;反义链:gauauacaaagacaagaaa,seq id n0.3;(2)参照lipofectamin2000说明书,将nc
‑
sirna和ac100830.3
‑
sirna分别转染如脐血间充质干细胞中,继续培养48h后,提取rna;(3)参照takara反转录试剂盒说明书,将得到的rna反转录为cdna;(4)参照takara荧光定量pcr试剂盒说明书,检测转染后细胞中基因ac100830.3的表达量,反应引物如下:gapdh上游引物(5'
‑
>3'):aatgggcagccgttaggaaa,seq id no.4;gapdh下游引物(5'
‑
>3'):gcgcccaatacgaccaaatc,seq id no.5;ac100830.3上游引物(5'
‑
>3'):gactgacttccctgggatgc,seq id no.6;ac100830.3下游引物(5'
‑
>3'):gcagtggtgtgatctcagct,seq id no.7;(5)采用2
‑
δδct
法计算ac100830.3基因的相对表达量。
17.得到的实验结果如图1所示,a代表转染nc
‑
sirna的细胞,b代表转染ac100830.3
‑
sirna的细胞,其中,b中ac100830.3的相对表达量为0.142
±
0.293,说明转染ac100830.3
‑
sirna后可以有效的抑制ac100830.3的表达量。
18.实施例3转染ac100830.3
‑
sirna的脐血间充质干细胞的分泌物对于子宫内膜基质细胞的增殖的影响(1)将脐血间充质干细胞接种于细胞培养板中,分别转染nc
‑
sirna和ac100830.3
‑
sirna,使用无血清培养基培养48h后收集培养基,分别命名为培养基a和培养基b;(2)将子宫内膜基质细胞接种于96孔细胞培养板中,每孔5000个细胞,细胞贴壁之后a组细胞添加100ul含有10%fbs的培养基a,b组细胞添加100ul含有10%fbs的培养基b,分别与培养48h后,使用cck
‑
8检测od值。
19.得到的实验结果如图2所示,a代表使用a培养基培养的子宫内膜基质细胞,b代表使用b培养基培养的子宫内膜基质细胞。其中,a组的od值为0.554
±
0.060,b组的od值为0.768
±
0.054,二者之间的差异具有统计学意义。因此,可以得出转染ac100830.3
‑
sirna的脐血间充质干细胞的分泌物对于子宫内膜基质细胞增殖具有促进作用。
20.实施例4转染ac100830.3
‑
sirna的脐血间充质干细胞的分泌物对于子宫内膜基质细胞周期蛋白的影响(1)将脐血间充质干细胞接种于细胞培养板中,分别转染nc
‑
sirna和ac100830.3
‑
sirna,使用无血清培养基培养48h后收集培养基,分别命名为培养基a和培养基b;(2)将子宫内膜基质细胞接种于6孔板中,使用完全培养基进行培养,至细胞密度
70%时,a组更换为培养基a,b组更换为培养基b,置于细胞培养箱中继续培养48h;(3)培养结束后,使用pbs洗涤3次,加入100ul含有蛋白酶抑制剂和磷酸酶抑制剂的蛋白裂解液,4℃,裂解30min;(4)将细胞裂解液转入到1.5ml ep管中,放入4℃预冷离心机中,12000rom离心10min;(5)离心结束后,取上清至新的离心管中,使用bca法测定蛋白浓度,
‑
20℃保存备用;(6)先配置适当浓度的分离胶,室温30分钟后分离胶凝固后,配置浓缩胶,待胶凝固后使用;(7)在蛋白样品中加入loading buffer,95℃煮变性5min;(8)上样之后,倒入sds
‑
page电泳缓冲液进行电泳,电压设定为80v,约30min后,调节电压为120v至电泳结束;(9)待溴酚蓝跑出时终止电泳,制作“三明治”转膜夹,冰水浴环境中300ma恒流转膜90min;(10)将膜取出,放入到抗体孵育盒中,加入5%的脱脂牛奶室温封闭1h;(11)使用2%bsa按照相应的比例稀释cyclin
‑
d1,cdk1,β
‑
actin一抗,4℃孵育过夜;(12)使用1
×
tbst缓冲液洗膜3次,共30min,加入相应的二抗,摇床孵育1h后,移除二抗,使用1
×
tbst洗膜3次后,进行显影。
21.实验得到的结果如图3所示,a代表使用a培养基培养的子宫内膜基质细胞,b代表使用b培养基培养的子宫内膜基质细胞。可以看出,b组的cyclin
‑
d1和cdk1的表达量明显高于a组,可以得出转染ac100830.3
‑
sirna的脐血间充质干细胞的分泌物对于子宫内膜基质细胞周期蛋白cyclin
‑
1和cdk1表达具有促进作用。
22.实施例5转染ac100830.3
‑
sirna的脐血间充质干细胞的分泌物对于子宫内膜基质细胞迁移的影响(1)将脐血间充质干细胞接种于细胞培养板中,分别转染nc
‑
sirna和ac100830.3
‑
sirna,使用无血清培养基培养48h后收集培养基,分别命名为培养基a和培养基b;(2)将transwell小室置于24孔细胞培养板中,将子宫内膜基质细胞消化,并使用无血清培养基制成单细胞悬液;(3)将1
×
105的200ul子宫内膜基质细胞接种于transwell小室的上室中;(4)在a组transwell小室的下室中加入培养基a,在b组transwll小室的下室中加入培养基b;(5)将细胞培养板置于细胞培养箱中,继续培养48h,使用pbs轻轻的清洗transwell小室,并且使用棉签将滤膜上室面的细胞擦去;(6)加入固定液处理20min,吸去固定液,加入giemsa染色液进行染色,室温下染色20min;(7)染色结束后,使用pbs清洗小室,吸干pbs后,置于显微镜下进行拍照。
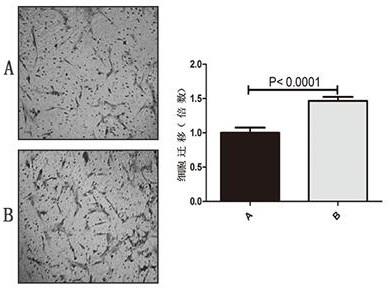
23.实验得到的结果如图3所示,a代表使用a培养基培养的子宫内膜基质细胞,b代表
使用b培养基培养的子宫内膜基质细胞。可以看出b组穿过transwell小室的细胞显著多于a组,可以得出转染ac100830.3
‑
sirna的脐血间充质干细胞的分泌物对于子宫内膜基质细胞迁移具有促进作用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1