一种肿瘤光热-光动力联合治疗纳米药物及其制备方法和应用
一种肿瘤光热
‑
光动力联合治疗纳米药物及其制备方法和应用
技术领域
1.本发明属于生物医药技术领域,具体涉及一种肿瘤光热
‑
光动力联合治疗纳米药物及其制备方法和应用。
背景技术:
2.2019年,han课题组首次将a
‑
d
‑
a型有机共轭小分子itic应用于肿瘤光热治疗当中,至此此类小分子光敏剂在肿瘤光线治疗领域中的应用得到了越来越多的关注。该类分子结构多变,具有宽而强的近红外吸收,分子中含有可以自由转动的柔性侧链能够提高分子光热转化效率,近两年的研究也表面该类分子能够同时产生两种高活性氧物种(1o2和
.
oh),可以避免肿瘤细胞缺氧微环境对光动力治疗的影响(参考文献:x.li,l.liu,s.li,y.wan,j.
‑
x.chen,s.tian,z.huang,y.
‑
f.xiao,x.cui,c.xiang,q.tan,x.
‑
h.zhang,w.guo,x.
‑
j.liang and c.
‑
s.lee,acs nano,2019,13,12901;l.li,c.shao,t.liu,z.chao,h.chen,f.xiao,h.he,z.wei,y.zhu,h.wang,x.zhang,y.wen,b.yang,f.he and l.tian,adv.mater.,2020,32,2003471),因此基于该类光敏剂的纳米药物的制备和应用研究是十分有意义的。
3.另一方面,选择合适的纳米载体是制备具有良好水溶性和靶向性的纳米药物的关键,目前文献报道的基于a
‑
d
‑
a型小分子光敏剂的纳米药物所使用的纳米药物载体均为两亲性聚合物,但是聚合物自身不易合成,其载药量也有限,因此开发新型纳米药物载体进一步改善该类光敏剂对肿瘤的光热
‑
光动力联合治疗效果具有重大的现实意义。近年来两亲性柱芳烃由于其结构易修饰,水溶性好等优点而得到了巨大关注,分子中巨大的空腔可以实现多类型药物的负载,因此通过两亲性柱芳烃包裹a
‑
d
‑
a型小分子光敏剂而制备出的纳米药物将具有更好的水溶性及更高的肿瘤治疗效果。
技术实现要素:
4.本发明的目的是提供一种肿瘤光热
‑
光动力联合治疗纳米药物及其制备方法和应用。
5.为了实现上述目的,本发明采用以下技术方案:
6.一种肿瘤光热
‑
光动力联合治疗纳米药物,包括柱芳烃p
‑
2peg和光敏剂dbdp,柱芳烃p
‑
2peg将光敏剂dbdp包裹在柱芳烃内;
7.所述柱芳烃p
‑
2peg的结构式如下式所示:
[0008][0009]
上述肿瘤光热
‑
光动力联合治疗纳米药物的制备方法,具体为:将光敏剂dbdp与柱芳烃p
‑
2peg按质量比1:2.5~6溶于四氢呋喃中,将混合溶液以2~4ml/h的速度滴入搅拌的去离子水中,搅拌5~10小时,之后使用5000分子量透析袋进行透析处理,即可获得纳米药物的水溶液。
[0010]
上述纳米药物在制备肿瘤治疗药物中的应用。
[0011]
本发明的纳米药物具有更好的水溶性和靶向性,小分子光敏剂dbdp具有宽而强的近红外光吸收。本发明提供的纳米药物制备工艺简单,纳米药物水溶性好,光热转化效率高,能够产生两种高活性氧物种,具有很强的光动力活性,能够实现对深层肿瘤的高效光热
‑
光动力联合治疗。
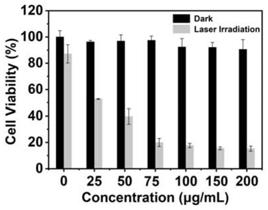
附图说明
[0012]
图1为两亲性柱芳烃p
‑
2peg的核磁氢谱图。
[0013]
图2为纳米药物的扫描电镜图、透射电镜图和动态光散射粒径分布图。
[0014]
图3为不同浓度纳米药物在光照条件下(808nm,1.5w/cm2)的升温曲线。
[0015]
图4为纳米药物在光照条件下(808nm,1.5w/cm2)的升温曲线及撤掉光照之后的降温曲线。
[0016]
图5为不同浓度纳米药物在光照条件下(808nm,1.5w/cm2),混合物中dpbf在415nm处的吸收变化曲线。
[0017]
图6为不同浓度下纳米药物在光照条件下(808nm,1.5w/cm2),混合物中sosg于530nm处的荧光强度随时间变化曲线和apf于516nm处的荧荧光强度随时间变化曲线。
[0018]
图7为宫颈癌细胞中高活性氧物种检测的荧光成像图。
[0019]
图8为宫颈癌细胞中1o2和
.
oh检测的荧光成像图。
[0020]
图9为宫颈癌细胞中
.
oh检测的荧光成像图。
[0021]
图10为纳米药物对宫颈癌细胞的毒性及光照条件下(808nm,1.5w/cm2)对宫颈癌细胞的致死率。
[0022]
图11不同治疗方向下宫颈癌细胞的死活荧光成像图。
具体实施方式
[0023]
下面结合具体实施例对本发明做进一步说明。下述实施例中所使用的实验方法如无特殊说明,均为常规方法。所用的材料、试剂等,如无特殊说明,均可从商业途径得到,未详细描述的技术均按照本领域人员熟知的标准方法进行。
[0024]
本发明所述柱芳烃p
‑
2peg的结构式如下式所示:
[0025][0026]
其合成路线如下式所示:
[0027][0028]
具体地:
[0029]
化合物1的合成:丙酮(250ml)、对苯二酚(11g,0.1mol)、氯乙酸甲酯(40g,0.37mol)与k2co3(25g,0.18mol)置于500ml圆底烧瓶中,在50℃下反应24h。反应结束后抽滤除去沉淀物,将获得的滤液通过旋转蒸发仪进行浓缩,浓缩液置于冰箱12h,低温下析出固体,抽滤获得化合物1。
[0030]
将产物溶于cdcl3中(约0.4ml),封管,下于unity inova
‑
400型nmr仪上测定表征:1h nmr(400mhz,cdcl3):δ6.85(s,4h),4.58(s,4h),3.80(s,6h).
[0031]
化合物2的合成:二氯甲烷(150ml)、化合物1(1.3g,5mmol)、对苯二乙醚(4.15g,25mmol)与多聚甲醛(2.7g)置于250ml圆底烧瓶中,在三氟化硼乙醚(4.26g,30mmol)的催化下常温反应30分钟。利用饱和碳酸氢钠将反应液中三氟化硼乙醚淬灭后,使用旋转蒸发仪除去溶剂。以石油醚:乙酸乙酯=30:1的混合比通过柱层析分离获得化合物2,产率约为40%。
[0032]
将产物溶于cdcl3中(约0.4ml),封管,下于unity inova
‑
400型nmr仪上测定表征:1h nmr(400mhz,cdcl3):6.80
‑
6.77(m,8h),6.71(s,2h),4.51(s,4h),3.93
‑
3.76(m,26h),3.09(s,6h),1.40
‑
1.30(m,24h).
[0033]
化合物3的合成:四氢呋喃(20ml)、30mg/ml氢氧化钠水溶液(20ml),化合物2
(300mg,0.3mmol)在70℃的温度条件下混合反应12小时。反应液冷却至室温,缓慢滴加盐酸使溶液ph=1~2,使用三氯甲烷萃取,将萃取液通过旋转蒸发仪除去溶剂后得到白色化合物3,产率约为85%。
[0034]
将产物溶于cdcl3中(约0.4ml),封管,下于unity inova
‑
400型nmr仪上测定表征:1h nmr(400mhz,cdcl3):6.81(s,2h),6.76(s,2h),6.74(s,2h),6.62(s,2h),6.49(s,2h),4.50(s,4h),3.93
‑
3.75(m,26h),1.34
‑
1.27(m,18h),1.18
‑
1.15(m,6h).
[0035]
柱芳烃p
‑
2peg的合成:dmf(10ml)、聚乙二醇胺(200mg,0.2mmol)、化合物3(100mg,0.1mmol),二异丙基乙胺(10μl)与hatu(114mg,0.3mmol)混合,常温反应12h。反应液通过旋转蒸发仪除去dmf后使用乙醚沉降,抽滤获得p
‑
2peg,产率约为70%,此产物极易吸水,保存环境需保持干燥。
[0036]
将产物溶于cdcl3中(约0.4ml),封管,下于unity inova
‑
400型nmr仪上测定表征:1h nmr(400mhz,cdcl3):6.89
‑
6.75(m,10h),4.60
‑
4.36(m,4h),3.95
‑
3.81(m,16h),3.78
‑
3.75(m,10h),3.66
‑
3.64(m,176h),3.56
‑
3.54(m,8h),3.38(s,6h),1.50
‑
1.37(m,24h).
[0037]
柱芳烃p
‑
2peg的核磁氢谱图如图1所示。
[0038]
光敏剂dbdp的结构式如下式所示:
[0039][0040]
其合成路线参考文献(z,wang,b,jia,g,cai,j,wang,y,li,p,xue,x,lu,y,lin,g,wang,x,zhan,dyes pigm.,2021,195,109705)。
[0041]
实施例1
[0042]
纳米药物的制备和表征
[0043]
将p
‑
2peg(3mg)与光敏剂dbdp(1.2mg)溶于1ml的thf中,使用注射泵将该dmf溶液以4ml/h的速度滴入快速搅拌的10ml去离子水中,搅拌2小时。将混合溶液使用5000分子量透析袋进行透析处理,获得蓝色澄清纳米药物水溶液。
[0044]
分别利用sem、tem和dls对纳米药物自组装形态进行表征,由sem与tem图可知其自组装形态为囊泡,粒径约为170nm左右(图2所示)。
[0045]
(1)光热升温曲线:
[0046]
使用808nm,1.5w/cm2激光进行照射,绘制0μg/ml、50μg/ml、100μg/ml和200μg/ml四个不同浓度dbdp nps的升温曲线。
[0047]
如图3所示,dbdp nps水溶液的升温速度随着浓度的增大而提高,在最大浓度下温度最大升高了超过40℃,此温度足以满足光热治疗的需要。
[0048]
(2)光热效率计算:
[0049]
测量200μg/ml浓度的纳米药物在808nm,1.5w/cm2下的光热转换效率。
[0050]
如图4所示,最高温度t
max
=66.0℃,环境温度t
sur
=27.0℃,激光照射时间t=
720s,808nm处吸光度a
λ
=0.825,空白溶液吸收热量q
dis
=0.03879j,降温拟合τ
s
=269.9,溶液质量1g。光热转换效率η=55.6%。
[0051]
(3)纳米药物体外光动力活性:以dpbf为探针,测量在880nm激光照射下纳米药物生成的总ros。在石英试管中将不同浓度(2.97ml)的dbdp nps与dpbf的乙醇溶液(30.0μl,10.0mm)搅拌混合。随后用1.5w/cm2的激光照射,照射周期为300s。在此过程中,在预先设定的时间点,使用紫外分光光度仪记录dpbf在415nm处的吸光度。
[0052]
如图5所示,所有浓度下的纳米药物溶液在光照之后,混合溶液中的dpbf在415nm处的吸光度都在持续下降,由于dpbf能与单线态氧反应,因此可以推断纳米药物在光照之后能够使氧气等物质转化为单线态氧,同时单线态氧的产生速度与纳米药物浓度有关。
[0053]
单线态氧(1o2)释放:使用sosg作为检测试剂,将sosg(50μm)和纳米药物(200μg/ml)的混合物(3ml)添加到石英试管中,使用880nm 1.5w/cm2的激光照射600s。在设定的时间点,用荧光分光光度计记录在530nm处的荧光强度(激发波长为488nm)。
[0054]
羟基自由基(
.
oh)释放:使用apf作为检测试剂,将apf(10μm)和纳米药物(200μg/ml)的混合液(3ml)添加到石英试管中,使用880nm 1.5w/cm2的激光照射600s。在设定的时间点,用荧光分光光度计记录516nm处的荧光强度(激发波长为488nm)。
[0055]
如图6所示,加入sosg探针或者apf探针的纳米药物溶液在光照之后,荧光都在持续增强,证实纳米药物在光照之后能够产生单线态氧和羟基自由基两种高活性氧物种,这将极大的增强的纳米药物的光动力治疗效果
[0056]
(4)纳米药物在hela细胞中的光动力活性:
[0057]
将hela细胞以每孔20x104个细胞的密度,接种在6孔板中,每孔1ml,细胞置于5%co2和37℃培养箱内培养24h。加入100μg/ml的dbdp nps培育5h,使用dcfh
‑
da(10μm)染色30分钟后用pbs缓冲液冲洗三遍。细胞使用808nm,1.5w/cm2的激光照射10分钟后用激发波长为488nm的clsm观察到绿色荧光,发射采集波长为510~550nm。
[0058]
如图7所示,只有使用纳米药物培养的hela细胞在光照之后能够观察到绿色荧光,证实在细胞里纳米药物在光照之后能够产生高活性氧物种。
[0059]
单线态氧(1o2)释放:将hela细胞以每孔20x104个细胞的密度,接种在6孔板中,每孔1ml,细胞置于5%co2和37℃培养箱内培养24h。加入100μg/ml的纳米药物培育5h,使用sosg(2μm)染色30分钟后用pbs缓冲液冲洗三遍。细胞使用808nm,1.5w/cm2的激光照射10分钟后用激发波长为488nm的clsm观察到绿色荧光,发射采集波长为500nm~550nm。
[0060]
如图8所示,只有使用纳米药物培养的hela细胞在光照之后能够观察到绿色荧光,证实在细胞里纳米药物在光照之后能够产生单线态氧。
[0061]
羟基自由基(
.
oh)释放:将hela细胞以每孔20x104个细胞的密度,接种在6孔板中,每孔1ml,细胞置于5%co2和37℃培养箱内培养24h。加入100μg/ml的纳米药物培育5h,使用apf(10μm)染色30分钟后用pbs缓冲液冲洗三遍。细胞使用808nm,1.5w/cm2的激光照射10分钟后用激发波长为488nm的clsm观察到绿色荧光,发射采集波长为510nm~550nm。
[0062]
如图9所示,只有使用纳米药物培养的hela细胞在光照之后能够观察到绿色荧光,证实在细胞里纳米药物在光照之后能够产生羟基自由基。
[0063]
(5)细胞毒性实验:
[0064]
将hela细胞以每孔1x104个细胞的密度,接种在96孔板中,每孔200μl,细胞置于
5%co2和37℃培养箱内培养24h,加入不同浓度纳米药物粒子(0μg/ml,25μg/ml,50μg/ml,75μg/ml,100μg/ml,200μg/ml)的dmem溶液,每孔50μl,加完结束后,继续培养4h,接着在808nm,1.5w/cm2光照7分钟,后更换新鲜的dmem培养基在培养箱中继续培养24h。然后每孔加入20μl预先配置好的mtt的pbs溶液(5mg/ml),继续培养4h后,吸去dmem培养液,每孔加入200μl dmso萃取蓝紫色甲瓒,用酶标仪测定490nm处吸光值,
[0065]
如图10所示,纳米药物粒子在光照之后对肿瘤细胞具有很好致死率,而相同条件下非光照条件下纳米药物对肿瘤细胞并不具有非常大的毒性。
[0066]
(6)细胞死活荧光成像:
[0067]
拍摄浓度为100μg/ml纳米药物在808nm,1.5w/cm2激光照射和无照射情况下的死活情况。将hela细胞以每孔30x104个细胞的密度,接种在6孔板中,每孔1ml,细胞置于5%co2和37℃培养箱内培养24h。在其中两皿加入浓度为100μg/ml纳米药物,两皿加入等体积pbs溶液。培养5h后,将纳米药物组和pbs组各一皿使用880nm,1.5w/cm2的激光照射10min,继续培养43小时。利用calcein/pi细胞活性与细胞毒性检测试剂进行染色,使用clsm观察细胞死活情况。
[0068]
如图11所示,只有通过纳米药物培养的细胞出现了大面积死亡,证实纳米药物对hela细胞具有非常好的致死率。
[0069]
实施例2
[0070]
纳米药物的制备和表征
[0071]
将p
‑
2peg(3mg)与光敏剂dbdp(1mg)溶于1ml的thf中,使用注射泵将该dmf溶液以4ml/h的速度滴入快速搅拌的10ml去离子水中,搅拌2小时。将混合溶液使用5000分子量透析袋进行透析处理,获得蓝色澄清纳米药物水溶液。
[0072]
实施例3
[0073]
纳米药物的制备和表征
[0074]
将p
‑
2peg(6mg)与光敏剂dbdp(1mg)溶于1ml的thf中,使用注射泵将该dmf溶液以4ml/h的速度滴入快速搅拌的10ml去离子水中,搅拌2小时。将混合溶液使用5000分子量透析袋进行透析处理,获得蓝色澄清纳米药物水溶液。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1