低分子海参糖胺聚糖作为制备防治冠状病毒相关疾病药物的应用的制作方法
1.本发明属于生物医药领域,具体涉及一种低分子海参糖胺聚糖作为制备预防和治疗冠状病毒相关疾病药物的应用。
2.
背景技术:
3.低分子海参糖胺聚糖,英文名为low molecular weight holothurian glycosaminoglycan(简称lhg),是一种由天然海参糖胺聚糖经过化学解聚制备的低分子量的杂多糖,由本技术人的在先申请(中国专利申请号:201911102517.0,申请日:2019年11月12日;pct国际申请号:pct/cn2019/119414,申请日:2019年11月19日)公布。
4.简要的,在前述在先申请中,该低分子海参糖胺聚糖,化学结构如下式所示:其中,组成单元为葡萄糖醛酸基(glca)、n-乙酰氨基半乳糖基(galnac)和岩藻糖基(fuc)以及它们的硫酸酯钠(-oso
3-na
+
)或乙酰酯(-ac)或钠(na
+
),葡萄糖醛酸基和n-乙酰氨基半乳糖基通过β(1-3)及β(1-4)糖苷键交互连接形成二糖重复结构单元的主链,岩藻糖基以侧链形式连接于主链,以摩尔比计,葡萄糖醛酸基:n-乙酰氨基半乳糖基:岩藻糖基的比值为1:(0.8~1.2):(0.6~1.2),低分子海参糖胺聚糖的结构式中,n = 1~ 32,-r1、-r2、-r4和-r6均为羟基(-oh)或硫酸酯钠,-r3中的10%~30%为硫酸酯钠,其余为羟基,-r5中的10%~30%为乙酰酯,其余为羟基或硫酸酯钠。
5.此外,低分子海参糖胺聚糖可以是上述结构示意图所示的钠盐形式,钠以离子键结合于羧基或硫酸酯基,也可以转换为其他的金属盐形式。
6.该低分子海参糖胺聚糖,具有众多的生物学活性,包括具有较低的抗凝血活性,以及具 有调节血小板活性、抗炎、抗血管病变、抗肿瘤或抗肿瘤转移以及改善学习记忆能力的作用。 在先申请主张将其制备成药物或保健品,应用于上述相关病症,但是,没有将其应用于作为 病毒相关疾病药物的用途。
[0007][0008]
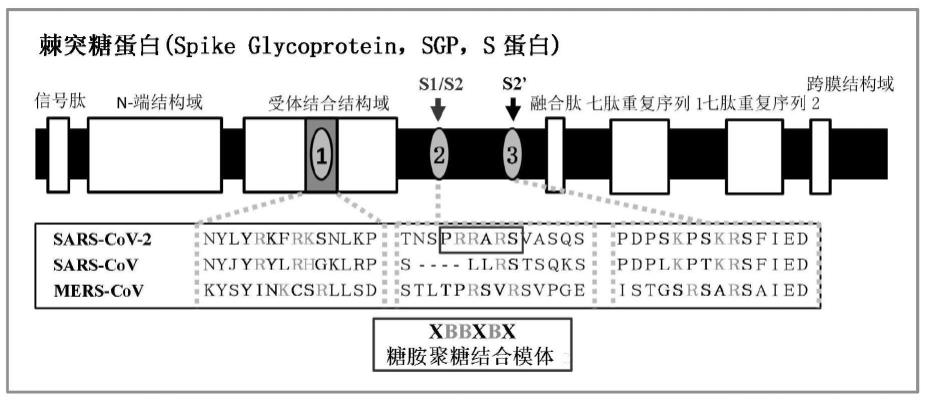
冠状病毒为单链(+)rna病毒,外包有脂肪膜,膜表面分布有棘突糖蛋白(s蛋白,spike protein),可以识别宿主细胞的血管紧张素转化酶ii(ace2)受体,并诱导病毒膜和宿主的细胞膜融合,进而侵染和破坏宿主细胞。根据文献(so young kim等,plos pathogens,2020年4月,电子稿论文草案(网络公布))记载,在冠状病毒(sars-cov-2(引发新型冠状病毒肺炎)、sars-cov(引发非典型肺炎——重症急性呼吸综合征)和mers-cov(引发中东呼吸综合征))的s蛋白上,有连续的碱性氨基酸(r(精氨酸)+k(赖氨酸))区域)(图1),其携带的正电荷可以通过静电作用与糖胺聚糖携带的负电荷结合。因而,外源糖胺聚糖可以阻断棘突糖蛋白与细胞表面糖胺聚糖的结合,同时封闭包膜病毒与细胞受体(ace2)结合的部位,阻止病毒与宿主细胞的吸附,抑制感染过程。如前述结构描述,低分子海参糖胺聚糖具有大量的硫酸基,是一种带大量负电荷的阴离子聚合物,潜在地,具有抗冠状病毒的
活性。
[0009]
此外,冠状病毒的侵染主要以肺部细胞为主,其在感染肺部后,肺泡毛细血管膜的完整性会被严重地损伤,出现炎症性充血或血栓,同时,肺里的成纤维细胞为了弥补损伤部位,会进行代偿性增殖与分化,大量没有气体交换功能的纤维化组织将代替肺泡,渐渐地导致肺纤维化。一旦肺纤维化形成,机体通气功能将下降,氧气进入血液的量不足,病人就会出现缺氧并呼吸困难,严重者则会出现急性呼吸窘迫综合症和多器官功能障碍综合症,进而死亡。因此,对于冠状病毒引发的其他病症,还须进行抗炎症和抗凝血栓塞的预防和对症治疗。
[0010]
迄今为止,冠状病毒尤其是新冠病毒,作为21世纪最为严重的世界公共卫生事件,仍然没有有效药物可以预防和治疗由冠状病毒引发的疾病。低分子海参糖胺聚糖具有抗炎症、抗凝血栓塞活性,以及潜在的抗病毒活性,将其应用为防治冠状病毒的药物,意义将极为重要。
技术实现要素:
[0011]
本发明是为了解决上述冠状病毒相关疾病还没有特效药物的技术问题,提供了低分子海参糖胺聚糖作为制备防治冠状病毒相关疾病药物的应用,尤其是用于作为有效抗病毒(复制)、抗炎症和抗凝血栓塞病症的防治药物的应用。
[0012]
为了实现以上目的,本发明采取的技术方案如下:一种低分子海参糖胺聚糖,作为制备预防和治疗冠状病毒相关疾病药物的应用。
[0013]
所述应用的药物,包括低分子海参糖胺聚糖和药学上可接受的辅料。其中,低分子海参糖胺聚糖为药物活性成分;药学上可接受的辅料包括但不限于等渗调节剂,和/或ph调节剂,和/或溶剂,和/或赋形剂。
[0014]
本发明提供了所述低分子海参糖胺聚糖在预防和治疗冠状病毒相关疾病模型中的药效学活性。
[0015]
在一项优选的实施方案中,以表面等离子共振技术(surface plasmon resonance,spr)考察了低分子海参糖胺聚糖与冠状病毒棘突糖蛋白的结合亲和力,结果表明,低分子海参糖胺聚糖与冠状病毒棘突糖蛋白结合亲和力高,潜在地,可封闭冠状病毒与细胞受体结合的部位,阻止冠状病毒与宿主细胞的吸附,抑制感染过程。
[0016]
在一项优选的实施方案中,低分子海参糖胺聚糖被在细胞水平上考察对于冠状病毒的抑制作用,细胞试验表明:低分子海参糖胺聚糖对冠状病毒具有明显的抑制作用,可显著减缓或解除新冠病毒对vero-e6细胞(非洲绿猴肾细胞)的侵染,细胞生长状态良好,增殖正常,无明显病变。
[0017]
在一项优选的实施方案中,低分子海参糖胺聚糖用于预防治疗静脉栓塞大鼠时,能显著降低抗栓重,抗栓效果达到或由于阳性药物法华林灌胃。低分子海参糖胺聚糖具有抗凝血栓塞作用。
[0018]
优选地,低分子海参糖胺聚糖的给药方式可以有多种,包括但不限于注射、口服和吸入。在一项优选的实施方案中,以活化部分凝血酶时间(aptt)作为考察指标,考察了兔体内不同给药方式的抗凝血作用的药效效果,结果注射、口服和雾化吸入均具有较好的生物利用度。
[0019]
优选地,所述应用的药物,剂型包括但不限于注射剂、口服剂和吸入剂。
[0020]
在一项优选的实施方案中,由于难获得可用的由新冠病毒或其他冠状病毒导致的(感染、炎症和凝血栓塞)肺炎动物模型,因此选择与之类似的由流感病毒导致的肺炎动物模型,模拟考察了低分子海参糖胺聚糖对病毒引发的感染、炎症和凝血栓塞等治疗或预防效果。结果表明低分子海参糖胺聚糖能够显著降低病毒感染大鼠的肺指数,减缓炎症的严重程度,且注射、口服和雾化吸入这些给药方式都有显著效果,因此,潜在地,可应用于冠状病毒感染相关疾病的预防和治疗。
[0021]
优选地,所述冠状病毒相关疾病包括但不限于冠状病毒引发的呼吸道感染、炎症及凝血栓塞。
[0022]
总之,低分子海参糖胺聚糖具有抗凝血栓塞、抗炎、以及抗病毒等作用,因此其可被作为药物活性物质,以药学上可接受的载体,制备药物,用于预防和治疗冠状病毒感染相关疾病。
[0023]
所述低分子海参糖胺聚糖,还可以作为药物活性成分,在制备预防和治疗流感病毒、腺病毒、呼吸道合胞病毒、副流感病毒、鼻病毒、巨细胞病毒以及eb病毒引发的呼吸道感染、炎症及凝血栓塞疾病药物中的应用。
[0024]
上述实施例只为说明本发明的技术构思及特点,其目的在于让熟悉此项技术的人士能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围。凡根据本发明精神实质所作的等效变化或修饰,都应涵盖在本发明的保护范围之内。
[0025]
发明的效果本发明提供了低分子海参糖胺聚糖为制备防治冠状病毒相关疾病药物的应用,尤其是用于作为有效抗病毒(复制)、抗炎症和抗凝血栓塞病症的防治药物的应用,所述低分子海参糖胺聚糖具有抗凝血栓塞、抗炎、以及抗病毒等作用,给药方式可以注射、口服和吸入,应用低分子海参糖胺聚糖作为药物活性物质,以药学上可接受的载体,制备药物,可以在多种场景下,为冠状病毒患者进行抗病毒、抗炎症和抗凝血栓塞等病症的预防和治疗。
附图说明
[0026]
图1 sars-cov-2(新冠病毒)、sars-cov(重症急性呼吸综合征冠状病毒)和mers-cov(中东呼吸综合征冠状病毒)的棘突糖蛋白(spike glycoprotein,sgp,s蛋白)中糖胺聚糖结合模体的示意图。
[0027]
图2 低分子海参糖胺聚糖与重症急性呼吸综合征冠状病毒棘突糖蛋白s1的结合亲和力分析示意图图3 低分子海参糖胺聚糖的不同给药方式/剂量对兔体内aptt时间延长的效果比较示意图
具体实施方式
[0028]
为使本发明的目的、技术方案和优点更加清楚明了,下面结合具体实施方式,对本发明进一步详细说明,但并不用于限制本发明的保护范围。
[0029]
实施例1:低分子海参糖胺聚糖与冠状病毒棘突糖蛋白的结合亲和力分析本实施例采用表面等离子共振技术(spr)研究低分子海参糖胺聚糖与冠状病毒棘
突糖蛋白的结合亲和力。
[0030]
1.实验材料:受试化合物:低分子海参糖胺聚糖(批号:lhg-l180501),来自在先申请(中国专利申请号:201911102517.0)的实施例1,以注射用水分别配制成100 mg/ml溶液;细胞:vero-e6细胞(非洲绿猴肾细胞)。
[0031]
冠状病毒棘突糖蛋白:重症急性呼吸综合征冠状病毒棘突糖蛋白s1(sars-cov spike s1 protein)2.实验方法:将冠状病毒棘突糖蛋白共价固定在芯片表面,将待分析物(低分子海参糖胺聚糖溶液)注入并流过芯片表面,记录二者间的反应变化。
[0032]
3.试验结果:图2显示了低分子海参糖胺聚糖样品和重症急性呼吸综合征冠状病毒棘突糖蛋白s1具有较高的结合亲和力,结合亲和力常数为3.06e-09nm。
[0033]
以上结果说明,低分子海参糖胺聚糖可以与冠状病毒棘突糖蛋白结合,潜在地,可封闭冠状病毒与细胞受体结合的部位,阻止冠状病毒与宿主细胞的吸附,抑制感染过程。
[0034]
实施例2:药物活性成分低分子海参糖胺聚糖在细胞水平对冠状病毒的抑制效果分析本实施例在细胞水平考察低分子海参糖胺聚糖对冠状病毒的抑制效果。
[0035]
1.实验材料:受试化合物:低分子海参糖胺聚糖(批号:lhg-190301),来自在先申请(中国专利申请号:201911102517.0)的实施例1,以注射用水分别配制成10 mg/ml溶液;细胞:vero-e6细胞(非洲绿猴肾细胞)。
[0036]
2.实验方法:1)取生长状态良好的vero-e6细胞进行消化传代,稀释调整细胞密度至1
×
105/ml,各100μl/孔接种于96孔板,放置于37℃、5%co2培养箱;2)培养16h后,离心弃去孔中培养基,1
×
pbs洗三次,甩干后每孔各加入50μl的10 mg/ml受试化合物溶液,再加入100μl的sars-cov-2病毒(moi = 0.01),同时设置正常细胞对照和病毒细胞对照,放置于37℃、5%co2培养箱继续培养;3)接毒48h后,显微镜观察受试化合物与病毒共同作用后的细胞状态变化并记录结果。
[0037]
3.试验结果:经显微镜观察,正常细胞对照组的vero-e6细胞生长状态良好,增殖数量正常,细胞形态完整,边界清晰;病毒细胞对照组即病毒感染组,细胞数量少,出现拉丝现象,细胞无完整形态,病变很明显;加入低分子海参糖胺聚糖受试化合物组,各孔细胞生长状态良好,数量正常,形态完整,无明显病变没有拉丝现象,有极少数细胞形态不完整和边界不清晰情况。
[0038]
整体来看,低分子海参糖胺聚糖可以显著减缓新冠病毒对vero-e6细胞的侵染,保护细胞的正常增殖,抑制新冠病毒的增殖。
[0039]
实施例3:低分子海参糖胺聚糖的抗血栓作用分析
血栓形成是静脉血栓的病理原因,冠状病毒感染后,易引起肺部静脉栓塞梗阻,导致肺功能下降或失活。血栓可以使一系列相关疾病恶化,严重时易引起病患死亡,是全球新冠病患死亡的重要原因之一。因此,找到适用于抗冠状病毒的抗血栓药物具有很重要的临床意义。
[0040]
1.实验材料:受试化合物:低分子海参糖胺聚糖(批号:lhg-181102),来自在先申请(中国专利申请号:201911102517.0)的实施例1。
[0041]
动物:sd大鼠,雄性,每组3只,230
±
30g。
[0042]
2.实验方法:低剂量组:3 mg/kg;高剂量组:30 mg/kg;阴性对照:生理盐水;阳性对照:华法林,1.5 mg/kg。
[0043]
给药方式:静脉注射,法华林灌胃给药(30min后)。
[0044]
大鼠适应环境并禁食一天,给药后及手术前2 min腹腔注射20%的乌拉坦溶液。将麻醉大鼠腹部备皮、消毒、沿腹白线打开腹腔。从腹腔内拖出小肠等器官,并用浸润过生理盐水的纱布包裹。钝性分离血管周围结缔组织,暴露下腔静脉及其分支。在肾静脉下方将腹主动脉和下腔静脉剥离,然后用生理盐水浸湿的缝合线在下腔静脉与左肾静脉的交汇处将下腔静脉结扎。按解剖位置将从腹腔内拖出的器官放回腹腔,用缝合线逐层缝合腹腔。术后将大鼠置于25℃的环境中血液循环4小时,再次打开腹腔,逐个将分支结扎,从下腔静脉与左肾静脉的交汇处的结扎处开始取出2cm下腔静脉,从中取出血栓称重。
[0045]
3.结果:表1 低分子海参糖胺聚糖的抗静脉血栓活性化合物/剂量栓重(mg)生理盐水17.2
±
5.1华法林(1.5mg/kg)8.1
±
2.4**低分子海参糖胺聚糖低剂量组(3mg/kg)10.1
±
3.9*低分子海参糖胺聚糖高剂量组(30mg/kg)5.8
±
4.3**备注:与生理盐水组相比,*表示p《0.05,**表示p《0.01。
[0046]
如上表所示,经过低分子海参糖胺聚糖给药,低分子海参糖胺聚糖无论是低剂量组(3 mg/kg)还是高剂量组(30 mg/kg),治疗静脉栓塞大鼠的栓重均显著小于生理盐水治疗组,其中高剂量组与1.5 mg/kg法华林灌胃治疗大鼠的栓重无显著差异。实验结果说明低分子海参糖胺聚糖具有良好的抗静脉血栓活性。潜在地,可应用于预防和治疗凝血栓塞相关疾病。
[0047]
实施例4:低分子海参糖胺聚糖的不同给药方式比较低分子海参糖胺聚糖是一种带有大量负电荷的聚阴离子聚合物,原药(活性药物成分)为白色至浅黄色无定形粉末,无味,易溶于水,不溶于乙醇和乙醚等有机溶剂。依据其理化特性(分子量大(10000da以下)、携带的负电荷多、水易溶),给药方式可优选为注射给药(静脉或皮下),以获得高生物利用度。此外,一些临床使用的硫酸化多糖(如用于间质性膀胱炎治疗的爱泌罗胶囊(elmiron
®
),以及用于有血栓形成危险的血管疾病的舒洛地特软胶囊(vessel due f,伟素
®
))采用的口服胶囊剂型,肠道吸收仍有很好的生物利用度。
最后,作为应用于冠状病毒预防和治疗,由于病症部位主要是呼吸系统尤其是肺部,因此吸入给药将具有给药部位精准、方便快捷的优点。
[0048]
本实施例根据低分子海参糖胺聚糖具有的(低)抗凝活性,考察兔体内抗凝血作用(活化部分凝血酶时间,aptt),以确定不同给药方式(注射、口服与吸入)的药效效果。
[0049]
1.实验材料:受试药物:低分子海参糖胺聚糖(批号:lhg-l180501),来自在先申请(中国专利申请号:201911102517.0)的实施例1,注射用水配制至所需浓度。
[0050]
动物:日本大白兔2-3 kg,雄性,每组4只。
[0051]
2.实验方法:口服灌胃高剂量组:50 mg/kg;口服灌胃低剂量组:5 mg/kg;雾化吸入高剂量组:50 mg/kg;雾化吸入低剂量组:5 mg/kg;静脉注射组:5 mg/kg;空白模型对照:生理盐水,静脉注射;测定仪器:全自动血凝仪(stago compact)。
[0052]
抗凝血试验:测定包括活化部分凝血酶时间(aptt)根据兔体重分别按照不同的剂量和方式给药。于给药前及给药后30 min、1 h、2 h、4 h、6 h和8 h分别采血分别采血3 ml,用3.8%枸橼酸钠抗凝剂1:9抗凝,3000转/分离心5分钟,分离出贫血小板血浆(ppp)。按试剂盒方法,上机(全自动血凝仪)检测aptt。
[0053]
3.结果:实验结果如附图2所示,从图中可以看出:注射、口服和雾化吸入均能延长aptt;从给药剂量均为5 mg/kg的组别看,静脉组的aptt延长时间要显著高于口服组和雾化吸入组,后两者的效果相近;但是,高剂量上(50 mg/kg),口服和雾化对aptt的延长作用均要高于上述静脉组(5 mg/kg),这反映了口服和雾化都具有较好的生物利用度,且至少在10%以上;另一个方面,低分子海参糖胺聚糖的抗凝作用(aptt延长作用)还体现了明显的量效关系。
[0054]
以上结果说明,低分子海参糖胺聚糖在应用于冠状病毒感染相关疾病的预防和治疗时,潜在地,可以有多种给药方式灵活运用。
[0055]
实施例5:低分子海参糖胺聚糖的小鼠体内病毒性肺炎抑制效果分析冠状病毒的侵染主要以肺部细胞为主,其在感染病患肺部后,肺泡毛细血管膜的完整性会被严重地损伤,出现炎症性充血或血栓,继而引起凝血栓塞或肺梗阻,同时,肺里的成纤维细胞为了弥补损伤部位,会进行代偿性增殖与分化,大量没有气体交换功能的纤维化组织将代替肺泡,渐渐地导致肺纤维化。一旦肺纤维化形成,机体通气功能将下降,氧气进入血液的量不足,病人就会出现缺氧并呼吸困难,严重者则会出现急性呼吸窘迫综合症和多器官功能障碍综合症,进而死亡。
[0056]
因此,找到适用于抗冠状病毒的药物具有很重要的临床意义。而低分子海参糖胺聚糖由于具有抗炎症(在先申请(中国专利申请号:201911102517.0)的实施例9)活性以及抗栓抗凝活性,预期可以有效预防和治疗由冠状病毒引发的局部炎症和凝血栓塞(尤其是肺栓塞),阻止、减缓和修复炎症反应,保护肺等脏器功能。
[0057]
由于难获得由冠状病毒导致的(感染、炎症和凝血栓塞)肺炎动物模型,本实施例选择与之类似的由流感病毒导致的肺炎动物模型进行,模拟考察低分子海参糖胺聚糖对病毒引发的感染、炎症和凝血栓塞等治疗或预防效果。
[0058]
1.实验材料:受试药物:低分子海参糖胺聚糖(批号:lhg-190501),来自在先申请(中国专利申请号:201911102517.0)的实施例1,以注射用水溶解配制。
[0059]
病毒:甲型h1n1流感病毒鼠肺适应株(fm/1/47株)。鸡胚传代,bsl-3实验室内检测,分装,-80℃保存。
[0060]
动物:sd大鼠,200
±
20g,雄性。
[0061]
2.实验方法:静脉注射低剂量组:5 mg/kg/d,尾静脉;静脉注射高剂量组:25 mg/kg/d,尾静脉;口服低剂量组:5 mg/kg/d,灌胃;口服高剂量组:50 mg/kg/d,灌胃;雾化吸入低剂量组:5 mg/kg/d,按雾化器雾化后口腔吸入;雾化吸入高剂量组:50 mg/kg/d,按雾化器雾化后口腔吸入;空白模型对照:生理盐水;阳性对照:达菲,10 mg/kg/d,灌胃给药。
[0062]
将雄性sd大鼠随机分为4组各6只,分别为空白模型对照组、达菲对照组和各不同给药方式的低分子海参糖胺聚糖低/高剂量组。各实验组动物用乙醚轻度麻醉,以15个ld50的fm1流感病毒液滴鼻感染,每只200μl。各治疗组开始时间为感染24h,给药时间每12h一次,连续5天。空白对照组每天尾静脉注射给药,达菲灌胃给药,受试药物组(低/高剂量组)按照规定的方式给药。第6天后称重后处死,解剖,取肺,称重,计算肺指数与肺指数抑制率。
[0063]
3.结果:表2 低分子海参糖胺聚糖对大鼠肺炎模型肺指数的影响
组别给药方式肺指数肺指数抑制率空白模型对照组尾静脉注射0.59
±
0.09/达菲对照组(10mg/kg/d)灌胃0.41
±
0.0730.1%**低分子海参糖胺聚糖组1(5mg/kg/d)尾静脉注射0.45
±
0.0824.5%*低分子海参糖胺聚糖组2(25mg/kg/d)尾静脉注射0.39
±
0.0734.9%**低分子海参糖胺聚糖组3(5mg/kg/d)灌胃0.51
±
0.0817.4%*低分子海参糖胺聚糖组4(50mg/kg/d)灌胃0.46
±
0.0826.1%**低分子海参糖胺聚糖组5(5mg/kg/d)雾化口腔吸入0.48
±
0.0720.3%*低分子海参糖胺聚糖组6(50mg/kg/d)雾化口腔吸入0.37
±
0.0937.2%**
备注:与空白模型对照组相比,*表示p《0.05,**表示p《0.01。
[0064]
肺指数反映肺炎的严重程度,数值越大表示肺炎越严重。上表中结果显示,所有给药处理的低分子海参糖胺聚糖组均能够显著降低流感病毒感染大鼠的肺指数,且呈现一定的量效关系,表明低分子海参糖胺聚糖对大鼠流感病毒性肺炎有预防和治疗作用,潜在地,可应用于类似病症如冠状病毒感染相关疾病的预防和治疗。
[0065]
实施例的作用与效果根据实施例1的结果可知,低分子海参糖胺聚糖可以与冠状病毒棘突糖蛋白结合,潜在地,可封闭冠状病毒与细胞受体结合的部位,阻止冠状病毒与宿主细胞的吸附,抑制感染过程。
[0066]
根据实施例2的结果可知,低分子海参糖胺聚糖在细胞水平上,可显著抑制冠状病毒,减缓或解除新冠病毒对vero-e6细胞(非洲绿猴肾细胞)的侵染,对正常细胞有很好的保护作用。
[0067]
根据实施例3的结果可知,低分子海参糖胺聚糖用于预防治疗静脉栓塞大鼠时,能显著降低抗栓重,抗栓效果达到或由于阳性药物法华林灌胃,说明低分子海参糖胺聚糖具有用于预防或治疗凝血栓塞相关疾病的潜力。
[0068]
根据在先申请(中国专利申请号:201911102517.0)的实施例9的结果可知,低分子海参糖胺聚糖在作用于以二甲苯致耳廓肿胀的小鼠时,能够显著降低耳廓肿胀度,抗炎效果达到或优于地塞米松,说明低分子海参糖胺聚糖具有用于预防或治疗炎症的潜力。
[0069]
根据实施例4的结果可知,低分子海参糖胺聚糖的给药方式可以有多种(包括但不限于注射、口服和吸入),潜在地,可灵活适用于不同状况下的冠状病毒患者治疗。
[0070]
根据实施例5的结果可知,低分子海参糖胺聚糖用于治疗流感病毒感染大鼠时,能够显著降低被流感病毒感染大鼠的肺指数,且呈现一定的量效关系,同时不同给药方式(静脉注射、口服灌胃以及雾化吸入)均有显著效果,表明低分子海参糖胺聚糖对大鼠流感病毒性肺炎有预防和治疗作用,潜在地,可应用于类似病症如冠状病毒感染相关疾病的预防和治疗。
[0071]
总之,低分子海参糖胺聚糖具有抗凝血栓塞、抗炎、以及抗病毒等作用,因此可以应用低分子海参糖胺聚糖作为药物活性物质,以药学上可接受的载体,制备药物,用于预防和治疗冠状病毒感染相关疾病。
[0072]
上述实施例只为说明本发明的技术构思及特点,其目的在于让熟悉此项技术的人士能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围。凡根据本发明精神实质所作的等效变化或修饰,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1