一种壳材、纳米载体及其用途的制作方法
1.本发明涉及化妆品领域,具体为一种壳材、纳米载体及其用途。
背景技术:
2.cn2020116376570公开了一种基于人参皂苷次生苷的脂质体,所述脂质体中含有磷脂和如式(1)所示的二醇型人参皂苷次生苷;公开了一种负载活性物质的脂质体,所述的负载活性物质的脂质体是指将化妆品的活性物质中的一种或多种包封于基于二醇型人参皂苷次生苷的脂质体中;该发明负载活性物质的脂质体的制备方法,将磷脂和如式(1)所示的人参皂苷次生苷在醇类有机溶剂中混合,再加入所述化妆品中的活性物质,减压蒸发,直至成膜,然后将ph值为7~8之间的磷酸盐缓冲液作为水化介质,于40~50℃下水化,均质,即得脂质体溶液。
[0003][0004]
其中,r1为下述基团中的任何一种﹕
‑
o
‑
glc、
‑
o
‑
xyl、
‑
o
‑
rha、
‑
o
‑
ara、
‑
o
‑
lyx、
‑
o
‑
glc(2
→
1)glc、
‑
o
‑
glc(6
→
1)glc、
‑
o
‑
glc(2
→
1)xyl、
‑
o
‑
glc(6
→
1)xyl、
‑
o
‑
glc(2
→
1)rha、
‑
o
‑
glc(6
→
1)rha、
‑
o
‑
glc(2
→
1)ara、
‑
o
‑
glc(6
→
1)ara、
‑
o
‑
glc(2
→
1)lyx、
‑
o
‑
glc(6
→
1)lyx、
‑
o
‑
glc(2
→
1)glc(2
→
1)glc、
‑
o
‑
glc(2
→
1)glc(6
→
1)glc、
‑
o
‑
glc(6
→
1)glc(2
→
1)glc、
‑
o
‑
glc(6
→
1)glc(6
→
1)glc、
‑
o
‑
glc(2
→
1)glc(2
→
1)xyl、
‑
o
‑
glc(2
→
1)glc(6
→
1)xyl、
‑
o
‑
glc(6
→
1)glc(2
→
1)xyl、
‑
o
‑
glc(6
→
1)glc(6
→
1)xyl、
‑
o
‑
glc(2
→
1)glc(2
→
1)rha、
‑
o
‑
glc(2
→
1)glc(6
→
1)rha、
‑
o
‑
glc(6
→
1)glc(2
→
1)rha、
‑
o
‑
glc(6
→
1)glc(6
→
1)rha、
‑
o
‑
glc(2
→
1)glc(2
→
1)ara、
‑
o
‑
glc(2
→
1)glc(6
→
1)ara、
‑
o
‑
glc(6
→
1)glc(2
→
1)ara、
‑
o
‑
glc(6
→
1)glc(6
→
1)ara、
‑
o
‑
glc(2
→
1)glc(2
→
1)lyx、
‑
o
‑
glc(2
→
1)glc(6
→
1)lyx、
‑
o
‑
glc(6
→
1)glc(2
→
1)lyx、
‑
o
‑
glc(6
→
1)glc(6
→
1)lyx﹔
[0005][0006]
cn201310155639.2公开了人参皂苷纳米胶束及其制备方法、应用和药物组合物。该人参皂苷纳米胶束包含人参皂苷rg3、人参皂苷rg5和人参皂苷rk1,其中,所述rg3的含量为15%~45%,所述rg5的含量为15%~45%,所述rk1的含量为15%~45%,且所述的rg3、rg5和rk1的总量≥70%,所述的百分比质量百分比。该制备方法将人参皂苷纳米胶束的各成分在能溶解人参皂苷的有机溶剂中溶解,之后除去有机溶剂即得。
[0007]
所以可见人参皂苷次生苷作为壳材制备脂质体、胶束的应用已经有相关的研究发表。
[0008]
上述研究存在的问题是:cn2020116376570所公开的是用于容纳水溶性活性物质的脂质体的结构,且所得的脂质体均为基于二醇型人参次生苷的脂质体结构,cn201310155639.2公开的壳结构均为纯人参皂苷,不含有其他化学组分,所制备的纯人参皂苷纳米胶束均为中性或者微弱负电荷纳米材料,经过研究其高温长期存储稳定性具有一定的挑战,无法满足化妆品中稳定的油溶性活性物质的包裹、存储和释放的需求。
[0009]
不可否认的是,上述两个方案均注意到了人参皂苷次生苷作为壳结构,在表现壳材的基本特性的同时,也会将人参皂苷的活性特性予以展现。
[0010]
针对人参皂苷次生苷作为壳材,我们经过研究发现,如果不经过壳材优化,其在体系中的溶解相容性、皮肤吸附性、刺激性、舒缓抗敏作用、降低膜材材料本身作为营养物质对细菌的增殖作用,均达不到理想程度。
[0011]
所以,本案解决的技术问题是:如何提高以人参皂苷次生苷为壳层基材的体系相容性、皮肤吸附性、舒缓抗敏作用,同时增强壳层基材的表面电荷可调控性,降低传统膜材料本身作为营养物的对细菌的增殖作用。
技术实现要素:
[0012]
本发明的目的在于提供一种壳材,该壳材能够作为胶束、脂质体的壳层稳定的包裹和平稳的释放亲油性活性物质、亲水性活性物质,在体系中表现出优异的相容性,沉淀现象明显减弱,降低化妆品的刺激性,具有舒缓抗敏的效果,提高皮肤对于活性物质的吸收效果,降低了传统膜材作为营养物质对细菌的增殖作用,同时本发明还公开了基于该壳材的纳米载体及其用途。
[0013]
为实现上述目的,本发明提供如下技术方案:一种壳材,包括磷脂、肽脂肪酸化衍生物和三醇型人参皂苷次生苷;磷脂、肽脂肪酸化衍生物和三醇型人参皂苷次生苷的重量比为0.1~100:0.1~100:0.1~100;
[0014]
所述肽脂肪酸化衍生物包括多肽单元结构且含有一个或多个精氨酸或者赖氨酸单元;所述多肽单元结构为二肽至五肽之一;
[0015]
所述三醇型人参皂苷次生苷如下通式ⅰ所示:
[0016][0017]
r1选自以下基团中的一种:
[0018]
‑
o
‑
glc、
‑
o
‑
xyl、
‑
o
‑
rha、
‑
o
‑
ara、
‑
o
‑
lyx、
‑
o
‑
glc(2
→
1)glc、
‑
o
‑
glc(6
→
1)glc、
‑
o
‑
glc(2
→
1)xyl、
‑
o
‑
glc(6
→
1)xyl、
‑
o
‑
glc(2
→
1)rha、
‑
o
‑
glc(6
→
1)rha、
‑
o
‑
glc(2
→
1)ara、
‑
o
‑
glc(6
→
1)ara、
‑
o
‑
glc(2
→
1)lyx、
‑
o
‑
glc(6
→
1)lyx、
‑
o
‑
glc(2
→
1)glc(2
→
1)glc、
‑
o
‑
glc(2
→
1)glc(6
→
1)glc、
‑
o
‑
glc(6
→
1)glc(2
→
1)glc、
‑
o
‑
glc(6
→
1)glc(6
→
1)
glc、
‑
o
‑
glc(2
→
1)glc(2
→
1)xyl、
‑
o
‑
glc(2
→
1)glc(6
→
1)xyl、
‑
o
‑
glc(6
→
1)glc(2
→
1)xyl、
‑
o
‑
glc(6
→
1)glc(6
→
1)xyl、
‑
o
‑
glc(2
→
1)glc(2
→
1)rha、
‑
o
‑
glc(2
→
1)glc(6
→
1)rha、
‑
o
‑
glc(6
→
1)glc(2
→
1)rha、
‑
o
‑
glc(6
→
1)glc(6
→
1)rha、
‑
o
‑
glc(2
→
1)glc(2
→
1)ara、
‑
o
‑
glc(2
→
1)glc(6
→
1)ara、
‑
o
‑
glc(6
→
1)glc(2
→
1)ara、
‑
o
‑
glc(6
→
1)glc(6
→
1)ara、
‑
o
‑
glc(2
→
1)glc(2
→
1)lyx、
‑
o
‑
glc(2
→
1)glc(6
→
1)lyx、
‑
o
‑
glc(6
→
1)glc(2
→
1)lyx、
‑
o
‑
glc(6
→
1)glc(6
→
1)lyx;
[0019]
r2选自以下基团中的一种:
[0020][0021]
在上述的壳材中,所述肽脂肪酸化衍生物为乙酰基二肽
‑
1鲸蜡酯、棕榈酰二肽
‑
7、棕榈酰三肽
‑
1、棕榈酰三肽
‑
8、棕榈酰四肽
‑
7、棕榈酰五肽
‑
4之一。
[0022]
在本发明的实施例中,对乙酰基二肽
‑
1鲸蜡酯进行了大量的验证。在本发明的研究过程中发现,与乙酰基二肽
‑
1鲸蜡酯具有类似结构的如上衍生物都可以形成较为稳定的纳米载体。
[0023]
在上述的壳材中,所述磷脂、肽脂肪酸化衍生物和三醇型人参皂苷次生苷的重量比为1~99.9:0.1~40:1~99.9。
[0024]
在上述的壳材中,所述磷脂为天然卵磷脂、大豆卵磷脂、蛋黄卵磷脂、氢化卵磷脂和脑磷脂中的一种。
[0025]
同时,本发明还公开了一种纳米载体,由核层和壳层组成,所述壳层如上任一所述,所述核层为疏水性物质或亲水性物质。
[0026]
优选地,所述核层和壳层的重量比为0.01~100:0.01~100。
[0027]
优选地,所述核层和壳层的重量比为1:1
‑
201:。
[0028]
需要说明的是,当纳米载体为脂质体时,壳体内可以没有核层,也就是说核壳比可以达到0:1。
[0029]
在本发明的实施例中由于篇幅限制,核壳层的比例实际上在应用中是非常宽泛的。
[0030]
在上述的纳米载体中,所述纳米载体为胶束或脂质体,若纳米载体为脂质体,则核层为疏水性物质或亲水性物质;若纳米载体为胶束,则核层为疏水性物质。
[0031]
脂质体的定义是双分子层或多分子层所述膜材(磷脂+皂苷+肽)的纳米载体材料,包覆物为亲水或者疏水活性物;胶束的定义是单分子层所述膜材(磷脂+皂苷+肽)的纳米载体材料,包覆物为疏水活性物;
[0032]
在上述的纳米载体中,若纳米载体为胶束,则所述磷脂、肽脂肪酸化衍生物和三醇型人参皂苷次生苷的重量比为1:0.1
‑
100:0.1
‑
100;
[0033]
若纳米载体为脂质体,则所述磷脂、肽脂肪酸化衍生物和三醇型人参皂苷次生苷的重量比为10:0.1
‑
10:0.1
‑
10。
[0034]
优选地,若纳米载体为胶束,则所述磷脂、肽脂肪酸化衍生物和三醇型人参皂苷次生苷的重量比为1:0.1
‑
50:0.1
‑
50;
[0035]
若纳米载体为脂质体,则所述磷脂、肽脂肪酸化衍生物和三醇型人参皂苷次生苷
的重量比为10:0.2
‑
8:0.2
‑
8。
[0036]
优选地,若纳米载体为胶束,则所述磷脂、肽脂肪酸化衍生物和三醇型人参皂苷次生苷的重量比为1:0.2
‑
30:0.2
‑
30;
[0037]
若纳米载体为脂质体,则所述磷脂、肽脂肪酸化衍生物和三醇型人参皂苷次生苷的重量比为10:0.5
‑
5:0.5
‑
5。
[0038]
优选地,若纳米载体为胶束,则所述磷脂、肽脂肪酸化衍生物和三醇型人参皂苷次生苷的重量比为1:0.3
‑
6:0.3
‑
2;
[0039]
若纳米载体为脂质体,则所述磷脂、肽脂肪酸化衍生物和三醇型人参皂苷次生苷的重量比为10:1
‑
2:0.5
‑
1。
[0040]
可见磷脂用量多,则偏向于脂质体,磷脂用量少,则偏向于胶束。
[0041]
需要说明的是,随着磷脂的用量由少增多,从胶束至脂质体的变化过程中,两者的转变的用量界限并不是那么明显,和磷脂的选用、肽脂肪酸化衍生物的选用甚至三醇型人参皂苷次生苷的选用都有一定的关联。
[0042]
在上述的纳米载体中,所述疏水活性物质为天然或合成油脂类化合物、磷脂类化合物、维生素、胡萝卜素、类胡萝卜素类化合物、精油类化合物、脂溶性小分子类活性物中的一种或多种,所述脂溶性小分子类活性物为辅酶q
‑
10、白藜芦醇、虾青素中的一种或多种;
[0043]
所述亲水活性物质为括水解蛋白类化合物、水溶性小分子多肽类化合物、水溶性小分子类化合物中的一种或多种;
[0044]
所述水解蛋白类化合物为水解蚕丝蛋白多肽、水解胶原蛋白多肽、水解牛奶蛋白多肽、水解大米蛋白多肽、水解羊毛蛋白多肽中的一种或多种;
[0045]
所述水溶性小分子多肽类化合物为生物素三肽
‑
1、乙酰基六肽
‑
8、类蛇毒三肽、九肽
‑
1中的一种或多种;
[0046]
所述水溶性小分子类化合物为水溶性抗坏血酸及衍生物、果酸、植物提取物、视黄醇/酸、烟酰胺、苯乙基间苯二酚、α
‑
熊果苷、生物活性寡糖、多糖中的一种或多种。
[0047]
在上述的纳米载体中,所述纳米载体的粒径为10nm~500nm,较优地为20nm~200nm,更优的为40nm~100nm。
[0048]
最后,本发明还公开了上述任一所述的纳米载体用于化妆品、食品的用途。
[0049]
本发明胶束、脂质体的制备方法包含但不限于:多通道快速混合法:将磷脂、乙酰基二肽
‑
1鲸蜡酯、和如通式ⅰ所示的稀有人参皂苷次生苷在醇类有机溶剂中混合,在室温条件下搅拌至完全溶解,形成稀有人参次生苷、乙酰基二肽
‑
1鲸蜡酯、磷脂等制备纳米脂质体、胶束的原料的良溶剂溶液;在多通道混合器的其中一个或几个通道内通入良溶剂溶液,在其余通道内通入反溶剂或含有亲水性活性物、疏水性活性物的反溶剂混合溶液,使其在多通道混合器的混合腔中快速自组装成基于稀有人参次生苷的纳米脂质体、胶束溶液。
[0050]
与现有技术相比,本发明的有益效果是:
[0051]
本发明的壳材能够作为胶束、脂质体的壳层稳定的包裹和平稳的释放油溶性活性物质、水溶性活性物质,达到优异的日化护理效果,降低化妆品的刺激性,独特的电荷可调控性提高了与皮肤的亲和性,降低了传统膜材作为细菌营养物质的不良增殖,同时本发明还公开了该胶束和脂质体,以及基于该理论的其他结构的壳材、胶束、脂质体。
[0052]
本实验使用的稀有人参次生苷功效成分明确、品质稳定、皮肤吸收性好;具有产业
化及商业化优势。人参皂苷主要分为原人参二醇型和原人参三醇型两大类。这两类成分具有截然不同的活性和药理作用,在化妆功效的差别也非常显著,因此必须分离富集后使用于不同的化妆品中。本实验中使用的经过特殊转化的三醇型人参次生苷不仅具有明确的成分结构,而且具有更好的功效活性。经过转化的三醇型人参次生苷极性降低,属于两亲性分子,是一种可以更好地用来替代化学合成包裹材料的天然植物来源的化合物,且与带有正电荷的乙酰基二肽
‑
1鲸蜡酯作为膜材使用时有更好的兼容性。
[0053]
本发明的三醇型稀有人参次生苷及其所制备的纳米胶束、脂质体可以大大降低细胞毒性,尤其是长期细胞毒性。在正常成纤维细胞培养中,添加了50ug/ml所示样品,在添加后对不同时间的细胞进行取样测试并对比不同样品对细胞活性(mtt)的影响。所得细胞活性越低,表明细胞毒性越大。测试结果如图1所示,本发明所述的三醇型稀有人参次生苷的细胞毒性在同等条件下,比二醇型稀有人参次生苷和市售人参皂苷原生苷的细胞毒性低,尤其是长期作用的细胞毒性,具有更优异的细胞兼容性;此外,经过本发明所述的纳米胶束包裹后,可进一步降低使用的稀有人参次生苷的细胞毒性,在同等条件下,三醇型次生苷的纳米胶束比二醇型的纳米胶束具有更高的细胞兼容性。
[0054]
本发明的基于磷脂、人参皂苷次生苷、乙酰基二肽
‑
1鲸蜡酯所构成的壳结构其具有独特的优势:
[0055]
1)肽脂肪酸化衍生物会改变胶束的表面带电性能,因而本发明所述的膜材组合可以更加有效、便捷地调节纳米载体表面电荷性能,从原始的负电荷人参卵磷脂胶束、脂质体变为稳定的正电荷人参胶束、脂质体。
[0056]
2)制备表面正电荷载体材料能更好的吸附带有负电荷的皮肤,且肽脂肪酸化衍生物在存在于壳层提高了制备纳米载体材料的抗敏舒缓的效果和降低了材料的皮肤刺激性。
[0057]
3)肽脂肪酸化衍生物在壳层具有阳离子性能,从而具有一定的抑菌性能,作为共膜材使用,降低了传统壳材组分及所包裹的活性物化合物(例如卵磷脂等)作为有害细菌增殖的营养物质的利用度。但是需要注意的是,肽脂肪酸化衍生物必须在磷脂、三醇型人参皂苷次生苷的存在下才能使壳材混合物的醇类溶液沉淀少,兼容性好,从而可以实现通过本发明阐述的多通道混合方法制备稳定的的胶束和脂质体,并且表现出非常优异的皮肤吸附性能和其他性能。
[0058]
通过上述优化,正电荷人参胶束或脂质体能够和人体肌肤更稳定的结合,相比不含肽脂肪酸化衍生物的壳材、相比采用二醇型人参皂苷次生苷作为替换的壳材,其体系更易制得稳定的壳材醇溶液及纳米胶束和脂质体、和人体亲和性佳、刺激性小。
附图说明
[0059]
图1为本发明的三醇型人参次生苷、二醇型人参次生苷、及市售人参原生苷的长期细胞毒性对比、二醇型人参次生苷纳米胶束和三醇型纳米胶束的长期细胞毒性对比;
[0060]
图2为本发明的实施例9和对比例2的溶液兼容性对比;
[0061]
图3为本发明的实施例9制备的纳米脂质体冷冻透射电镜图
[0062]
图4为本发明的实施例9和对比例3的类皮肤界面吸附性能对比
[0063]
图5为本发明的实施例8和对比例5的溶液兼容性对比;
[0064]
图6为本发明的实施例8制备的纳米胶束冷冻透射电镜图
[0065]
图7为本发明的实施例8和对比例4的类皮肤界面吸附性能对比
具体实施方式
[0066]
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0067]
第一部分、胶束制备实验
[0068]
<实施例1>
[0069]
取蛋黄卵磷脂:如通式ⅰ所示的三醇型稀有人参次生苷:乙酰基二肽
‑
1鲸蜡酯:辅酶q10的质量比1:1:1:1共同溶于无水乙醇中,在室温条件下搅拌1h至完全溶解,配制乙醇溶液相的总浓度为15mg/ml,然后将配制好的乙醇溶液相与反溶剂去离子水分别吸入针筒。通过数字注射泵将配制好的卵磷脂人参皂苷乙醇溶液和去离子水,通过数字注射泵将配制好的卵磷脂乙醇溶液和去离子水分别连接多通道混合器的两个通道,通入速度优选为5ml/min,在另外两个通道分别通入相同的去离子水,通入速度优选为45ml/min,所得纳米胶束液体从出口流出,用容器承接。
[0070]
其中,r1基团为
‑
o
‑
glc,r2为
[0071]
<实施例1
‑
1>
[0072]
取蛋黄卵磷脂:如通式ⅰ所示的三醇型稀有人参次生苷:乙酰基二肽
‑
1鲸蜡酯:辅酶q10的质量比1:0.1:0.1:1共同溶于无水乙醇中,在室温条件下搅拌1h至完全溶解,配制乙醇溶液相的总浓度为15mg/ml,然后将配制好的乙醇溶液相与反溶剂去离子水分别吸入针筒。通过数字注射泵将配制好的卵磷脂人参皂苷乙醇溶液和去离子水,通过数字注射泵将配制好的卵磷脂乙醇溶液和去离子水分别连接多通道混合器的两个通道,通入速度优选为5ml/min,在另外两个通道分别通入相同的去离子水,通入速度优选为45ml/min,所得纳米胶束液体从出口流出,用容器承接。
[0073]
其中,r1基团为
‑
o
‑
glc,r2为
[0074]
<实施例1
‑
2>
[0075]
取蛋黄卵磷脂:如通式ⅰ所示的三醇型稀有人参次生苷:乙酰基二肽
‑
1鲸蜡酯:辅酶q10的质量比1:0.1:1:1共同溶于无水乙醇中,在室温条件下搅拌1h至完全溶解,配制乙醇溶液相的总浓度为15mg/ml,然后将配制好的乙醇溶液相与反溶剂去离子水分别吸入针筒。通过数字注射泵将配制好的卵磷脂人参皂苷乙醇溶液和去离子水,通过数字注射泵将配制好的卵磷脂乙醇溶液和去离子水分别连接多通道混合器的两个通道,通入速度优选为5ml/min,在另外两个通道分别通入相同的去离子水,通入速度优选为45ml/min,所得纳米胶束液体从出口流出,用容器承接。
[0076]
其中,r1基团为
‑
o
‑
glc,r2为
[0077]
<实施例1
‑
3>
[0078]
取蛋黄卵磷脂:如通式ⅰ所示的三醇型稀有人参次生苷:乙酰基二肽
‑
1鲸蜡酯:辅酶q10的质量比1:0.1:0.1:10共同溶于无水乙醇中,在室温条件下搅拌1h至完全溶解,配制乙醇溶液相的总浓度为15mg/ml,然后将配制好的乙醇溶液相与反溶剂去离子水分别吸入针筒。通过数字注射泵将配制好的卵磷脂人参皂苷乙醇溶液和去离子水,通过数字注射泵将配制好的卵磷脂乙醇溶液和去离子水分别连接多通道混合器的两个通道,通入速度优选为5ml/min,在另外两个通道分别通入相同的去离子水,通入速度优选为45ml/min,所得纳米胶束液体从出口流出,用容器承接。
[0079]
其中,r1基团为
‑
o
‑
glc,r2为
[0080]
<实施例1
‑
4>
[0081]
取蛋黄卵磷脂:如通式ⅰ所示的三醇型稀有人参次生苷:乙酰基二肽
‑
1鲸蜡酯:辅酶q10的质量比1:0.1:100:1共同溶于无水乙醇中,在室温条件下搅拌1h至完全溶解,配制乙醇溶液相的总浓度为15mg/ml,然后将配制好的乙醇溶液相与反溶剂去离子水分别吸入针筒。通过数字注射泵将配制好的卵磷脂人参皂苷乙醇溶液和去离子水,通过数字注射泵将配制好的卵磷脂乙醇溶液和去离子水分别连接多通道混合器的两个通道,通入速度优选为5ml/min,在另外两个通道分别通入相同的去离子水,通入速度优选为45ml/min,所得纳米胶束液体从出口流出,用容器承接。
[0082]
其中,r1基团为
‑
o
‑
glc,r2为
[0083]
<实施例1
‑
5>
[0084]
取蛋黄卵磷脂:如通式ⅰ所示的三醇型稀有人参次生苷:乙酰基二肽
‑
1鲸蜡酯:辅酶q10的质量比1:100:0.1:1共同溶于无水乙醇中,在室温条件下搅拌1h至完全溶解,配制乙醇溶液相的总浓度为15mg/ml,然后将配制好的乙醇溶液相与反溶剂去离子水分别吸入针筒。通过数字注射泵将配制好的卵磷脂人参皂苷乙醇溶液和去离子水,通过数字注射泵将配制好的卵磷脂乙醇溶液和去离子水分别连接多通道混合器的两个通道,通入速度优选为5ml/min,在另外两个通道分别通入相同的去离子水,通入速度优选为45ml/min,所得纳米胶束液体从出口流出,用容器承接。
[0085]
其中,r1基团为
‑
o
‑
glc,r2为
[0086]
<实施例1
‑
6>
[0087]
取蛋黄卵磷脂:如通式ⅰ所示的三醇型稀有人参次生苷:乙酰基二肽
‑
1鲸蜡酯:辅酶q10的质量比1:100:1:1共同溶于无水乙醇中,在室温条件下搅拌1h至完全溶解,配制乙醇溶液相的总浓度为15mg/ml,然后将配制好的乙醇溶液相与反溶剂去离子水分别吸入针筒。通过数字注射泵将配制好的卵磷脂人参皂苷乙醇溶液和去离子水,通过数字注射泵将
配制好的卵磷脂乙醇溶液和去离子水分别连接多通道混合器的两个通道,通入速度优选为5ml/min,在另外两个通道分别通入相同的去离子水,通入速度优选为45ml/min,所得纳米胶束液体从出口流出,用容器承接。
[0088]
其中,r1基团为
‑
o
‑
glc,r2为
[0089]
<实施例1
‑
7>
[0090]
取蛋黄卵磷脂:如通式ⅰ所示的三醇型稀有人参次生苷:乙酰基二肽
‑
1鲸蜡酯:辅酶q10的质量比1:100:100:1共同溶于无水乙醇中,在室温条件下搅拌1h至完全溶解,配制乙醇溶液相的总浓度为15mg/ml,然后将配制好的乙醇溶液相与反溶剂去离子水分别吸入针筒。通过数字注射泵将配制好的卵磷脂人参皂苷乙醇溶液和去离子水,通过数字注射泵将配制好的卵磷脂乙醇溶液和去离子水分别连接多通道混合器的两个通道,通入速度优选为5ml/min,在另外两个通道分别通入相同的去离子水,通入速度优选为45ml/min,所得纳米胶束液体从出口流出,用容器承接。
[0091]
其中,r1基团为
‑
o
‑
glc,r2为
[0092]
<实施例1
‑
8>
[0093]
与实施例1大体相同,不同的是,乙酰基二肽
‑
1鲸蜡酯由同用量的棕榈酰二肽
‑
7替代。
[0094]
实施例1
‑
1~1
‑
8研究了壳材不同配比时,所能形成的纳米胶束情况。通过实验验证,本发明所述的制备方法,可以通过调整实验参数得到不同壳层配比的纳米胶束。
[0095]
<实施例2>
[0096]
取卵磷脂:如通式ⅰ所示的三醇型稀有人参次生苷:乙酰基二肽
‑
1鲸蜡酯:乳木果油的质量比1:2:6:5共同溶于无水乙醇中,在室温条件下搅拌1h至完全溶解,配制乙醇溶液相的总浓度为90mg/ml,然后将配制好的乙醇溶液相与反溶剂去离子水分别吸入针筒。通过数字注射泵将配制好的卵磷脂人参皂苷乙醇溶液和去离子水,通过数字注射泵将配制好的卵磷脂乙醇溶液和去离子水分别连接多通道混合器的两个通道,通入速度优选为7ml/min,在另外两个通道分别通入相同的去离子水,通入速度优选为81ml/min,所得纳米胶束液体从出口流出,用容器承接。
[0097]
其中,r1基团为
‑
o
‑
glc,r2为
[0098]
<实施例3>
[0099]
取大豆卵磷脂:如通式ⅰ所示的三醇型稀有人参次生苷:乙酰基二肽
‑
1鲸蜡酯:虾青素的质量比2:3:2:1共同溶于无水乙醇中,在室温条件下搅拌1h至完全溶解,配制乙醇溶液相的总浓度为100mg/ml,然后将配制好的乙醇溶液相与反溶剂去离子水分别吸入针筒。通过数字注射泵将配制好的卵磷脂人参皂苷乙醇溶液和去离子水,通过数字注射泵将配制好的卵磷脂乙醇溶液和去离子水分别连接多通道混合器的两个通道,通入速度优选为8ml/min,在另外两个通道分别通入相同的去离子水,通入速度优选为100ml/min,所得纳米胶束
液体从出口流出,用容器承接。
[0100]
其中,r1基团为
‑
o
‑
glc(6
→
1)glc(2
→
1)glc,r2为
[0101]
<实施例4>
[0102]
取蛋黄卵磷脂:如通式ⅰ所示的三醇型稀有人参次生苷:乙酰基二肽
‑
1鲸蜡酯:白藜芦醇的质量比2:1:1:3共同溶于无水乙醇中,在室温条件下搅拌1h至完全溶解,配制乙醇溶液相的总浓度为45mg/ml,然后将配制好的乙醇溶液相与反溶剂去离子水分别吸入针筒。通过数字注射泵将配制好的卵磷脂人参皂苷乙醇溶液和去离子水。通过数字注射泵将配制好的卵磷脂乙醇溶液和去离子水分别连接多通道混合器的两个通道,通入速度优选为6ml/min,在另外两个通道分别通入相同的去离子水,通入速度优选为100ml/min,所得纳米胶束液体从出口流出,用容器承接。
[0103]
其中,r1基团为
‑
o
‑
glc(6
→
1)xyl,r2为
[0104]
<实施例5>
[0105]
取天然卵磷脂:如通式ⅰ所示的三醇型稀有人参次生苷:乙酰基二肽
‑
1鲸蜡酯:维生素c四异棕榈酸酯的质量比1:2:3:4共同溶于无水乙醇中,在室温条件下搅拌1h至完全溶解,配制乙醇溶液相的总浓度为160mg/ml,然后将配制好的乙醇溶液相与反溶剂去离子水分别吸入针筒。通过数字注射泵将配制好的卵磷脂人参皂苷乙醇溶液和去离子水。通过数字注射泵将配制好的卵磷脂乙醇溶液和去离子水分别连接多通道混合器的两个通道,通入速度优选为9ml/min,在另外两个通道分别通入相同的去离子水,通入速度优选为90ml/min,所得纳米胶束液体从出口流出,用容器承接。
[0106]
其中,r1基团为
‑
o
‑
glc(6
→
1)glc(6
→
1)lyx,r2为
[0107]
<实施例6>
[0108]
取天然卵磷脂:如通式ⅰ所示的三醇型稀有人参次生苷:乙酰基二肽
‑
1鲸蜡酯:叶黄素的质量比3:1:1:10共同溶于无水乙醇中,在室温条件下搅拌1h至完全溶解,配制乙醇溶液相的总浓度为75mg/ml,然后将配制好的乙醇溶液相与反溶剂去离子水分别吸入针筒。通过数字注射泵将配制好的卵磷脂人参皂苷乙醇溶液和去离子水,通过数字注射泵将配制好的卵磷脂乙醇溶液和去离子水分别连接多通道混合器的两个通道,通入速度优选为6ml/min,在另外两个通道分别通入相同的去离子水,通入速度优选为60ml/min,所得纳米胶束液体从出口流出,用容器承接。
[0109]
其中,r1基团为
‑
o
‑
glc(6
→
1)xyl,r2为
[0110]
实施例7
[0111]
取氢化卵磷脂:如通式ⅰ所示的三醇型稀有人参次生苷:乙酰基二肽
‑
1鲸蜡酯:维生素e醋酸酯的质量比2:2:1:5共同溶于无水乙醇中,在室温条件下搅拌1h至完全溶解,配制乙醇溶液相的总浓度为30mg/ml,然后将配制好的乙醇溶液相与反溶剂去离子水分别吸
入针筒。通过数字注射泵将配制好的卵磷脂人参皂苷乙醇溶液和去离子水,通过数字注射泵将配制好的卵磷脂乙醇溶液和去离子水分别连接多通道混合器的两个通道,通入速度优选为8ml/min,在另外两个通道分别通入相同的去离子水,通入速度优选为75ml/min,所得纳米胶束液体从出口流出,用容器承接。
[0112]
其中,r1基团为
‑
o
‑
glc(6
→
1)ara,r2为
[0113]
实施例8
[0114]
取氢化卵磷脂:如通式ⅰ所示的三醇型稀有人参次生苷:乙酰基二肽
‑
1鲸蜡酯:维生素e醋酸酯的质量比2:2:2:5共同溶于无水乙醇中,在室温条件下搅拌1h至完全溶解,配制乙醇溶液相的总浓度为33mg/ml,然后将配制好的乙醇溶液相与反溶剂去离子水分别吸入针筒。通过数字注射泵将配制好的卵磷脂人参皂苷乙醇溶液和去离子水。通过数字注射泵将配制好的卵磷脂乙醇溶液和去离子水分别连接多通道混合器的两个通道,通入速度优选为8ml/min,在另外两个通道分别通入相同的去离子水,通入速度优选为75ml/min,所得纳米胶束液体从出口流出,用容器承接。
[0115]
其中,r1基团为
‑
o
‑
glc(6
→
1)ara,r2为
[0116]
第二部分、纳米脂质体实施例
[0117]
实施例9
[0118]
取蛋黄卵磷脂:如通式ⅰ所示的三醇型稀有人参次生苷:乙酰基二肽
‑
1鲸蜡酯质量比10:1:2共同溶于无水乙醇中,在室温条件下搅拌1h至完全溶解,配制乙醇溶液相的总浓度为91mg/ml,然后将配制好的乙醇溶液相与反溶剂去离子水分别吸入针筒。通过数字注射泵将配制好的卵磷脂人参皂甙乙醇溶液和去离子水。通过数字注射泵将配制好的卵磷脂乙醇溶液和去离子水分别连接多通道混合器的两个通道,通入速度优选为6ml/min,在另外两个通道分别通入相同的去离子水,通入速度优选为54ml/min,所得纳米脂质体液体从出口流出,用容器承接。
[0119]
其中,r1基团为
‑
o
‑
glc,r2为
[0120]
需要说明的是,在脂质体制备过程中,核层并不是必备成分。
[0121]
实施例10
[0122]
取蛋黄卵磷脂:如通式ⅰ所示的三醇型稀有人参次生苷:乙酰基二肽
‑
1鲸蜡酯质量比10:0.5:2共同溶于无水乙醇中,在室温条件下搅拌1h至完全溶解,配制乙醇溶液相的总浓度为87.5mg/ml,然后将配制好的乙醇溶液相与反溶剂去离子水分别吸入针筒。通过数字注射泵将配制好的卵磷脂人参皂甙乙醇溶液和去离子水。通过数字注射泵将配制好的卵磷脂乙醇溶液和去离子水分别连接多通道混合器的两个通道,通入速度优选为6ml/min,在另外两个通道分别通入相同的去离子水,通入速度优选为54ml/min,所得纳米脂质体液体从出口流出,用容器承接。
[0123]
其中,r1基团为
‑
o
‑
glc,r2为
[0124]
实施例11
[0125]
取蛋黄卵磷脂:如通式ⅰ所示的三醇型稀有人参次生苷:乙酰基二肽
‑
1鲸蜡酯质量比10:2:2共同溶于无水乙醇中,在室温条件下搅拌1h至完全溶解,配制乙醇溶液相的总浓度为98mg/ml,然后将配制好的乙醇溶液相与反溶剂去离子水分别吸入针筒。通过数字注射泵将配制好的卵磷脂人参皂甙乙醇溶液和去离子水。通过数字注射泵将配制好的卵磷脂乙醇溶液和去离子水分别连接多通道混合器的两个通道,通入速度优选为6ml/min,在另外两个通道分别通入相同的去离子水,通入速度优选为54ml/min,所得纳米脂质体液体从出口流出,用容器承接。
[0126]
其中,r1基团为
‑
o
‑
glc,r2为r3为oh。
[0127]
实施例11
‑1[0128]
取蛋黄卵磷脂:如通式ⅰ所示的三醇型稀有人参次生苷:乙酰基二肽
‑
1鲸蜡酯质量比10:0.1:0.1共同溶于无水乙醇中,在室温条件下搅拌1h至完全溶解,配制乙醇溶液相的总浓度为98mg/ml,然后将配制好的乙醇溶液相与反溶剂去离子水分别吸入针筒。通过数字注射泵将配制好的卵磷脂人参皂甙乙醇溶液和去离子水。通过数字注射泵将配制好的卵磷脂乙醇溶液和去离子水分别连接多通道混合器的两个通道,通入速度优选为6ml/min,在另外两个通道分别通入相同的去离子水,通入速度优选为54ml/min,所得纳米脂质体液体从出口流出,用容器承接。
[0129]
其中,r1基团为
‑
o
‑
glc,r2为r3为oh。
[0130]
实施例11
‑2[0131]
取蛋黄卵磷脂:如通式ⅰ所示的三醇型稀有人参次生苷:乙酰基二肽
‑
1鲸蜡酯质量比10:0.1:1共同溶于无水乙醇中,在室温条件下搅拌1h至完全溶解,配制乙醇溶液相的总浓度为98mg/ml,然后将配制好的乙醇溶液相与反溶剂去离子水分别吸入针筒。通过数字注射泵将配制好的卵磷脂人参皂甙乙醇溶液和去离子水。通过数字注射泵将配制好的卵磷脂乙醇溶液和去离子水分别连接多通道混合器的两个通道,通入速度优选为6ml/min,在另外两个通道分别通入相同的去离子水,通入速度优选为54ml/min,所得纳米脂质体液体从出口流出,用容器承接。
[0132]
其中,r1基团为
‑
o
‑
glc,r2为r3为oh。
[0133]
实施例11
‑3[0134]
取蛋黄卵磷脂:如通式ⅰ所示的三醇型稀有人参次生苷:乙酰基二肽
‑
1鲸蜡酯质量比10:0.1:10共同溶于无水乙醇中,在室温条件下搅拌1h至完全溶解,配制乙醇溶液相的总浓度为98mg/ml,然后将配制好的乙醇溶液相与反溶剂去离子水分别吸入针筒。通过数字注射泵将配制好的卵磷脂人参皂甙乙醇溶液和去离子水。通过数字注射泵将配制好的卵磷脂
乙醇溶液和去离子水分别连接多通道混合器的两个通道,通入速度优选为6ml/min,在另外两个通道分别通入相同的去离子水,通入速度优选为54ml/min,所得纳米脂质体液体从出口流出,用容器承接。
[0135]
其中,r1基团为
‑
o
‑
glc,r2为r3为oh。
[0136]
实施例11
‑4[0137]
取蛋黄卵磷脂:如通式ⅰ所示的三醇型稀有人参次生苷:乙酰基二肽
‑
1鲸蜡酯质量比10:1:0.1共同溶于无水乙醇中,在室温条件下搅拌1h至完全溶解,配制乙醇溶液相的总浓度为98mg/ml,然后将配制好的乙醇溶液相与反溶剂去离子水分别吸入针筒。通过数字注射泵将配制好的卵磷脂人参皂甙乙醇溶液和去离子水。通过数字注射泵将配制好的卵磷脂乙醇溶液和去离子水分别连接多通道混合器的两个通道,通入速度优选为6ml/min,在另外两个通道分别通入相同的去离子水,通入速度优选为54ml/min,所得纳米脂质体液体从出口流出,用容器承接。
[0138]
其中,r1基团为
‑
o
‑
glc,r2为r3为oh。
[0139]
实施例11
‑5[0140]
取蛋黄卵磷脂:如通式ⅰ所示的三醇型稀有人参次生苷:乙酰基二肽
‑
1鲸蜡酯质量比10:1:10共同溶于无水乙醇中,在室温条件下搅拌1h至完全溶解,配制乙醇溶液相的总浓度为98mg/ml,然后将配制好的乙醇溶液相与反溶剂去离子水分别吸入针筒。通过数字注射泵将配制好的卵磷脂人参皂甙乙醇溶液和去离子水。通过数字注射泵将配制好的卵磷脂乙醇溶液和去离子水分别连接多通道混合器的两个通道,通入速度优选为6ml/min,在另外两个通道分别通入相同的去离子水,通入速度优选为54ml/min,所得纳米脂质体液体从出口流出,用容器承接。
[0141]
其中,r1基团为
‑
o
‑
glc,r2为r3为oh。
[0142]
实施例11
‑6[0143]
取蛋黄卵磷脂:如通式ⅰ所示的三醇型稀有人参次生苷:乙酰基二肽
‑
1鲸蜡酯质量比10:10:0.1共同溶于无水乙醇中,在室温条件下搅拌1h至完全溶解,配制乙醇溶液相的总浓度为98mg/ml,然后将配制好的乙醇溶液相与反溶剂去离子水分别吸入针筒。通过数字注射泵将配制好的卵磷脂人参皂甙乙醇溶液和去离子水。通过数字注射泵将配制好的卵磷脂乙醇溶液和去离子水分别连接多通道混合器的两个通道,通入速度优选为6ml/min,在另外两个通道分别通入相同的去离子水,通入速度优选为54ml/min,所得纳米脂质体液体从出口流出,用容器承接。
[0144]
其中,r1基团为
‑
o
‑
glc,r2为r3为oh。
[0145]
实施例11
‑7[0146]
取蛋黄卵磷脂:如通式ⅰ所示的三醇型稀有人参次生苷:乙酰基二肽
‑
1鲸蜡酯质量
比10:10:10共同溶于无水乙醇中,在室温条件下搅拌1h至完全溶解,配制乙醇溶液相的总浓度为98mg/ml,然后将配制好的乙醇溶液相与反溶剂去离子水分别吸入针筒。通过数字注射泵将配制好的卵磷脂人参皂甙乙醇溶液和去离子水。通过数字注射泵将配制好的卵磷脂乙醇溶液和去离子水分别连接多通道混合器的两个通道,通入速度优选为6ml/min,在另外两个通道分别通入相同的去离子水,通入速度优选为54ml/min,所得纳米脂质体液体从出口流出,用容器承接。
[0147]
其中,r1基团为
‑
o
‑
glc,r2为r3为oh。
[0148]
实施例11
‑8[0149]
与实施例11大体相同,不同的是,乙酰基二肽
‑
1鲸蜡酯由同样用量的棕榈酰四肽
‑
7替代。
[0150]
实施例11
‑
1~11
‑
8研究了壳材不同配比时,所能形成的纳米脂质体情况。通过实验验证,本发明所述的制备方法,可以通过调整实验参数得到不同壳层配比的纳米脂质体。
[0151]
第三部分、对比案例
[0152]
对比例1
[0153]
参考实施例9和cn2020116376570中<实施例14>,将200mg乙酰基二肽
‑
1鲸蜡酯溶于质量分数为20%乙酸水溶液中;将1g蛋黄卵磷脂、100mg如通式ⅰ所示的二醇型人参皂苷次生苷材料溶于乙醇溶液;将以上两种溶液混匀,置于圆底烧瓶中;减压蒸馏,除去瓶内的有机试剂与乙酸水溶液,瓶内形成一层均匀的脂质薄膜;利用氮气除去多余酸类成分与水分,形成干燥的薄膜;加入14.3ml的水,将瓶内薄膜洗脱;用高压均质机进行均质化处理(400bar,2min),得脂质体(蛋黄卵磷脂:二醇型稀有人参次生苷:乙酰基二肽
‑
1鲸蜡酯质量比10:1:2)。
[0154]
其中,其中,r1基团为
‑
o
‑
glc,r2为
[0155]
需要说明的是:在cn2020116376570中的权利要求9中记载:所述化妆品中的活性物质为乙酰基二肽
‑
1鲸蜡酯、棕榈酰四肽
‑
7、棕榈酰五肽
‑
4中的一种时,先将其在乙酸水溶液中溶解。
[0156]
相比于本案的实施例9,两者区别在于,cn2020116376570乙酰基二肽
‑
1鲸蜡酯是作为活性成分而非壳层存在的,其作为壳层活性成分必须先在乙酸水溶液中溶解。
[0157]
在本案中,如果乙酰基二肽
‑
1鲸蜡酯要作为壳层存在,其有必要将三者共混,然后通过多通道混合器制备得到。
[0158]
对比例2
[0159]
参考实施例9,取蛋黄卵磷脂:如cn2020116376570所示的式1所示的二醇型稀有人参次生苷:乙酰基二肽
‑
1鲸蜡酯的质量比10:1:2共同溶于无水乙醇中,配制乙醇溶液相的总浓度为91 mg/ml,在室温条件下搅拌3hr,超声震荡等均无法得到完全溶解的溶液。如图3所示,溶液沉淀相分离,无法继续制备纳米脂质体。
[0160]
r1基团为
‑
o
‑
glc,r2为
[0161]
通过该对比例的实验我们可以得到如下结论:二醇型稀有人参次生苷不支持含有乙酰基二肽
‑
1鲸蜡酯的壳材的脂质体的稳定存在。
[0162]
对比例3
[0163]
取蛋黄卵磷脂:如通式ⅰ所示的三醇型稀有人参次生苷质量比10:1共同溶于无水乙醇中,在室温条件下搅拌1h至完全溶解,配制乙醇溶液相的总浓度为77mg/ml,然后将配制好的乙醇溶液相与反溶剂去离子水分别吸入针筒。通过数字注射泵将配制好的卵磷脂人参皂甙乙醇溶液和去离子水。通过数字注射泵将配制好的卵磷脂乙醇溶液和去离子水分别连接多通道混合器的两个通道,通入速度优选为6ml/min,在另外两个通道分别通入相同的去离子水,通入速度优选为54ml/min,所得纳米脂质体液体从出口流出,用容器承接。
[0164]
其中,r1基团为
‑
o
‑
glc,r2为
[0165]
对比例4
[0166]
参考实施例8,取氢化卵磷脂:如通式ⅰ所示的三醇型稀有人参次生苷:维生素e醋酸酯的质量比2:2:5共同溶于无水乙醇中,在室温条件下搅拌1h至完全溶解,配制乙醇溶液相的总浓度为27mg/ml,然后将配制好的乙醇溶液相与反溶剂去离子水分别吸入针筒。通过数字注射泵将配制好的卵磷脂人参皂苷乙醇溶液和去离子水。通过数字注射泵将配制好的卵磷脂乙醇溶液和去离子水分别连接多通道混合器的两个通道,通入速度优选为8ml/min,在另外两个通道分别通入相同的去离子水,通入速度优选为75ml/min,所得纳米胶束液体从出口流出,用容器承接。
[0167]
其中,r1基团为
‑
o
‑
glc(6
→
1)ara,r2为
[0168]
对比例5
[0169]
取氢化卵磷脂:如通式ⅰ所示的三醇型稀有人参次生苷:乙酰基二肽
‑
1鲸蜡酯:维生素e醋酸酯的质量比2:2:1:5共同溶于无水乙醇中,配制乙醇溶液相的总浓度为30mg/ml,在室温条件下搅拌3hr,超声震荡等均无法得到完全溶解的溶液。如图4所示,溶液沉淀相分离,无法继续制备纳米胶束。
[0170]
r1基团为
‑
o
‑
glc,r2为
[0171]
本对比例可证实:采用普通超声的方式无法得到稳定的含所述壳材的纳米胶束。
[0172]
第五部分、性能测试
[0173]
5.1作为脂质体膜材的性能优势对比
[0174]
5.1.1纳米脂质体形貌、粒径、单分散性及壳层电荷可调控性
[0175]
如表1所示,使用相同浓度(同样的磷脂、人参次生苷及乙酰基二肽
‑
1鲸蜡酯的浓度和比例),参照cn2020116376570中<实施例14>所阐述的高压均质的方法制备的脂质体对比例1,其表面电荷zeta正电位为12.4mv远远低于本发明所制备的实施例9的zeta正电位
41mv。说明cn2020116376570中<实施例14>所阐述的方法没有使大多数带有正电荷的乙酰基二肽
‑
1鲸蜡酯进入壳层,且无法通过乙酰基二肽
‑
1的浓度自由调节纳米材料壳层表面的正负电荷的大小。
[0176]
参照本发明实施例9的多通道混合制备方法,使用与对比例1同样的磷脂、二醇型人参次生苷及乙酰基二肽
‑
1鲸蜡酯的浓度和比例,如图2所示,在含有乙酰基二肽
‑
1鲸蜡酯时,二醇型人参皂苷(对比例2)不能与磷脂、乙酰基二肽
‑
1鲸蜡酯形成稳定均一的醇相溶液(图2右),产生明显的沉淀,因而无法进一步制备得到稳定的、带有正电荷的纳米脂质体。
[0177]
而本发明所阐述的三醇型人参次生苷、磷脂与乙酰基二肽
‑
1,与对比例2相比,表现出非常好的兼容性,如图2所示,以上三种物质可以形成稳定的均一相的乙醇相溶液(图2左),进一步,通过本发明所阐述的多通道混合制备方法,可以得到粒径均一、表面带有高正电荷的纳米脂质体。如图3所示,实施例9纳米脂质体水溶液成像分析使用冷冻电镜(talos f200c 200kv),首先使用pelco easiglow
tm
glow discharge辉光放电使铜网(ted pella inc.,u.s.a.)亲水化。然后使用vitrobot fei
tm
制备低温tem样品,参数如下:blot times 4.5s和blot force 3,wait time 3.0s和bolt total 1,drain time 0s。样品液体先到液乙烷中快速冻结,再到液氮中冷却。然后用gatan 698cryo
‑
transfer holder移至冷冻电镜成像。实施例9的成像结果如图3所示,呈现稀有人参次生苷纳米脂质体结构。
[0178]
更进一步,如表1所示的实施例9
‑
11,通过调整乙酰基二肽
‑
1鲸蜡酯的浓度,经过本发明所述的膜材复合物和多通道混合制备方法,可得到稳定的、带有正电荷的、表面电荷数可调节的纳米脂质体。
[0179]
表1
[0180][0181]
5.1.2纳米脂质体皮肤斑贴刺激性及舒缓抗敏效果
[0182]
采用48小时人体斑贴实验,测试对比3%的实施例9和3%的对比例1的水溶液对人体皮肤的刺激性,测试30名志愿者,年龄均为20
‑
40岁。贴敷48小时候后取下斑贴,观察皮肤状况。结果表明,对比例1的刺激性大,斑贴实验呈阳性反应,10
‑
15名的志愿者表现出皮肤轻微发红,并有刺痛感。而本发明的实施例9刺激性小,30例无一例阳性,且具有抗敏舒缓效果。以上结果说明本发明所制备的脂质体,乙酰基二肽
‑
1鲸蜡酯、三醇型人参次生苷、卵磷脂所构成的脂质体膜材具有更优的皮肤温和性,更低的刺激性。
[0183]
采用低浓度2%和高浓度10%的sls刺激模型,测试对比添加5ul实施例9和对比例3的样品对刺激物的舒缓抗敏效果。测试3名志愿者,年龄均为20
‑
25岁。清水清洗三名志愿者的手臂前端,轻轻擦干残留水分。在指定编号位置用棉签轻轻涂抹对应的实施例样品(空白及纯刺激物位置使用等量去离子水轻轻涂抹),等待5分钟。在斑试器对应位置加入15μl sls溶液(2%或者10%)和5μl指定实施例溶液,将制备好的斑贴置于相应编号的手臂位置封闭。在闭塞条件下反应至24小时,斑贴器移除后,观察并评估皮肤的反应。由于测试刺激物sls并未对受试者皮肤产生明显红斑或者鳞屑反应,因而对班贴器移除后,皮肤的刺痛感进行感官的自主评价和打分(0分为完全无刺痛感,5分为强烈刺痛感)。将三名测评者的评分取平均值并记录于表2。表2的结果显示,相较于不含乙酰基二肽
‑
1鲸蜡酯的三醇型阴离子脂质体对比例3,本发明所阐述的基于三醇型人参次生苷、卵磷酯、乙酰基二肽
‑
1鲸蜡酯的阳离子脂质体实施例9,可以更优的降低高低浓度下sls的刺激,具有提高舒缓抗敏功效的作用。
[0184]
表2
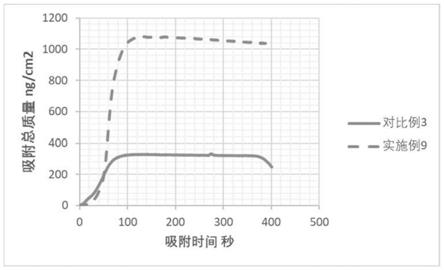
[0185][0186][0187]
5.1.3纳米脂质体的稳定性
[0188]
取对比例1和实施例9制备的纳米脂质体溶液做长期高温稳定性对比。将纳米脂质体溶液稀释250倍后导入nanosight ns300颗粒跟踪分析仪,测定待测纳米脂质体溶液的粒径和zeta电荷。将实施例放置高温48度恒温箱存贮4周,追踪得到表2所示的纳米脂质体的粒径和zeta电位随时间的变化情况。测定结果如表3所示。
[0189]
表3
[0190][0191]
由表2可知,实施例9使用本发明的三醇型人参次生苷、卵磷脂和乙酰基二肽
‑
1鲸蜡酯所得的纳米脂质体粒径小(均在100nm以下),单分散性好(pdi<0.3),且表面电荷具有可调控性,在高温存储下,粒径和表面电位均随时间变化不大,非常稳定。
[0192]
而对比例2的二醇型人参皂苷次生苷纳米脂质体的粒径则随时间变大,表面电荷随时间降低,有聚集现象,表现出不稳定的状态。
[0193]
5.1.4纳米脂质体的皮肤吸附性能
[0194]
如图4所示,对比了壳层使用乙酰基二肽
‑
1鲸蜡酯的亲肤性优势(实施例9含有乙酰基二肽
‑
1鲸蜡酯,对比例4不含有乙酰基二肽
‑
1鲸蜡酯),使用耗散型石英晶体微天平测定相同浓度的实施例和对比例在模拟皮肤的界面上的平衡吸附量。吸附量越高,表明样品与皮肤的亲和力越强,具有更好的吸附效果。从图4结果可以看出,本发明所阐述的实施例9的吸附性能(~1070ng/cm2)远远优于对比例3(~320ng/cm2),实施例9与皮肤界面的吸附量远远高于对比例3。
[0195]
通过上述对比可以发现:要形成均匀稳定性的带有正电荷的纳米脂质体溶液,且同时具有低皮肤刺激性和舒缓抗敏效果,优异的皮肤吸附性能,采用具有正点电荷倾向的乙酰基二肽
‑
1鲸蜡酯配合磷脂、兼容性更优的三醇型人参皂苷次生苷是必须且三者缺一不可的。
[0196]
5.2作为纳米胶束膜材的性能优势对比
[0197]
5.2.1.纳米胶束形貌、粒径、单分散性及壳层电荷可调控性
[0198]
如表4所示,使用相同浓度(同样的磷脂、人参次生苷及生育酚乙酸酯的浓度和比例),对比例4不含有乙酰基二肽
‑
1鲸蜡酯,其表面电荷zeta为负电位
‑
38.2mv,本发明所制备的实施例8的zeta电位为正电荷72.3mv。且进一步对比实施例7和实施例8表明,通过调整乙酰基二肽
‑
1鲸蜡酯的浓度,可以调控纳米胶束的表面正电荷,再一次证明带有正电荷的乙酰基二肽
‑
1鲸蜡酯进入壳层,通过乙酰基二肽
‑
1的浓度自由调节纳米胶束壳层表面的正电荷的大小。
[0199]
对比例5使用与实施例8同样的磷脂、二醇型人参次生苷、生育酚乙酸酯及乙酰基二肽
‑
1鲸蜡酯的浓度和比例,如图5所示,在含有乙酰基二肽
‑
1鲸蜡酯时,二醇型人参皂苷(对比例2)不能与磷脂、生育酚乙酸酯、乙酰基二肽
‑
1鲸蜡酯形成稳定均一的醇相溶液(图5右),产生明显的沉淀,因而无法进一步制备得到稳定的、带有正电荷的纳米胶束。而本发明所阐述的实施例8(三醇型人参次生苷、生育酚乙酸酯、磷脂与乙酰基二肽
‑
1),与对比例5相比,表现出非常好的兼容性,如图5(左)所示,以上三种物质可以形成稳定的均一相的乙醇相溶液,进一步,通过本发明所阐述的多通道混合制备方法,可以得到粒径均一、表面带有高正电荷的纳米胶束。
[0200]
纳米胶束水溶液成像分析使用冷冻电镜(talos f200c 200kv),首先使用pelco easiglow
tm
glow discharge辉光放电使铜网(ted pella inc.,u.s.a.)亲水化。然后使用vitrobot fei
tm
制备低温tem样品,参数如下:blot times 4.5s和blot force 3,wait time 3.0s和bolt total 1,drain time 0s。样品液体先到液乙烷中快速冻结,再到液氮中冷却。然后用gatan 698cryo
‑
transfer holder移至冷冻电镜成像。实施例8的成像结果如图6所示,呈现稀有人参次生苷纳米胶束结构。
[0201]
表4
[0202][0203]
5.2.2纳米胶束溶液稳定性对比
[0204]
取对比例4、对比例5和实施例8所制备的纳米胶束溶液做稳定性对比。将纳米胶束溶液稀释250倍后导入nanosight ns300颗粒跟踪分析仪,测定待测纳米胶束溶液的粒径。将实施例放置高温48度恒温箱存贮4周,追踪得到的含人参皂苷次生苷或者人参皂苷原生苷的纳米胶束的粒径随时间的变化情况。
[0205]
测定结果如表5所示。
[0206]
表5
[0207][0208][0209]
由表5可知,实施例8使用本发明的三醇型人参次生苷、卵磷脂和乙酰基二肽
‑
1鲸蜡酯所得的纳米胶束粒径非常小(100nm以下),单分散性好(pdi<0.2),在高温存储下,粒径和zeta电位随时间变化不大(<15%)。
[0210]
而对比例4,不含有乙酰基二肽
‑
1鲸蜡酯的三醇型人参皂苷次生苷纳米胶束也相对较为稳定,但粒径则随时间变大的程度大于实施例8(约为~40%),表明对比例4可能有部分聚集或者融合现象。
[0211]
对比例5,在使用二醇型人参次生苷时,在多数条件下,不能制备出好的胶束溶液,无法进行稳定性监测。
[0212]
通过上述对比可以发现:要形成均匀稳定性的带有正电荷的纳米胶束溶液,采用具有正点电荷倾向的乙酰基二肽
‑
1鲸蜡酯配合磷脂、兼容性更优的三醇型人参皂苷次生苷是必须且三者缺一不可的。
[0213]
6.2.3纳米胶束疏水物质包裹率
[0214]
例如上述实施例8,由于疏水物质不溶于水,且在最终水醇(5%v/v乙醇)溶液中难以溶解,所制备的溶液即使经过高温长期存储,也并未发现疏水活性物维生素e醋酸酯的析出或者分层浮油,且粒径及表面电位均稳定,因而可以得出本发明所制备的基于稀有人参次生苷的纳米胶束可以100%的包裹疏水活性物。
[0215]
5.2.4纳米胶束的皮肤吸附效果测试
[0216]
如图7所示,对比了壳层使用乙酰基二肽
‑
1鲸蜡酯的纳米胶束的亲肤性优势(实施例8含有乙酰基二肽
‑
1鲸蜡酯,对比例4不含有乙酰基二肽
‑
1鲸蜡酯),使用耗散型石英晶体微天平测定相同浓度的实施例和对比例在模拟皮肤的界面上的平衡吸附量。吸附量越高,表明样品与皮肤的亲和力越强,具有更好的吸附效果。从图4结果可以看出,本发明所阐述的纳米胶束实施例8的吸附性能(~380ng/cm2)优于对比例4(~330ng/cm2),实施例8与皮肤界面的吸附量高于对比例4。
[0217]
5.2.5纳米胶束抗敏舒缓效果评估
[0218]
采用低浓度2%和高浓度10%的sls刺激模型,测试对比添加5ul实施例8和对比例4的样品对刺激物的舒缓抗敏效果。测试3名志愿者,年龄均为20
‑
25岁。清水清洗三名志愿者的手臂前端,轻轻擦干残留水分。在指定编号位置用棉签轻轻涂抹对应的实施例样品(空白及纯刺激物位置使用等量去离子水轻轻涂抹),等待5分钟。在斑试器对应位置加入15μl sls溶液(2%或者10%)和5μl指定实施例溶液,将制备好的斑贴置于相应编号的手臂位置封闭。在闭塞条件下反应至24小时,斑贴器移除后,观察并评估皮肤的反应。由于测试刺激物sls并未对受试者皮肤产生明显红斑或者鳞屑反应,因而对班贴器移除后,皮肤的刺痛感进行感官的自主评价和打分(0分为完全无刺痛感,5分为强烈刺痛感)。将三名测评者的评分取平均值并记录于表2。表6的结果显示,相较于不含乙酰基二肽
‑
1鲸蜡酯的三醇型阴离子纳米胶束对比例4,本发明所阐述的基于三醇型人参次生苷、卵磷酯、乙酰基二肽
‑
1鲸蜡酯的阳离子纳米胶束实施例8,可以更优的降低高低浓度下sls的刺激,具有提高舒缓抗敏功效的作用。进一步,通过实施例7和实施例8的对比,表明抗敏舒缓效果可通过提高壳层使用的乙酰基二肽
‑
1鲸蜡酯提高。
[0219]
测试结果可参考下表6
[0220]
表6不同的纳米胶束的抗敏舒缓效果评估结果
[0221]
样品涂抹样品说明评分空白空白02%sls低浓度刺激物5
2%sls+对比例4低浓度刺激物+三醇型阴离子纳米胶束42%sls+对比例7低浓度刺激物+三醇型阳离子纳米胶束12%sls+实施例8低浓度刺激物+三醇型阳离子纳米胶束0
[0222]
5.2.6纳米胶束抑制有害细菌资质化的效果
[0223]
细菌资化性指的是添加一种物质,对于特定的细菌可作为营养源被利用的特性。对腐败菌表现出有资化性,会加速腐败变质;对皮肤有刺激性的有害细菌表现出资化性,会诱发皮肤刺激及其他相关皮肤疾病。对实施例8和对比例4所述的阳离子三醇型人参纳米胶束和阴离子三醇型人参纳米胶束进行了有害菌群的资质化性能对比。用半固体培养基中,加入大肠杆菌或金黄色葡萄球菌(s.aureus),在厌氧条件,37℃下进行24小时培养。在培养24小时后后进行光学浓度(od値600)的测定。od值越高,表明该材料作为有害菌群的营养物质,导致过度增殖(资化性)越严重。
[0224]
测试结果可参考表7。
[0225]
表7的实验结果表明,由乙酰基二肽
‑
1鲸蜡酯带来的阳离子特性,使本发明阐述的实施例8,相较于对比例4,在其他材料相同的情况下,可以有效的降低传统膜材及核材(如卵磷脂、维生素e、油脂)等对有害细菌的增殖作用,从而避免了细菌资质化的负面作用。
[0226]
表7不同的纳米胶束的抑制细菌资质化效果评估结果
[0227][0228]
综上所述,通过以上测试我们可以得到如下结论:
[0229]
1.三醇型人参皂苷次生苷能够提高由磷脂、乙酰基二肽
‑
1鲸蜡酯作为共混膜材时的胶束或者脂质体的体系相容性,但是二醇型人参皂苷次生苷对于磷脂、乙酰基二肽
‑
1鲸蜡酯的胶束的体系相容性差。
[0230]
2.乙酰基二肽
‑
1鲸蜡酯、磷脂、三醇型人参皂苷次生苷构成的胶束其存储稳定性特别是高温存储稳定性明显优于对比例。
[0231]
3.乙酰基二肽
‑
1鲸蜡酯会改变胶束的表面带电性能,从原始的负电荷人参卵磷脂脂质体、胶束变为稳定的正电荷人参脂质体、胶束,使其与皮肤的吸附性能或亲肤性效果更好
[0232]
4.乙酰基二肽
‑
1是有舒缓抗敏作用,相比对比例,本发明的纳米脂质体或者胶束的抗敏舒缓效果更佳。
[0233]
5.乙酰基二肽
‑
1是有阳离子抑菌作用,相比对比例,本发明的纳米脂质体或者胶束的抑制有害细菌的资质化效果更佳。
[0234]
对于本领域技术人员而言,显然本发明不限于上述示范性实施例的细节,而且在
不背离本发明的精神或基本特征的情况下,能够以其他的具体形式实现本发明。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在本发明内。不应将权利要求中的任何附图标记视为限制所涉及的权利要求。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1