一种主动肿瘤靶向可控释药纳米胶束及其制备方法、应用
1.本发明涉及生物与医学纳米材料技术领域,特别涉及一种主动肿瘤靶向可控释药纳米胶束及其制备方法、应用。
背景技术:
2.近年来,恶性肿瘤的发病率和死亡率呈现明显上升趋势,已成为严重威胁人民健康的疾病,具有死亡率高、预后差的特点。目前在临床上,化疗仍然是肿瘤治疗中最常见的手段之一。然而,由于其较差的组织选择性和副作用过大等问题,化疗仍然无法达到令人满意的治疗效果。为了解决这些问题,近年来研究人员将纳米技术应用到了肿瘤的治疗中,构建了各种纳米递药系统,通过高通透性和滞留效应或主动靶向的方式,使药物在肿瘤部位聚集,增大药物浓度,同时提高抗肿瘤药物的载药量、稳定性、生物利用度。
3.理想的纳米递药系统应该能使抗肿瘤药物在体内稳定运输,到达肿瘤之前无泄漏,达到肿瘤组织之后的药物释放是可控的,而刺激响应性纳米载体是解决这一问题的有效手段。其中,ros刺激响应性纳米载体具有响应速度快、灵敏度高的优势。利用ros敏感基团如双硫键、双硒键、硫醚键连接聚合物开发出许多ros可断裂性药物载体。其中,联合光敏剂ros响应给药载体获得了大量关注。包载光敏剂的纳米载体到达肿瘤部位后对肿瘤组织进行特定波长光照,激发产生光动力治疗作用的同时,产生的ros能裂解纳米粒子触发化疗药物释放,协同增强抗肿瘤疗效。
4.比如,授权公告号cn105617379b的专利公开了一种ros响应的纳米药物递送系统及其制备方法与应用,包括ucnps、与ucnps连接的羧基化的peg、光敏剂、ros敏感的缩硫酮linker,以及与缩硫酮linker连接的抗肿瘤化疗药物;光敏剂含有羧基且其激发光谱和ucnps的上转换发射光谱重合。本发明的ros响应的纳米药物递送系统通过ucnps发射的荧光或光敏剂发射出的光可进行荧光成像,因而可进行治疗成像一体化。但是,本专利的光敏剂存在组织选择性差、聚集诱导淬灭等不足,很大程度上限制了光动力治疗的临床应用。
技术实现要素:
5.(一)解决的技术问题
6.本发明的目的在于提供一种主动肿瘤靶向可控释药纳米胶束及其制备方法、应用,以解决现有的抗肿瘤相关药物采用的传统光敏剂存在组织选择性差、聚集诱导淬灭等不足,很大程度上限制了光动力治疗的临床应用的问题。
7.(二)技术方案
8.为实现上述主动肿瘤靶向可控释药纳米胶束及其制备方法、应用解决现有的抗肿瘤相关药物采用的传统光敏剂存在组织选择性差、聚集诱导淬灭等不足,很大程度上限制了光动力治疗的临床应用的问题,本发明提供如下技术方案:
9.一种主动肿瘤靶向可控释药纳米胶束,所述纳米胶束以peg-tk-plga为基本骨架,表面具有crgd修饰。
10.本发明还提供一种主动肿瘤靶向可控释药纳米胶束的制备方法,包括以下步骤:
11.将crgd多肽通过酰胺化反应与nhs-peg-tk-plga偶联,具体为将二甲基甲酰胺dmf中的nhs-peg-tk-plga混合到包含crgd多肽的dmf溶液中;
12.在室温下反应24h后,用超纯水透析纯化48h,然后冻干即可获得crgd-peg-tk-plga;
13.然后,将peg-tk-plga和crgd-peg-tk-plga溶于thf/chcl3溶剂中,然后缓慢加入超纯水,然后用超纯水透析1d,制备具有主动肿瘤靶向作用的纳米胶束rtk。
14.优选的,所述包含crgd多肽的dmf溶液中含有的crgd多肽为20mg,0.033mmol。
15.优选的,所述二甲基甲酰胺dmf为5ml。
16.优选的,所述用超纯水透析纯化48h采用的透析袋为mwco 3500。
17.优选的,所述将peg-tk-plga和crgd-peg-tk-plga溶于thf/chcl3溶剂中,然后缓慢加入超纯水,采用的peg-tk-plga为9mg,采用的crgd-peg-tk-plga为1mg,所述thf/chcl3溶剂的v/v=1:1且体积1.5ml,超纯水为8.5ml。
18.本发明还提供一种主动肿瘤靶向可控释药纳米胶束的应用,具体为:将9mg的peg-tk-plga、1mg的crgd-peg-tk-plga、1mg的aie光敏剂tb和1mg的ptx溶于thf/chcl3溶剂中,其中thf/chcl3溶剂体积比为v/v=1:1,1.5ml;在黑暗中溶解,然后缓慢加入8.5ml超纯水;然后用超纯水透析1d,制备具有主动肿瘤靶向作用的可控释药纳米胶束tb/ptx@rtk。
19.本发明还提供一种抗肿瘤药物,所述抗肿瘤药物包括所述主动肿瘤靶向可控释药纳米胶束的制备方法制备的主动肿瘤靶向可控释药纳米胶束。
20.(三)有益效果
21.与现有技术相比,本发明提供了一种主动肿瘤靶向可控释药纳米胶束及其制备方法、应用,具备以下有益效果:
22.(1)本发明的crgd-peg-tk-plga聚合物,采用peg-tk-plga作为基本骨架,对其进行crgd修饰,使得纳米胶束具有主动靶向肿瘤效果。其中:plga是一种可降解的功能高分子有机化合物,具有良好的生物相容性、无毒性、良好的成膜的性能;通过在载体中引入ros敏感性基团硫缩酮键(tk),赋予该纳米系统ros触发式的释药行为,保证迅速、充分、精准地在肿瘤细胞内释药;peg化修饰能够增加纳米递药系统的体内保留时间,提高血浆半衰期,增加肿瘤部位的积聚。
23.(2)本发明制备的crgd-peg-tk-plga聚合物的纳米递药系统包载的aie光敏剂(tb)和/或经典化疗药紫杉醇(ptx),在进入细胞内部经特定波长光照刺激可促进肿瘤细胞大量产生活性氧,介导的光动力治疗导致肿瘤细胞死亡。同时,crgd-peg-tk-plga聚合物中的硫缩酮键(tk)能够响应活性氧刺激而发生特异性断裂,从而到达肿瘤部位进行定位释放化疗药物,协同提高抗肿瘤效果。
24.(3)本发明制备的peg-tk-plga作为基本骨架的纳米递药系统,具有良好的生物相容性和可降解性,克服了难溶性药物水溶性差的缺陷,大大改善了难溶性抗肿瘤药物的溶解度,且原料廉价易得,制备工艺简单,制备条件温和,是一种优良抗癌药物靶向纳米载体。
25.(4)本发明制备的载药纳米胶束其粒径较小,形态圆整且呈现均匀的球形,具有适宜的载药量和包封率,且稳定性好。
26.(5)本发明制备的主动肿瘤靶向可控释药纳米胶束同时将疏水性的aie光敏剂
(tb)和/或ptx包载于纳米胶束中,降低给药剂量,能够协同提高抗肿瘤治疗效果。
附图说明
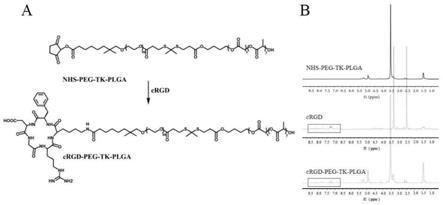
27.图1:(a)ros敏感的两亲性聚合物crgd-peg-tk-plga的合成;(b)nhs-peg-tk-plga,crgd和crgd-peg-tk-plga的1h nmr结构谱图;
28.图2:(a)纳米胶束的的粒径分布图;(b)纳米胶束的透射电子显微镜照片图,比例尺:100nm;
29.图3:(a)光照(540nm,100mw/cm2,10min)2h、4h和6h后tb/ptx@rtk胶束的流体力学尺寸分布;(b)包载紫杉醇的tb/ptx@rtk纳米胶束的累计释放百分率折线图;
30.图4为tb/ptx@rtk纳米胶束的肿瘤靶向图;
31.图5为tb@rtk和tb/ptx@rtk纳米胶束经或不经过光照处理对hep 1-6和hep g2肿瘤细胞活性的影响,(**p《0.01)。
具体实施方式
32.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
33.实施例1、本发明提供一种主动肿瘤靶向可控释药纳米胶束,纳米胶束以peg-tk-plga为基本骨架,表面具有crgd修饰。
34.聚乳酸-乙醇酸共聚物(plga)是当今使用最普遍的可生物降解的聚合物药物递送载体。为了构建刺激响应性纳米载体,以plga为辅料的多聚合物物构建的可控释药纳米系统获得了大量的关注。硫缩酮键(tk)能够响应活性氧刺激而发生特异性断裂,从而达到肿瘤部位的定位释放化疗药物,有效的提高抗肿瘤药物的利用率。此外,聚乙二醇(peg)是一种被广泛应用于蛋白质和多肽等生物聚合物进行共价修饰的高分子材料。peg具有无毒、无免疫原性、无抗原性、水溶性好等优点,是当今最常用的高分子材料之一。peg化修饰(pegylation)能够增加药物的体内保留时间,提高血浆半衰期,延长吸收时间。药物经peg修饰后可减少给药次数、提高疗效、改善耐受性、降低严重程度和不良事件发生率。因此peg常被用作药物传递和药物修饰技术,可以直接与药物偶联,或附着在药物表面一起封装于纳米材料里。
35.因此,本发明的纳米胶束以peg-tk-plga为基本骨架,具有以下优点:
36.首先,plga是一种可降解的功能高分子有机化合物,具有良好的生物相容性、无毒性、良好的成膜的性能;其次,通过在载体中引入ros敏感性基团硫缩酮键(tk),赋予该纳米系统ros触发式的释药行为,保证迅速、充分、精准的肿瘤细胞内释药;再次,peg化修饰能够增加纳米递药系统的体内保留时间,提高血浆半衰期,增加肿瘤部位的积聚;另外,采用crgd作为修饰使得纳米胶束具有主动靶向肿瘤效果;最后,在纳米胶束中包载aie光敏剂(tb)和经典化疗药紫杉醇(ptx),因而在特定波长照射下可大量产生ros,介导的光动力治疗促使肿瘤细胞死亡,同时硫缩酮键(tk)能够响应活性氧刺激而发生特异性断裂,从而达到肿瘤部位的定位释放化疗药物,协同提高抗肿瘤效果。另外,本发明制备的纳米胶束在自
组装构建过程中,对其进行crgd修饰,赋予载体材料潜在的整合素α
ν
β3高表达肿瘤主动靶向的特性,设计思路合理、操作易行。
37.实施例2、可主动靶向肿瘤的ros刺激响应的纳米胶束的合成
38.具体的制备方法包括以下步骤:
39.(1)crgd-peg-tk-plga的合成:将crgd多肽通过酰胺化反应与nhs-peg-tk-plga偶联,其合成途径如图1a所示,将5ml二甲基甲酰胺(dmf)中的nhs-peg-tk-plga混合到包含crgd多肽(20mg,0.033mmol)的dmf溶液中。在室温下反应24h后,用超纯水透析(mwco 3500)纯化48h,然后冻干即可获得crgd-peg-tk-plga。偶联率:74.6%。
40.(2)可主动靶向肿瘤的ros刺激响应的纳米胶束的合成:将peg-tk-plga(9mg)和crgd-peg-tk-plga(1mg)溶于thf/chcl3(v/v=1:1,1.5ml)溶剂中,然后缓慢加入超纯水(8.5ml)。然后用超纯水透析1d,制备具有主动肿瘤靶向作用的ros刺激响应的纳米胶束(rtk)。
41.nhs-peg-tk-plga,crgd和crgd-peg-tk-plga的1h nmr结构谱图见图1b,证实了crgd成功的偶联到了peg-tk-plga骨架上。
42.实施例3、可主动肿瘤靶向的包载aie光敏剂(tb)和(或)化疗药紫杉醇(ptx)的纳米胶束的合成
43.(1)tb@rtk纳米胶束的合成:将peg-tk-plga(9mg)、crgd-peg-tk-plga(1mg)和aie光敏剂(tb)(1mg)溶于thf/chcl3(体积比v/v=1:1,1.5ml)溶剂中,在黑暗中溶解,然后缓慢加入超纯水(8.5ml)。然后用超纯水透析1d,制备具有主动肿瘤靶向作用的包载aie光敏剂(tb)的纳米胶束(tb@rtk)。高效液相色谱法检测结果显示其载药量为7.43%。
44.(2)ptx@rtk纳米胶束的合成:将peg-tk-plga(9mg)、crgd-peg-tk-plga(1mg)和ptx(1mg)溶于thf/chcl3(v/v=1:1,1.5ml)溶剂中,然后缓慢加入超纯水(8.5ml)。然后用超纯水透析1d,制备具有主动肿瘤靶向作用的包载化疗药紫杉醇(ptx)的纳米胶束(ptx@rtk)。高效液相色谱法检测结果显示其载药量为6.15%。
45.(3)tb/ptx@rtk纳米胶束的合成:将peg-tk-plga(9mg)、crgd-peg-tk-plga(1mg)、aie光敏剂(tb)(1mg)和ptx(1mg)溶于thf/chcl3(v/v=1:1,1.5ml)溶剂中,在黑暗中溶解,然后缓慢加入超纯水(8.5ml)。然后用超纯水透析1d,制备具有主动肿瘤靶向作用的可控释药纳米胶束(tb/ptx@rtk)。高效液相色谱法检测结果显示aie光敏剂(tb)的载药量为7.83%,ptx的载药量为5.37%。
46.其中,上述的nhs-peg-tk-plga是peg-tk-plga经过nhs酯化修饰。目的是为了将crgd修饰到peg-tk-plga上,起到桥接的作用。
47.用粒度仪和透射电镜(tem)对上述所得的具有主动肿瘤靶向作用的纳米胶束进行观察,如图2所示的tem图,该探针呈均匀球形,平均粒径为90-120nm,尺寸合适、均一性好,良好的生物相容性。
48.实施例4、包载aie光敏剂(tb)和化疗药紫杉醇(ptx)的tb/ptx@rtk纳米胶束的体外释放试验
49.本实施例中,采用h2o2模拟光动力治疗(pdt)进程中的ros的大量生成,采用透析法测定化疗药紫杉醇(ptx)的释放度:将2ml新鲜制备的tb/ptx@rtk纳米胶束溶液转移到透析袋(mwco 1000)中,然后在37℃下将40ml的释放介质(pbs,含0.1%tween 80)放入透析袋
中,并以100转/分钟的速度平稳地摇匀。在设定的时间内,取出释放液2ml,同时加入等量的新鲜释放介质。采用高效液相色谱法测定化疗药紫杉醇(ptx)浓度,计算累积释放百分率,如图3b所示。为研究化疗药紫杉醇(ptx)的释放行为,释放条件为10mm h2o2,或者纳米胶束溶液在100mw/cm2(540nm)的光照下照射10min。用粒度仪对上述tb/ptx@rtk纳米胶束进行观察,如图3a所示,tb/ptx@rtk纳米胶束在接受光照(540nm,100mw/cm2,10min)后,纳米胶束的粒径发生了明显的变化,证实了在特定波长光照下tb/ptx@rtk纳米胶束能够响应pdt诱导产生的ros而发生裂解,进而促进ptx从纳米胶束当中释放出来。
50.实施例5、包载aie光敏剂(tb)和化疗药紫杉醇(ptx)的tb/ptx@rtk纳米胶束的体外肿瘤靶向实验
51.本实施例中,采用hep g2(人源)和hep 1-6(鼠源)肝细胞癌细胞进行纳米胶束肿瘤靶向能力的考察,同时以正常人肝细胞系(l-o2)和正常人肾小管上皮细胞系(hk-2)作为对照。采用上述方法制备tb/ptx@rtk纳米胶束。随后,将处于对数生长期的细胞以1
×
104个/孔的密度接种至的共聚焦小皿上培养,过夜孵育后,加入含有tb/ptx@rtk纳米胶束的无血清培养基继续孵育4h。用pbs洗3次后,加入4%多聚甲醛固定35分钟。再用含0.1%triton x-100的pbs洗涤3次,每次约5分钟。actin-tracker green染色工作液染色30分钟以标记细胞骨架。hoechst 33258染色5min以标记细胞核,再次用pbs洗涤3次后,于激光共聚焦显微镜下进行摄取情况的观察。结果如图4所示,结果表明,相比于正常组织细胞系,经该胶束包载后的光敏剂和药物可以更好的靶向于肿瘤细胞中。
52.实施例6、包载aie光敏剂(tb)和化疗药紫杉醇(ptx)的tb/ptx@rtk纳米胶束在光照作用下对肿瘤细胞生长的抑制作用
53.用cck-8法考察包载aie光敏剂(tb)和化疗药紫杉醇(ptx)的tb/ptx@rtk纳米胶束对hep g2和hep 1-6细胞在未加光照的毒性和光照后的毒性。将处于对数生长期的细胞以5
×
103个细胞/孔的密度接种于96孔板中。培养过夜后,分别加入含不同胶束溶液的培养基孵育4h。弃去培养基,用pbs洗三次,将不施加光照的细胞加入适量新鲜培养基避光孵育24h;而考察光动力治疗的细胞则在功率为100mw/cm2(540nm)的条件下分别光照3min,随后避光孵育24h。孵育结束后,每孔加入10μl cck-8检测液和100μl培养基于培养箱中继续孵育2h,随后用酶标仪在450nm条件下测定吸收值(od)。细胞活率的计算如下所示:
54.细胞活率(%)=((od
样品-od
空白
)/(od
对照-od
空白
))
×
100%
55.结果如图5所示,在无光照情况下tb@rtk和tb/ptx@rtk纳米胶束均未表现出明显的细胞毒作用。而在光照情况下,tb/ptx@rtk纳米胶束的细胞杀伤效果明显强于tb@rtk纳米胶束,表明tb/ptx@rtk胶束在光照下产生的ros足以触发化疗药物ptx的快速释放,并与pdt协同发挥抗肿瘤疗效。
56.本发明的工作机理是:
57.本发明提供的一种以peg-tk-plga为骨架的纳米递药系统,采用crgd作为修饰使得纳米胶束具有主动靶向肿瘤效果,形成的纳米胶束尺寸较小,具有良好的生物相容性、生物可降解性、载药效果和包封率,另外采用crgd作为修饰使得纳米胶束具有主动靶向肿瘤效果。plga是一种可降解的功能高分子有机化合物,具有良好的生物相容性、无毒性、良好的成膜的性能;通过在载体中引入ros敏感性基团硫缩酮键(tk),赋予该纳米系统ros触发式的释药行为,纳米胶束在特定波长的光照刺激下,纳米胶束包载的光敏剂能够将氧气转
化成活性氧,纳米胶束骨架中的硫缩酮键(tk)能够响应活性氧刺激而发生特异性断裂,从而保证迅速、充分、精准地在肿瘤细胞内释药,有效提高抗肿瘤药物利用率;peg化修饰能够增加药物的体内保留时间,提高血浆半衰期,延长吸收时间,增加肿瘤部位的积聚。纳米药物经peg修饰后可减少给药次数、提高疗效、改善耐受性、降低严重程度和不良事件发生率。本发明提供的主动靶向肿瘤的可控释药纳米胶束作为抗肿瘤药物载体,具有良好的应用前景。
58.同时,本发明利用聚集诱导发光(aie)分子作为光敏剂,将其包裹入纳米载体内,同时纳米粒子表面修饰环状精氨酸-甘氨酸-天冬氨酸(arg-gly-asp)短肽(crgd)作为肿瘤细胞表面整合素α
ν
β3,和纳米探针相互作用的识别位点,介导肿瘤细胞对纳米胶束的主动摄取。在避免了聚集诱导淬灭的同时,通过纳米技术改善光敏剂的组织选择性,起到一箭双雕的作用。此外,aie分子具有荧光和光敏双重特性,这就将荧光成像和治疗集于一身,既可以做到肿瘤实时荧光成像,同时也可为接下来的光照激发光动力治疗的同时诱导光控释药起到导航的作用,这就是所谓的诊疗一体化探针。
59.需要说明的是,在本文中,诸如第一和第二等之类的关系术语仅仅用来将一个实体或者操作与另一个实体或操作区分开来,而不一定要求或者暗示这些实体或操作之间存在任何这种实际的关系或者顺序。而且,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。在没有更多限制的情况下,由语句“包括一个
……”
限定的要素,并不排除在包括所述要素的过程、方法、物品或者设备中还存在另外的相同要素。
60.尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1